Что характеризует электроотрицательность элемента
Электроотрицательность
Между атомами в молекуле образуется определенная химическая связь, которую в современном научном мире описывает квантовая механика. Заряженные частицы в атоме взаимодействуют между собой, обеспечивая молекуле определенную устойчивость.
В зависимости от расстояния между атомами, полярности и прочности, химическая связь между атомами может быть:
Электроотрицательность — это способность атома в молекуле смещать к себе общие электронные пары. Она является необходимым показателем для описания молекулярных систем, определения типа связей в молекуле, распределения ионного заряда между взаимодействующими элементами. К факторам, которые влияют на эту величину, относятся: валентное состояние атома, степень окисления, координационное число и другие.
Приняв значение электроотрицательности водорода равной 2.1 произвольно и используя известные термодинамические данные, сравнивая электроотрицательность элементов с водородом, Поллинг составил первую шкалу относительных атомных электроотрицательностей.
Необходимо помнить, что электроотрицательность — величина не постоянная, а относительная, и позволяет лишь определить, в сторону какого элемента сдвигается общая электронная пара.
Помимо шкалы Поллинга, что изучают в школьном курсе химии, и которую можно найти на странице 276 учебника «Химия 8 класс» под редакцией В.В.Еремина, в мире существует около двадцати шкал определения электроотрицательности.
Таблица электроотрицательности Поллинга — справочный материал, и не всегда есть под рукой. Однако существуют общие закономерности электроотрицательности, и, зная расположение элемента в Периодической системе Д.И.Менделеева, можно косвенно оценить, в сторону какого из элементов в молекуле будет сдвигаться общая электронная пара.
Электроотрицательность химических элементов, расположенных правее, больше, чем у элементов, расположенных левее в одном периоде. Электроотрицательность элементов, расположенных выше, больше, чем у элементов, расположенных ниже в одной группе. Исходя из этих данных, самый высокий показатель у элементов, расположенных в правом верхнем углу, и самый низкий у элементов внизу слева.
По этим данным был составлен ряд электроотрицательности, в котором химические элементы расположены в порядке убывания ее величины: F, O, N, Cl, Br, S, C, P, H, Si, Mg, Li, Na.
Если таблица Поллинга под рукой, с помощью несложных арифметических действий можно определить тип связи в молекуле. Для этого нужно найти относительную электроотрицательность атомов, входящих в молекулу по таблице, и из большего значения вычесть меньшее, а по результату оценить связь.
Разность значений равна 0,5 или меньше — сила притяжения у атомов практически равна, электронное облако находится примерно посередине расстояния между атомами веществ, а связь является ковалентной неполярной. Если молекула состоит из двух одинаковых атомов, то разность значений электроотрицательностей равна 0. Атомы в молекуле с ковалентной полярной связью прочно соединены.
Разность значений составляет от 0,5 до 1,6 — сила притяжения у одного из атомов значительно больше, и он смещает общую электронную пару к себе, приобретая таким образом частичный отрицательный заряд. Атом, от которого общая электронная пара на более далеком расстоянии, приобретает частичный положительный заряд. Между атомами возникает ковалентная полярная связь. Сдвиг общей электронной пары приводит к определенному дисбалансу и молекула может вступать в определенные химические превращения.
Разность значений равна 2,0 и выше. В этом случае общая пара электронов достанется атому, чья электроотрицательность больше. Заряд у такого атома становится отрицательным, а у другого атома в молекуле за счет потери электрона — положительным. Между атомами возникает ионная связь. Ионная связь нестойкая, и молекулы легко вступают в реакции с другими атомами и полярными молекулами.
Разность значений составляет от 1,6 до 2,0. Самый сложный для определения тип связи, поскольку зависит от входящих в состав молекулы атомов. Если в молекулу входит атом металла, то связь ионная. Если в молекуле атомы металла отсутствуют — связь ковалентная полярная.
Электроотрицательность элементов по таблице Менделеева
Электроотрицательность — это характеристика атома, показывающая, насколько высока его способность притягивать к себе электроны. Когда химическая связь образована двумя разными элементами, электроны у одного из них всегда расположены более плотно, чем у другого. Тот атом, у которого электронная плотность выше, называется электроотрицательным, тот, у кого ниже — соответственно, электроположительным.
Как определить электроотрицательность
Существует несколько шкал, ориентируясь на которые, можно определить электроотрицательность того или иного элемента. Попробуем их перечислить:
Чтобы определить параметр «электроотрицательность» по таблице Менделеева, нужно всего лишь знать, что наиболее электроотрицательные свойства имеют те элементы, которые располагаются вверху таблицы и в правой ее части. То есть, чем выше и правее элемент находится в таблице Менделеева, тем выше у него электроотрицательность и наоборот, чем ниже и левее — тем выше у него электроположительность.
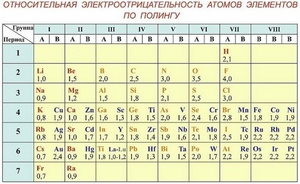
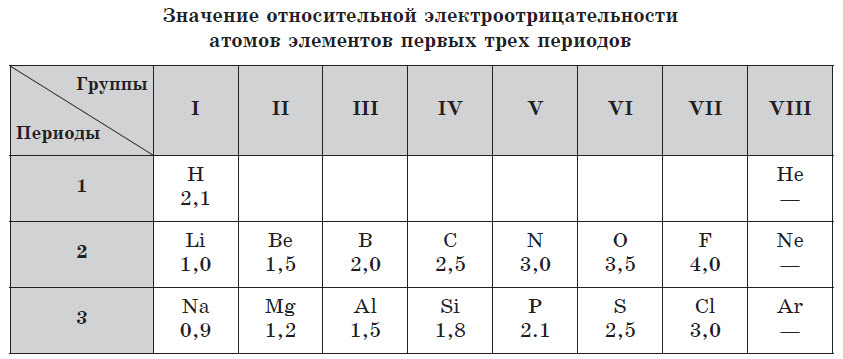
Шкала Полинга — наиболее часто используемая таблица электроотрицательности. Названа она в честь американского химика Лайнуса Полинга, который впервые ввел понятие электроотрицательности. Согласно шкале Поллинга, электроотрицательность всех имеющихся в природе элементов лежит в интервале от 0,7 (таковой она является у щелочного металла франция) до 4,0 (у газа-галогена фтора). В таблице приводятся относительные и неточные величины.
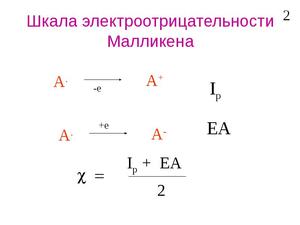
Шкала Малликена рассматривает электроотрицательность как величину энергии связи между валентными электронами. Приводятся максимально точные расчеты.
Расположение элементов в каждой из таблиц является идентичным, несмотря на то, что методы определения отличаются друг от друга, и величины тоже.
Самые высокие значения электроотрицательности
Фтор, один из галогенов — это элемент, обладающий наивысшей электроотрицательностью, а точнее — 3,98. Его химическая активность невероятно высока, настолько, что химики называют его не иначе как «все разгрызающий».
Следом за фтором идет кислород. Электроотрицательность кислорода немного пониже — 3,44, но тоже достаточно высока.
Следом за ними (спускаясь все ниже по правой части таблицы Менделеева) идут:
Большая часть неметаллов имеет электроотрицательность, колеблющуюся между значениями 2 и 3. У отличающихся наиболее высокой активностью металлов, от франция до бериллия, она колеблется от значения 0,7 до 1,57.
Как определить валентные электроны
Валентностью называют способность атома вступать во взаимодействие с другими атомами, образуя с ними определенные химические связи. Валентными электронами именуются электроны, непосредственно участвующие в образовании химической связи. Основными создателями, внесшими в теорию валентности наибольший вклад, являются русский ученый Бутлеров и немецкий ученый Кекуле. Электроны, которые принимают участие в образовании химической связи, называют валентными.
Атом, как мы все знаем из школьного курса, устроен таким образом, что довольно-таки напоминает по своему устройству Солнечную систему. В центре атома находится огромное ядро, чья масса чуть менее, чем полностью равняется массе всего атома, а вокруг него по орбиталям вращаются мелкие электроны, неодинаковые по своим внутренним характеристикам. Ядро атома окажется не таким уж и большим, если сравнить его размеры с длиной расстояния до орбиталей, по которым вращаются атомы. Чем дальше от ядра и чем ближе к внешней электронной оболочке находится электрон конкретно взятого атома, тем быстрее он вступает во взаимодействие с электронами других атомов.
Итак, перед нами таблица Менделеева. Найти на ней нужно третий период. Последовательно перебираем элементы главных подгрупп в нем. Существует правило, согласно которому валентность элемента определяется по номеру его группы и равняется количеству электронов на внешней оболочке его атома.
Помимо главных, есть еще и побочные подгруппы. Когда дело касается их, учитываются еще и d-электроны на предыдущем подуровне. В таблице Менделеева все эти значения легко можно отыскать. Попробуем определить высшую валентность хрома. На внешнем уровне у хрома находится 1 электрон, на d-подуровне — 5. Следовательно, его высшая валентность равна 6. У марганца на внешнем уровне 2 электрона, на d-подуровне — 5. Значит, его высшая валентность — 7.
Все вышеописанное, за некоторыми исключениями, действительно для элементов всех других побочных подгрупп (помимо тех, в которые включены марганец и хром). Вот исключения:
Видео
Это видео поможет вам лучше усвоить такое понятие, как электроотрицательность.
Электроотрицательность
Эле́ктроотрица́тельность (χ) — фундаментальное химическое свойство атома, количественная характеристика способности атома в молекуле смещать к себе общие электронные пары.
Современное понятие об электроотрицательности атомов было введено американским химиком Л. Полингом. Он использовал понятие электроотрицательности для объяснения того факта, что энергия гетероатомной связи A—B (A, B — символы любых химических элементов) в общем случае больше среднего геометрического значения гомоатомных связей A—A и B—B.
В настоящее время для определения электроотрицательностей атомов существует много различных методов, результаты которых хорошо согласуются друг с другом, за исключением относительно небольших различий, и во всяком случае внутренне непротиворечивы.
Первая и широко известная шкала относительных атомных электроотрицательностей Полинга охватывает значения от 0,7 для атомов франция до 4,0 для атомов фтора. Фтор — наиболее электроотрицательный элемент, за ним следует кислород (3,5) и далее азот и хлор (3,0). Активные щелочные и щёлочноземельные металлы имеют наименьшие значения электроотрицательности, лежащие в интервале 0,7—1,2, а галогены — наибольшие значения, находящиеся в интервале 4,0—2,5. Электроотрицательность типичных неметаллов находится в середине общего интервала значений и, как правило, близка к 2 или немного больше 2. Электроотрицательность водорода принята равной 2,1. Для большинства переходных металлов значения электроотрицательности лежат в интервале 1,5—2,0. Близки к 2,0 значения электроотрицательностей тяжёлых элементов главных подгрупп. Существует также несколько других шкал электроотрицательности, в основу которых положены разные свойства веществ. Но относительное расположение элементов в них примерно одинаково.
Теоретическое определение электроотрицательности было предложено американским физиком Р. Малликеном. Исходя из очевидного положения о том, что способность атома в молекуле притягивать к себе электронный заряд зависит от энергии ионизации атома и его сродства к электрону, Р. Малликен ввёл представление об электроотрицательности атома А как о средней величине энергии связи наружных электронов при ионизации валентных состояний (например, от А − до А + ) и на этой основе предложил очень простое соотношение для электроотрицательности атома:
где J1 A и εA — соответственно энергия ионизации атома и его сродство к электрону.
Помимо шкалы Малликена, описанной выше, существует более 20-ти различных других шкал электроотрицательности, среди которых шкала Л. Полинга (основана на энергии связи при образовании сложного вещества из простых), шкала Олреда-Рохова (основана на электростатической силе, действующей на внешний электрон) и др.
Строго говоря, элементу нельзя приписать постоянную электроотрицательность. Электроотрицательность атома зависит от многих факторов, в частности, от валентного состояния атома, формальной степени окисления, координационного числа, природы лигандов, составляющих окружение атома в молекулярной системе, и от некоторых других. В последнее время все чаще для характеристики электроотрицательности используют так называемую орбитальную электроотрицательность, зависящую от типа атомной орбитали, участвующей в образовании связи, и от её электронной заселённости, т. е. от того, занята атомная орбиталь неподелённой электронной парой, однократно заселена неспаренным электроном или является вакантной. Но, несмотря на известные трудности в интерпретации и определении электроотрицательности, она всегда остаётся необходимой для качественного описания и предсказания природы связей в молекулярной системе, включая энергию связи, распределение электронного заряда и степень ионности, силовую постоянную и т. д.
В период бурного развития квантовой химии как средства описания молекулярных образований (середина и вторая половина XX века) плодотворной оказался подход Л.Полинга, который в числе прочих исследований ввел собственную шкалу электроотрицательностей, в которой из «стандартных» элементов максимальную имеет фтор (

где 
Одним из наиболее развитых в настоящее время подходов является подход Сандерсона. В основу этого подхода легла идея выравнивания электроотрицательностей атомов при образовании химической связи между ними. В многочисленных исследованиях были найдены зависимости между электроотрицательностями Сандерсона и важнейшими физико-химическими свойствами неорганических соединений подавляющего большинства элементов периодической таблицы. [1] Очень плодотворной оказалась и модификация метода Сандерсона, основанная на перераспределении электроотрицательности между атомами молекулы для органических соединений. [2] [3] [4]
Что характеризует электроотрицательность элемента
Ключевые слова конспекта: строение веществ, кристаллические решетки, электроотрицательность.
Молекулярное и немолекулярное строение веществ
В химические взаимодействия вступают не отдельные атомы или молекулы, а вещества. Вещества при заданных условиях могут находиться в трех агрегатных состояниях: твердом, жидком и газообразном. Свойства веществ зависят также и от характера химической связи между частицами, которые их образуют — молекулами, атомами и ионами. По типу связи различают вещества молекулярного и немолекулярного строения.
Вещества, которые состоят из молекул, называются молекулярными. Связи между молекулами в таких веществах очень слабые, значительно слабее, чем между атомами в середине молекулы. Уже при сравнительно низких температурах они разрываются — вещество превращается в жидкость, а затем в газ (сублимация газа). Температура плавления и кипения веществ, которые состоят из молекул, повышается с увеличением молекулярной массы. К молекулярным веществам относятся вещества с атомной структурой (C, Si, Li, Na, K, Cu, Fe, W), среди них имеются металлы и неметаллы.
Простые вещества — неметаллы могут иметь молекулярное и атомное строение. Молекулярное строение при н. у. имеют газы (H2, N2, F2, Cl2, O3) либо твердые вещества (I2, P4, S8), а также единственная жидкость (Br2). Все эти вещества имеют молекулярное строение и обладают летучестью. В твердом состоянии они легкоплавкие и могут сублимироваться. Температуры кипения и плавления низкие.
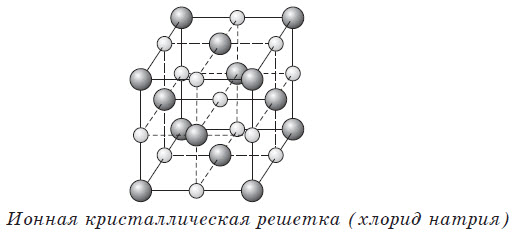
К веществам немолекулярного строения относятся ионные соединения. Такие структуры имеют большинство соединений металлов с неметаллами: все соли (NaCl, K2SO4), некоторые гидриды (LiH) и оксиды (CaO, MgO, FeO), основания (NaOH, KOH). Ионные (немолекулярные) вещества имеют высокие температуры плавления и кипения.
Кристаллические решетки
Твердые вещества принято делить на кристаллические и аморфные.
Аморфные вещества не имеют четкой структуры, в них не существует закономерного расположения отдельных частиц. Следовательно, аморфные вещества не имеют и четкой температуры плавления. При нагревании они постепенно размягчаются и переходят в текучее состояние. К аморфным веществам относится большинство органических веществ (воск, стекло, полиэтилен, парафин, пластилин, смолы).
Кристаллические вещества характеризуются структурированным, упорядоченным расположением составляющих их частиц в строго определенных точках пространства, расположенных на определенном расстоянии друг от друга. При соединении этих точек прямыми линиями образуется пространственный каркас, называемый кристаллической решеткой. Точки расположения частиц, составляющих кристаллическую решетку, называют узлами решетки.
Тип кристаллической решетки определяется видом частиц, расположенных в ее узлах, и характером связи между этими частицами. Различают четыре типа кристаллических решеток: ионные, атомные, молекулярные и металлические.
Атомными называют кристаллические решетки, в узлах которых находятся отдельные атомы. В таких решетках атомы соединены прочными ковалентными связями. Примером вещества с таким типом кристаллической решетки может быть алмаз — аллотропное видоизменение углерода.
Молекулярными называют кристаллические решетки, в узлах которых расположены молекулы. Химические связи у этих молекул могут быть как полярными (HCl, H2O), так и неполярными (N2, O2).
Несмотря на то, что атомы в молекулах связаны очень прочными ковалентными связями, между самими молекулами действуют слабые силы межмолекулярного взаимодействия. Вещества с молекулярным типом решеток имеют низкую прочность, низкие температуры плавления, они летучи. Молекулярные кристаллические решетки имеют большинство органических соединений (нафталин, глюкоза, сахар).
Вещества с металлической связью имеют металлические кристаллические решетки. В узлах таких решеток расположены атомы и ионы (атомы металла переходят в ионы и отдают внешние электроны в общее пользование). Такая внутренняя структура металла определяет его характерные свойства: ковкость, пластичность, электро- и теплопроводность, металлический блеск.
Электроотрицательность
В основе образования химических связей лежит явление электроотрицателъности. В ходе химических взаимодействий одни атомы отдают электроны, другие их присоединяют.
Электроотрицательность — это условная величина, характеризующая относительную способность атома приобретать отрицательный заряд.
Фактически электроотрицательность выражает способность атома оттягивать к себе общие электронные пары, участвующие в образовании химической связи.
Электроотрицательность атома определяет характер его свойств: сильнее всего металлические свойства проявляются у элементов, атомы которых легко отдают электроны, а неметаллические — соответственно у элементов, атомы которых легко их присоединяют.
Абсолютные значения электроотрицательности элементов выражаются числами, затрудняющими их практическое применение для вычислений, поэтому в химии используют значения относительной электроотрицателъности. Условно за единицу принимают значение электроотрицательности лития (Li).
Чем меньше значение относительной элетроотрицательности, тем ярче выражены металлические свойства элемента. У всех металлов в периодической системе значение относительной электроотрицательности, как правило, меньше 2. У неметаллов это значение, как правило, превышает 2.
Электроотрицательность элементов также изменяется периодически: в периодах возрастает слева направо, а в главных подгруппах — снизу вверх.
При образовании химических связей электроны переходят или смещаются к атомам элементов, которые обладают большей электроотрицательностью.
Конспект урока «Строение веществ. Электроотрицательность».
Электроотрицательность. Степень окисления и валентность химических элементов
Содержание:
Электроотрицательность химических элементов
Электроотрицательность (ЭО) – свойство атомов элементов оттягивать на себя электроны от другого атома в соединении.
На ЭО влияет несколько факторов: радиус атома и расстояние между ядром и валентными электронами. Численные значения ЭО приблизительные. Часто используют шкалу определения ЭО по Полингу.
Относительная электроотрицательность атомов элементов по Полингу
Анализируя данную шкалу можно выявить ряд закономерностей, перекликающихся с периодическим законом (ПЗ).
В зависимости от значения электроотрицательности образуются вещества с различным видом химической связей: если между атомами нет разности в электроотрицательности, образуются простые вещества (состоящие из одного вида атомов), чем больше разность, тем полярность молеклы возрастает: образуются молекулы веществ с полярной связью и ионной связью.
Степень окисления химических элементов и ее вычисление
Степень окисления (СО) – условный заряд атомов химических элементов в соединении на основании того, что все связи ионные.
Степень окисления может иметь отрицательное, положительное или нулевое значение, которое обычно помещается над символом элемента в верхней части.
При определении СО следует руководствоваться следующими правилами:
Применяя эти правила можно рассчитать степени окисления элементов в сложном веществе.
К примеру, определим степени окисления элементов в фосфорной кислоте H3PO4.
Рассчитаем степени окисления у элементов в нитрате алюминия Al(NO3)3.
Валентность. Валентные возможности атомов
Валентность — это способность атома присоединять ряд других атомов для образования химической связи.
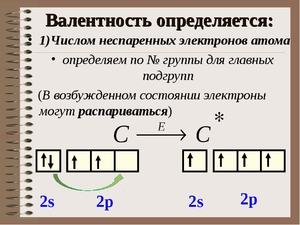
Валентность может быть определена числом химических связей, образующих атом, или числом неспаренных электронов.
Для определения валентности применяются определенные правила:
Валентность может совпадать со степенью окисления, но не имеет знака «+» или «-», не может быть равна нулю.
Валентные возможности атомов могут определяться:
Валентные возможности водорода
Валентные возможности водорода определяются одним неспаренным электроном на единственной орбитали. Водород обладает слабой способностью отдавать или принимать электроны, поэтому для него характерны в основном ковалентные химические связи. Ионные связи он может создавать с металлами, образуя гидриды. Ковалентные химические связи образуются за счет общих электронных пар. Поскольку у водорода всего один электрон, он способен образовывать только одну связь. По этой причине для него характерна валентность равная I.
Валентные возможности углерода
На внешнем энергетическом уровне у углерода 4 электрона: 2 спаренных и 2 неспаренных. Это состояние атома называется основным. По числу неспаренных электронов можно сказать, что углерод проявляет валентность равную II. Однако такая валентность проявляется только в некоторых соединениях.
В органических соединениях и некоторых органических веществах углерод проявляет валентность равную IV. Эта валентность характерна для возбужденного состояния С. Из основного в возбужденное состояние он может переходить при получении дополнительной энергии. Один электрон с s-подуровня переходит на p-подуровень, где есть свободная орбиталь.
Валентные возможности азота
У азота на валентном энергетическом уровне находится 5электронов: 3 неспаренных и 2 спаренных. Исходя из этого, валентность азота может быть равна III. В возбужденное состоянии атом азота не может переходить. Однако азот может выступать в качестве донора при образовании ковалентных химических связей, обеспечивая своей электронной паре атом, имеющий свободную орбиталь. В этом случае валентность у азота будет равна IV, причем для азота, как элемента пятой группы, это максимальная валентность. Валентность V он проявлять не способен.
Валентные возможности фосфора
В отличие от азота, фосфор имеет свободные 3d-орбитали, на которые могут переходить электроны. На внешнем энергетическом уровне находятся 3 неспаренных электрона. Атом фосфора способен переходить из основного состояния в возбужденное. Электроны с p-подуровня переходят на d-подуровень. В этом случае атом Р приобретает валентность, равную V. Таким образом, строение электронной оболочки атома увеличивает валентные возможности Р, по сравнению с азотом, от I до V.
Валентные возможности кислорода
На последнем энергетическом уровне у кислорода 2 неспаренных электрона. В соединениях чаще всего проявляет валентность II. У кислорода нет d-подуровня, поэтому переход электронов невозможен. Валентные возможности очень ограничены – проявляет II и III валентности.
Валентные возможности серы
Сера, так же, как и кислород, р в VI группе главной подгруппе ПСХЭ. Поэтому на валентном энергетическом уровне у серы 2 неспаренных электрона. Напрашивается вывод, что валентность серы равна II. Однако у серы есть и d-подуровень, который расширяет ее валентные возможности. Сера способна переходить из основного состояния в возбужденное, при этом может быть либо 4 неспаренных электрона, либо 6.
Таким образом, сера способна проявлять валентности II, IV, VI.
Опираясь на этот материал, можно определить все возможные валентности для любого химического элемента.