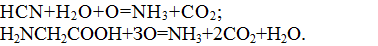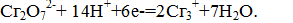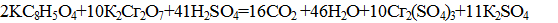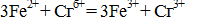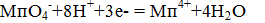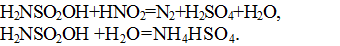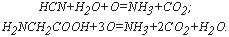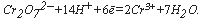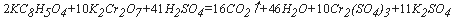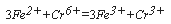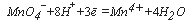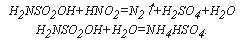Что характеризует окисляемость воды
Окисляемость воды
Органические и минеральные вещества, находящиеся в воде, при определенных условиях испытывают на себе воздействие сильных химических окислителей. Для определения содержания в воде данных веществ используется такое понятие как окисляемость. А так как этот процесс происходит под влиянием кислорода, принято выражать окисляемость в миллиграммах кислорода, присутствующих в 1 дм3 воды.
Известны следующие виды окисляемости: перманганатная, бихроматная, иодатная, цериевая. Перманганатный и бихроматный методы дают наиболее высокие показатели окисления.
В процессе очистки воды перманганатная окисляемость определяется для природных вод с невысоким уровнем загрязнения. В случае, когда вода загрязнена в большей степени, определяют бихроматную окисляемость.
Окисляемость, таким образом, можно рассматривать как способ определения уровня загрязнения воды органическими веществами.
Химический состав органических веществ может быть самым разнообразным, т.к. зависит от биохимических процессов, которые происходят внутри водоемов, а также от влияния поступления подземных и поверхностных вод, атмосферных осадков, промышленных сточных вод и т.п.
Существуют некоторые стандарты, определяющие состав и свойство воды, используемой в качестве питьевой. В соответствии с этими требованиями вода не должна иметь ХПК выше 15 О2/дм3.
1. Водоемы и показатели качества воды
А.Н. Петин, М.Г. Лебедева, О.В. Крымская
Анализ и оценка качества поверхностных вод
Учебное пособие. – Белгород: Изд-во БелГУ, 2006. – 252 с.
1. Водоемы и показатели качества воды
1.3. Растворенный в воде кислород
1.3.2. Окисляемость, или химическое потребление кислорода (ХПК)
Величина, характеризующая содержание в воде органических и минеральных веществ, окисляемых одним из сильных химических окислителей при определенных условиях, называется окисляемостью. Существует несколько видов окисляемости воды: перманганатная, бихроматная, иодатная, цериевая. Наиболее высокая степень окисления достигается методами бихроматной и иодатной окисляемости воды.
Окисляемость выражается в миллиграммах кислорода, пошедшего на окисление органических веществ, содержащихся в 1 дм 3 воды.
Состав органических веществ в природных водах формируется под влиянием многих факторов. К числу важнейших относятся внутриводоемные биохимические процессы продуцирования и трансформации, поступления из других водных объектов, с поверхностными и подземными стоками, с атмосферными осадками, с промышленными и хозяйственно-бытовыми сточными водами. Образующиеся в водоеме и поступающие в него извне органические вещества весьма разнообразны по своей природе и химическим свойствам, в том числе по устойчивости к действию разных окислителей. Соотношение содержащихся в воде легко- и трудноокисляемых веществ в значительной мере влияет на окисляемость воды в условиях того или иного метода ее определения.
В поверхностных водах органические вещества находятся в растворенном, взвешенном и коллоидном состояниях. Последние в рутинном анализе отдельно не учитываются, поэтому различают окисляемость фильтрованных (растворенное органическое вещество) и нефильтрованных (общее содержание органических веществ) проб.
Окисляемость подвержена закономерным сезонным колебаниям. Их характер определяется, с одной стороны, гидрологическим режимом и зависящим от него поступлением органических веществ с водосбора, с другой – гидробиологическим режимом.
В водоемах и водотоках, подверженных сильному воздействию хозяйственной деятельности человека, изменение окисляемости выступает как характеристика, отражающая режим поступления сточных вод. Для природных малозагрязненных вод рекомендовано определять перманганатную окисляемость; в более загрязненных водах определяют, как правило, бихроматную окисляемость (ХПК).
В программах мониторинга ХПК используется в качестве меры содержания органического вещества в пробе, которое подвержено окислению сильным химическим окислителем. ХПК применяют для характеристики состояния водотоков и водоемов, поступления бытовых и промышленных сточных вод (в том числе, и степени их очистки), а также поверхностного стока (табл. 18).
Для вычисления концентрации углерода, содержащегося в органических веществах, значение ХПК (мг О/дм 3 ) умножается на 0,375 (коэффициент, равный отношению количества вещества – эквивалента углерода к количеству вещества – эквивалента кислорода).
Величины ХПК в водоемах с различной степенью загрязненности [1]
Степень загрязнения (классы водоемов)
Присутствующие в воде органические соединения могут претерпевать не только аэробное биохимическое окисление в результате жизнедеятельности бактерий, используемое при определении БПК. При наличии в пробе воды сильных окислителей и соответствующих условий протекают химические реакции окисления органических веществ, причем характеристикой процесса химического окисления, а также мерой содержания в пробе органических веществ является потребление в реакции кислорода, химически связанного в окислителях. Показатель, характеризующий суммарное содержание в воде органических веществ по количеству израсходованного на окисление химически связанного кислорода, называется химическим потреблением кислорода (ХПК).
Являясь интегральным (суммарным) показателем, ХПК в настоящее время считается одним из наиболее информативных показателей антропогенного загрязнения вод. Этот показатель, в том или ином варианте, используется повсеместно при контроле качества природных вод, исследовании сточных вод и др. Результаты определения окисляемости выражаются в миллиграммах потребленного кислорода на 1 л воды (мгО/л).
Однако не все органические вещества в равной степени участвуют в реакции химического окисления. Так же, как и при биохимическом окислении, при химическом окислении можно выделить группы легко, нормально и тяжело окисляющихся органических веществ. Поэтому всегда существует разница между теоретически возможным и практически достигаемым значениями ХПК.
Теоретическим значение ХПК (ХПКтеор) называют количество кислорода (или окислителя в пересчете на кислород) в мг/л, необходимое для полного окисления содержащихся в пробе органических веществ, т.е. всех способных окисляться элементов из состава органического соединения. При таком окислении углерод теоретически количественно окисляется до СО2, а сера и фосфор (если они присутствуют в соединении) – до SО3 и Р2О5. Азот превращается в аммонийную соль; кислород, входивший в состав окисляемых органических молекул, является «строительным материалом» для образующихся продуктов окисления, а водород переходит в структуру Н2О или аммонийной соли.
Например, при окислении синильной кислоты и гликоля протекают реакции:
Практически используемые методы определения ХПК дают результаты, близкие к ХПКтеор, но всегда отклоняющиеся в ту или иную сторону. При наличии трудно окисляющихся органических веществ их окисление за время реакции проходит не полностью, и это приводит к занижению результата. В то же время, при наличии в пробе неорганических восстановителей, также потребляющих кислород на собственное окисление, результат получается завышенный. Совместное действие обоих факторов и вызывает отклонение реального ХПК от ХПКтеор.
Таким образом, окисляемость, или ХПК, характеризует общее количество содержащихся в воде восстановителей (органических и неорганических), реагирующих с сильными окислителями. В качестве таких окислителей обычно используют бихромат- и перманганат-анионы, и соответственно называются основные методы определения ХПК — бихроматный и перманганатный. Следует отметить, что результаты определения окисляемости одной и той же воды с помощью разных окислителей обычно неоднозначны из-за неодинаковой степени окисления веществ, присутствующих в воде. Результаты зависят также от свойств окислителя, его концентрации, температуры, рН, продолжительности окисления и др. Получаемые результаты сопоставимы только в том случае, когда точно соблюдены все условия проведения анализа.
Бихроматная окисляемость позволяет получить значение ХПК, наиболее приближенное к ХПКтеор, т.е. наиболее полное окисление достигается бихроматом калия. Поэтому определение бихроматной окисляемости является основным методом определения ХПК. Именно бихроматную окисляемость часто называют «химическим потреблением кислорода». В условиях этого метода большинство органических соединений окисляется на 95 % и более, однако окисляются не все соединения (толуол, бензол, пиридин, парафин и др. практически не окисляются). Катализатором окисления является сульфат серебра, который добавляется в аналитическую рецептуру для ускорения реакции и повышения полноты окисления органических веществ. Избыток бихромата оттитровывается раствором соли Мора. Реакцию проводят в жестких условиях – в 50 %-ной
(разбавление 1:1) серной кислоте при кипячении. Содержание неорганических восстановителей в пробе определяют отдельно специальными методами и вычитают из ХПК пробы.
Бихромат при этом восстанавливается согласно уравнению:
В таких условиях получаемый результат обычно составляет 95-98 % от ХПКтеор.
На примере окисления фталата калия бихроматом реакцию можно записать следующим образом:
Из уравнения реакции следует, что на окисление 2 молекул фталата калия расходуется 16 молекул кислорода, связанного в бихромате. В весовом отношении ХПКтеор для 1 мг фталата калия составляет 1,175 мгО.
Значения ХПКтеор (в мг кислорода на 1 мг вещества) для разных соединений, по данным [26], приведены в табл. 19.
Значения ХПКтеор для разных соединений
Бихроматная окисляемость определяется методом титрования. Соответствующие методики, с незначительными различиями, регламентированы как отечественными руководящими документами, так и международным стандартом ИСО 6060. Согласно методу титрования, избыток бихромата калия после операции окисления (уравнение реакции см. выше) оттитровывают солью Мора в присутствии индикатора, в качестве которого обычно используется ферроин – комплекс 1,10-фенатролина с сульфатом железа (II) (в качестве индикатора может быть также использована
М-фенилантраниловая кислота). При этом катион Fе 2+ в титранте реагирует с катионом хрома:
Для определения ХПК, наряду с окислением бихроматом, проводят также окисление перманганатом. Соответствующий показатель называется перманганатной окисляемостыо (за рубежом также используют термин «перманганатный индекс»). Перманганатная окисляемость является мерой загрязнения воды окисляемыми органическими и неорганическими веществами, способными к окислению в условиях анализа, и такими условиями являются окисление 0,01 н. раствором перманганата калия в сернокислой среде или кипячении в течение 10 мин.
Уравнение реакции при окислении пробы перманганатом можно записать следующим образом:
Определение перманганатной окисляемости может давать некорректные результаты при анализе сточных вод по следующим причинам:
1) перманганат – недостаточно сильный окислитель, поэтому окисление многих веществ проходит неполно или совсем не проходит;
2) при кипячении растворов, содержащих перманганат, последний разлагается до диоксида марганца и кислорода (как в кислой, так и в щелочной средах). Выпадающий диоксид марганца каталитически ускоряет процесс, однако в холостой пробе или относительно чистой воде этого не происходит. Процесс осложняется тем, что количество выпадающего диоксида марганца зависит от условий и состава анализируемой пробы.
Следует отметить, что в природных водах содержание трудно окисляющихся органических веществ обычно крайне мало, и результаты, получаемые при анализе природных вод бихроматным и перманганатным методами, практически достаточно близки.
Перманганатную окисляемость используют для оценки качества питьевой, водопроводной воды, природной воды источников водоснабжения и др. Ее определение предусмотрено ГОСТ 2761 при обследовании источников хозяйственно-питьевого водоснабжения. Более загрязненные поверхностные и сточные воды также, с известным приближением, можно анализировать этим методом, однако их необходимо разбавлять. Перманганатную окисляемость нельзя рассматривать как меру теоретического потребления кислорода или общего содержания органических веществ в воде, т.к. ряд органических соединений в условиях этого метода окисляется лишь частично.
Таким образом, для характеристики ХПК как показателя химической активности пробы, традиционно используются методы «мокрой» химии. Тем не менее, ХПК определяют также и «сухимии» приборными методами. Например, методами сжигания органических веществ пробы в токе кислорода или СО2. Эти методы также позволяют получить результаты, близкие ХПКтеор, однако требуют приборного оснащения, а приборы – соответствующего обслуживания, поверки и т.п.
Мешают точному определению ХПК в первую очередь, хлорид-анионы, как правило, содержащиеся в природных и, особенно, в сточных водах. Хлориды окисляются в условиях анализа до элементарного хлора, поэтому при содержании в пробе в концентрации свыше 300 мг/л их влияние устраняется (или минимизируется) путем добавления сульфата ртути (II) в количестве 22,2 мг Н2SО4 на 1 мг С1. Образующийся малодиссоциированный хлорид ртути (II) устойчив в присутствии большой концентрации серной кислоты и бихромата.
Помимо хлоридов и нитритов, определению мешают сульфиды, сероводород и железо. Все указанные соединения, при их присутствии в пробе, могут быть определены индивидуально, и результат анализа на окисляемость, в таком случае, уменьшают на величину потребления кислорода этими соединениями. В частности, 1 мг Н2S соответствует 0,47 мг О; 1 мг NО2 – – 0,35 мг O; 1 мг Fе 2+ – 0,14 мг О.
Нормативы на ХПК в воде водоемов: для питьевой воды – 5,0 мгО/л (для перманганатной окисляемости), ХПК – 15 мгО/л.
Перманганатная окисляемость
Химическое обозначение: перманганатная окисляемость (ПО).
Синонимы: окисляемость.
Описание: интегральный показатель, который характеризует содержание в воде восстановителей (например железа (II)) и органических веществ, которые полностью или частично окисляются ионом перманганата в условиях кислой или щелочной среды и при нагревании. Перманганатная окисляемость выражается в мг кислорода на 1 литр воды, что условно можно интерпретировать как количество кислорода, которое требуется для окисления веществ в воде.
Методы определения: обратное титрование.
Методики, используемые в Испытательном центре МГУ для определения перманганатной окисляемости в природных средах
| Нормативный документ на методику | Метод определения | Оборудование |
|---|---|---|
| Вода | ||
| ПНД Ф 14.1:2:4.154 | обратное титрование | вспомогательное оборудование |
| Почва | ||
| Перманганатная окисляемость не определяется в почве — её можно определить только в водной вытяжке, но этот параметр не будет нести какой-либо информации | ||
Распространённость: иперманганатная окисляемость обусловлена наличием в воде большой группы веществ и элементов. При этом нужно помнить, что перманганат — не самый сильный окислитель, поэтому часть органического вещества может быть не учтена. Вклад в этот параметр вносят не только соединения, опасные для здоровья, но также полезные или нейтральные, например:
Нормирование
Обнаружение значений окисляемости, превышающих предельно допустимые, само по себе не даёт информации о составе воды, но даёт повод провести расширенные исследования для выявления причины превышения. К опасным веществам, вызывающим превышения окисляемости, относятся:
Перманганатная окисляемость нормируется только в питьевой воде, аналогичный параметр для природных вод водоемов и сточных вод — химическое потребление кислорода (ХПК). При его определении использую более сильный окислитель бихромат и агрессивные условия.
Предельно допустимая концентрация (ПДК) перманганатной окисляемости в различных водных объектах
| Нормирование | ПДК, мг/л |
|---|---|
| Бутилированная вода первой категории СанПиН 2.1.4.1116-02 | 0–3,0 |
| Бутилированная вода высшей категории СанПиН 2.1.4.1116-02 | 0–2,0 |
| Вода систем централизованного водоснабжения СанПиН 2.1.4.1074-01 | 0–5,0 |
| Водные объекты рыбохозяйственного значения Приказ Минсельхоза РФ № 552 | 0–40 |
| Объекты рекреационного водопользования СанПиН 2.1.5.980-00 | — |
| Вода плавательных бассейнов СанПиН 2.1.2.1188-03 | — |
| Хозяйственно-бытовые стоки Постановление Правительства РФ № 644 | — |
| Ливневые стоки Постановление Правительства РФ № 644 | — |
Польза и вред
Поскольку перманганатная окисляемость — интегральный параметр, сам по себе он не несёт вреда или пользы для здоровья человека. Его основная задача — предоставление возможности оперативно заметить отклонения от нормы и провести развернутый анализ группы органических веществ и восстановителей или принять решение об установке фильтров. Также этот показатель помогает оперативно контролировать качество водопроводной и бутилированной воды и соблюдение правил технологических процессов.
Методы очистки воды
Ионный обмен. Используется, как правило, в сочетании с ионным обменом для других компонентов в воде, например железа: органические вещества способны образовывать хорошо растворимые комплексные соединения с железом. Это усложняет процедуру обезжелезивания. В таких случаях используют смеси ионообменных смол, которые сорбируют и органические вещества, и железо.
Дозирование окислителей. Эффективно показатель перманганатной окисляемости снижает добавление в воду окислительных агентов: к ним относятся гипохлорит (часто применяется для дезинфекции и защиты от микробиологического загрязнения воды), перекись водорода и др. Также помогает озонирование воды. Такой подход может применяться для решения комплекса проблем — обеззараживания и снижения содержания органического вещества.
Не все окислительные агенты безопасны для здоровья даже в остаточных количествах. Перед применением убедитесь, что вещество не нанесет вред вашему организму.
Угольные фильтры. Угольные фильтры обладают средней эффективностью фильтрации в отношении органических веществ. Они наиболее эффективны в сочетании с предварительным дозированием окислителей.
Обратный осмос. Вместе с другими веществами обратный осмос убирает из воды органику, поэтому он может применяться для снижения как самой перманганатной окисляемости как сам по себе, так и в сочетании с другими методами очистки.
Перманганатная окисляемость характеризует суммарное количество органических веществ, которых должно содержаться как можно меньше в питьевой воде. Повышенные значения этого параметра говорят о необходимости проведения более расширенных исследований и поиска источника загрязнения. Причиной превышения в колодезной воде может быть ее загрязнение (рекомендуется чистка), в воде из скважины — подмес грунтовых вод и выход из строя гидроизоляции, в водопроводе — некачественные коммуникации или сбой в системе фильтрации водоканала.
Что характеризует окисляемость воды
Присутствующие в воде органические соединения могут претерпевать не только аэробное биохимическое окисление в результате жизнедеятельности бактерий, используемое при определении БПК (см. раздел 6.2.5). При наличии в пробе воды сильных окислителей и соответствующих условий протекают химические реакции окисления органических веществ, причем характеристикой процесса химического окисления, а также мерой содержания в пробе органических веществ является потребление в реакции кислорода, химически связанного в окислителях. Показатель, характеризующий суммарное содержание в воде органических веществ по количеству израсходованного на окисление химически связанного кислорода, называется химическим потреблением кислорода (ХПК). Являясь интегральным (суммарным) показателем, ХПК в настоящее время считается одним из наиболее информативных показателей антропогенного загрязнения вод. Этот показатель, в том или ином варианте, используется повсеместно при контроле качества природных вод, исследовании сточных вод и др. Результаты определения окисляемости выражаются в миллиграммах потребленного кислорода на 1 л воды (мгО/л).
Однако не все органические вещества в равной степени участвуют в реакции химического окисления. Так же, как и при биохимическом окислении, при химическом окислении можно выделить группы легко, нормально и тяжело окисляющихся органических веществ. Поэтому всегда существует разница между теоретически возможным и практически достигаемым значениями ХПК.
Теоретическим значением ХПК (ХПКтеор) называют количество кислорода (или окислителя в пересчете на кислород) в мг/л, необходимое для полного окисления содержащихся в пробе органических веществ, т.е. всех способных окисляться элементов из состава органического соединения. При таком окислении углерод теоретически количественно окисляется до CO2, а сера и фосфор (если они присутствуют в соединении) – до SO3 и P2O5. Азот превращается в аммонийную соль; кислород, входивший в состав окисляемых органических молекул, является «строительным материалом» для образующихся продуктов окисления, а водород переходит в структуру H2O или аммонийной соли.
Например, при окислении синильной кислоты и гликоколя протекают реакции:
Практически используемые методы определения ХПК дают результаты, близкие к ХПКтеор, но всегда отклоняющиеся в ту или иную сторону. При наличии трудно окисляющихся органических веществ их окисление за время реакции проходит неполностью, и это приводит к занижению результата. В то же время, при наличии в пробе неорганических восстановителей, также потребляющих кислород на собственное окисление, результат получается завышенный. Совместное действие обоих факторов и вызывает отклонение реального ХПК от ХПКтеор.
Таким образом, окисляемость, или ХПК, характеризует общее количество содержащихся в воде восстановителей (органических и неорганических), реагирующих с сильными окислителями. В качестве таких окислителей обычно используют бихромат- и перманганат-анионы, и соответственно называются основные методы определения ХПК – бихроматный и перманганатный. Следует отметить, что результаты определения окисляемости одной и той же воды с помощью разных окислителей обычно неоднозначны из-за неодинаковой степени окисления веществ, присутствующих в воде. Результаты зависят также от свойств окислителя, его концентрации, температуры, рН, продолжительности окисления и др. Получаемые результаты сопоставимы только в том случае, когда точно соблюдены все условия проведения анализа.
Бихроматная окисляемость позволяет получить значение ХПК, наиболее приближенное к ХПКтеор, т.е. наиболее полное окисление достигается бихроматом калия. Поэтому определение бихроматной окисляемости является основным методом определения ХПК. Именно бихроматную окисляемость часто называют «химическим потреблением кислорода»*. В условиях этого метода большинство органических соединений окисляется на 95% и более, однако окисляются не все соединения (толуол, бензол, пиридин, парафин и др. практически не окисляются). Катализатором окисления является сульфат серебра, который добавляется в аналитическую рецептуру для ускорения реакции и повышения полноты окисления органических веществ. Избыток бихромата оттитровывается раствором соли Мора. Реакцию проводят в жестких условиях – в 50%-ной (18-нормальной, разбавление 1:1) серной кислоте при кипячении. Содержание неорганических восстановителей в пробе определяют отдельно специальными методами и вычитают из ХПК пробы.
Бихромат при этом восстанавливается согласно уравнению:
В таких условиях получаемый результат обычно составляет 95–98% от ХПКтеор.
На примере окисления фталата калия бихроматом реакцию можно записать следующим образом:
Из уравнения реакции следует, что на окисление 2 молекул фталата калия расходуется 16 молекул кислорода, связанного в бихромате. В весовом отношении ХПКтеор для 1 мг фталата калия составляет 1,175 мгО.
Значения ХПКтеор (в мг кислорода на 1 мг вещества) для разных соединений по данным [12] приведены в табл. 14.
Значения ХПКтеор для разных соединений
Бихроматная окисляемость определяется методом титрования. Соответствующие методики, с незначительными различиями, регламентированы как отечественными руководящими документами, так и международным стандартом ИСО 6060. Согласно методу титрования, избыток бихромата калия после операции окисления (уравнение реакции см. выше) оттитровывают солью Мора в присутствии индикатора, в качестве которого обычно используется ферроин – комплекс 1,10-фенатролина с сульфатом железа (II) (в качестве индикатора может быть также использована N-фенилантраниловая кислота). При этом катион Fe 2+ в титранте реагирует с катионом хрома:
Для определения ХПК, наряду с окислением бихроматом, проводят также окисление перманганатом. Соответствующий показатель называется перманганатной окисляемостью (за рубежом также используют термин «перманганатный индекс»). Перманганатная окисляемость является мерой загрязнения воды окисляемыми органическими и неорганическими веществами, способными к окислению в условиях анализа, и такими условиями являются окисление 0,01 ммоль/л экв. раствором перманганата калия в сернокислой среде или кипячение в течении 10 мин.
Уравнение реакции при окислении пробы перманганатом можно записать следующим образом:
Для определения перманганатной окисляемости используется более простой метод, чем для бихроматной окисляемости, однако он имеет ограниченное применение. Так, определение перманганатной окисляемости может быть рекомендовано (и широко используется) лишь при анализе природных вод для контроля за динамикой содержания легкоокисляющихся веществ природного происхождения (например, гуминовых кислот). И это понятно, т.к. «жестко» окисляющиеся органические загрязнители, часто присутствующие в сточных водах, в природной воде практически не встречаются. Следует отметить также, что именно перманганатная окисляемость является единственным показателем ХПК, регламентирующим качество питьевой воды согласно СанПиН 2.1.4.559-96 (норматив составляет 5,0 мгО/л).
Перманганатная окисляемость может давать некорректные результаты при анализе сточных вод по следующим причинам:
перманганат – недостаточно сильный окислитель, поэтому окисление многих веществ проходит неполно или совсем не проходит;
при кипячении растворов, содержащих перманганат, последний разлагается до диоксида марганца и кислорода (как в кислой, так и в щелочной средах). Выпадающий диоксид марганца каталитически ускоряет процесс, однако в холостой пробе или относительно чистой воде этого не происходит. Процесс осложняется тем, что количество выпадающего диоксида марганца зависит от условий и состава анализируемой пробы.
Как уже отмечалось, в природных водах содержание трудно окисляющихся органических веществ обычно крайне мало, и результаты, получаемые при анализе природных вод бихроматным и перманганатным методами, практически достаточно близки.
Перманганатную окисляемость используют для оценки качества питьевой, водопроводной воды, природной воды источников водоснабжения и др. Ее определение предусмотрено ГОСТом 2761 при обследовании источников хозяйственно-питьевого водоснабжения. Более загрязненные поверхностные и сточные воды** также, с известным приближением, можно анализировать этим методом, однако их необходимо разбавлять. Перманганатную окисляемость нельзя рассматривать как меру теоретического потребления кислорода или общего содержания органических веществ в воде, т.к. ряд органических соединений в условиях этого метода окисляются лишь частично.
Таким образом, для характеристики ХПК как показателя химической активности пробы, традиционно используются методы «мокрой» химии. Тем не менее ХПК определяют также и «сухими» приборными методами. Например, методами сжигания органических веществ пробы в токе кислорода или СО2. Эти методы также позволяют получить результаты, близкие ХПКтеор, однако требуют приборного оснащения, а приборы – соответствующего обслуживания, поверки и т.п.
Помимо хлоридов и нитритов, определению мешают сульфиды, сероводород и железо (2). Все указанные соединения, при их присутствии в пробе, могут быть определены индивидуально, и результат анализа на окисляемость в таком случае уменьшают на величину потребления кислорода этими соединениями. В частности, 1 мг H2S соответствует 0,47 мгО, 1 мг NO 2– – 0,35 мгО, 1 мг Fe 2+ – 0,14 мгО.
Нормативы на ХПК в воде водоемов: для питьевой воды – 5,0 мгО/л (для перманганатной окисляемости), ХПН – 15 мгО/л; КБН – 30 мгО/л (для бихроматной окисляемости).
* Показатель ХПК по международной терминологии (англ.) называется «Сhemical oxyden demand» (COD). При этом имеется в виду исключительно бихроматная окисляемость.
** Для оценки загрязненности сточных вод органическими веществами используют обычно бихроматную окисляемость.