что относится к химическим свойствам
Химические свойства
К химическим свойствам относятся способность реагировать с другими веществами, способность к разложению и к диссоциации. Одним из фундаментальных химических свойств химического элемента является его электроотрицательность.
В отличие от физических свойств, химические свойства вещества, такие как реакционная способность, трудно сопоставить с одной прямо измеримой численной величиной. Для характеристики реакционной способности используется ряд численных значений, каждое из которых зависит от конкретных условий измерения. Поэтому реакционная способность вещества воспринимается не как непосредственное свойство, а как обобщение результатов химических исследований.Химические свойства вещества зависят не только от того, из каких химических элементов оно состоит, но и от структуры молекул вещества (структурная изомерия) и от пространственной конфигурации молекул (конформация, стереоизомерия). Как правило, вещества, имеющие одинаковый состав и структуру, имеют и одинаковые химические свойства, за исключением реакций с веществами другой пространственной конфигурации. Это различие особенно важно в биохимии, например, способность белка к реакции с другими биологически активными веществами может зависеть от способа его сворачивания.
Связанные понятия
Вещества, изучаемые химией (chemical substance) — вещества, состоящие из атомов; вещества, в которых выделение атомов невозможно или теряет физический смысл (например, плазма или звёздное вещество), к предмету рассмотрения химией не относят. Состоящее из атомов вещество — основной объект изучения химии. Вещества в химии принято разделять на индивидуальные вещества (простые и сложные), организованные в атомы, молекулы, ионы и радикалы, и их смеси. Простое вещество образовано атомами одного химического.
Упоминания в литературе
Связанные понятия (продолжение)
Углерод — вещество с самым большим числом аллотропических модификаций (более 9 обнаруженных на данный момент).
Химические свойства
Химические свойства — свойства веществ (химических элементов, простых веществ и химических соединений), имеющие отношение к химическим процессам, то есть проявляемые в процессе химической реакции.
Химические свойства вещества зависят не только от того, из каких химических элементов оно состоит, но и от структуры молекул вещества (структурная изомерия) и от пространственной конфигурации молекул (конформация, стереоизомерия). Как правило, вещества, имеющие одинаковый состав и структуру, имеют и одинаковые химические свойства, за исключением реакций с веществами другой пространственной конфигурации. Это различие особенно важно в биохимии, например, способность белка к реакции с другими биологически активными веществами может зависеть от способа его сворачивания.
Примеры химических свойств
См. также
Примечания
Полезное
Смотреть что такое «Химические свойства» в других словарях:
Химические свойства — – определяют способность материала к химическим превращениям при контакте с веществами внешней среды (в том числе агрессивной), к сохранению состава и структуры в условиях инертной окружающей среды, химическому взаимодействию компонентов… … Энциклопедия терминов, определений и пояснений строительных материалов
химические свойства — — [http://www.eionet.europa.eu/gemet/alphabetic?langcode=en] EN chemical property Properties of a substance depending on the arrangement of the atoms in the molecule, e.g. bio availability, degradability, persistence, etc. (Source: RRDA)… … Справочник технического переводчика
химические свойства — – совокупность электромагнитных взаимодействий между химическими элементами, приводящих к образованию равновесных устойчивых систем (молекул, ионов, радикалов). Словарь по аналитической химии [3] … Химические термины
химические свойства — cheminės savybės statusas T sritis automatika atitikmenys: angl. chemical properties vok. chemische Eigenschaften, f rus. химические свойства, n pranc. propriétés chimiques, f … Automatikos terminų žodynas
Химические свойства спиртов — Химические свойства спиртов это химические реакции спиртов во взаимодействии с другими веществами. Они определяются в основном наличием гидроксильной группы и строением углеводородной цепи, а также их взаимным влиянием: Чем больше… … Википедия
Физико-химические свойства — – характеризуют влияние физического состояния материала на протекание определенных химических процессов (например, степень дисперсности материала влияет на кинетику химических реакций). [Косых, А. В. Искусственные и природные строительные… … Энциклопедия терминов, определений и пояснений строительных материалов
Физико-химические свойства огнеупорного сырья — [огнеупора] –совокупность химического и/или зернового состава огнеупорного сырья [огнеупора], его термомеханических и теплофизических свойств, определяющих область применения. [ГОСТ Р 52918 2008] Рубрика термина: Сырье Рубрики энциклопедии … Энциклопедия терминов, определений и пояснений строительных материалов
Физико-химические свойства пластовых флюидов — Значимость предмета статьи поставлена под сомнение. Пожалуйста, покажите в статье значимость её предмета, добавив в неё доказательства значимости по частным критериям значимости или, в случае если частные критерии значимости для… … Википедия
физические и химические свойства — fizikinės ir cheminės savybės statusas T sritis automatika atitikmenys: angl. physicochemical properties vok. physikalish chemische Eigenschaften, f rus. физические и химические свойства, n pranc. propriétés physico chimiques, f … Automatikos terminų žodynas
физико-химические свойства — — [А.С.Гольдберг. Англо русский энергетический словарь. 2006 г.] Тематики энергетика в целом EN physicochemical properties … Справочник технического переводчика
Виды и характеристики химических свойств
Объектом химии считается вещество и влияние на него звуковых и магнитных полей. Само понятие имеет массу и бывает в трёх агрегатных состояниях — твёрдом, газообразном и жидком. Для каждого компонента характерны определённые химические свойства. При их вступлении в реакцию получается новое образование, например, нагретый сахар превращается в уголь и воду.
Объекты и задачи предмета
На уроках химии школьники изучают особенности превращения одних веществ в другие. К задачам предмета относится определение, с какими химическими компонентами при определённых условиях реагирует то либо иное вещество, что при этом образуется. Дополнительно изучаются условия, при которых протекают подобные превращения, и методы получения нужного состояния.
Под химсвойствами подразумевается совокупность информации о том, с какими иными компонентами и при каких условиях вступает во взаимодействие данное вещество. Атомы — частицы, которые участвуют в превращениях. При реакции они перегруппировываются. Старые связи между ними разрушаются, но возникают новые.
Для каждого вида атома характерен конкретный химический элемент (ХМ) — совокупность атомов с близкими либо одинаковыми характеристиками. В природе известно до 90 разных ХМ. Учёные в области физики способны создать новые виды атомов, которые отсутствуют на Земле. Такие компоненты называются искусственными. Их число превышает два десятка. У ХМ имеется латинское название и символ из 1−2 букв. От класса соединения зависит, какие химические свойства (ХС) характерны: кислоты, галогены, спирт.
Под ХС понимается способность взаимодействовать с иными компонентами, а также распадаться и диссоциироваться. Главное свойство — электроотрицательность. Чтобы описать реакционную способность, используются некоторые численные значения. Каждое из них зависит от определённых условий измерения.
ХС зависит от структуры молекул, степени их пространственности. Для веществ с одним составом и структурой характерны одинаковые виды химических свойств, кроме реакций с ХМ иной пространственной конфигурации.
Электролиты и галогены
Кислоты участвуют в реакциях с переходом электрона. Химические характеристики, свойственные для образования, зависят от его названия. Электролиты появляются в результате диссоциации водорода, который легко замещается металлами с последующим формированием соли.
Для кислот характерно сообразование гидратированных ионов, которые придают соответствующий вкус и способность изменять цвет. Другое химическое вещество — галоген. В переводе с греческого означает «рождение, происхождение». Компоненты относятся к основной подгруппе VII группы таблицы Менделеева. Им свойственно реагировать с любым простым элементом, кроме неметаллов.
Галогены считаются энергетическими окислителями, поэтому в природе встречаются в качестве соединений. При увеличении номера уменьшается активность галогенов:
Взаимодействуя с металлами, формируется ионная связь, образуется соль. Все представители группы, кроме фтора, взаимодействуя с электроотрицательными компонентами, проявляют восстановительные свойства. Для них характерна высокая окислительная активность. Она уменьшается в процессе перехода от фтора к астату.
Сам фтор (F) считается самым активным галогеном. Он реагирует с любым металлом. Без нагрева он реагирует с неметаллами. Облучение способствует образованию инертного газа. Энергично протекает взаимодействие фтора со сложным веществом. Таким методом окисляется вода, а реакция приобретает взрывной характер.
Аналогичное явление наблюдается при освещении хлора (Cl) с водородом. Первый компонент быстро реагирует со сложными ХМ. При нагреве легко вытесняется йод либо бром из соединения хлора с металлом. При взаимодействии с водой наблюдаются следующие явления:
Cl легко диспропорционируется со щелочами. Бром (Br) способен быстро растворяться в воде, частично реагируя с Н2О, образуя бромную воду.
Йод в воде не растворяется и не окисляется при нагревании. При этом он способен расщепляться в иодидных растворах, образуя комплексные анионы, включая раствор Люголя.
Йод отличается от других ХМ своей активностью. Он не вступает в реакцию со многими неметаллами, а с металлами при нагревании реагирует медленно. Для реакции водорода и йода характерна эндотермичность и сильнообратимость. Учёные доказали, что химическая активность галогенов уменьшается последовательно от F к астату (At). Каждый компонент из ряда вытесняет последующий из его соединений с металлом либо водородом. Любой галоген окисляет галогенид-ион любого из последующих галогенов. В процессе диссоциации формируются протоны, ионы.
Взаимодействие со спиртами
К химическим элементам относятся спирты. Они легко вступают в реакцию с иными компонентами и относятся к гидроксильной группе, для которой характерно наличие углеводородной цепи. Чем она больше, тем сильнее влияет на функциональную группу. При этом снижается полярность связи О-Н.
При разрыве связи реакция протекает медленно. На основе гидроксильной группы наблюдается отрицательный индуктивный эффект. В основе классификации спиртов на группы лежат их химические свойства. Специалисты выделяют воду либо оксид водорода, металлы, простые вещества. Первый компонент представлен в виде прозрачной жидкости без цвета, вкуса и запаха. Его свойства:
Н2О считается самым распространённым растворителем на Земле. Химически вода активна. Её полярные молекулы способствуют образованию гидратов и кристаллогидратов. Н2О при комнатной температуре реагирует со следующими компонентами:
При нагревании она вступает в реакцию с магнием и железом, метаном и углём. На основе катализаторов образуется ацетилен, алкен, амидам.
Описание металлов
К простым ХМ относятся металлы. Для них характерны следующие свойства: высокие электро- и теплопроводность, пластичность, блеск, положительное сопротивление. Внешний электронный уровень представлен в виде незначительного числа электронов (максимум три). Вступая в реакцию, они выполняют функции восстановителей, отдавая свои электроны.
С кислородом взаимодействуют все элементы группы, кроме платины и золота. Реакция с серебром возможна, если достигнута высокая температура. Из-за термической неустойчивости оксид серебра не образуется. Перечень элементов, которые появляются на выходе (зависит от названия металла, который участвует в реакции):
Для получения пероксида используется металл. С малоактивным и средним компонентом реакции возникает при нагревании. Взаимодействие с азотом осуществляется на основе максимально активных металлов (АМ). При комнатной температуре взаимодействует только литий, который способствует появлению нитридов. При нагревании серы и железа получается сульфид.
С водородом и углеродом взаимодействуют наиболее АМ. С кислотами металл реагирует по-разному. ХМ, которые находятся в таблице до водорода, взаимодействуют с любой кислотой. Неокисляющие вещества с металлами участвуют в реакции замещения, для которой свойственно окисление и восстановление.
Окисляющая кислота, вступая в реакцию с металлом, расположенным после водорода, образует следующие продукты:
При взаимодействии железа и HNO3 различной концентрации получается Cu, NO. Больше вариантов реакций характерно для взаимодействия с АМ. Современные химики разработали технологию легирования, с помощью которой осуществляется ввод в расплав дополнительных ХМ. Они легко модифицируют физические, механические и химические свойства главного материала.
Вещество. Химические свойства.
Химические свойства — умение веществ (химических элементов, простых веществ и химических соединений) взаимодействовать с иными веществами либо видоизменяться под воздействием некоторых факторов. Результатом будет видоизменение первоначального вещества либо веществ в иные вещества.
К химическим свойствам причисляют умение реагировать с другими веществами и умение разлагаться.
Химические свойства вещества обусловлены не только тем, какими химическими элементами оно образовано, но и строением молекулы вещества, а так же пространственной конфигурацией молекул. Чаще всего, веществам с идентичным составом и структурой будут присущи и однотипные химические свойства, исключение составляет взаимодействие с веществами с несхожей пространственной конфигурацией.
К примеру, кислотные свойства демонстрируют те вещества, которые своеобразно меняют цвет индикаторов (метилоранжа с оранжевого на красный); могут растворять преобладающее число металлов с выделением (в подавляющем числе опытов) водорода; растворяют значительную часть оксидов металлов (основных оксидов); реакции со щелочами протекают с формированием соли и воды.
Химические свойства простых веществ. Химические свойства сложных вещест
Характерные химические свойства простых веществ — металлов: щелочных, щелочноземельных, алюминия, переходных металлов — меди, цинка, хрома, железа
С развитием производства металлов (простых веществ) и сплавов связано возникновение цивилизации (бронзовый век, железный век).
И, конечно же, мы не должны забывать, что в большинстве сплавов используют давно известный металл железо, а основу многих легких сплавов составляют сравнительно «молодые» металлы — алюминий и магний.
Сверхновыми стали композиционные материалы, представляющие, например, полимер или керамику, которые внутри (как бетон железными прутьями) упрочнены металлическими волокнами из вольфрама, молибдена, стали и других металлов и сплавов — все зависит от поставленной цели и необходимых для ее достижения свойств материала.
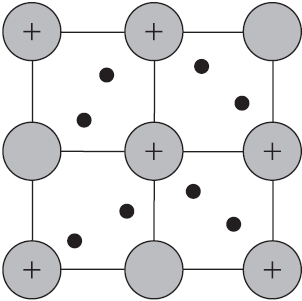
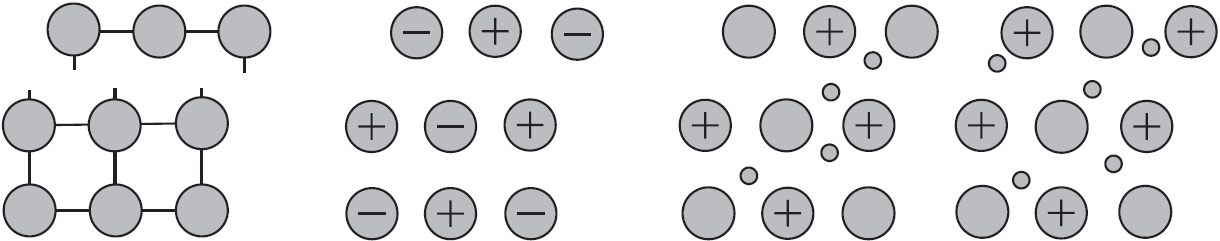
Такую химическую связь называют металлической. Металлическую связь образуют элементы, атомы которых на внешнем слое имеют мало валентных электронов по сравнению с большим числом внешних энергетически близких орбиталей. Их валентные электроны слабо удерживаются в атоме. Электроны, осуществляющие связь, обобществлены и перемещаются по всей кристаллической решетке в целом нейтрального металла.
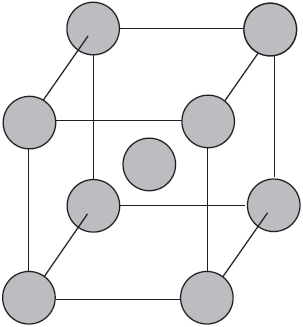
Веществам с металлической связью присущи металлические кристаллические решетки, которые обычно изображают схематически так, как показано на рисунке. Катионы и атомы металлов, расположенные в узлах кристаллической решетки, обеспечивают ее стабильность и прочность (обобществленные электроны изображены в виде черных маленьких шариков).
Металлическая связь — это связь в металлах и сплавах между атомионами металлов, расположенными в узлах кристаллической решетки, осуществляемая обобществленными валентными электронами.
Некоторые металлы кристаллизуются в двух или более кристаллических формах. Это свойство веществ — существовать в нескольких кристаллических модификациях — называют полиморфизмом.
Например, железо имеет четыре кристаллических модификации, каждая из которых устойчива в определенном температурном интервале:
Олово имеет две кристаллические модификации:
Конечно, особый вид химической связи и тип кристаллической решетки металлов должны определять и объяснять их физические свойства.
Каковы же они? Это металлический блеск, пластичность, высокая электрическая проводимость и теплопроводность, рост электрического сопротивления при повышении температуры, а также такие значимые свойства, как плотность, высокие температуры плавления и кипения, твердость, магнитные свойства.
Давайте попробуем объяснить причины, определяющие основные физические свойства металлов.
Почему металлы пластичны?
Механическое воздействие на кристалл с металлической кристаллической решеткой вызывает смещение слоев ион-атомов друг относительно друга, а так как электроны перемещаются по всему кристаллу, разрыв связей не происходит, поэтому для металлов характерна большая пластичность.
Аналогичное воздействие на твердое вещество с ковалентными связями (атомной кристаллической решеткой) приводит к разрыву ковалентных связей. Разрыв связей в ионной решетке приводит к взаимному отталкиванию одноименно заряженных ионов. По этому вещества с атомными и ионными кристаллическими решетками хрупкие.
Почему металлы имеют характерный блеск, а также непрозрачны?
Электроны, заполняющие межатомное пространство, отражают световые лучи (а не пропускают, как стекло), причем большинство металлов в равной степени рассеивают все лучи видимой части спектра. Поэтому они имеют серебристо-белый или серый цвет. Стронций, золото и медь в большей степени поглощают короткие волны (близкие к фиолетовому цвету) и отражают длинные волны светового спектра, поэтому имеют светло-желтый, желтый и медный цвета.
Хотя на практике металл не всегда нам кажется светлым телом. Во-первых, его поверхность может окисляться и терять блеск. Поэтому самородная медь выглядит зеленоватым камнем. А во-вторых, и чистый металл может не блестеть. Очень тонкие листы серебра и золота имеют совершенно неожиданный вид — они имеют голубовато-зеленый цвет. А мелкие порошки металлов кажутся темно-серыми, даже черными.
Наибольшую отражательную способность имеют серебро, алюминий, палладий. Их используют при изготовлении зеркал, в том числе и в прожекторах.
Почему металлы имеют высокую электрическую проводимость и теплопроводны?
Хаотически движущиеся электроны в металле под воздействием приложенного электрического напряжения приобретают направленное движение, т. е. проводят электрический ток. При повышении температуры металла возрастают амплитуды колебаний находящихся в узлах кристаллической решетки атомов и ионов. Это затрудняет перемещение электронов, электрическая проводимость металла падает. При низких температурах колебательное движение, наоборот, сильно уменьшается и электрическая проводимость металлов резко возрастает. Вблизи абсолютного нуля сопротивление у металлов практически отсутствует, у большинства металлов появляется сверхпроводимость.
Следует отметить, что неметаллы, обладающие электрической проводимостью (например, графит), при низких температурах, наоборот, не проводят электрический ток из-за отсутствия свободных электронов. И только с повышением температуры и разрушением некоторых ковалентных связей их электрическая проводимость начинает возрастать.
Наибольшую электрическую проводимость имеют серебро, медь, а также золото, алюминий, наименьшую — марганец, свинец, ртуть.
Чаще всего с той же закономерностью, как и электрическая проводимость, изменяется теплопроводность металлов.
Она обусловлена большой подвижностью свободных электронов, которые, сталкиваясь с колеблющимися ионами и атомами, обмениваются с ними энергией. Происходит выравнивание температуры по всему куску металла.
Механическая прочность, плотность, температура плавления у металлов очень сильно отличаются. Причем с увеличением числа электронов, связывающих ион-атомы, и уменьшением межатомного расстояния в кристаллах показатели этих свойств возрастают.
Кальций, имеющий два электрона на внешнем энергетическом уровне атомов, гораздо более тверд и плавится при более высокой температуре ($842°С$).
Еще более прочной является кристаллическая решетка, образованная ионами скандия, который имеет три валентных электрона.
Металлы по-разному взаимодействуют с магнитным полем. Такие металлы, как железо, кобальт, никель и гадолиний выделяются своей способностью сильно намагничиваться. Их называют ферромагнетиками. Большинство металлов (щелочные и щелочноземельные металлы и значительная часть переходных металлов) слабо намагничиваются и не сохраняют это состояние вне магнитного поля — это парамагнетики. Металлы, выталкиваемые магнитным полем, — диамагнетики (медь, серебро, золото, висмут).
В технике принято классифицировать металлы по различным физическим свойствам: