что относится к иммуноглобулинам препараты
Иммуноглобулины на страже здоровья
Лекарства на основе иммуноглобулинов (или антител) известны давно. Еще в начале XX века немецкий ученый Эмиль Беринг изобрел препарат для лечения дифтерии на основе сыворотки крови переболевших, и именно за это получил самую первую Нобелевскую премию по физиологии и медицине. Учение об антителах стало одним из перспективных направлений в науке на долгие годы вперед.
На практике это сделало возможным появление новых лекарств против опасных заболеваний, таких как гепатит B, клещевой энцефалит, столбняк и др. Но несмотря на доказанную пользу и вируснейтрализующее действие, у иммуноглобулинов первого поколения были выраженные побочные эффекты и неудобная форма приема – внутримышечная. Она была болезненной и имела ограничения по объему, допустимому для введения в организм. Это заставило ученых сконцентрироваться на инновациях в области иммуноглобулинов. Дальнейший рост производства был неразрывно связан с прогрессом в технологиях очистки, повышающих безопасность препаратов.
В XXI столетии мировые лидеры в этом направлении используют современные стандарты многоступенчатой очистки иммуноглобулинов. Благодаря им примеси, провоцирующие побочные реакции в препарате сведены к минимуму, а концентрация чистого иммуноглобулина класса G достигает 98%. Препараты последнего поколения безопасны и защищены от вирусов. Именно передовые методы очистки позволили использовать потенциал антител в борьбе с инфекционными агентами в полной мере.
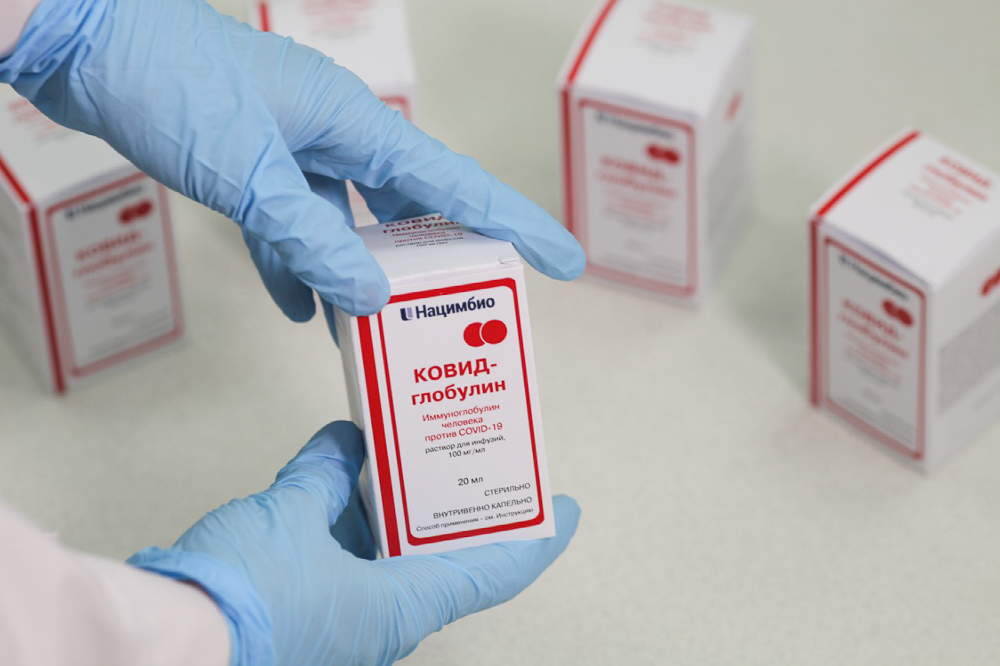
Сегодня разработки холдинга «Нацимбио» Госкорпорации Ростех приходят на помощь и в борьбе с коронавирусной инфекцией – недавно в России был официально одобрен ее препарат направленного действия «КОВИД-глобулин». Это первый в мире зарегистрированный препарат иммуноглобулинов из плазмы крови для лечения COVID-19.
Рассказываем о том, что такое иммуноглобулины, об истории изучения антител, их применении в борьбе с коронавирусом.
История вопроса: как антитела превратились в «волшебную пулю»
Иммуноглобулины (антитела) – это особые белки, которые участвуют в иммунном ответе. Они связываются с фрагментами опасных «врагов» нашего организма – бактерий, вирусов, грибов, собственных опухолевых клеток, токсинов, и запускают механизм уничтожения угрозы. Антитела можно назвать эволюционным изобретением человека, как и всех позвоночных животных. В день наш организм производит порядка 2-3 граммов разнообразных антител. Всего в течение жизни в человеческом теле может синтезироваться огромное множество уникальных вариантов разновидностей иммуноглобулинов. Благодаря этому наш организм способен подобрать специфическое антитело к любому из опасных агентов, с которым встретится.
Изучать эти процессы ученые начали во второй половине XIX века. Именно тогда зародилась иммунология, появились первые данные о способности организма распознать и победить возбудителя заболевания при повторной встрече с ним. Конечно, основу заложил еще английский врач Эдвард Дженнер, который в конце XVIII века изобрел первую вакцину против натуральной оспы. Позже ученые выяснили, что такая защита возможна благодаря особым веществам в жидкой части крови – сыворотке. Значит сыворотку можно ввести в организм вместо прививки и добиться временной защиты или помочь справиться с инфекцией уже больному человеку. Первым на практике это успешно продемонстрировал немецкий ученый Эмиль Беринг в конце XIX века, когда изобрел препарат для лечения дифтерии на основе сыворотки крови переболевших.

Эмиль Беринг с ассистентом
В то время дифтерия уносила тысячи детских жизней по всему миру – каждый двадцатый ребенок в Европе и США становился жертвой этой коварной болезни. Медики были бессильны, поэтому первый успех антидифтерийной сыворотки Беринга для кого-то стал настоящим рождественским чудом. В ночь перед Рождеством 1891 года умирающие от дифтерии пациенты Берлинского детского госпиталя получили инъекцию спасительной сыворотки Беринга. Тогда этот укол оказался последним шансом на жизнь для многих маленьких пациентов, но не стал спасением для всех.
Доработать и довести до совершенства противодифтерийную сыворотку Берингу помог коллега и приятель врач-иммунолог Пауль Эрлих. Его глубокие познания в иммунологии помогли точнее рассчитать дозировку антитоксина и подготовить очищенные, более безопасные сыворотки. В 1894 году новая версия была успешно введена более 200 маленьким пациентам.
Популярный сегодня термин «иммуноглобулины» появился гораздо позже – в 1959 году его предложил бельгийский иммунохимик Йозеф Хереманс. Это название очень хорошо отражает двойную сущность антител – функционально они являются иммунными факторами, а по своей структуре относятся к группе белков сыворотки крови с названием «глобулины».
В 1972 году было расшифровано химическое строение антител – за это американский иммунолог Джеральд Эдельман и английский биохимик Родни Портер также получили Нобелевскую премию. Следующие два важных открытий в этой сфере произошли в 1984 году – обоснование теории идиотипической цепи и разработка методики получения моноклональных антител, которые также удостоились Нобелевской премии. С этого же периода стартовало развитие методов очистки иммуноглобулинов, которые стали ключевым условием эффективности терапии. Сегодня стандартом в этой области является хроматография.
Более ста лет исследований и четыре Нобелевские премии – такого внимания и признания не получало ни одно другое открытие в области физиологии и медицины.
Иммуноглобулинотерапия – природный механизм защиты
В наши дни иммуноглобулины используются для борьбы с различными инфекционными болезнями – клещевым энцефалитом, цитамегаловирусом, стафилококком, а также как терапия пациентов с аллергиями и первичным иммунодефицитом. В последнем случае показано лечение с использованием иммуноглобулина человека нормального. При таких видах иммунодефицитов, когда организм пациентов не способен вырабатывать антитела самостоятельно, препарат иммуноглобулина человека нормального восполняет нехватку антител, обычно циркулирующих в крови здорового человека, обеспечивая пациентам высокое качество жизни.
В случае лечения аллергии используют препарат противоаллергического иммуноглобулина. Иммуноглобулины также помогают в борьбе с аутоиммунными болезнями, такими как системная красная волчанка, синдром Гийена – Барре или синдром Кавасаки.
Иммуноглобулинотерапия в силу своей естественной природы часто прописывается беременным, когда противопоказаны многие антибиотики из-за негативного влияния на плод. При этом, антирезусный иммуноглобулин – это единственный способ избежать гемолитическую болезнь плода при резус-конфликте во время беременности.
Сегодня фарминдустрия может предложить препараты специфических иммуноглобулинов к различным видам микроорганизмов. Но даже при отсутствии нужного препарата, его можно достаточно оперативно создать. В этом и заключается одно из ключевых преимуществ иммуноглобулинов – возможность экстренно получить специфические антитела. Таким образом, иммуноглобулинотерапия незаменима при появлении новых штаммов инфекции, например, вируса гриппа, при эпидемиях, особенно в условиях отсутствия вакцины. Неудивительно, что терапия иммуноглобулином стала особо актуальной в условиях пандемии COVID-19.
Двойной иммунный ответ «ковиду»
В нашей стране одним из крупнейших производителей препаратов на основе антител является «Нацимбио». Предприятие фармхолдинга – НПО «Микроген» – выпускает «Иммуноглобулин человека нормальный», «Альбумин» и другие лекарства на основе плазмы крови, включая специфические иммуноглобулины, линейку которых недавно дополнил «КОВИД-глобулин». Таким образом, Россия получила возможность применять сразу два вида иммунизации против коронавируса – иммуноглобулин и вакцину.

Фото: Нацимбио
«Нацимбио» разрабатывал препарат при активном сотрудничестве с Департаментом здравоохранения Москвы. К этой работе были привлечены столичные врачи и эксперты, Москва также предоставила центры для проведения клинических испытаний препарата. Ну, и самое главное – это передача сырья для производства иммуноглобулина. «КОВИД-глобулин» создается на основе плазмы крови людей, обладающих антителами к вирусу SARS-CoV-2. Для этого столичный Департамент здравоохранения поставил «Нацимбио» 2,5 тонны донорской плазмы. Особенностью иммуноглобулина является применение системы хроматографической очистки, которая обеспечивает вирусную безопасность и полное отсутствие посторонних элементов и белков.
После успешно проведенных доклинических испытаний и первой фазы клинических исследований Минздрав РФ зарегистрировал «КОВИД-глобулин». В начале апреля стартовала вторая и третья фазы клинических испытаний, которые продлятся примерно полгода.
В планах на этот год – переработка не менее 15 тонн плазмы, что позволит помочь 10-15 тыс. пациентов. Стать причастным к этому большому делу может любой желающий, кто перенес COVID-19. Подробнее о том, как стать донором плазмы читайте здесь
Что относится к иммуноглобулинам препараты
Ю.В. Олефир, В.А. Меркулов, В.Д. Мосягин, М.В. Вдовиченко, В.Б. Иванов, Э.Ю. Кудашева, В.П. Бондарев, И.В. Борисевич
ФГБУ «Научный центр экспертизы средств медицинского применения» Минздрава России, Москва
Начало применения препаратов из крови человека для профилактики и лечения инфекционных болезней относится к 1910 г., когда исследователи из Института Пастера во Франции M. Nicolle и E. Consei предложили для предупреждения тифа у детей использовать сыворотку крови реконвалесцентов [1], а в 1918 г. M. Nicolle и E. Consei, а также D.L. Richardson и H. Connor независимо друг от друга успешно применили сыворотку детей, выздоровевших после перенесенной кори, для профилактики этого заболевания [2]. В СССР это направление профилактики было начато в 1925 г. [3]. Гомологичные сыворотки обладали профилактической эффективностью в отношении ряда инфекционных заболеваний, однако было много проблем с их производством и применением. Себестоимость получаемой сыворотки была высокой, в то же время пациентам требовалось введение больших доз препарата. Так, например, для профилактики кори необходимо было вводить детям в возрасте до 2 лет от 15 до 40 мл сыворотки, процедура была болезненной и небезопасной из-за высокой вероятности развития абсцессов в месте введения [4]. Практическому здравоохранению требовались более дешевые, безопасные и эффективные иммунобиологические лекарственные препараты.
В 1946 г. группа исследователей во главе с H. Gold и J.E. Cohn разработала уникальную технологию разделения фракций плазмы, ставшую впоследствии классической, и охарактеризовала каждую из фракций. Было установлено, что белковая фракция, названная гамма-глобулином, состоит из массы антител против возбудителей различных болезней. Первый в США коммерческий препарат был выпущен во флаконе объемом 2 мл под наименованием «иммунно-сывороточный глобулин (человека)» (immune serum globulin (human)). Он представлял собой приблизительно 16%-ный раствор, содержащий антитела, представленные в пуле нормальной плазмы, но в концентрации, почти в 25 раз большей. В препарате были идентифицированы антитела к возбудителям кори, скарлатины, эпидемического паротита, коклюша, краснухи, ветряной оспы, диареи новорожденных, полиомиелита, сывороточного гепатита, инфекционного гепатита, гриппа. По результатам исследований наиболее высокую эффективность препарат показал при применении для профилактики кори и инфекционного гепатита [5].
В СССР в 1948 г. исследователями Московского института эпидемиологии и бактериологии Н.В. Холчевым и Л.И. Колесниковой метод получения гамма-глобулина из сыворотки, разработанный Коном и сотрудниками, был доработан, вместо центрифугирования осадка предложен метод фильтрации [6]. Методика была принята к использованию для производства гамма-глобулина с целью профилактики кори [7]. Препарат, содержащий не менее 18% белка, для предупреждения кори вводился внутримышечно в объеме 3,0 мл (соответствовало 60 мл проти-вокоревой сыворотки) [8].
В 1952 г. военный врач O. Вruton (США) успешно использовал фракцию гамма-глобулина человека, полученную Коном и сотрудниками [9], в форме внутримышечной инъекции для профилактики хронических болезней легких и других бактериальных инфекций у детей с крайне низким содержанием иммуноглобулинов, выявленным методом электрофореза образцов крови [10]. В 1952–1953 гг. гамма-глобулин был внесен в медицинские стандарты США [11]. Таким образом, было положено начало широкого применения препаратов иммуноглобулина человека нормального (ИГЧН) в заместительной терапии первичных и некоторых вторичных иммунодефицитов (отсутствия или снижения уровня выработки антител), а также иммуномодулирующей терапии. В середине ХХ в. гамма-глобулин активно применяли для профилактики кори, краснухи, ветряной оспы, полиомиелита, эпидемического паротита и инфекционного гепатита [12–15].
Поскольку опыт исследований и практического применения показал эффективность гамма-глобулина в лечении и профилактике разнообразных болезней, на состоявшемся в декабре 1954 г. в Париже семинаре, посвященном гамма-глобулину, было принято решение изменить международное название «противокоревой гамма-глобулин» на более общее – «гамма-глобулин». В 1966 г. экспертный комитет по применению иммуноглобулина человека при Всемирной организации здравоохранения (ВОЗ) рекомендовал использовать единое международное название препарата «иммуноглобулин» [16].
Эффективность и безопасность медицинского применения препаратов ИГЧН определяются тем, что находящиеся в их составе антитела могут специфически взаимодействовать с чужеродными антигенами, а также способностью препарата вызывать неспецифические эффекты [17]. Препараты иммуноглобулина до 1981 г. (до появления методов глубокой очистки) применялись почти всегда внутримышечно. Недостатками, не решаемыми в рамках технологии получения препаратов иммуноглобулина для внутримышечного введения, являются болезненность в месте введения, низкая скорость поступления антител в системный кровоток и невозможность быстро создавать высокие концентрации антител в ситуациях, требующих неотложных лечебных мероприятий. Различные побочные явления, развивающиеся в ответ на введение таких препаратов, объединены общим названием «сывороточная болезнь» – боль в суставах, лихорадка, увеличение лимфатических узлов и эритема [4]. При внутривенном введении иммуноглобулинов для внутримышечного введения у пациентов могут развиваться анафилактоидные реакции, связанные с неспецифической активацией комплемента в результате спонтанного образования агрегатов иммуноглобулинов и наличием в препарате следовых количеств протеаз [18].
Менее токсичное подкожное введение препаратов ИГЧН практиковалось реже, т.к. этот способ введения препарата был ограничен по объему (как правило, не более 5 мл за одну инъекцию), что не позволяло использовать его в качестве средства для иммунозаместительной терапии [19].
В отчете экспертного комитета по применению иммуноглобулина при ВОЗ [16] отмечено, что начиная с 1945 г., когда гамма-глобулин начали применять для профилактики кори и инфекционного гепатита, сфера его применения значительно расширилась и получила развитие в двух направлениях: профилактика некоторых вирусных болезней (корь, инфекционный гепатит и краснуха); лечение синдромов дефицита антител для предотвращения рекуррентных бактериальных инфекций. Тем не менее в отчете было указано, что нормативная база, регламентирующая применение гамма-глобулина, должна быть пересмотрена, т.к. развитие и широкое применение безопасных и эффективных вакцин снижает необходимость пассивной иммунизации и, соответственно, применения гамма-глобулина.
Авторы отчета на основании результатов многочисленных клинических данных (в т.ч. с участием воинских контингентов в различных странах) признали, что ИГЧН не эффективен для профилактики и лечения гриппа и других респираторных вирусных инфекций.
Согласно современным требованиям ВОЗ, опыту практического применения препаратов, внутримышечное введение ИГЧН ограничено коротким перечнем показаний: профилактика гепатита А, а также некоторых специфических инфекций (например, кори) [20, 21]. Показана эффективность таких препаратов для предупреждения бактериальных инфекций у детей с наследственной агаммаглобулинемией [22].
В Российской Федерации зарегистрировано 8 препаратов ИГЧН для внутримышечного введения [23].
В инструкциях по применению отечественных препаратов указаны следующие показания: профилактика гепатита А, профилактика кори, профилактика и лечение гриппа, профилактика коклюша, профилактика менингококковой инфекции, профилактика полиомиелита, лечение гипо- и агаммаглобулинемии у детей, повышение резистентности организма в периоде реконвалесценции острых инфекционных заболеваний с затяжным течением и при хронических пневмониях. При этом перечень показаний в инструкциях по применению различных препаратов значительно различается и требует пересмотра. Результаты многочисленных клинических исследований подтвердили неэффективность применения иммуноглобулина для профилактики и лечения гриппа [24], а также внутримышечного введения препаратов для заместительной терапии и иммуномодуляции [21].
В США зарегистрирован только один препарат ИГЧН для внутримышечного введения. Показаниями к его применению служит профилактика гепатита А, кори, краснухи, ветряной оспы (в отсутствие возможности применения специфического иммуноглобулина) [25]. Для препаратов ИГЧН для внутримышечного введения, согласно руководствам Европейского агентства по лекарственным средствам (ЕМА) [20, 26], не требуется представления данных клинических исследований только по показанию «для профилактики гепатита А». Для других показаний должны быть представлены данные собственных клинических исследований. Внутримышечное введение иммуноглобулина, согласно этим документам, не считается эффективным для длительного применения и допускается только в исключительных случаях.
Внутривенное введение ИГЧН впервые в клинической практике было применено в 1962 г. [18]. Применение ранних препаратов ИГЧН для внутривенного введения очень часто сопровождалось серьезными нежелательными реакциями из-за низкой степени очистки и содержания иммуноглобулина класса А (IgA) в количествах, вызывающих анафилактические реакции. После разработки методики обработки гамма-глобулина, предотвращающей образование агрегатов глобулинов, очистки от протеаз, плазмина, плазминогена, активатора прекалликреина, других примесей стало возможным получение безопасных и эффективных препаратов ИГЧН для внутривенного введения. В 1981 г. в США был зарегистрирован первый такой препарат. Назначением для его применения была замена недостаточно эффективного и болезненного в использовании ИГЧН для внутримышечного введения пациентам в качестве заместительной терапии. Внутривенное введение ИГЧН позволило обеспечить необходимую концентрацию иммуноглобулинов, предотвращающую возникновение рекуррентных заболеваний в крови пациентов с ослабленным иммунитетом [27]. Спустя некоторое время было установлено, что внутривенное введение ИГЧН не только успешно заменяет внутримышечное введение, но и намного превосходит его по эффективности, в т.ч. за счет возможности поддержания определенной концентрации иммуноглобулинов. Наглядным примером преимущества внутривенного введения ИГЧН по сравнению с внутримышечным стала высокоэффективная терапия идиопатической тромбоцитопенической пурпуры у детей [28].
Международный союз иммунологических обществ и эксперты ВОЗ, обобщив в 1982 г. накопившуюся информацию об опыте применения нормального иммуноглобулина, приняли меморандум «О надлежащем применении иммуноглобулина человека в клинической практике», в котором были перечислены и обоснованы критерии для терапевтического назначения иммуноглобулина [24]. В этом документе рекомендовано для лечения пациентов с иммунодефицитом внутривенное применение ИГЧН. Кроме этого был еще раз сделан акцент на необходимости придерживаться научно обоснованных показаний к применению. Особо было отмечено, что активная иммунизация (вакцинация) более эффективна по сравнению с пассивной иммунизацией, дающей защиту лишь на короткое время. Подчеркнуто, что неуместно использовать ИГЧН для профилактики инфекций у недоношенных детей или в периоде физиологической гипогаммаглобулинемии, или для лечения недоедания (нарушения питания).
В тексте документа указано противопоказание к применению ИГЧН – дефицит IgA, т.к. терапия иммуноглобулином может вызывать индукцию антител против IgA и как следствие – нежелательную реакцию. Тем не менее применение иммуноглобулина может быть целесообразным под наблюдением специалиста в случае комбинированного дефицита IgA-IgG2, если препарат содержит низкий уровень IgA.
В последние годы выпускаются препараты ИГЧН для внутривенного введения с высокой чистотой, полной активностью Fc-фрагмента, высокой степенью вирусной безопасности, достигаемой многоступенчатым процессом производства. В то же время следует констатировать, что пока не разработаны технологические приемы, позволяющие гарантировать вирусную безопасность крови на 100%. Достигнута только максимальная степень вирусной безопасности [22, 29].
Терапевтическая эффективность иммуноглобулинов для внутривенного введения при отдельной патологии по мере накопления опыта их применения периодически переоценивается. Использование стандартных иммуноглобулинов для внутривенного введения, по данным многоцентрового исследования, не снижало смертности у кардиохирургических больных с тяжелой послеоперационной системной воспалительной реакцией, считавшейся показанием к их применению. Многолетняя клиническая практика показала, что только введение препаратов, обогащенных иммуноглобулинами классов M и A, повышает выживаемость пациентов при лечении сепсиса [22].
В настоящее время в Российской Федерации зарегистрировано 14 препаратов ИГЧН для внутривенного введения (из них 9 зарубежного производства) [23]. Препараты ИГЧН включены в Перечень жизненно необходимых и важнейших лекарственных препаратов для медицинского применения [30]. Проведенный анализ показал, что лишь часть из показаний в инструкциях по применению препаратов ИГЧН для внутривенного введения, произведенных в России, совпадает с назначениями препаратов, зарегистрированных ЕМА и Управлением по санитарному надзору за качеством пищевых продуктов и медикаментов (FDA) [31, 32]. В инструкциях по применению некоторых отечественных препаратов ИГЧН для внутривенного введения указаны показания, которые в настоящее время считаются недостаточно обоснованными и не подтверждены результатами клинических исследований: заболевания крови, системные заболевания соединительной ткани, профилактика оппортунистических инфекций и послеоперационных осложнений, последствия иммуносупрессивной терапии, тяжелые бактериальные, включая сепсис, и вирусные инфекции, послеоперационные осложнения, сопровождающиеся бактериемией и септико-пиемическими состояниями, тяжелая миастения в стадии обострения.
Современные технологии получения препаратов иммуноглобулина с высокой степенью очистки позволили за последнее десятилетие вернуться к практике их подкожного введения. Применение иммуноглобулина в виде подкожных инфузий было обсуждено в рекомендациях ВОЗ в 2007 г. [33]. Данный способ введения ИГЧН эксперты ВОЗ рекомендовали при лечении первичных иммунодефицитов. На основании многолетней практики применения подкожного введения ИГЧН практикующие врачи и международные органы контроля Европейского союза в нормативных документах [20, 34, 35] указывают, что подкожное введение предпочтительно, т.к. может проводиться в домашних условиях, позволяет поддерживать постоянный уровень IgG в сыворотке (в отличие от снижения концентрации IgG при внутривенном введении), уменьшает вероятность возникновения нежелательных реакций и переноса трансмиссивных инфекционных агентов. Такой способ введения значительно комфортнее для пациентов, зачастую подходит даже пациентам, у которых были ранее отмечены нежелательные реакции при внутривенном введении иммуноглобулинов, и позволяет врачам и пациентам проводить заместительную терапию без премедикации кортикостероидами или антигистаминными препаратами. Кроме того, подкожное применение иммуноглобулина комфортно как для детей и взрослых, так и для пожилых пациентов и, что немаловажно, значительно снижает стоимость лечения. Продолжительность инфузии при подкожном введении препаратов иммуноглобулина ограничивается одним часом или менее, в то время как внутривенные инфузии продолжаются в течение нескольких часов. В настоящее время ИГЧН для подкожного введения в основном используются для лечения пациентов с низким уровнем IgA, с положительными серологическими воспалительными маркерами, флебитами, заболеваниями почек и другой патологией, создающей условия для осложнения при внутривенном введении иммуноглобулинов [36]. Целью заместительной терапии служит снижение частоты и тяжести бактериальных инфекций, предотвращение развития необратимых и тяжелых осложнений, а также жизнеугрожающих инфекций, что возможно при достижении близких к нормальным претрансфузионных уровней IgG [37].
В Европе за последние 15 лет спрос на препараты иммуноглобулина для внутривенного и подкожного введения вырос в 2,5 раза [38]. Препараты для подкожного введения с учетом совокупности свойств и простоты применения в перспективе могут вытеснить с рынка иммуноглобулины для внутривенного введения. В Российской Федерации препараты ИГЧН для подкожного введения пока не зарегистрированы [23].
В 1991 г. разрешен к использованию в практике здравоохранения первый отечественный комплексный иммуноглобулиновый препарат для энтерального применения. В составе препарата представлены иммуноглобулины классов G, M, A, выделенные из осадка «Б» (фракция III по Кону). Содержание секреторного IgA в препарате достигает 15–25% (для сравнения: не более 3% в других препаратах ИГЧН), что дает возможность использовать его местно при инфекционно-воспалительных процессах слизистых оболочек желудочно-кишечного тракта. Препарат отличается хорошей переносимостью и возможностью получения быстрого терапевтического эффекта, особенно при лечении дисбактериозов у детей [39]. В настоящее время в Российской Федерации зарегистрировано 3 препарата ИГЧН для энтерального применения [23]. Препараты показаны к лечению острых кишечных инфекций у детей в возрасте от 1 месяца.
Спрос на препараты иммуноглобулина человека растет по мере появления новых показаний. Так, на Европейском конгрессе иммунологов (Германия, 2014 г) было отмечено, что 42% мирового потребления ИГЧН связано с неврологическими показаниями, 18% – с гематоонкологическими болезнями [38, 40]. В 33% случаев препараты ИГЧН применяются не по показаниям. В настоящее время проводятся многочисленные клинические исследования по применению ИГЧН для лечения дерматомиозитов/полимиозитов, хронического идиопатического и комплексного регионального болевого синдрома, тяжелой диабетической полинейропатии, глиобластомы, нейробластомы, аутоиммунной вегетативной ганглиопатии, аутоиммунных нейропсихиатрических нарушений у детей, ассоциированных со стрептококковой инфекцией, ВИЧ-ассоциированной миелопатии, анемии, вызванной парвовирусом B19 и/или кардиомиопатией, спинально-церебеллярной атаксии типа 3, острого ишемического инсульта, миастении гравис, синдромаЛамберта–Итона, токсического эпидермального некролиза, системной красной волчанки и волчаночного нефрита, идиопатической острой и рефрактерной солнечной крапивницы, при трансплантации органов, для предотвращения опосредованного антителами отторжения трансплантированного органа, септического шока, беременных женщин с первичной цитомегаловирусной инфекцией, привычных выкидышей, для удаления антигенов лейкоцитов человека [38].
В соответствии с подходами руководств ЕМА препараты ИГЧН для внутривенного введения рекомендованы к применению по следующим показаниям: заместительная терапия у взрослых, детей и подростков (0–18 лет) при первичных иммунодефицитах с нарушенной продукцией антител; гипогаммаглобулинемия и рецидивирующие бактериальные инфекции у пациентов с хроническим лимфоцитарным лейкозом при неэффективности профилактической антибактериальной терапии; гипогаммаглобулинемия и рецидивирующие бактериальные инфекции у пациентов с множественной миеломой в фазе плато при неэффективности вакцинации пневмококковой вакциной; гипогаммаглобулинемия у пациентов после аллогенной трансплантации гемопоэтических стволовых клеток; врожденный синдром приобретенного иммунодефицита человека (СПИД) при наличии рецидивирующих бактериальных инфекций; иммуномодулирующая терапия взрослых, детей и подростков (0–18 лет) при идиопатической тромбоцитопенической пурпуре у детей или у взрослых при высоком риске кровотечений или перед хирургическими вмешательствами с целью коррекции количества тромбоцитов, при синдроме Гийена–Барре, при болезни Кавасаки [31]. Отдельные препараты, по результатам подтверждающих собственных клинических исследований, разрешены к применению для лечения других аутоиммунных заболеваний (мультифокальная моторная невропатия, хроническая воспалительная демиелинизирующая полирадикулоневропатия, миастения гравис и др.). В инструкциях по применению препаратов ИГЧН для внутривенного введения, зарегистрированных FDA, представлены аналогичные показания к применению [32].
Согласно действующим нормативным документам Минздрава России и Роспотребнадзора (приказы об утверждении стандартов оказания медицинской помощи различного уровня, санитарно-эпидемиологические правила и методические указания по профилактике отдельных инфекционных болезней), препараты ИГЧН без указания способа введения рекомендовано применять детям и взрослым для профилактики вирусных гепатитов В, дельта, ни А, ни В с парентеральным механизмом передачи возбудителя, профилактики и лечения гриппа и острых респираторных заболеваний, профилактики и лечения эпидемического паротита; детям – для лечения ветряной оспы, инфекционного мононуклеоза, цитомегаловирусной инфекции, геморрагической лихорадки с почечным синдромом, генерализованной формы менингококковой инфекции, шигеллеза, сальмонеллеза, острых кишечных инфекций и пищевых отравлений, псевдотуберкулеза, иерсиниоза, кампилобактериоза, хронических панкреатитов, гастроэнтеритов вирусной этиологии, хронического активного гепатита (аутоиммунного), цирроза печени, болезни Крона, язвенного (хронического) илеоколита (неспецифического язвенного колита), эпилепсии, тяжелой миастении, осложненной кризом, вирусного энцефалита, миелита, острого рассеянного энцефаломиелита, юношеского артрита с системным началом; взрослым – для лечения полиневропатии с системными поражениями соединительной ткани, узелкового полиартрита и родственных состояний, других некротизирующих васкулопатий и других системных поражений соединительной ткани, при системном склерозе, абсцессе, фурункуле, карбункуле кожи, при искусственном прерывании беременности, при гипертензии со значительной протеинурией, вызванной беременностью, больным с неуточненными эффектами излучения, острым промиелоцитарным лейкозом, наследственным дефицитом фактора VIII, наследственным дефицитом фактора IX, отдельными нарушениями, вовлекающими иммунный механизм.
Таким образом, показания к применению и способы введения ИГЧН за 70-летний период их применения претерпели существенные изменения. В инструкциях по применению препаратов ИГЧН, зарегистрированных в Российской Федерации, других нормативных документах по лечению и профилактике болезней, указаны различные показания, в большинстве случаев не соответствующие таковым к применению в других странах, целесообразность отдельных из них нуждается в клиническом обосновании. Поэтому необходима актуализация информации в инструкциях по применению препаратов ИГЧН, произведенных в Российской Федерации, унификация показаний к применению препаратов с идентичными способами введения, гармонизация информации с актуальной информацией об опыте применения препаратов иммуноглобулина за рубежом.