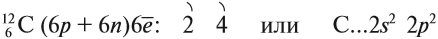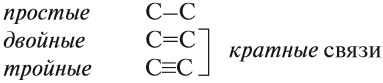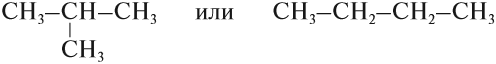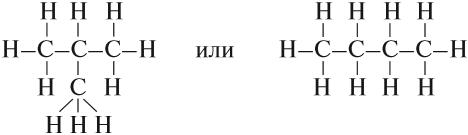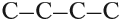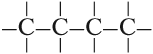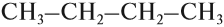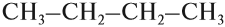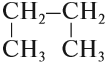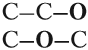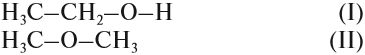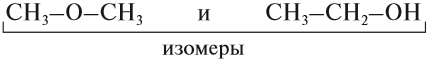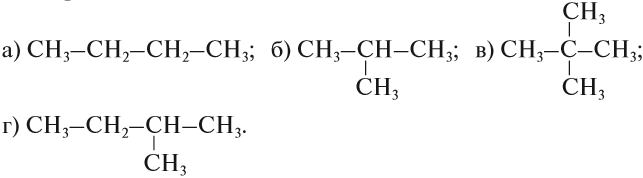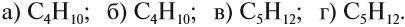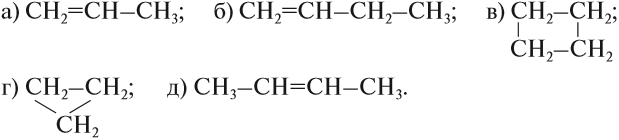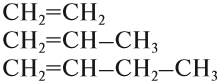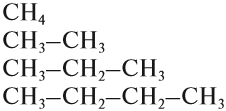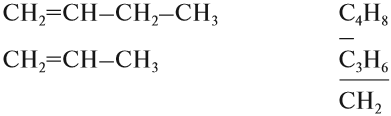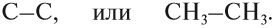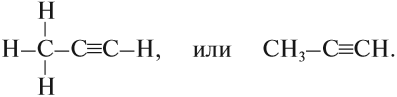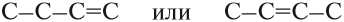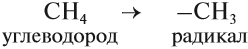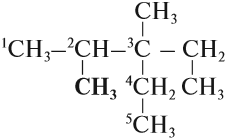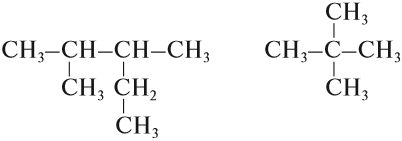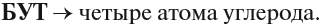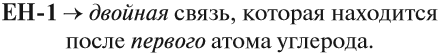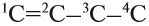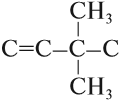что относится к органической химии
Органическая химия
Органи́ческая хи́мия — раздел химии, изучающий соединения углерода, их структуру, свойства, методы синтеза. [1] Органическими называют соединения углерода с другими элементами. Наибольшее количество соединений углерод образует с так называемыми элементами-органогенами: H, N, O, S, P. [2] Способность углерода соединяться с большинством элементов и образовывать молекулы различного состава и строения обусловливает многообразие органических соединений (к концу XX века их число превысило 10 млн, сейчас более 60 млн [источник не указан 472 дня] ). Органические соединения играют ключевую роль в существовании живых организмов.
Предмет органической химии включает следующие цели, экспериментальные методы и теоретические представления:
Содержание
История
Способы получения различных органических веществ были известны ещё с древности. Египтяне и римляне использовали красители индиго и ализарин, содержащиеся в растительных веществах. Многие народы знали секреты производства спиртных напитков и уксуса из сахар- и крахмалсодержащего сырья.
Во времена средневековья к этим знаниям ничего не прибавилось, некоторый прогресс начался только в XVI—XVII в: были получены некоторые вещества, в основном путём перегонки определённых растительных продуктов. В 1769—1785 г. Шееле выделил несколько органических кислот, таких как яблочная, винная, лимонная, галловая, молочная и щавелевая. В 1773 г. Руэль выделил из человеческой мочи мочевину.
Выделенные из животного или растительного сырья продукты имели между собой много общего, но отличались от неорганических соединений. Так возник термин «Органическая химия» — раздел химии, изучающий вещества, выделенные из организмов (определение Берцелиуса, 1807 г.). При этом полагали, что эти вещества могут быть получены только в живых организмах благодаря «жизненной силе».
Как принято считать, органическая химия как наука появилась в 1828 году когда Фридрих Вёлер впервые получил органическое вещество — мочевину — в результате упаривания водного раствора цианата аммония (NH4OCN).
Важным этапом стала разработка теории валентности Купером и Кекуле в 1857 г., а также теории химического строения Бутлеровым в 1861 г. В основу этих теорий были положены четырёхвалентность углерода и его способность к образованию цепей. В 1865 году Кекуле предложил структурную формулу бензола, что стало одним из важнейших открытий в органической химии. В 1875 г. Вант-Гофф и Ле Бель предложили тетраэдрическую модель атома углерода, по которой валентности углерода направлены к вершинам тетраэдра, если атом углерода поместить в центр этого тетраэдра. В 1917 году Льюис предложил рассматривать химическую связь с помощью электронных пар.
В 1931 г. Хюккель применил квантовую теорию для объяснения свойств альтернантных ароматических углеродов, чем основал новое направление в органической химии — квантовую химию. В 1933 г. Ингольд провёл изучение кинетики реакции замещения у насыщенного атома углерода, что привело к масштабному изучению кинетики большинства типов органических реакций.
Историю органической химии принято излагать в связи с открытиями сделанными в области строения органических соединений, однако такое изложение больше связано с историей химии вообще. Гораздо интереснее рассматривать историю органической химии с позиции материальной базы, то есть собственно предмета изучения органической химии.
На заре органической химии предметом изучения были преимущественно субстанции биологического происхождения. Именно этому факту органическая химия обязана своим названием. Научно-технический прогресс не стоял на месте, и со временем основной материальной базой органической химии стала каменноугольная смола, выделяемая при получении кокса прокаливанием каменного угля. Именно на основе переработки каменноугольной смолы в конце XIX века возник основной органический синтез. В 50-60 годах прошлого века произошёл переход основного органического синтеза на новую базу — нефть. Таким образом появилась новая область химии — нефтехимия. Огромный потенциал, который был заложен в новом сырье вызвал бум в органической химии и химии вообще. Появление и интенсивное развитие такой области как химии полимеров обязана прежде всего новой сырьевой базе.
Несмотря на то, что современная органическая химия в качестве материальной базы по прежнему использует сырье биологического происхождения и каменноугольную смолу, объём переработки этих видов химического сырья по сравнению с переработкой нефти мал. Смена материально-сырьевой базы органической химии была вызвана прежде всего возможностями наращивания объёмов производства.
Классификация органических соединений
Правила и особенности классификации
В основе классификации лежит структура органических соединений. Основа описания структуры — структурная формула. Атомы элементов обозначаются латинскими символами, как они обозначены в периодической таблице химических элементов (таблице Менделеева). Водородные и электронодефицитные связи обозначаются пунктирной линией, ионные связи обозначаются указанием зарядов частиц, входящих в состав молекулы. Поскольку в подавляющее большинство органических молекул входит водород, его обычно не обозначают при изображении структуры. Таким образом, если в структуре у одного из атомов изображена недостаточная валентность, значит, возле этого атома расположен один или несколько атомов водорода.
Атомы могут образовывать циклические и ароматические системы.
Основные классы органических соединений
Строение органических молекул
Органические молекулы в основном образованы ковалентными неполярными связями C—C, или ковалентными полярными типа C—O, C—N, C—Hal. Согласно октетной теории Льюиса и Косселя молекула является устойчивой, если внешние орбитали всех атомов полностью заполнены. Для таких элементов как C, N, O, Галогены необходимо 8 электронов, чтобы заполнить внешние валентные орбитали, для водорода необходимо только 2 электрона. Полярность объясняется смещением электронной плотности в сторону более электроотрицательного атома.
Классическая теория валентных связей не в состоянии объяснить все типы связей, существующие в органических соединениях, поэтому современная теория использует методы молекулярных орбиталей и квантовохимические методы.
Строение органического вещества
Свойства органических веществ определяются не только строением их молекул, но и числом и характером их взаимодействий с соседними молекулами, а также взаимным пространственным расположением. Наиболее ярко эти факторы проявляются в различии свойств веществ, находящихся в разных агрегатных состояниях. Так, вещества, легко взаимодействующие в виде газа, могут совершенно не реагировать в твёрдом состоянии, или приводить к другим продуктам.
В твёрдых органических веществах, в которых наиболее ярко проявляются эти факторы, различают органические кристаллы и аморфные тела. Их описанием занимается наука «химия органического твёрдого тела», основание которой связывают с именем советского физика-кристаллографа А. И. Китайгородского. Примеры полезных органических твёрдых тел — органические люминофоры, разнообразные полимеры, сенсоры, катализаторы, электропроводники, магниты и др.
Особенности органических реакций
В неорганических реакциях обычно участвуют ионы, они проходят быстро и до конца при комнатной температуре. В органических реакциях часто происходят разрывы ковалентных связей с образованием новых. Как правило, эти процессы требуют особых условий: определённой температуры, времени реакции, и часто наличия катализатора. Обычно протекает не одна, а сразу несколько реакций, поэтому выход целевого вещества зачастую не превышает 50 %. Поэтому при изображении органических реакций используют не уравнения, а схемы без расчёта стехиометрии.
Реакции классифицируются в зависимости от способов разрыва и образования связей, способов возбуждения реакции, её молекулярности.
Определение структуры органических соединений
За все время существования органической химии как науки важной задачей было определить структуру органических соединений. Это значит узнать, какие атомы входят в состав соединения, в каком порядке эти атомы связаны между собой и как расположены в пространстве.
Существует несколько методов решения этих задач.
Описанных выше методов, как правило, полностью хватает для определения структуры неизвестного вещества.
Урок 17. Основные понятия органической химии
Известно, что все сложные вещества условно можно разделить на органические и неорганические.
В состав неорганических веществ может входить любой элемент периодической системы. Основными классами неорганических веществ являются оксиды, кислоты, основания и соли. Свойства этих веществ были рассмотрены в первых двух разделах.
В состав органических веществ обязательно входит атом углерода, который в подавляющем числе органических соединений образует цепи. Эти цепи имеют разную длину и разное строение, поэтому органических соединений теоретически может быть бесчисленное множество.
Основу любого органического соединения составляет углеводородная цепь, которая может соединяться с функциональными группами.
Свойства органического соединения описывают по схеме:
Прочитав очередной урок, попробуйте описать изучаемые соединения на любом примере, используя эту схему. И всё получится!
Предмет органической химии. Теория строения органических веществ
Органические вещества известны людям с давних пор. Ещё в древности люди использовали сахар, животные и растительные жиры, красящие и душистые вещества. Все эти вещества выделялись из живых организмов. Поэтому такие соединения стали называться органическими, а раздел химии, который изучал вещества, образующиеся в результате жизнедеятельности живых организмов, получил название «органическая химия». Это определение было дано шведским учёным Берцелиусом* в 1827 году.
* Берцелиус Йенс Якоб (20.08.1779–7.08.1848) — шведский химик. Проверил и доказал ряд основных законов химии, определил атомные массы 45 химических элементов, ввёл современное обозначение химических элементов (1814) и первые химические формулы, разработал понятия «изомерия», «катализ» и «аллотропия».
Уже первые исследователи органических веществ отмечали особенности этих соединений. Во-первых, все они при сжигании образуют углекислый газ и воду, значит, все они содержат атомы углерода и водорода. Во-вторых, эти соединения имели более сложное строение, чем минеральные (неорганические) вещества. В-третьих, возникали серьёзные затруднения, связанные со способами получения и очистки этих соединений. Полагали даже, что органические соединения невозможно получить без участия «жизненной силы», которая присуща только живым организмам, то есть органические соединения нельзя, казалось, получить искусственно.
И, наконец, были обнаружены соединения одинакового молекулярного состава, но различные по свойствам. Такое явление не было характерно для неорганических веществ. Если для неорганического вещества известен состав, то известны и его свойства.
А химики-органики обнаружили, что вещество состава С2Н6О у одних исследователей является достаточно инертным газом, а у других — жидкостью, активно вступающей в разнообразные реакции. Как это объяснить?
К середине 19-го века было создано немало теорий, авторы которых пытались объяснить эти и другие особенности органических соединений. Одной из таких теорий стала теория химического строения Бутлерова*.
* Бутлеров Александр Михайлович (15.09.1928–17.08.1886) — русский химик. Создал теорию химического строения органических веществ, лежащей в основе современной химии. Предсказал изомерию многих органических соединений, заложил основы учения о таутомерии.
Некоторые её положения были изложены А. М. Бутлеровым в 1861 году на конференции в г. Шпейере, другие были сформулированы позже в научных работах А. М. Бутлерова. В целом, основные положения этой теории в современном изложении можно сформулировать так.
1. Атомы в молекулах располагаются в строгом порядке, согласно их валентности.
2. Атом углерода в органических молекулах всегда имеет валентность равную четырём.
3. Порядок соединений атомов в молекуле и характер химических связей между атомами называется химическим строением.
4. Свойства органических соединений зависят не только от того, какие атомы и в каких количествах входят в состав молекулы, но и от химического строения:
5. Изучая свойства органических соединений, можно сделать вывод о строении данного вещества и описать это строение одной-единственной химической формулой.
6. Атомы в молекуле влияют друг на друга, и это влияние сказывается на свойствах вещества.
При изучении органической химии нужно чаще вспоминать эти положения и, прежде чем описывать свойства какого-либо вещества, следует указать его строение при помощи химической формулы, в которой будет показан порядок соединения атомов в молекуле — графическая формула.
Особенности строения органических соединений
Органическая химия изучает строение молекул и свойства соединений углерода, кроме самых простых (угольная и синильная кислоты и их соли).
В состав неорганических соединений могут входить любые из 114 известных в настоящее время химических элементов. Сейчас известно более 0,5 млн неорганических веществ.
В состав органических молекул обычно входят атомы 6 химических элементов: C, H, O, N, P, S. И тем не менее в настоящее время известно более 20 миллионов органических соединений.
Почему органических веществ так много?
Поскольку в состав любого органического соединения входит атом углерода, попробуем найти ответ на этот вопрос, рассмотрев особенности строения атома углерода.
Углерод — химический элемент 2-го периода, IV группы Периодической системы химических элементов Менделеева, следовательно, строение его атома можно изобразить так:
Таким образом, на внешнем уровне атома углерода находится четыре электрона. Являясь неметаллом, атом углерода может и отдавать четыре электрона, и принимать до завершения внешнего уровня также четыре электрона. Поэтому:
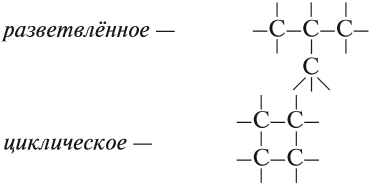
В состав углеродных цепочек может входить разное число атомов углерода: от одного до нескольких тысяч. Кроме того, цепочки могут иметь разное строение:
Между атомами углерода могут возникать химические связи разного типа:
Поэтому всего лишь четыре (!) атома углерода могут образовать более 10 соединений разного строения, даже если в состав таких соединений будут входить только атомы углерода и водорода. Эти соединения будут иметь, например, следующие «углеродные скелеты»:
Задание 17.1. Попробуйте составить сами 2–3 цепочки атомов углерода иного строения из четырёх атомов углерода.
Выводы
Способность атомов углерода образовывать УГЛЕРОДНЫЕ ЦЕПИ разного состава и строения — главная причина многообразия органических соединений.
Классификация органических соединений
Поскольку органических соединений очень много, их классифицируют по разным признакам:
В данном пособии будут рассмотрены свойства соединений различных классов, поэтому определения и примеры будут даны позднее.
Формулы органических соединений
Формулы органических соединений можно изображать по-разному. Состав молекулы отражает молекулярная (эмпирическая) формула:
Но эта формула не показывает расположения атомов в молекуле, т. е. строения молекулы вещества. А в органической химии это понятие — химическое строение молекулы вещества — самое главное! Последовательность соединения атомов в молекуле показывает графическая (структурная) формула. Например, для вещества строения С4Н10 можно написать две такие формулы:
Можно показать все химические связи:
Такие развёрнутые графические формулы наглядно показывают, что атом углерода в органических молекулах четырёхвалентен. При составлении графических формул нужно сначала изобразить углеродную цепь, например:
Затем чёрточками обозначить валентность каждого атома углерода:
У каждого атома углерода должно быть четыре чёрточки!
Затем заполнить «свободные» валентности атомами водорода (или другими одновалентными атомами или группами).
Теперь можно переписать эту формулу в сокращённом виде:
Если вы хотите сразу написать такую формулу для бутана — ничего сложного нет, нужно только считать до четырёх. Изобразив углеродный «скелет», нужно задать себе вопрос: сколько валентностей (чёрточек) имеет данный конкретный атом углерода?
Две. Значит, нужно добавить 2 атома водорода:
Следует помнить, что графические формулы можно записывать по-разному. Например, графическую формулу бутана можно записать так:
Поскольку последовательность расположения атомов не нарушилась, то это формулы одного и того же соединения(!) Проверить себя можно, составив названия этих соединений (см урок 17.7). Если названия веществ совпадают, то это — формулы одного и того же вещества.
Изомерия
К середине 19-го века, когда было получено и изучено достаточно много органических соединений, химики-органики обнаружили непонятное явление: соединения, имеющие одинаковый состав, имели разные свойства! Например, газ, который с трудом вступает в реакции и не реагирует с Nа, имеет состав C2H6O. Но существует жидкость, имеющая тот же состав и очень активная в химическом отношении. В частности, эта жидкость состава C2H6O активно реагировала с Na, выделяя водород. Совершенно разные по физическим и химическим свойствам вещества имеют одинаковую молекулярную формулу! Почему? Ответ на этот вопрос можно получить при помощи теории строения органических соединений Бутлерова, одно из положений которой утверждает: «Свойства органических соединений зависят от химического строения их молекул».
Так как химические свойства рассматриваемых соединений различны, значит, их молекулы имеют разное строение. Попробуем составить графические формулы этих соединений. Для вещества состава C2H6O можно предложить только два вида цепочек:
Заполнив эти «скелеты» атомами водорода, получаем:
Вопрос. Какое из этих соединений способно реагировать с Nа, выделяя водород?
Очевидно, к такому взаимодействию способно только вещество (I), содержащее связь «О–Н», которой нет в молекуле (II). И газ Н2 выделяется потому, что разрушается связь «О–Н». Если бы для образования водорода нужно было бы разрушить связь «С–Н», то поскольку такие связи есть в обоих веществах, газ Н2 выделялся бы в обоих случаях. Таким образом, формула (I) отражает строение молекулы жидкости, а формула (II) — газа.
Существование соединений, которые имеют одинаковый состав, но разное химическое строение, называется изомерией.
ИЗОМЕРЫ — это соединения, которые имеют одинаковый состав, но разное химическое строение, а значит, и разные свойства.
Поэтому молекулы органических соединений следует изображать при помощи графических (структурных) формул, так как в этом случае будет видно строение изучаемого вещества, а значит, будет видно, как и за счёт чего происходит химическая реакция.
Упражнение 17.1. Среди следующих соединений найдите изомеры:
Решение. Поскольку изомеры имеют одинаковый состав, определим состав (молекулярные формулы) всех этих соединений, то есть пересчитаем число атомов углерода и водорода:
Ответ. Соединения а) и б) изомерны друг другу, так как имеют одинаковый состав C4H10, но различное химическое строение.
Соединения в) и г) изомерны друг другу, так как имеют одинаковый состав C5H12, но различное химическое строение.
Задание 17.2. Среди следующих соединений найдите изомеры:
Гомологи
Из того же положения теории строения органических соединений Бутлерова следует, что вещества, имеющие похожее (сходное) строение молекул, должны иметь и похожие (сходные) свойства. Органические соединения, которые имеют похожее строение, а, значит, и похожие свойства, образуют гомологические ряды.
Например, углеводороды, в составе молекул которых есть только одна двойная связь, образуют гомологический ряд алкенов:
Углеводороды, в молекулах которых имеются только простые связи, образуют гомологический ряд алканов:
Члены любого гомологического ряда называются ГОМОЛОГАМИ.
Гомологи — это органические соединения, которые похожи по химическому строению и, значит, по свойствам. Гомологи отличаются друг от друга по составу на группу СН2 или (СН2)n.
Убедимся в этом на примере гомологического ряда алкенов:
Задание 17.3. Сравните состав членов гомологического ряда алканов (гомологов алканов) и убедитесь, что по составу они отличаются на группу СН2 или (СН2)n.
Выводы
Гомологи похожи по строению, а значит, и по свойствам; гомологи отличаются по составу на группу СН2. Группа СН2 называется гомологической разностью.
Названия углеводородов. Правила международной номенклатуры
Для того чтобы понимать друг друга, нужен язык. Люди говорят на разных языках и не всегда понимают друг друга. Химики же, для того чтобы понимать друг друга, пользуются одним и тем же международным языком. Основу этого языка составляют названия соединений (номенклатура).
Правила номенклатуры (названий) органических соединений были приняты в 1965 году. Они называются правилами ИЮПАК (IUPAC)*.
* IUPAC — International Union of Pure and Applied Chemistry — Международный союз чистой и прикладной химии.
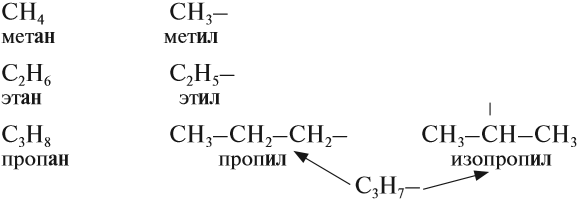
За основу названий органических соединений принимаются названия гомологов-алканов:
** Для этих соединений имеется ввиду, что они имеют линейное строение.
В этих названиях КОРНИ слов (полужирный шрифт) — мет-, эт-, проп- и так далее — указывают на число атомов углерода в цепи:
Задание 17.4. Сколько атомов углерода содержит углеродная цепь соединений:
Суффикс в названии указывает на характер (тип) связей. Так, суффикс -ан- показывает, что все связи между атомами углерода простые.
Задание 17.5. Вспомните, что такое гомологи, и установите, являются ли гомологами алканов следующие вещества:
В названиях могут быть и другие суффиксы:
Упражнение 17.2. Попробуйте составить графические формулы ЭТана, ЭТена и ЭТина.
Решение. Все эти вещества имеют корень -ЭТ-, то есть в состав этих веществ входит . атома углерода. В первом веществе имеется . связь, так как суффикс -ан-:
Рассуждая аналогично, Вы получите:
Предположим, нужно изобразить графическую формулу пропина.
1. Корень -проп- указывает, что в цепи 3 атома углерода:
2. Суффикс -ин- указывает, что имеется одна тройная связь:
3. Каждый атом углерода имеет валентность IV. Поэтому допишем недостающие атомы водорода:
Задание 17.6. Составить графическую формулу пропена.
Теперь, предположим, нужно составить графическую формулу бутена. Корень -бут- означает, что в цепи имеется 4 атома углерода, суффикс -ен- указывает, что имеется двойная связь. Но где расположена эта связь? Возможны варианты:
Значит, в этом случае необходимо обозначить место двойной связи. Для этого атомы углерода нумеруют. Нумерацию начинают с того конца углеродной цепи, к которому ближе кратная двойная связь:
Хотя двойная связь в каждом случае соединяет два атома углерода, после суффикса -ен- записывают меньший номер.
Задание 17.7. Составьте графические формулы соединений: а) пентен-2; б) бутин-1.
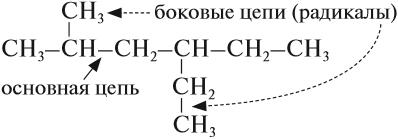
Ранее было сказано, что углеродные цепи могут быть линейными и разветвлёнными. Мы научились составлять названия линейных углеводородов. Теперь рассмотрим правила составления названий разветвлённых углеводородов. Для этого вспомним, что разветвлённые углеводороды имеют ответвления (боковые цепи, радикалы) от основной цепи:
Ответвления от основной (главной) цепи называются радикалами.
Радикалы по составу отличаются от соответствующего углеводорода на один атом водорода:
Названия радикалов предельных углеводородов имеют суффикс -ил-:
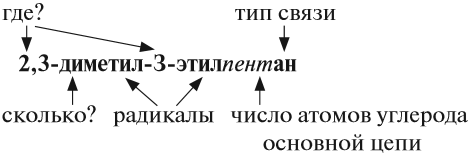
Правила составления названий углеводородов:
1) выбрать главную цепь: она должна быть самой длинной и самой разветвлённой (содержать максимальное число радикалов);
2) атомы углерода, которые не вошли в состав главной цепи, образуют боковые цепи (радикалы);
3) нумерацию атомов главной (основной) цепи начинают с того конца, от которого ближе кратная связь, а для предельных углеводородов — с того конца, к которому ближе радикал. В любом случае сумма номеров, которые появились в названии, должна быть наименьшей;
4) перед названием радикала ставят номер атома углерода (адрес), с которым он соединён;
5) если одинаковых радикалов несколько, то их число обозначают так:
6) затем записывают названия соответствующих радикалов (начиная с самых простых) и в конце названия записывают название углеводорода — основной цепи, указывая тип связи и место положения этой связи.
Упражнение 17.3. Назвать углеводород:
1. Выберем самую длинную цепь; в данном случае она содержит 5 атомов углерода: корень — пент.
2. Все связи простые: суффикс -ан-. Получается: пентан.
3. Нумеруем главную цепь слева направо, так как к левому концу ближе радикал «метил-»:
4. У второго атома углерода и у третьего атома углерода имеется по одному радикалу «метил-», то есть всего два радикала «метил-»; обозначим их «ди»; получаем: 2,3-диметил…
5. У третьего атома углерода есть ещё один радикал «этил-», поэтому получаем:
Упражнение 17.4. Назвать:
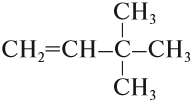
Пример. Составить графическую формулу углеводорода: 3,3-диметилбутен-1.
1. Определим число атомов углерода в основной цепи:
2. Определим тип химической связи в основной цепи:
3. Составляем «углеродный скелет»:
4. У атома углерода № 3 имеется два (ДИ) радикала «метил», т. е. каждый радикал имеет один атом углерода:
5. Допишем атомы водорода согласно валентности:
Задание 17.8. Составьте структурные (графические) формулы: