что относится к пептидам
Пептиды в косметике: кому и зачем они нужны
Пептиды в косметике: кому и зачем они нужны
Что такое пептиды

Проникая в кожу, они соединяются с клеточными рецепторами, которые воспринимают их как сигнал к действию. Они диктуют клеткам, чтонадо делать — делиться, отмереть. Важно понимать, что действия пептидов различаются в зависимости от группы. В косметике используют 4 вида — сигнальные, транспортные, ингрибиторы энзимов и нейротрансмиттеры.
Сигнальные стимулируют выработку коллагена и эластина. К этой группе относится хорошо знакомый матриксил.
Транспортные выполняют роль «перевозчика» и доставляют необходимые микроэлементы в клетки.
Ингибиторы энзимов увеличивают длительность жизни коллагена.
Нейротрансмиттеры расслабляют мышцы, потому что работает один из самых известных пептидов — ботолуксин.
Плюсы
Минусы
Опасно ли ее использовать
Но их пептидов связано с балансировкой и тонкой настройкой работы клеток и не может нанести организму вред. Эти сигнальные молекулы заставляют клетки организма вырабатывать правильный здоровый продукт, очищают межклеточное пространство и улучшают среду вокруг, а соответственно и их работу. Наш организм устроен таким образом, что принимает только нужное ему количество пептидов для восстановления, а излишек распадается и выводится.
Как выбрать косметику для домашнего ухода
Нужно очень четко понимать, что средства с этим компонентом на самом деле эффективны, если подбирать их правильно. Составлять программу ухода должен врач-косметолог на очной консультации. У каждого свои особенности, показания, и часто мы не можем сами определить истинные потребности нашей кожи.
Кремы и сыворотки содержат в себе не весь набор пептидов, а определенные комбинации в нужной концентрации для решения той или иной задачи. Другие компоненты в составе способны снижать или усиливать действие пептидоа.
Например, гиалуроновая кислота или витамин С помогают пептидам проникнуть в глубокие слои, а кислоты, наоборот, ослабляют действие (откажись от таких средст, когда пользуешься пептидной косметикой).
Противопоказания для любых типов кожи: индивидуальная непереносимость и ряд тяжелых заболеваний, например диабет. При этом косметика с пептидами гипоаллергена — ее можно использовать, даже если у тебя чувствительная кожа.
Подписаться на новости
В соответствии с Федеральным законом № 152-ФЗ «О персональных данных» от 27.07.2006, отправляя любую форму на этом сайте, вы подтверждаете свое
согласие на обработку персональных данных.
Пептидные биорегуляторы и их применение: от неонатологии до геронтологии
Пептидный препарат Кортексин, представляющий собой комплекс натуральных низкомолекулярных соединений мозга животных (высокоочищенная вытяжка ядерных белков), продолжает оставаться одним из самых широко обсуждаемых в периодической медицинской печати фармак
Пептидный препарат Кортексин, представляющий собой комплекс натуральных низкомолекулярных соединений мозга животных (высокоочищенная вытяжка ядерных белков), продолжает оставаться одним из самых широко обсуждаемых в периодической медицинской печати фармакологических средств. При этом внимание привлекают два аспекта: во-первых, применение Кортексина представителями различных врачебных специальностей (мультидисциплинарность в целевом назначении препарата), а во-вторых, отсутствие возрастных ограничений к его использованию. В современной фармакопее существует не слишком много подобных лекарственных препаратов, не имеющих возрастных противопоказаний и ограничений к применению. Поэтому Кортексин, обосновано называемый «препаратом XXI века», заслуживает более подробного рассмотрения [1].
Категоризация и состав Кортексина
Как известно, Кортексин принадлежит к фармакологической группе 9.7 («Ноотропы (нейрометаболические стимуляторы)»). По АТХ-системе (анатомо-терапевтически-химической) классификации препарат относится к рубрике N06BX («Другие психостимуляторы и ноотропные препараты»). Среди пептидных препаратов х-классов (цитогены, цитамины, цитомедины) Кортексин относится к цитомединам, которые представляют собой высокоочищенную вытяжку ядерных белков (фракции 1–10 кДа) и характеризуются подтвержденным свойством к регуляции иммунологической реактивности [2]. Кортексин — инновационный пептидный препарат; его субстанция и лекарственные формы защищены патентами РФ (РФ № 2104702, 2275924, 2195297) и других стран.
Кортексин — многокомпонентный препарат, состав которого не ограчивается нейропептидными субстанциями. Помимо нейропептидов, ингредиенты Кортексина представлены не менее чем тремя группами веществ: аминокислотами, витаминами и минеральными веществами. Есть основания полагать, что положительные эффекты препарата объясняются не только действием аминокислот и полипептидов, но и нейрохимической активностью макро- и микроэлементов, витаминов [3, 4].
В частности, в составе пептидов Кортексина имеется не менее двух стимулирующих аминокислот — аспарагиновой кислоты (446 нмоль/мг) и глицина (298 нмоль/мг). Помимо вышеназванных аспарагиновой кислоты и глицина, в Кортексине представлены следующие аминокислоты:
Из представленной информации следует, что на долю аспарагиновой кислоты приходится до 12%, а глутаминовой кислоты — около 15% от общего содержания аминокислот в составе пептидов Кортексина. Метионина в препарате не содержится. Кроме того, стабилизатором препарата является свободная аминокислота глицин (12 мг), роль которой в нормализации функций коры головного мозга многократно доказана.
В Кортексине представлен ряд витаминов, в частности, водорастворимые: тиамин (витамин В1) — 0,08 мкг/10 мг, рибофлавин (витамин В2) — 0,03 мкг/10 мг, ниацин (витамин В3, витамин РР, никотиновая кислота) — 0,05 мкг/10 мг; а также жирорастворимые: ретинол (витамин А) — 0,011 мкг/10 мг, альфа-токоферол (витамин Е) — 0,007 мкг/10 мг. Надо признать откровенно, что такой витаминный состав является оптимальным для нейронов головного мозга, так как идеально сбалансирован природой!
Кроме пяти эссенциальных витаминов, в препарате Кортексин содержится немало минеральных веществ (макро- и микроэлементов):
Практически все из перечисленных минеральных веществ, входящих в состав препарата Кортексин, обладают нейромодулирующими и иными функциями.
Традиционные и новые области применения Кортексина
Кортексин применяется не только в Российской Федерации. Он зарегистрирован и используется в таких странах, как Украина, Беларусь, Армения, Узбекистан, Казахстан, Азербайджан, Киргизия, Таджикистан и Молдова (применению Кортексина во всех случаях предшествовала доклиническая и клиническая экспертиза).
Важнейшим свойством Кортексина, определяющим области его использования, считается коррекция когнитивных функций, но когнитивно-модулирующий эффект препарата является далеко не единственным. Описаны ноотропный, нейротрофический, антиконвульсантный, иммуномодулирующий (иммунорегуляторный) и нейропротекторный эффекты препарата, а также его антистрессорное, антиоксидантное и метаболическое действие. В связи с последним хотелось бы особенно отметить способность Кортексина к нормализации обмена нейромедиаторов и регуляции баланса активирующих/тормозных аминокислот.
Поэтому на протяжении последних 10 лет Кортексин активно использовался российскими врачами в различных областях клинической медицины (в неврологии, педиатрии, офтальмологии, геронтологии и т. д.): при черепно-мозговых травмах, нейроинфекциях, детском церебральном параличе (ДЦП), перинатальном поражении нервной системы, нарушениях (задержка) психомоторного и речевого развития, нарушениях мышления, сниженной способности к обучению, невротических расстройствах, синдроме дефицита внимания и гиперактивности (СДВГ), синдроме эмоционального выгорания, вегетативной дисфункции, гипертензивной ангиоретинопатии, глаукоме, диабетической нейропатии, амблиопии и т. д. [1–6].
Следует отметить, что для препарата Кортексин обнаруживаются все новые области применения. Так, Бочкова Л. Г. и Носова О. М. (2008) сообщают об опыте использования Кортексина при лечении натальной цервикальной травмы у новорожденных, Каменских Т. Г. и соавт. (2006) — в терапии частичной атрофии зрительного нерва (ЧАЗН), Утаганова Г. Х. (2010) — в коррекции шейно-спондилогенных поражений у детей раннего возраста [7–9].
Кортексин активно используется в геронтологии (нарушения мозгового кровообращения, астенические состояния, энцефалопатии различного генеза и т. д.) [10]. Достаточно вспомнить, что препарат был впервые внедрен в клиническую практику сотрудниками Военно-Медицинской Академии (на полях сражений в Афганистане [16, 17]), а затем сотрудниками Санкт-Петербургского института биорегуляции и геронтологии СЗО РАМН. По утверждению член-корреспондента РАМН, проф. Хавинсона В. Х., являющегося вице-президентом Геронтологического общества РАН, «использование пептидных препаратов позволяет эффективно проводить профилактику преждевременного старения, а также лечить заболевания, ассоциированные с возрастом…».
Использование Кортексина при мигрени, рекомендуемое Пак Л. А. и соавт. (2005, 2006, 2008), Иззати-Заде К. Ф. и соавт. (2006) и др., уже прочно вошло в практику российских неврологов, занимающихся этой группой первичных цефалгий [11–14]. Указывается, что во время приступа мигрени Кортексин стабилизирует мембраны тромбоцитов, тормозит развитие «серотонинового каскада», подавляет нейрональную корковую депрессию Лео, снижает нейрогенное воспаление сосудов твердой оболочки мозга, подавляет высвобождение нейропептидов боли и воспаления из периваскулярных афферентных волокон тройничного нерва [14].
Предварительные исследования сотрудников НЦЗД РАМН позволяют предположить, что в ближайшем будущем Кортексин будет применяться в качестве средства для коррекции различных форм неврологического дефицита, сопутствующего некоторым разновидностям пищевой непереносимости (целиакия, лактазная недостаточность и др.) в детском возрасте, а впоследствии — у совершеннолетних пациентов. Но, по-видимому, наиболее впечатляющей является возможность применения препарата в лечении эпилепсии.
Кортексин и эпилепсия
Терапия эпилепсии — сравнительно недавнее показание к применению Кортексина. Об использовании Кортексина в комплексном лечении различных форм эпилепсии сообщается в работах Гузевой В. И. и Трубачевой А. Н. (2003), Головкина В. И. (2005, 2006) и Звонковой Н. Г. (2006) [15–18]. Хоршев С. К. и соавт. (2002, 2008) рассматривают Кортексин в качестве корректора нейроиммунной составляющей эпилептогенеза и, основываясь на данных собственных биохимических и нейроиммунофизиологических исследований, рекомендуют этот нейропептидный препарат для профилактического лечения эпилепсии [19, 20]. Эффективности Кортексина в терапии эпилепсии у детей и взрослых посвящены публикации Цыгана В. Н. и соавт. (2008) и Федуновой Г. В. и соавт. (2008) [21, 22]. На необходимость коррекции когнитивных нарушений ноотропными препаратами при эпилепсии указывают Балканская С. В. и соавт. (2007, 2008) и Калинин В. В. и соавт. (2009) [23–25]. Именно Кортексину в этом плане принадлежит немаловажная роль.
Наконец, в апреле 2010 г. на XVII Российском национальном конгрессе «Человек и лекарство» при поддержке компании «Герофарм» был проведен симпозиум «Нейропротекция в терапии эпилепсии» (под председательством проф. Гехт А. Б.). В ходе работы указанного симпозиума докладчики (Калинин В. В., Калачева И. О., Одинцова Г. В.) отразили как теоретические аспекты, так и собственный опыт применения препарата Кортексин в лечении эпилепсии у детей и совершеннолетних пациентов.
В частности, в Институте мозга РАН (Н. Ю. Королева и Г. В. Одинцова) имеется положительный опыт применения Кортексина у 8 000 пациентов, и, как отметила А. Б. Гехт, в это учреждение поступают «далеко не самые легкие больные».
Не исключено, что в дальнейшем Кортексин найдет широкое применение в превентивном лечении фебрильных судорог (ФС), являющихся наиболее частым хроническим нарушением церебральных функций у детей.
Кортексин для детей — новая форма нейропептидного препарата
Новая форма препарата под названием «Кортексин для детей» была зарегистрирована в Российской Федерации 27 апреля 2009 г. [26].
Кортексин для детей — это лиофилизат для приготовления раствора для внутримышечного введения. В 1 флаконе (емкость 3 мл) содержатся 5 мг Кортексина (комплекс водорастворимых полипептидных фракций с молекулярной массой не более 10000 Да) вместо 10 мг, присутствующих в стандартной форме препарата Кортексин, а также глицин 6 мг как стабилизатор.
Фактически, Кортексин для детей — это чуть ли не единственный пример, когда препарат ноотропного действия адресно предназначается для пациентов педиатрического возраста. Предполагается, что новая форма пептидного препарата (Кортексин для детей) окажется востребованной и найдет самое широкое применение как в России, так и за ее пределами.
О чем умалчивает «Формулярная система»
Ранее нами уже неоднократно указывалось, что в «Формулярной системе» России отсутствует даже упоминание о Кортексине [2, 4, 6]. Приходится констатировать, что в XI выпуске (2010 г.) этого ежегодно обновляемого издания информация о Кортексине вновь отсутствует [27]. Это тем более странно, когда даже в интернет-энциклопедии «Википедия» представлены данные об этом «фармакопейном полипептидном биорегуляторе с биологической активностью».
Состав Кортексина в «Регистре лекарственных средств» (2010) представлен следующим образом: «в 1 флаконе Кортексина — 10 мг, глицина — 12 мг» (глицин, присутствующий в препарате, одновременно выполняет роль стабилизатора) [28]. В «Справочнике Видаль» (2010) состав Кортексина описан еще лаконичнее: «комплекс полипептидных фракций, выделенных из коры головного мозга крупного рогатого скота и свиней — 10 мг» [29]. На самом деле, как указывается выше, ингредиенты гораздо более многочисленны.
Мы постараемся представить информацию о препарате Кортексин, использовав форму, подобную обычно применяемой в «Федеральном руководстве по использованию лекарственных средств».
Кортексин (cortexin). Пептидный препарат, представляющий комплекс низкомолекулярных пептидов, выделенных из коры головного мозга крупного рогатого скота (телят) и свиней, не достигших 12-месячного возраста. Для выделения препарата используется метод уксусно-кислой экстракции. С целью получения фракции полипептидов с молекулярной массой, не превышающей 10000 Да (10 кДа), полученный экстракт подвергается многоступенчатой очистке и многократной фильтрации на специальных фильтрах. Очистка активной субстанции Кортексина обеспечивает инфекционную и антигенную безопасность препарата (отсутствие инфекционных агентов, нуклеиновых кислот, амилоидов, функционально активных проонкогенов и других нежелательных примесей).
Кортексин обладает выраженной метаболической активностью: нормализация обмена нейромедиаторов; регуляция баланса тормозных/активирующих аминокислот и уровней серотонина и дофамина; ГАМКергическое действие; антиоксидантный эффект; нормализация биоэлектрической активности (БЭА) мозга. Обладая выраженным тканеспецифическим действием на клетки коры головного мозга, этот нейропептидный препарат оказывает церебропротекторное, ноотропное, нейротрофическое), нейрометаболическое, стимулирующее, антистрессорное, антиоксидантное, противосудорожное и иммунорегуляторное действие.
Показания. Черепно-мозговая травма (ЧМТ), нарушения мозгового кровообращения (НМК — острые и хронические), нейроинфекции (вирусные и бактериальные), астенические состояния, энцефалопатии различного генеза, энцефалит (острый и хронический) и энцефаломиелит, эпилепсия, различные формы ДЦП, критические состояния новорожденных с перинатальным поражением нервной системы (ППНС), нарушения психомоторного и речевого развития, нарушения (снижение) памяти, мышления; нарушения других когнитивных функций (КФ), головные боли различного генеза и т. д.
Противопоказания. Индивидуальная непереносимость препарата, беременность, лактация.
Побочные эффекты. При применении по показаниям побочных эффектов Кортексина не выявлено.
Взаимодействие. Лекарственное взаимодействие препарата Кортексин с другими лекарственными средствами (ЛС) не описано.
Дозы и применение. Препарат назначают во внутримышечных введениях детям с массой тела до 20 кг — в дозе 0,5 мг/кг, а с массой тела более 20 кг — в дозе 10 мг. Продолжительность курса лечения Кортексином обычно составляет 10 дней. При необходимости предусмотрен повторный курс через 1–6 (чаще 3–6) месяцев.
Содержимое 1 флакона растворяют в 1–2 мл 0,5%-го раствора новокаина, воды для инъекций или 0,9%-го изотонического раствора NaCl.
Кортексин. Лиофилизированный порошок (лиофилизат) или пористая масса белого/белого с желтоватым оттенком цвета — для приготовления раствора для внутримышечного введения (флак.), 1 мл (1 мл = 10 мг).
Кортексин для детей. Лиофилизат для приготовления раствора для внутримышечного введения (флак.), 3 мл (5 мг).
В новом англоязычном научном журнале The Open Neuropsychopharmacology Journal, издаваемом с 2008 г. в Нидерландах, в конце 2009 г. появилась совместная публикация российских и итальянских ученых (Московский государственный университет им. М. В. Ломоносова, компания «Герофарм», L’Istituto Superiore di Sanita, Рим), посвященная применению препарата Кортексин и его влиянию на когнитивные функции и поведенческие реакции (в условиях эксперимента).
В частности, Adriani W. и cоавт. (2009) сообщают о подтвержденном анксиолитическом эффекте Кортексина, одновременно подчеркивая активность препарата при использовании в малых дозах и отсутствие побочных реакций при его применении в лечебных целях [30]. Такие публикации указывают не только на эффективность нейропептидного биорегулятора Кортексин с позиций доказательной медицины, но и на международное признание этого российского препарата.
Тканеспецифичность и высокая биодоступность Кортексина определяют все больший спектр возможностей для применения этого препарата в лечении пациентов, начиная с периода новорожденности и до старческого возраста.
Реальность дел в сегодняшней фармакологии такова, что фактически имеется очень скудный перечень препаратов, разрешенных для применения у детей, и в этом плане высокие терапевтические свойства Кортексина делают его препаратом выбора.
Литература
В. М. Студеникин, доктор медицинских наук, профессор
Л. А. Пак, кандидат медицинских наук
С. Ш. Турсунхужаева
В. И. Шелковский, кандидат медицинских наук
С. В. Балканская, кандидат медицинских наук
НЦЗД РАМН, Москва
Пептиды для здоровья и долголетия
Все наши органы и ткани состоят из молекул белка. Белковая молекула, в свою очередь, состоит из цепочек аминокислот. Пептиды – это небольшие «кусочки» этих цепочек, в среднем от 2 до 50 аминокислот. Основная роль пептидов это передача информации клеткам. Именно так пептиды управляют биохимическими процессами в организме.
Пептиды в составе кремов, сывороток, эмульсий вдохновляют косметологов всего мира и формируют новые тренды в индустрии.
Пептиды уже используются во многих beauty продуктах, помогая тысячам женщин оставаться молодыми. Однако перспективы для них есть не только в косметологии.
С возрастом, а также при воздействии негативных факторов, таких как среда, токсины, генетические «поломки», нарушается питание клетки – ее способность «принимать» полезные вещества и кислород, поэтому нарушаются обменные процессы. Пептиды восстанавливают поврежденные клеточные стенки и могут нейтрализовывать свободные радикалы, образующиеся из-за неправильно функционирующих клеток.
Пептиды активно применяются в профилактической медицине. Речь пойдет о Цитаминах, БАДах на основе пептидов, идентичных пептидам нашего организма. Такие препараты представляют из себя сбалансированные комплексы активных веществ, которые направлены на борьбу и профилактику с той или иной болезнью. Они регулируют внутриклеточные процессы и обеспечивают нормальную работу органов и тканей. И помимо пептидов, Цитамины содержат необходимые микроэлементы и минеральные вещества, а также витамины в легкоусвояемой форме. Линейка включают в себя 16 наименований
ЦИТАМИНЫ® нормализуют обмен веществ на клеточном уровне, помогают клеткам правильно работать, тем самым восстанавливают и продлевают функциональную активность «износившихся» или работающих с нарушениями органов и тканей.
Цитамины подходят для любого возраста, но особую пользу от БАД получают пожилые люди. Стоит отметить, что вещества легко усваиваются организмом, так как состоят из натуральных компонентов не содержат консервантов. Цитамины помогут после перенесенной травмы, операции, химиотерапии, стрессах, а также при повышенной физической нагрузке.
Цитамины добываются из тканей и органов животных. Благодаря легкой усвояемости, они могут быстро восстановить и урегулировать различные повреждения в клетках организма. В составе такого препарата имеется необходимое число жиров и белков, в нем практически исключены углеводы, что делает продукт диетическим.
Виды Цитаминов:
5. Вентрамин используют при заболеваниях желудочно-кишечного тракта, язвенной болезни или гастрите.
6. Панкрамин рекомендован для восстановления функций поджелудочной железы или при сахарном диабете.
12. Тирамин является препаратом, нормализующим функцию щитовидной железы.
Все эти препараты можно найти в виде таблеток. Эти БАДы могут использоваться для профилактики заболеваний.
БАД. Не является лекарственным средством
Имеются противопоказания. Перед применением необходимо ознакомиться с инструкцией или проконсультироваться со специалистом
Неизвестные пептиды: «теневая» система биорегуляции
Автор
Редакторы
Уже давно не вызывает сомнений значимость белков для практически любого аспекта существования жизни. Однако их «младшие братья» — пептиды — привлекают незаслуженно мало внимания, обычно считаясь биологически не такими уж важными. Нет, никто не забывает про исключительную роль пептидов в эндокринной системе и антибактериальной защите. Однако ещё двадцать лет назад нельзя было и заподозрить, что пептидный «фон», присутствующий во всех тканях и традиционно воспринимаемый как «обломки» функциональных белков, также выполняет свою функцию. «Теневые» пептиды формируют глобальную систему биорегуляции и гомеостаза, — возможно, более древнюю, чем эндокринная и нервная системы.
В начале 2010 года постановлением Президиума РАН директор Института биоорганической химии им. академиков М.М. Шемякина и Ю.А. Овчинникова — Вадим Тихонович Иванов — награждён Большой золотой медалью Российской академии наук имени М.В. Ломоносова — «за выдающийся вклад в развитие биоорганической химии». На общем собрании РАН в мае этого года В.Т. Иванов прочитал лекцию о роли пептидов в качестве универсальных биорегуляторов. По мотивам лекции Иванова написана эта статья.
Белки, как постулировано ещё классиками диалектического материализма, являются основным «рабочим телом» жизни. Недаром даже в школьном учебнике биологии отдельным списком перечисляются функции белков: каталитическая, структурная, защитная, регуляторная, сигнальная, транспортная, запасающая, рецепторная и двигательная. Первые белки описали ещё в XVIII веке — это были альбумин («яичный» белок), фибрин (один из белков крови) и глютен (запасающий белок пшеницы). Центральная роль белков во всей биологии была осознана к концу первой четверти XX века, и с тех пор ни у кого уже не вызывает сомнения, что абсолютно все жизненные процессы протекают с участием этих универсальных «молекул жизни».
Есть у белков и «младшие братья» — пептиды. Отличие между этими двумя классами молекул довольно условное — идентичные по химической природе, они различаются лишь размером (длиной полипептидной цепи): если молекула состоит более чем из 50 аминокислотных остатков — это белок, а если менее — то пептид. Перечисленные выше «классические» функции относятся главным образом к белкам, на долю пептидов же традиционно отводилась роль в эндокринной регуляции: большинство хорошо известных биологических пептидов (а их не так уж много) являются нейрогормонами и нейрорегуляторами. Основные пептиды с известной функцией в человеческом организме — пептиды тахикининового ряда, вазоактивные интестинальные пептиды, панкреатические пептиды, эндогенные опиоиды, кальцитонин и некоторые другие нейрогормоны.
Кроме этого, важную биологическую роль играют антимикробные пептиды [1], секретируемые как животными, так и растениями (встречаются, например, в семенах или в слизи лягушек), а также антибиотики пептидной природы, о которых ещё будет немного сказано далее.
И вот не так давно (не более тридцати лет назад) обнаружилось, что кроме этих пептидов, обладающих вполне определёнными функциями, ткани живых организмов содержат довольно мощный пептидный «фон», состоящий в основном из фрагментов более крупных функциональных белков. Долгое время считалось, что это не имеет принципиального значения, и что такие пептиды — всего лишь «обломки» рабочих молекул, которые организм ещё не успел «подчистить». Однако в последнее время становится понятно, что этот «фон» играет важную роль в поддержании гомеостаза (тканевого биохимического равновесия) и регуляции множества жизненно важных процессов самого общего характера — таких как рост, дифференциация и восстановление клеток. Не исключено даже, что система биорегуляции на основе пептидов — эволюционный «предшественник» более современных эндокринной и нервной систем.
Однако давайте разбираться по порядку, и, чтобы не утратить исторической перспективы, начнём с короткой экскурсии в историю изучения пептидных веществ в нашей стране.
Историческая справка: пептидная школа в СССР
В 1959 году в Академии наук СССР был создан Институт химии природных соединений, во главе которого встал академик Михаил Михайлович Шемякин (1908–1970). Сотрудники института с самого начала были ориентированы на изучение природных биорегуляторов, таких как витамины и антибиотики. Большую работу по синтезу пептидных антибиотиков вёл молодой инициативный учёный — будущий директор института и вице-президент АН СССР Юрий Анатольевич Овчинников (1934–1988).
«Визитной карточкой» Института на долгие годы стал валиномицин — депсипептидный циклический антибиотик из бактерий Streptomyces fulvissimus, — синтез которого осуществила команда под руководством Овчинникова [2], доказав заодно ошибочность существовавших ранее представлений о структуре этого вещества (рис. 1). Валиномицин оказался ионофором, то есть веществом, селективно увеличивающим проницаемость биологической липидной мембраны для определённого типа ионов. Конформационное исследование валиномицина и его комплексов с ионами калия (а именно их он и переносит через мембрану) позволило сформулировать механизм работы антибиотика [3]. Ион металла, как в браслет, помещается в центр полости, присутствующей в циклической молекуле, и без энергетических затрат переносится через клеточную мембрану, — что и приводит к «обнулению» калиевого трансмембранного потенциала и, в конечном счёте, к гибели микроорганизма.
Рисунок 1. На лабораторном коллоквиуме в Институте химии природных соединений (1965 г.). Структуру циклического антибиотика валиномицина на доске рисует В.Т. Иванов. Депсипептиды, к которым относится и валиномицин, содержат наряду с «классическими» пептидными связями также одну или несколько сложноэфирных групп.
Блестящий пример валиномицина и других ионофоров, плюс шедшие параллельно в США исследования краун-эфиров, также способных к формированию прочных комплексов с ионами металлов, породили по всему миру каскад работ, приведших к становлению контейнерной химии, основанной на концепции «хозяин-гость» [4]. За работы в этой области Дональд Крам, Жан-Мари Лен и Чарльз Педерсен в 1987 году были удостоены Нобелевской премии по химии. Кстати, пространственная структура трансмембранного калиевого канала, полученная уже в XXI веке, показала, что механизм переноса и селективности к иону K + у этого белка принципиально такой же, как и в случае валиномицина, — только в канале координационную сферу иона образуют аминокислотные остатки из субъединиц канала-тетрамера [5], а в антибиотике это остов самой циклической молекулы-депсипептида.
За огромную работу по исследованию валиномицина и других ионофоров, результаты которой суммированы в монографии «Мембрано-активные комплексоны», Ю. А. Овчинников и В. Т. Иванов — нынешний директор Института биоорганической химии РАН (ИБХ — так сегодня называется институт, созданный Шемякиным) — были в 1987 году удостоены Ленинской премии. А в память о том романтическом периоде в биоорганической химии около входа в ИБХ красуется статуя, изображающая комплекс валиномицина с ионом калия.
«Болгарская простокваша», или как пептиды стимулируют врождённый иммунитет
Пептидные антибиотики — вещь, бесспорно, интересная, однако они по большей части вырабатываются микроорганизмами и действуют на микроорганизмы же, а значит, исследования должны были двигаться дальше — в сторону изучения пептидов животных и человека. Чтобы сделать переход к рассказу о человеческих пептидах более плавным, сначала коротко расскажем о мурамилпептидах — компонентах клеточной стенки бактерий, способных стимулировать врождённый иммунитет у человека.
В 1970-е годы в ИБХ обратился болгарский врач Иван Богданов с просьбой помочь проанализировать препарат, полученный им из продуктов ферментации кисломолочной бактерии Lactobacillus bulgaricus. Дело в том, что он хотел найти действующее начало «чудотворных» болгарских кисломолочных продуктов (в первую очередь, простокваши), якобы играющих роль в знаменитом болгарском долголетии. Роль диеты в долголетии целых народов так и остаётся не до конца доказанной, но вот препарат Богданова вызвал живой интерес, поскольку обладал существенной противоопухолевой активностью. По своему составу этот экстракт представлял собой сложную смесь веществ бактериального происхождения.
В результате исследований обнаружилось, что действующим началом препарата Богданова является элементарное звено клеточной стенки бактерий — глюкозаминил-мурамил-дипептид (ГМДП), — оказывающее на организм человека иммуностимулирующее и противоопухолевое действие. Фактически, этот элемент бактерии представляет для иммунной системы как бы «образ врага», мгновенно запускающий каскад поиска и удаления патогена из организма. Кстати, быстрый ответ — неотъемлемое свойство врождённого иммунитета, в отличие от адаптивной реакции, требующей до нескольких недель, чтобы «развернуться» полностью. На основе ГМДП был создан лекарственный препарат ликопид [6], применяющийся сейчас для широкого спектра показаний, связанных в основном с иммунодефицитами и инфекционными заражениями — сепсисом, перитонитом, синуситами, эндометритами, туберкулёзом, а также при различных видах лучевой и химеотерапии.
Новые «-омики»: пептидомика — новое направление постгеномных исследований
На этом изыскания «из жизни пептидов» не закончились — на самом деле, история с «простоквашей» и многие другие работы по веществам пептидной природы сообщили толчок для рождения новой отрасли, занимающейся систематическим изучением пептидов, содержащихся в живых клетках и тканевых жидкостях.
В начале 1980-х годов стало понятно, что роль пептидов в биологии сильно недооценена — их функции много шире, чем у всем известных нейрогормонов. Прежде всего, обнаружилось, что пептидов в цитоплазме, межклеточной жидкости и тканевых экстрактах много больше, чем считалось до того — как по массе, так и по числу разновидностей. Более того, состав пептидного «пула» (или «фона») в разных тканях и органах существенно отличается, и эти отличия сохраняются у разных особей. Число «свеженайденных» в тканях человека и животных пептидов в десятки раз превышало количество пептидов «классических» с хорошо изученными функциями. В течение какого-то времени «теневые» пептиды считались просто биохимическим «мусором», оставшимся от деградации более крупных функциональных белков и ещё не «прибранным» организмом, и лишь с начала 1990-х завеса тайны начала приподниматься.
Изучением роли пептидных «пулов» стала заниматься новая дисциплина — пептидомика, — становление которой происходило не в последнюю очередь и в ИБХ. Всем известно, что реализация генетической программы, заложенной в ДНК организмов, начинается с генóма — совокупности хромосом и генов [7]. Изучением организации и работы генома занимается специальная область на стыке молекулярной биологии и биотехнологий — генóмика. Ядро клетки, подобно командному центру, отправляет в цитоплазму послания — матричные РНК (мРНК), являющиеся «слепками» генов. Этот процесс называется транскрипцией, а совокупность всех мРНК, присутствующих в данный момент в цитоплазме и отражающих активность генома, по аналогии назвали транскриптóмом, особенности которого изучает транскриптомика. Сумма всех белковых молекул, которые синтезировали рибосомы, «прочитав» кодирующие белки мРНК, называется протеóмом, и изучает эту «белковую сферу» протеомика [8].
Эти три «-омики» являются классическими, но если вспомнить о том, что белки имеют ограниченный «срок годности», после чего расщепляются протеазами на фрагменты — то есть на пептиды! — то появляется ещё одна «-омика»: пептидомика [9]. По аналогии, её роль — изучить состав и функции белковых «пулов», существующих в разных тканях и органах, а также объяснить механизмы их образования и разрушения. Пептидóм находится на самом конце информационной цепочки: Генóм → Транскриптóм → Протеóм → Пептидóм. Пептидомика — самая молодая дисциплина из перечисленных: её возраст не превышает 30 лет, а название было предложено только в районе 2000 года. К настоящему моменту экспериментальная пептидомика позволила сформулировать три самых главных закономерности, описывающие поведение совокупности «теневых пептидов» в живых организмах.
Прежде всего, биологические ткани, жидкости и органы содержат большое число пептидов, образующих «пептидные пулы», и роль их далеко не балластная. Эти пулы образуются как из специализированных белков-предшественников, так из белков с иными, своими собственными функциями (ферментов, структурных и транспортных белков и др.).
Во-вторых, состав пептидных пулов устойчиво воспроизводится при нормальных условиях и не обнаруживает индивидуальных отличий. Это значит, что у разных особей пептидóмы мозга, сердца, лёгких, селезёнки и других органов будет примерно совпадать, но между собой эти пулы будут достоверно различаться. У разных видов (по крайней мере, среди млекопитающих) состав аналогичных пулов также весьма схож.
И, наконец, в-третьих, при развитии паталогических процессов, а также в результате стрессов (в том числе, длительного лишения сна) или применения фармакологических препаратов состав пептидных пулов меняется, и иногда довольно сильно. Это может использоваться для диагностики различных патологических состояний, — в частности, такие данные есть для болезней Ходжкина и Альцгеймера.
Точный состав пептидных пулов определить сложно, — прежде всего, потому, что число «участников» существенным образом будет зависеть от концентрации, которую считать значимой. При работе на уровне единиц и десятых долей наномоля (10 −9 М) это несколько сотен пептидов, однако при увеличении чувствительности методик до пикомолей (10 −12 М) число зашкаливает за десятки тысяч. Считать ли такие «минорные» компоненты за самостоятельных «игроков», или же принять, что они не имеют собственной биологической роли и представляют лишь биохимический «шум» — вопрос открытый.
Пептидные пулы — общая черта живых организмов?
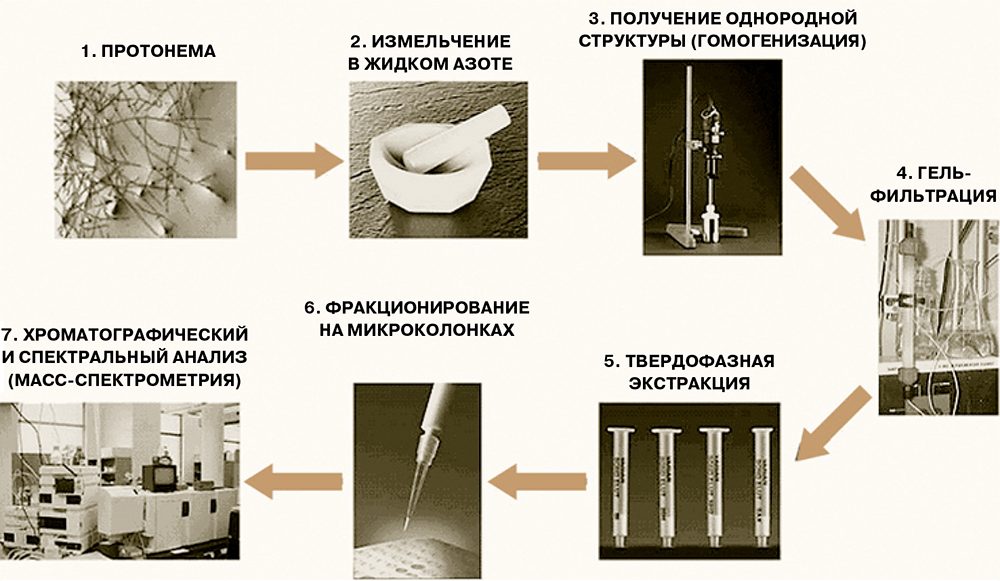
Большинство пионерских работ по пептидомике проведены на тканях животных, и во всех случаях были выявлены пептидные пулы определённого и характерного состава — у человека, быка, крысы, мыши, свиньи, суслика, гидры, дрозофилы, саранчи. Но является ли феномен наличия пептидных пулов общим, например, для растений и прокариот? В случае простейших или бактерий выяснить ситуацию ещё предстоит, но вот для растений, видимо, уже можно дать положительный ответ. В частности, для модельного растения — мха Рhyscomitrella patens, геном которого недавно был расшифрован, — было показано, что на каждой стадии развития (у нитчатой формы, протонемы и на стадии зрелой стадии, гаметофоров) в растении присутствует большое число эндогенных пептидов — фрагментов клеточных белков, набор которых индивидуален для каждой формы растения. (Схема экспериментального анализа пептидов из мха показана на рисунке 2.)
Рисунок 2. Схема анализа пептидов мха
Даже если у прокариот не обнаружится ничего похожего, уже можно сделать вывод, что большое число многоклеточных организмов культивирует внутри себя пептидные «пулы». Но для чего они служат и как образуются?
Пептиды: «теневая» система биорегуляции
Механизм образования пептидных пулов проще всего выяснить на культурах клеток, потому что, в отличие от целых тканей и органов, в этом случае появляется уверенность, что пептиды генерируются именно этим типом клеток, а не каким-то другим (или вообще не являются артефактом выделения из тканей). Наиболее подробно в этом смысле изучены эритроциты человека [10] — клетки тем более интересные, что они лишены ядра, а, следовательно, большинство биохимических процессов в них сильно заторможено.
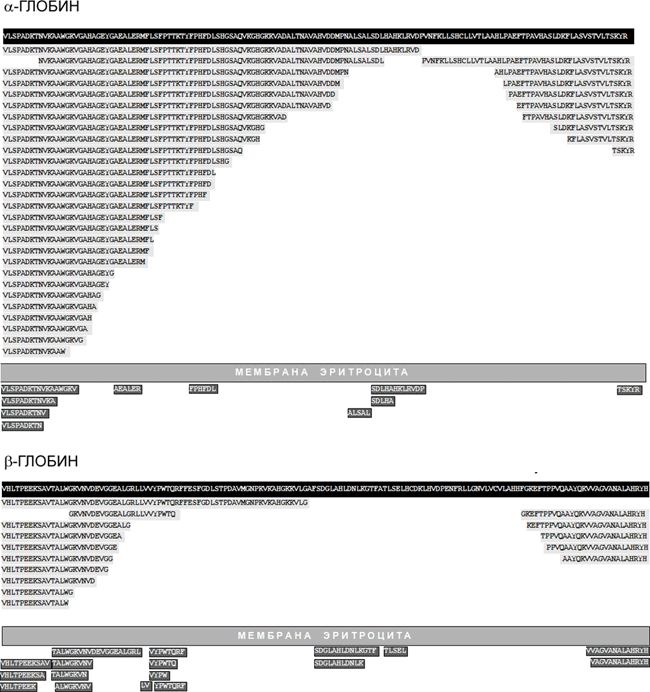
Установлено, что внутри эритроцитов происходит «нарезание» гемоглобиновых α- и β-цепей на серию крупных фрагментов (всего выделено 37 пептидных фрагментов α-глобина и 15 — β-глобина) и, кроме того, эритроциты выделяют в окружающую среду множество более коротких пептидов (рисунок 3). Пептидные пулы образуются и другими культурами клеток (трансформированными миеломоноцитами, клетками эритролейкемии человека и др.), т. е. продукция пептидов культурами клеток — широко распространённый феномен. В большинстве тканей 30–90% всех идентифицированных пептидов являются фрагментами гемоглобина, однако идентифицированы и другие белки, порождающие «каскады» эндогенных пептидов, — альбумин, миелин, иммуноглобулины и др. Для части «теневых» пептидов предшественников пока не найдено.
Даже беглый взгляд на перечень пептидных фрагментов гемоглобина (рис. 3) приводит к выводу, что разнообразие эндогенных пептидов значительно превосходит традиционный набор пептидных гормонов, нейромодуляторов и антибиотиков. Несмотря на множество разрозненных данных об активности отдельных компонентов пептидных пулов, ключевой вопрос о биологической роли пептидных пулов в целом оставался не решённым. Представляет ли основная масса пептидов в пулах просто нейтральные промежуточные продукты разрушения белковых субстратов на пути к аминокислотам, вновь используемым для ресинтеза белков, или эти пептиды играют самостоятельную биологическую роль?
Рисунок 3. Образование пептидов в культуре эритроцитов человека. На чёрном фоне показаны аминокислотные последовательности α- и β-глобина, а на сером — последовательности пептидов, идентифицированных как фрагменты этих белков.
Для ответа на этот вопрос было изучено действие более 300 пептидов — компонентов пептидных пулов тканей млекопитающих — на набор культур опухолевых и нормальных клеток. В результате оказалось, что более 75% этих пептидов оказывают выраженное пролиферативное или антипролиферативное действие хотя бы на одну культуру (то есть, ускоряют или замедляют деление клеток) [11]. Были обнаружены и другие виды биологической активности, более или менее пересекающиеся с активностями гормонов, парагормонов и нейротрансмиттеров. В результате ряда таких работ было сделано несколько выводов:
По-видимому, один из главных механизмов действия коротких биологических пептидов — работа через рецепторы хорошо известных пептидных нейрогормонов. Сродство «теневых» пептидов к рецепторам очень низкое — в десятки или даже тысячи раз ниже, чем у их «основных» лигандов, но нужно принимать во внимание и тот факт, что концентрация «теневых» пептидов примерно в такое же число раз выше. В результате оказываемый ими эффект может иметь ту же величину, а, учитывая широкий «биологический спектр» пептидного пула, можно сделать вывод об их важности в регуляторных процессах.
В то же время, мишени действия большинства «теневых» пептидов неизвестны. По предварительным данным, некоторые из них могут влиять на работу рецепторных каскадов и даже участвовать в «управляемой гибели» клетки — апоптозе.
Кстати, фрагменты более крупных белков, обладающие своей собственной функцией, никак не связанной с функцией «родителя», получили название криптеинов («спрятанные» белки). Криптеины сейчас довольно активно изучаются и выявляются в последовательностях «не секретных» белков в надежде обнаружить у них особые биологические (например, лекарственные) свойства.
Полифункциональный и полиспецифичный «биохимический буфер», который образует пептидный пул, «смягчая» метаболические колебания, позволяет говорить о новой, ранее неизвестной системе регуляции на основе пептидов (см. таблицу 1). Этот механизм дополняет всем известные нервную и эндокринную системы, поддерживая в организме своеобразный гомеостаз и устанавливая равновесие между ростом, дифференцировкой, восстановлением и гибелью клеток. Изменение пептидного «фона» почти наверняка обратит внимание на протекающий патологический процесс, а восстанавливающее и стимулирующее действие многих пептидных веществ, видимо, можно объяснить как раз восстановлением нарушенного равновесия.
Учитывая сказанное, можно даже высказать предположение, что пептидная биорегуляторная система является эволюционным предшественником более совершенных и современных нервной и эндокринной систем. Эффекты, оказываемые пептидным «фоном», могут проявляться уже на уровне отдельной клетки, в то время как невозможно себе представить работу нервной или эндокринной системы в одноклеточном организме.
| Свойство | Регуляторная система | ||
|---|---|---|---|
| Нервная | Эндокринная / паракринная | Тканеспецифичные пептидные пулы | |
| «Рабочее тело» | Нейротрансмиттеры | Гормоны | Пептиды — фрагменты функциональных белков |
| Предшественник | Специфический белковый предшественник | Специфический белковый предшественник | Функциональные белки |
| «Порождающий» процесс | Сайт-специфическое расщепление | Сайт-специфическое расщепление | Действие набора клеточных протеаз |
| Концентрация (нМ/г ткани) | 0,001–1.0 | 0,001–1.0 | 0,1–100 |
| Тип регуляции | Синаптическая секреция | Внеклеточная секреция | Изменение концентрации в ткани |
| Механизм действия | Связывание с рецепторами синаптической мембраны | Связывание с рецепторами клеточной мембраны | Связывание с рецепторами «родственных» гормонов |
| Константа связывания с рецептором (Kd, нМ) | 1–1000 | 0,1–10 | 100–10000 |
| Период активности | Секунды–минуты | Минуты–часы | Часы–дни |
| Биологическая роль | Передача нервного импульса | Регуляция физиологических процессов в ткани или всём организме | Поддержание тканевого гомеостаза |
Будущие приложения пептидомики
Лекарственные препараты, по существу являющиеся вариациями на тему пептидных пулов различных тканей животных, уже достаточно широко представлены на рынке (таблица 2), хотя они и не входят в число «блокбастеров», приносящих концернам максимальные барыши. Основная область их применения — состояния, связанные с дегенерацией или трансформацией клеток и тканей, а также необходимостью регенерации (заживления ран). Однако такие препараты не являются чистыми химическими веществами, а, следовательно, не удовлетворяют требованиям современной доказательной молекулярной медицины. (Дело в том, что современные фармакологические стандарты — такие как Good Clinical Practice — подразумевают проведение клинических испытаний, в которых совершенно чётко было бы доказано действие того или иного лекарственного компонента.)
| Препарат | Источник | Показание |
|---|---|---|
| Солкосерил (Швейцария) | Депротеинизированный гемодериват из телячьей крови | Заживление ран, трансплантация, ишемия |
| Актовегин (Дания) | Пептиды плазмы крови | Заживление ран, трансплантация, ишемия |
| Вирулизин (Канада) | Экстракт желчного пузыря крупного рогатого скота | Иммунодефициты, онкология |
| Тимулин (Россия) | Экстракт тимуса крупного рогатого скота | Иммунодефициты |
| Церебролизин (Австрия), Кортексин (Россия) | Экстракт головного мозга крупного рогатого скота/свиньи | Инсульт, болезнь Альцгеймера |
| Раверон (Швейцария) Простатилен (Россия) | Экстракт предстательной железы крупного рогатого скота | Простатит, аденома предстательной железы |
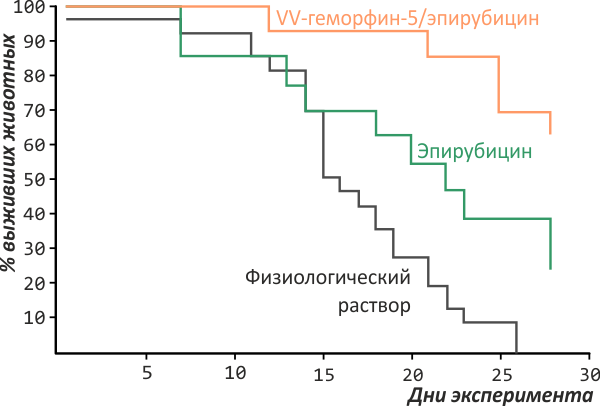
Одно из перспективных направлений здесь — использование упоминавшейся уже антипролиферативной активности пептидов. Так, в опытах на карциноме молочной железы мышей один из фрагментов гемоглобина (так называемый VV-геморфин-5) удваивал выживаемость животных при совместном применении со стандартным цитостатиком эпирубицином по сравнению с применением одного только эпирубицина [12] (рис. 4). Этот эксперимент даёт основания полагать, что на основе природных пептидных пулов возможно создание вспомогательных и поддерживающих препаратов для онкологической терапии.
Рисунок 4. Средняя продолжительность жизни мышей с карциномой молочной железы при интраперитонеальном введении эпирубицина и комбинированной терапии эпирубицином с VV-геморфином-5. Выживаемость во втором случае была выше в два раза.
Однако разработка и тестирование новых лекарств — чрезвычайно долгий и затратный процесс, осложняемый конкурентной борьбой фармацевтических гигантов [13]. Более близкая перспектива использования пептидных пулов — это диагностика заболеваний и прочих патологических состояний. Выше уже не раз было сказано, что пептидный состав образца сильно зависит от состояния, в котором находился организм — донор ткани. Уже есть примеры использования пептидомного подхода для выявления маркеров тех или иных заболеваний, в том числе — онкологических.
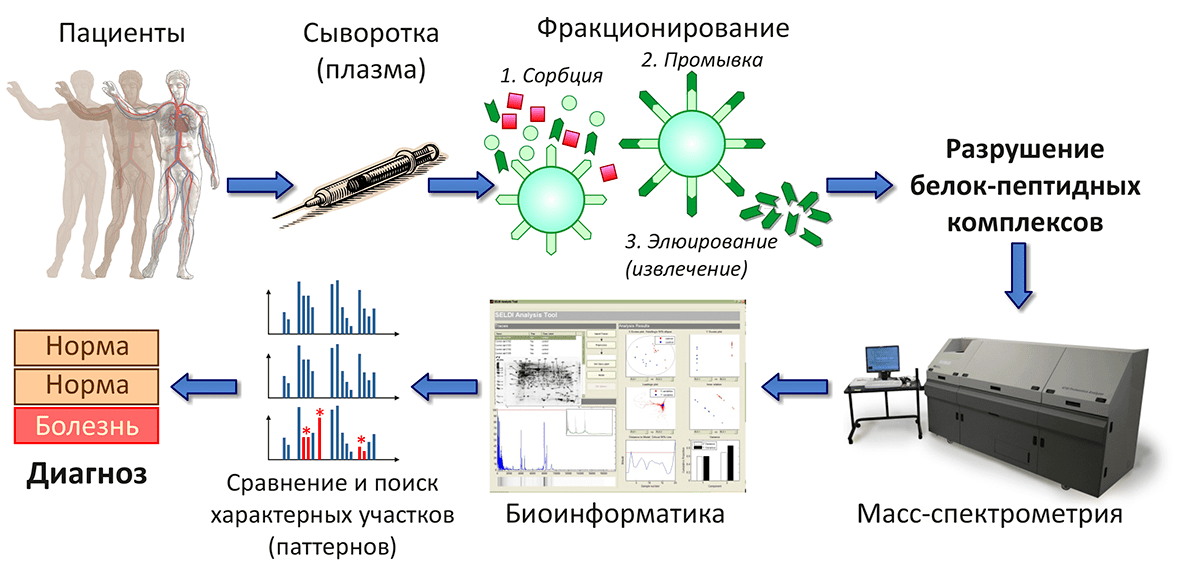
В Институте биоорганической химии разработана методика масс-спектрометрического анализа пептидного профиля образцов крови и выявлены статистически достоверные различия, по которым можно диагностировать рак яичников, колоректальный рак или сифилис (рис. 5). Масс-спектр, отражающий состав пептидного пула образца тканей, в случае больного человека будет иметь характерные отличия, по которым исследователи — а в перспективе и врачи — смогут ставить точный диагноз.
Рисунок 5. Медицинская диагностика на основе пептидного профилирования образцов крови. Сочетание масс-спектрометрических и биоинформатических методов позволяет выявить различия между пептидным составом крови больных и здоровых пациентов.
Эти примеры не оставляют сомнения, что «теневые» пептиды из тканевых пулов хранят массу практически полезной информации — от диагностики до лечения социально-значимых заболеваний.
Статья написана с использованием материалов и иллюстраций, любезно предоставленных В.Т. Ивановым. Упрощённая версия этой статьи была первоначально опубликована в журнале «Наука и жизнь» [14]; в 2011 году она заняла первое место в конкурсе научно-популярных статей «Наука — это понятно!», проводимом Советом молодых ученых РАН.