что относится к щелочам
Щелочь
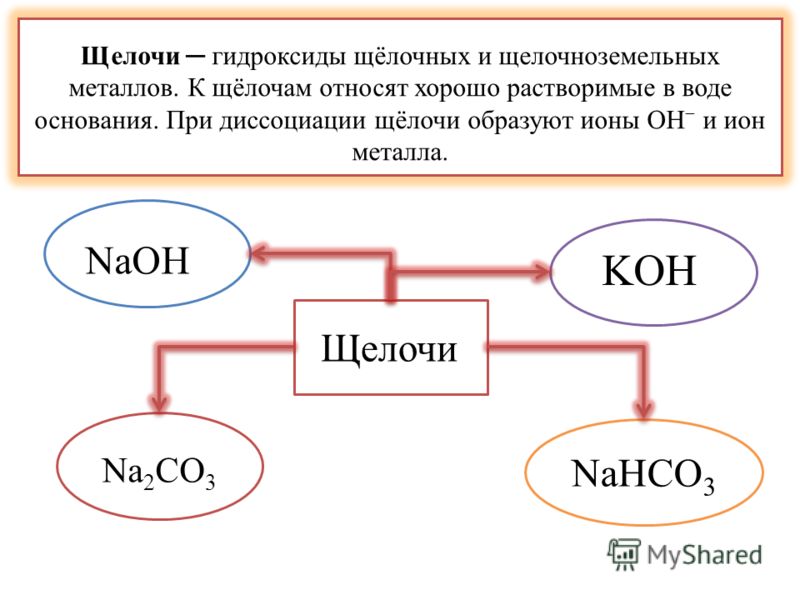
Щёлочи — гидроксиды щелочных и щёлочноземельных металлов. К щелочам относят растворимые в воде основания. При диссоциации щелочи образуют ионы OH- и ион металла.
К щелочам относятся гидроксиды металлов подгрупп Iа и IIа периодической системы, например NaOH(едкий натрий), KOH (едкий калий), Ba(OH)2 (едкий барий). Едкие щелочи — тривиальное название гидроксидов лития LiOH, натрия NaOH, калия КОН, рубидия RbOH, и цезия CsOH.
Физические свойства
Химические свойства
Поглощают H2O и CO2 из воздуха. Щёлочи широко применяются в промышленности. Важное химическое свойство щелочей — способность образовывать соли в реакции с кислотами.
Получение
Получают путём электролиза хлоридов щелочных металлов или действием воды на оксиды щелочных металлов.
Полезное
Смотреть что такое «Щелочь» в других словарях:
щелочь — сущ., кол во синонимов: 4 • алкали (1) • злюка (30) • каустик (1) • щёлочь (1) … Словарь синонимов
щелочь — — [http://www.dunwoodypress.com/148/PDF/Biotech Eng Rus.pdf] Тематики биотехнологии EN alkali … Справочник технического переводчика
щелочь — šarmas statusas T sritis chemija atitikmenys: angl. alkali; alkaline solution; lye rus. щелок; щелочь ryšiai: sinonimas – šarminis tirpalas … Chemijos terminų aiškinamasis žodynas
щелочь — šarmas statusas T sritis chemija apibrėžtis Vandenyje tirpus šarminio ar šarminių žemių metalo hidroksidas. atitikmenys: angl. alkali rus. щелочь … Chemijos terminų aiškinamasis žodynas
Щелочь — щёлочь ж. Едкое, хорошо растворимое в воде химическое соединение, при взаимодействии которого с кислотами образуются соли, а при погружении в него лакмусовая бумажка окрашивается в синий цвет. Толковый словарь Ефремовой. Т. Ф. Ефремова. 2000 … Современный толковый словарь русского языка Ефремовой
щелочь — ЩЁЛОЧЬ и; мн. род. щелочей; ж. Едкое, хорошо растворимое в воде химическое соединение, окрашивающее лакмусовую бумагу в синий цвет (при взаимодействии его с кислотами образуются соли) … Энциклопедический словарь
щелочь — з.б.п., чы, чæй, чьмæ … Орфографический словарь осетинского языка
Амарин щелочь — Амарин C 21H18N2 искусственная органическая щелочь, напоминающая по некоторым свойствам растительные алкалоиды; получается при обработке аммиаком спиртового раствора бензойного альдегида или же простым нагреванием около 120 130° изомерного с ним… … Энциклопедический словарь Ф.А. Брокгауза и И.А. Ефрона
Амарин, щелочь — Амарин C21H18N2 искусственная органическая щелочь, напоминающая по некоторым свойствам растительные алкалоиды; получается при обработке аммиаком спиртового раствора бензойного альдегида или же простым нагреванием около 120 130° изомерного с ним… … Энциклопедический словарь Ф.А. Брокгауза и И.А. Ефрона
летучая щелочь — сущ., кол во синонимов: 1 • нашатырь (6) Словарь синонимов ASIS. В.Н. Тришин. 2013 … Словарь синонимов
Что такое щелочь, в какие реакции вступают самые известные из них
Химия – наука, изучающая различные реакции, протекающие в природе, а также взаимодействия одних соединений с другими. Основными веществами здесь являются кислоты и щелочи, реакции между которыми обычно называются нейтрализацией. Они приводят к образованию растворимой в воде соли.
Что такое щелочь
Гидроксиды щелочных (металлы первой группы главной (А) подгруппы в периодической таблице химических элементов Д. И. Менделеева) и щелочноземельных (металлы второй группы главной (А) подгруппы, включая кальций) металлов, которые бурно взаимодействуют с водой и полностью в ней растворяются, называются щелочами. Так как они способны разрушать органический материал (кожу, древесину, бумагу), их называют едкими. Например, гидроксид калия (KOH) – едкий калий, бария (Ba(OH)2) – едкий барий и так далее.
Физические свойства сильных оснований
Исходя из определения, что такое щелочь, можно добавить, что эти гидроксиды также представляют собой твердые гигроскопичные (способные поглощать из воздуха пары воды) вещества белого цвета. К самым сильным щелочам относятся гидроксиды цезия CsOH и радия Ra(OH)2. Реакции щелочей чаще всего сопровождаются выделением тепла (экзотермические). Также к физическим свойствам таких оснований можно отнести их способность растворяться в некоторых органических соединениях, например, в спиртах: метаноле и этаноле.
Химические свойства
Растворы щелочей способны вступать в различные реакции.
Сильные основания обладают способностью взаимодействовать с кислотными и амфотерными оксидами:
При реагировании с амфотерными металлами (Zn, Al и прочие) также возможно образование как расплава, так и соответствующей комплексной соли. Причем обе реакции сопровождаются выделением газообразного водорода:
Также щелочи способны реагировать с солями, в результате чего образуется другое основание и другая соль. Условием протекания реакции является то, что в результате одно из образовавшихся веществ должно быть не растворимо в воде:
NaOH + CuSO4 = Na2SO4 + Cu(OH)2.
Как уже было упомянуто ранее, щелочи и кислоты вступают в реакцию нейтрализации, образуется соль и вода:
NaOH + HCl = NaCl + H2O.
Щелочи вступают в реакцию с другими основаниями только, если это гидроксиды амфотерных металлов:
NaOH + Al(OH)3 = Na[Al(OH)4].
Некоторые из них могут вступать во взаимодействие со многими органическими веществами: эфирами, амидами, многоатомными спиртами:
2C2H6O2 + 2NaOH = C2H4O2Na2 + 2H2O (продукт реакции – алкоголят натрия).
Как получают сильные основания
Щелочи получают разными способами как в промышленности, так и в лабораториях.
В промышленной индустрии существуют несколько методов получения щелочей: пиролиз, известковый, ферритный, электролиз, который делится на диафрагменный, мембранный и ртутный методы на жидких и твердых катодах.
Это электролиз растворов хлоридов натрия и калия, после чего на аноде и катоде выделяются хлор и водород, и получаются соответствующие гидроксиды:
При пиролизе в 1000 градусов на первом этапе происходит образование оксида натрия:
На втором этапе полученный охлажденный оксид растворяют в воде, в результате чего и получается необходимая щелочь:
В лабораториях также применяется электролиз. Еще щелочи могут получиться путем воздействия на соответствующие металлы водой или взаимодействия солей этих металлов с другими основаниями, в результате чего получается необходимая щелочь и нерастворимый в воде второй продукт реакции – соль.
2Cs + 2H2O = 2CsOH + H2.
В результате действия воды на оксид лития получается щелочь:
Li2O + 2H2O = 2LiOH + H2.
Применение
Опираясь на само определение того, что такое щелочь, можно понять, что они находят широкое применение не только в промышленности, но и в быту:
Меры предосторожности
Становится очевидным, что такие щелочи, как гидроксиды натрия, лития, калия, цезия и прочие, способны сильно повреждать и обжигать кожу и слизистые оболочки глаз даже при попадании туда мельчайших частиц соединения. Чтобы предотвратить это, необходимо носить защитные очки, резиновые перчатки, а также спецодежду, которая обработана специальными веществами, не позволяющими материалу взаимодействовать со щелочами.
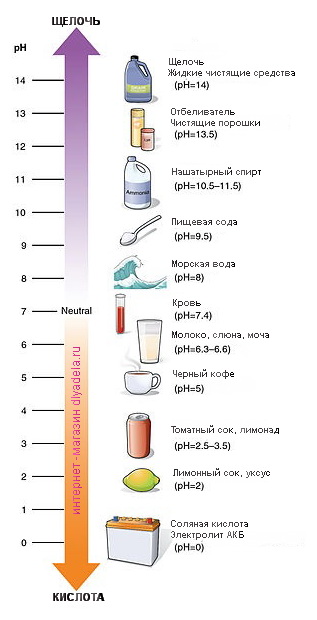
Чем отличаются кислоты от щелочей
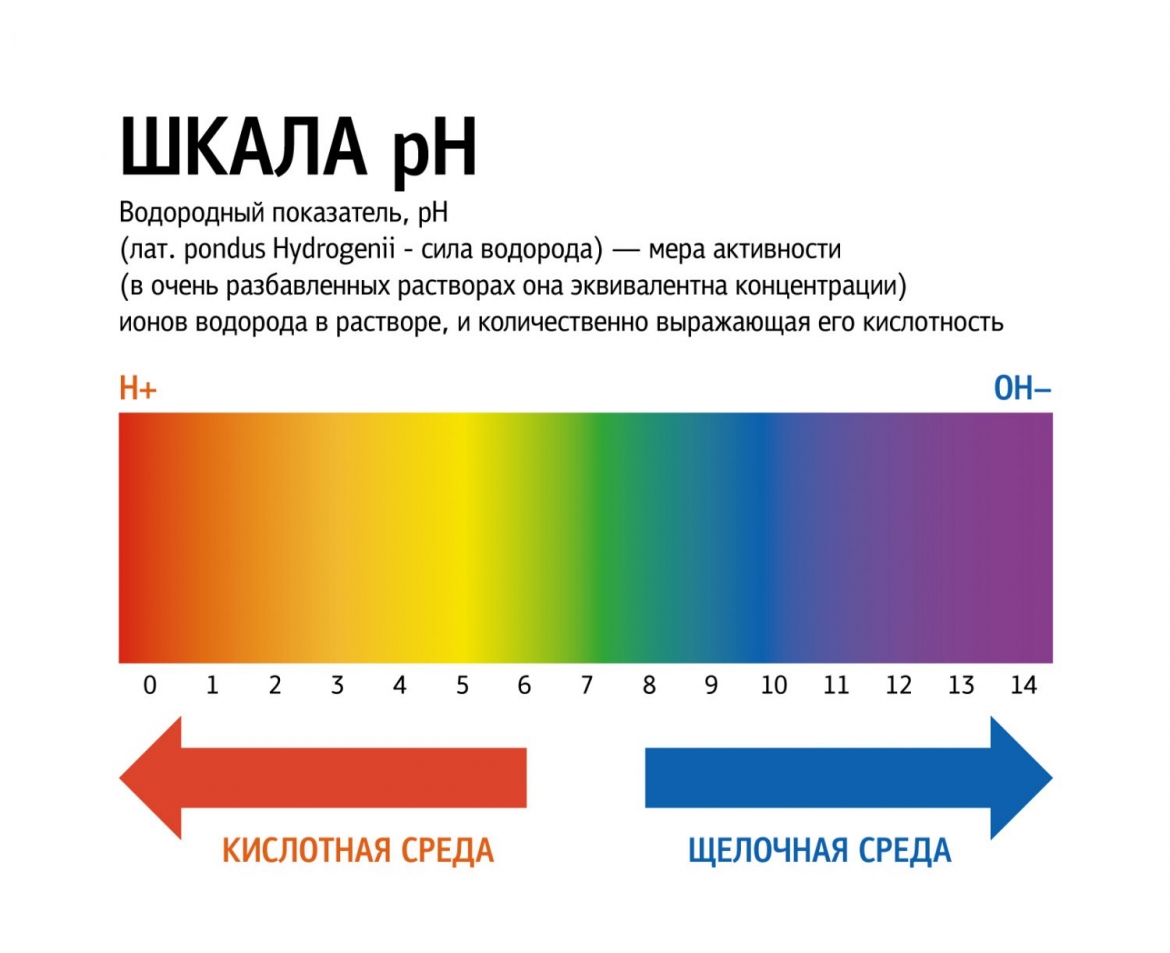
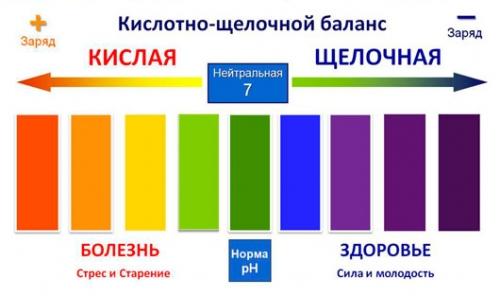
Кислоты и щёлочи отличают по показателям pH (шкала pH). Ниже Вы видите картинку – это специальная шкала, на которой имеются числа от 0 и до 14. Нулём обозначают самые сильные кислоты, а четырнадцатью – самую сильную щёлочь. Но какая же середина между этими числами? Может быть 5, может быть 7, а может быть 10? Серединой принято считать число 7 (нейтральное положение). То есть числа до 7 это все кислоты, а больше 7 это щёлочи.
Именно для этой шкалы разработаны специальные индикаторы — лакмусы. Это обычная полоска, которая реагирует на среду. В кислотной среде она окрашивается в красный цвет, а в щелочной среде – в синий цвет. Она необходима не только в химии, но и в быту.
Например, если у Вас есть аквариум, то немаловажную роль играет кислотность воды. От неё зависит вся жизнь аквариума. К примеру, показатель кислотности воды для аквариумных рыбок колеблется от 5 до 9 рН. Если будет больше или меньше, то рыбка будет чувствовать себя не комфортно, а может и вовсе умереть. Всё тоже самое и с растениями для аквариумов…
Кислоты
Кислоты — это соединения, содержащие водород и образующие ионы водорода (Н+) при растворении в воде. Ионы — это частицы с электрическим зарядом (см. статью «Химические связи»). Именно ионы придают кислотам их свойства, но существовать они могут только в растворе. Следовательно, свойства кислот проявляются исключительно в растворах. Молекула серной кислоты (H2SO4) состоит из атомов водорода, серы и кислорода. В состав соляной кислоты (НСl) входят водород и хлор. Кислота считается сильной, если большинство ее молекул распадаются в растворе, выделяя ионы водорода. Соляная, серная, азотная кислоты относятся к сильным. На контейнерах с сильными кислотами ставятся принятые во всем мире символы, означающие «опасно» и «высокая активность»Сила кислоты измеряется числом рН — водородным показателем. Сильные кислоты очень агрессивны; попав на поверхность предмета или на кожу, они прожигают её. На контейнерах с сильными кислотами ставятся принятые во всем мире символы, означающие «опасно» и «высокая активность».
Такие кислоты, как лимонная или уксусная, т.е. произведенные живыми организмами, называются органическими. Кислоты широко применяются в химической и медицинской промышленности, в производстве продуктов питания и синтетических волокон. Виноградный уксус содержит слабую кислоту, называемую уксусной. В помидорах есть органическая салициловая кислота. В цветных пятнах на коже морских улиток содержится кислота с неприятным вкусом, отпугивающая хищников. Для всех кислот характерно сходное поведение в химических реакциях. Например, при реакциях кислот с основаниями образуется нейтральное соединение — соль и вода. Реакции кислот с большинством металлов дают соль и водород. Реагируя с карбонатами, кислоты дают соль, углекислый газ и воду. Известный кулинарам пекарный порошок содержит гидрокарбонат натрия и винную кислоту. Когда в муку, содержащую пекарный порошок, добавляют воду, кислота и карбонат порошка вступают в реакцию, углекислый газ начинает выделятся в виде пузырьков, и это помогает тесту подниматься.
рН и индикаторы
Сила кислот и оснований определяется числом рН. Это мера концентрации ионов водорода в растворе. Число рН изменяется от 0 до 14. Чем меньше рН, тем выше концентрация водородных ионов. Раствор, рН которого меньше 7, — кислота. Апельсиновый сок имеет рН 4, значит, это кислота. Вещества с рН = 7 нейтральны, а вещества с рН больше 7 — основания или щелочи. рН кислоты или щелочи можно определить с помощью индикатора. Индикатор — это вещество, меняющее цвет при контакте с кислотой или щелочью. Так лакмус краснеет в кислоте и синеет в щелочи. Кислота окрашивает синюю лакмусовую бумажку в красные цвет, а красная лакмусовая бумажка в щелочи становится синей или фиолетовой. Лакмус получают из примитивных растений, называемых лишайниками. Другие растения, например, гортензия и краснокочанная капуста, также являются природными индикаторами.
Так называемый универсальный индикатор – это смесь нескольких красок. Он меняет цвет в зависимости от pH вещества. Он становится красным, оранжевым или желтым в кислотах, зеленым или желтым в нейтральных растворах и синим или фиолетовым в щелочах.
Серная кислота
Серная кислота играет важную роль в промышленности, прежде всего в производстве удобрений на основе суперфосфатов и сульфата аммония. Она также используется в производстве синтетических волокон, красителей, пластмасс, лекарств, взрывчатых веществ, моющих средств, автомобильных аккумуляторов. Когда-то серную кислоту называли минеральной кислотой, так как ее получали из серы — вещества, встречающегося в земной коре в виде минерала. Серная кислота очень активна и агрессивна. При растворении в воде она выделяет много тепла, поэтому ее нужно вливать в воду, но не наоборот — тогда кислота растворится, а вода поглотит тепло. Она — мощный окислитель, т.е. при реакциях окисления она отдает кислород другим веществам. Серная кислота также является осушителем, т.е. забирает воду, связанную с другим веществом. Когда сахар (C12H22O11) растворяется в концентрированной серной кислоте, кислота забирает у сахара воду, и от сахара остается пенящаяся масса черного угля.
Кислоты в почве
Цветы гортензии на кислотной почве синие, а на щелочной — розовыеКислотность почвы зависит от характера образовавших ее пород и от растущих на ней растений. На меловых и известняковых породах почва обычно щелочная, а на лугах, в песчаных и лесистых районах она более кислая. Кислотность также повышают кислотные дожди. Для земледелия лучше всего подходят нейтральные или слабокислые почвы, рН которых от 6,5 до 7. Разлагаясь, мертвые листья образуют органическую гуминовую кислоту и повышают кислотность почвы. Там, где почвы чересчур кислотные, в них добавляют измельченный известняк или гашеную известь (гидроксид кальция), т.е. основания, которые нейтрализуют кислоты почвы. Такие растения, как рододендроны и азалии хорошо растут на кислотных почвах. Цветы гортензии на кислотной почве синие, а на щелочной — розовые. Гортензия – природный индикатор. На кислотных почвах её цветы синие, а на щелочных розовые.
В настоящее время в химии принята теория Брёнстеда — Лоури и Льюиса, которая определяет кислоты и основания. В соответствии с этой теорией, кислоты — это вещества, способные отщеплять протон, а основания — отдавать электронную пару OH−. Можно сказать, что под основаниями понимают соединения, которые при диссоциации в воде образуют только анионы вида OH−. Если совсем просто, то щелочами называют соединения, состоящие из металла и гидроксид-иона OH−.
К щелочам принято относить гидроксиды щелочных и щелочно-земельных металлов. Все щелочи — это основания, но не наоборот, нельзя считать определения «основание» и «щелочь» синонимами.
Правильное химическое название щелочей — гидроксид (гидроокись), например, гидроокись натрия, гидроксид калия. Часто употребляются также названия, которые сложились исторически. Ввиду того, что щелочи разрушают материалы органического происхождения — кожу, ткани, бумагу, древесину, их называют едкими: например, едкий натр, едкий барий. Однако понятием «едкие щелочи» химики определяют гидроксиды щелочных металлов — лития, натрия, калия, рубидия, цезия.
Свойства щелочей
Щелочи — твердые вещества белого цвета; гигроскопичные, водорастворимые. Растворение в воде сопровождается активным выделением тепла. Вступают в реакции с кислотами, образуя соль и воду. Эта реакция нейтрализации является важнейшей из всех свойств щелочей. Кроме этого, гидроксиды реагируют с кислотными оксидами (образующими кислородосодержащие кислоты), с переходными металлами и их оксидами, с растворами солей.
Гидроксиды щелочных металлов растворяются в метиловом и этиловом спиртах, способны выдерживать температуры до +1000 °С (за исключением гидроксида лития).
Гидроксид натрия (едкий натр) используется в чистящих жидкостях, а также (как и гидроксид калия) для производства мыла. Мыло — это соль, образующаяся при реакции щелочей с кислотами растительных жиров. Жало осы выпускает щелочь, которую можно нейтрализовать кислотой, например уксусом.
Щелочи — активные химические реагенты, поглощающие из воздуха не только водяные пары, но и молекулы углекислого и сернистого газа, сероводорода, диоксида азота. Поэтому хранить гидроксиды следует в герметичной таре или, например, доступ воздуха в сосуд со щелочью организовать через хлоркальциевую трубку. В противном случае хим.реактив после хранения на воздухе будет загрязнен карбонатами, сульфатами, сульфидами, нитратами и нитритами.
Если сравнивать щелочи по химической активности, то она увеличивается при движении по столбцу таблицы Менделеева сверху вниз.
Концентрированные щелочи разрушают стекло, а расплавы щелочей — даже фарфор и платину, поэтому растворы щелочей не рекомендуется хранить в сосудах с пришлифованными стеклянными пробками и кранами, так как пробки и краны может заклинить. Хранят щелочи, обычно, в полиэтиленовых емкостях.
Именно щелочи, а не кислоты, вызывают более сильные ожоги, так как их сложнее смыть с кожи и они проникают глубоко в ткань. Смывать щелочь надо неконцентрированным раствором уксусной кислоты. Работать с ними необходимо в средствах защиты. Щелочной ожог требует немедленного обращения к врачу!
Применение щелочей
— В качестве электролитов.
— Для производства удобрений.
— В медицине, химических, косметических производствах.
— В рыбоводстве для стерилизации прудов.
Едкий натр. Самая популярная и востребованная в мире щелочь. Применяется для омыления жиров в производстве косметических и моющих средств, для изготовления масел в процессе нефтепереработки, в качестве катализатора и реактива в химических реакциях; в пищепроме.
Едкое кали. Применяется для производства мыла, калийных удобрений, электролитов для батареек и аккумуляторов, синтетического каучука. Также — в качестве пищевой добавки; для профессиональной очистки изделий из нержавеющей стали.
Гидроксид алюминия. Востребован в медицине как отличный адсорбент, антацид, обволакивающее средство; ингредиент вакцин в фармацевтике. Кроме этого, вещество применяется в очистных сооружениях и в процессах получения чистого алюминия.
Гидроокись кальция. Популярная щелочь с очень широким спектром применения, которую в быту знают под названием «гашеная известь». Используется для дезинфекции, смягчения воды, в производстве удобрений, едкого натра, «хлорки», строительных материалов. Применяется для защиты деревьев и деревянных сооружений от вредителей и огня; в пищепроме как пищевая добавка и реактив при производстве сахара.
Гидроокись лития. Востребованное соединение в химпроме как сырье; в стекольной, керамической, Фиксаналырадиотехнической индустрии; для производства смазочных материалов, электролитов; для поглощения вредных газов.
Гидроокись бария. Применяется в химпроме как катализатор, а также в пищепроме для очистки жиров, сахара.
• Кислоты и щелочи неспособны мирно сосуществовать даже одну секунду, находясь в соприкосновении. Перемешавшись, они мгновенно начинают бурное взаимодействие. Химическая реакция с ними сопровождается шипением и разогревом и длится до тех пор, пока эти ярые антагонисты не уничтожат друг друга.
• Кислотам свойственно образовывать кислую среду, а щелочам – щелочную.
• Химики отличают щелочь от кислоты по ее поведению с лакмусовой бумажкой или фенолфталеином.
ЩЕЛОЧИ
Щёлочи — общее название сильных водорастворимых оснований. В медицине щелочи применяют как раздражающие, прижигающие, дезинфицирующие и антисептические средства. Гидроксид кальция — гашеную известь (см. Известь) в виде водных растворов (известковая вода, Aqua calcarea) применяют для нейтрализации кислот.
К щелочам прежде всего относятся гидроксиды щелочных металлов (см.) NaOH, КОН, называемые обычно едкими щелочами (см. Едкий натр, Едкое кали). Свойствами щелочей обладают также гидроксиды щелочноземельных металлов (см.) — Ca(ОН)2, Ba(ОН)2, а также гидроксид аммония NH4OH (см. Аммиак), водные растворы алифатических аминов (см.) и гидразина (см.), гидроксиды тетраалкиламмония. Сходным со щелочами химическим действием обладают щелочные соли слабых кислот (см. Кислоты и основания) — карбонаты (сода, поташ), тетрабораты (например, Na2B4O7), трехзамещенные фосфаты (например, Na3PO4) и др. Свойства едких щелочей проявляют водные растворы алкоголятов щелочных металлов (см. Спирты). В водных растворах едкие щелочи почти полностью диссоциируют (см. Диссоциация в химии) на ионы щелочного металла и гидроксила (ОН-), благодаря чему они являются самыми сильными основаниями, этим же обусловлена высокая основность гидроксидов тетраалкиламмония, не уступающая едким щелочам. Меньшая основность щелочноземельных гидроксидов и гидроксида аммония NH4OH связана с меньшей степенью их диссоциации. Щелочные свойства солей слабых кислот объясняются их гидролизом с образованием едких щелочей: Na2CO3 + Н2O = NaHCO3 + NaOH.
Щелочи — гидроксиды щелочных и щелочноземельных металлов — бесцветные кристаллические вещества, они гигроскопичны, особенно едкие щелочи, расплывающиеся на воздухе. Все щелочи энергично поглощают диоксид углерода (углекислый газ СO2) из воздуха, превращаясь в карбонаты, поэтому их хранят герметически закрытыми. Едкие щелочи (кроме гидроксида лития LiOH) хорошо растворимы в воде (до 50% и выше), а также в метиловом и этиловом спиртах. Гидроксиды щелочноземельных металлов растворимы в воде умеренно, их растворимость повышается от Ca(ОН)2 к Ba(ОН)2. Растворение щелочи в воде происходит со значительным выделением тепла вследствие образования гидратов (см. Гидратация). Растворы щелочи имеют значения pH (см. Водородный показатель), равные приблизительно 11 — 14, и резко изменяют окраску кислотно-щелочных индикаторов (см.). При взаимодействии с кислотами щелочи образуют соли (см.), что широко используется на практике не только для нейтрализации кислот, но и как аналитический метод (см. Нейтрализации метод). При обработке щелочью жиров (см.) происходит их омыление (см.), в результате чего образуются соли жирных кислот — мыла (см.). Едкие щелочи обладают большой химической активностью и реагируют со многими веществами и материалами. Некоторые металлы — алюминий, цинк, олово и др. — реагируют с растворами едких щелочей, например алюминий корродируется даже слабыми щелочами (содой, аммиаком). В концентрированных растворах и особенно в расплавленном состоянии едкие щелочи разрушают стекло, фарфор и даже платину (в присутствии окислителей, в том числе воздуха), что следует учитывать при работе с расплавленными щелочами (в этих случаях используют посуду из железа, никеля или серебра). Едкие щелочи разъедают и разрушают животные и растительные ткани вследствие гидролитического действия на белки, однако растительные ткани подвергаются такому действию щелочи в меньшей степени.
Применение щелочей в дезинфекции основано на их свойствах гидролизовать белки, омылять жиры, расщеплять углеводы, разрушать микробную клетку (см. Дезинфекция, Дезинфицирующие средства).
Из щелочи наиболее активным является едкий натр, или каустическая сода (NaOH), который обладает бактерицидным, вирулицидным, а в высоких концентрациях при повышенной температуре — спороцидным действием; его 2—4% растворы применяют при кишечных и капельных инфекциях бактериальной и вирусной этиологии, а 10% раствор, нагретый до 75°, — при сибирской язве. Этими растворами обеззараживают помещения предприятий общественного питания, овчинно-шубных заводов, складских помещений для сырья животного происхождения, а также Помещений для животных.
Метасиликат натрия (смесь Na2O и SiO2) обладает бактерицидными, отбеливающими и моющими свойствами; его ограниченно применяют для дезинфекции при кишечных и капельных инфекциях бактериальной этиологии, так как 2% раствор метасиликата натрия портит краску, резиновые перчатки, обесцвечивает ткани, на стеклах оставляет несмываемые пятна. Карбонат натрия (сода) обладает слабым бактерицидным действием, его 1 — 2% растворы используют в качестве подсобного средства при кипячении с целью обеззараживания посуды, белья, предметов ухода за больными, а также для влажно-механической уборки помещений, чистки оборудования, мебели.
Гидроксид аммония NH4OH (см. Аммиак) обладает слабыми бактерицидными свойствами и используется в основном для нейтрализации формальдегида после обработки им различных объектов.
Негашеная известь CaO применяется для обеззараживания поверхностей путем их побелки из расчета 1 л 10% водного раствора (известкового молока) на 1 м2, а также для обработки выделений и почвы.
Щелочи как профессиональные вредности
Щелочи применяют в текстильной, бумажной, кожевенной промышленности, мыловарении и др. В организм человека они могут попадать с вдыхаемым воздухом или через рот (при случайном или умышленном приеме внутрь). Щелочи оказывают резкое раздражающее и прижигающее действие на кожу и слизистые оболочки. Едкие щелочи глубже, чем кислоты (см. Серная кислота, Соляная кислота), проникают в ткани, обезвоживают их, омыляют жиры, образуют с белками щелочные альбуминаты, вызывая колликвационный некроз. Тяжесть поражения зависит от концентрации и температуры раствора щелочи, величины его pH. При попадании на кожу щелочи вызывают ожоги (см.), заживление которых протекает более длительно, чем в случае воздействия кислот, так как в процесс вовлекаются глубже расположенные ткани. Общетоксическое действие щелочи выражено слабо и проявляется преимущественно в случаях хронического течения отравления.
При постоянном соприкосновении щелочи с кожей возможно развитие узелковых дерматитов (см.), появление болезненных, длительно не заживающих язвочек (типа «птичьих глазков»), экземы (см.). Кожа становится сухой, между пальцев образуются трещины, ногти истончаются, ломаются, деформируются, отделяются от ногтевого ложа. Прекращение контакта с щелочью приводит к быстрому выздоровлению.
При хроническом воздействии пыли или аэрозоля щелочи на дыхательные пути могут развиться хронические риниты (см.), фарингиты (см.), бронхиты (см.), эмфизема легких (см.). В результате заглатывания пыли или частиц аэрозоля возникают гастриты (см.), в ряде случаев могут наблюдаться язвенные поражения слизистой оболочки желудка.
При остром отравлении аэрозолями или пылью щелочи в высоких концентрациях, попавшими в дыхательные пути с вдыхаемым воздухом, происходит резкое раздражение слизистой оболочки верхних дыхательных путей, развивается трахеобронхит. При остром пероральном отравлении щелочью возникает ожог ротовой полости, пищевода, желудка, мучительная рвота, понос с кровью, сильная жажда, задержка мочи, позже — развивается токсический нефроз, пневмония, гнойный медиастинит, эмпиема плевры, сердечная недостаточность вплоть до коллапса и шока. Иногда отмечают ларингоспазм, отек гортани и легких, психомоторное возбуждение (особенно при отравлении гидроксидом аммония). Нередко происходит перфорация стенки желудка, иногда отмечают пищеводно-желудочные трудно останавливаемые кровотечения, перитонит и (без своевременной профилактики) образование стенозов пищевода, кардиального и пилорического отделов желудка более обширных, чем при отравлении кислотами.
При попадании щелочи в глаза возникает острое раздражение конъюнктивы, помутнение и изъязвление роговицы, повреждения более глубоких слоев глаза — радужки, стекловидного тела и сетчатки, следствием чего может быть слепота.
Первая помощь и неотложная терапия при попадании щелочи на кожу заключается в немедленном смывании щелочи струей воды в течение 5—10 минут, после чего на пораженное место кладут примочки из 5% раствора лимонной, виннокаменной или уксусной кислот. Если щелочь попала в глаза, их немедленно промывают обильной струей воды в течение 10—30 минут, при попадании в глаза гидроксида кальция глаза промывают 5% раствором хлористого аммония или 0,01% раствором тетацина кальция, после чего закапывают 0,5% раствор дикаина или 1 % раствор новокаина.
Экспертиза трудоспособности
Вопросы экспертизы трудоспособности, медицинской и трудовой реабилитации при интоксикациях щелочами решаются с учетом выраженности клинических симптомов интоксикации и гигиенической характеристики условий труда.
Профилактические мероприятия при работе с щелочью предусматривают герметизацию погрузки и выгрузки ГЦ., непрерывность технологического процесса; аппаратура должна быть снабжена укрытиями с местной вытяжной вентиляцией (см.). Под особым контролем должны находиться пылящие процессы (дробление, транспортировка и др.), а также работа с горячими растворами щелочи. Рабочие должны быть обеспечены защитными очками (см.), респираторами (см.), спецодеждой (см. Одежда специальная) и перчатками. Периодически проводятся медосмотры (см. Медицинский осмотр).
Предельно допустимая концентрация в воздухе рабочей зоны установлена для едких щелочей (в пересчете на едкий натр) 0.5 мг/м3, для карбоната кальция (известняка) — 6 мг/м3, карбоната натрия (соды кальцинированной)— 2 мг/м3.
Щелочи в судебно-медицинском отношении
При судебно-химическом исследовании щелочи выделяют из биологического материала путем диализа. При щелочной реакции к диализату прибавляют спиртовой раствор фенолфталеина и избыток хлорида бария. Сохранение диализатом розовой окраски свидетельствует о наличии в нем щелочи. Химическую природу катиона (Na+,К+,Са2+) устанавливают по образованию характерного кристаллического осадка при добавлении к диализату пиросурьмянокислого натрия, винно-каменной кислоты и оксалата аммония; по посинению красной лакмусовой бумажки при отрицательной пробе на сероводород определяют ионы NH. В основе количественного определения щелочи лежит титрование водной вытяжки из исследуемой ткани кислотой в присутствии индикатора (см. Титриметрический анализ).
В задачу судебно-медицинской экспертизы при освидетельствовании потерпевших может входить установление степени тяжести телесных повреждений, причиненных действием щелочи, а при исследовании трупов — установление отравления щелочью как причины смерти. Оценка степени тяжести телесных повреждений в этих случаях проводится обычным порядком (см. Повреждения в судебно-медицинском отношении); диагностика отравления щелочью как причины смерти производится на основании оценки анамнестических и клинических данных, результатов вскрытия трупа, с химических и гистологических исследований.
Библиогр.: Авдеев М. И. Судебно-медицинская экспертиза трупа, с. 367, М., 1976; Вашков В. И. Руководство по дезинфекции, дезинсекции и дератизации, с. 96, М., 1956; он же, Антимикробные средства и методы дезинфекции при инфекционных заболеваниях, с. 33, М., 1977; Вредные вещества в промышленности, под ред. Н. В. Лазарева и И. Д. Гадаскиной, т. 3, с. 320, Л., 1977; 3агора Э. Промышленная офтальмология, пер. с польск., с. 111 и др., М., 1961; Некрасов Б. В. Основы общей химии, т. 2, с. 213 и др., М., 1973; Руководство по судебно-медицинской экспертизе отравлений, под ред. Р. В. Бережного и др., с. 79, М., 1980; Судебная медицина, под ред. А. Р. Деньковского и А. А. Матышева, с. 229, Л., 1976.
А. И. Точилкин; И. В. Буромский (суд.), E. Н. Марченко (гиг.), Н. Ф. Соколова (эпид.).