Что такое оксид серы
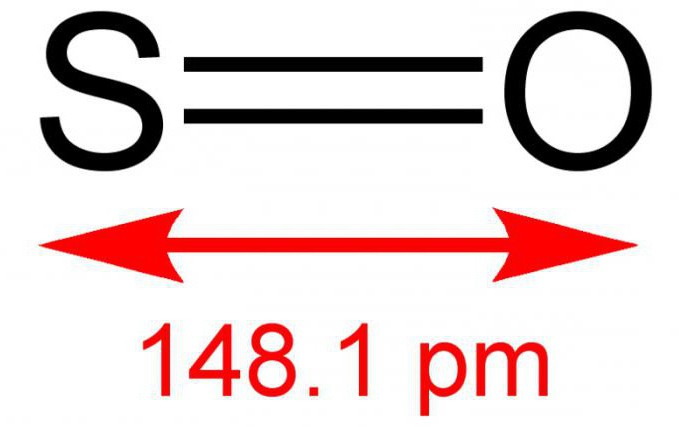
Оксид серы (IV)
Cпособы получения оксида серы (IV)
1. Сжигание серы на воздухе :
2. Горение сульфидов и сероводорода:
2CuS + 3O2 → 2SO2 + 2CuO
3. Взаимодействие сульфитов с более сильными кислотами:
4. Обработка концентрированной серной кислотой неактивных металлов.
Химические свойства оксида серы (IV)
SO2(изб) + NaOH → NaHSO3
Еще пример : оксид серы (IV) реагирует с основным оксидом натрия:
2. При взаимодействии с водой S O2 образует сернистую кислоту. Реакция обратимая, т.к. сернистая кислота в водном растворе в значительной степени распадается на оксид и воду.
3. Наиболее ярко выражены восстановительные свойства SO2. При взаимодействии с окислителями степень окисления серы повышается.
Сернистый ангидрид обесцвечивает бромную воду:
Азотная кислота очень легко окисляет сернистый газ:
Озон также окисляет оксид серы (IV):
Качественная реакция на сернистый газ и на сульфит-ион – обесцвечивание раствора перманганата калия:
Оксид свинца (IV) также окисляет сернистый газ:
4. В присутствии сильных восстановителей SO2 способен проявлять окислительные свойства.
Оксид серы (IV) окисляет угарный газ и углерод:
SO2 + 2CO → 2СО2 + S
Оксид серы в природе и жизни человека
В этой статье вы найдете информацию о том, что такое оксид серы. Будут рассмотрены его основные свойства химического и физического характера, существующие формы, способы их получения и отличия между собой. А также будут упомянуты области применения и биологическая роль данного оксида в его разнообразных формах.
Что представляет собой вещество
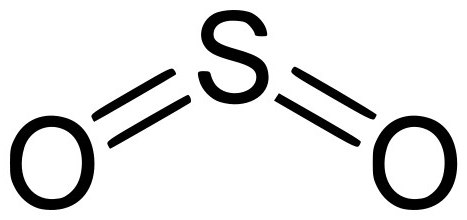
Оксид серы – это соединение простых веществ, серы и кислорода. Существует три формы оксидов серы, отличающиеся между собой степенью проявленной валентности S, а именно: SO (монооксид, моноокись серы), SO2 (серный диоксид или сернистый газ) и SO3 (триоксид или ангидрид серы). Все перечисленные вариации оксидов серы имеют схожие как химические, так и физические характеристики.
Общие данные о моноокисиде серы
Получают оксид серы (2) обычно при помощи сжигания серы или разложении ее ангидрида:
В воде вещество растворяется. В результате оксид серы образует тиосерную кислоту:
Общие данные о сернистом газе
Оксид серы – очередная форма оксидов серы с химической формулой SO2. Имеет неприятный специфический запах и не имеет цвета. Подвергаясь давлению, может зажигаться при комнатной температуре. При растворении в воде образует нестойкую сернистую кислоту. Может растворяться в растворах этанола и серной кислоты. Является компонентом вулканического газа.
В промышленности получают сжиганием серы или обжигом ее сульфидов:
В лабораториях, как правило, SO2 получают при помощи сульфитов и гидросульфитов, подвергая их воздействию сильной кислоты, а также воздействию на металлы с маленькой степенью активности концентрированной H2SO4.
Как и другие серные оксиды, SO2 является кислотным оксидом. Взаимодействуя со щелочами, образуя различные сульфиты, вступает в реакции с водой, создавая серную кислоту.
SO2 чрезвычайно активен, и это ярко выражается в его восстановительных свойствах, где окислительная степень оксида серы возрастает. Может проявлять свойства окислителя, если на него воздействует сильный восстановитель. Последнюю характерную особенность используют для производства фосфорноватистой кислоты, или для отделения S от газов металлургической области деятельности.
Оксид серы (4) широко используется человеком для получения сернистой кислоты или ее солей – это его основная область применения. А также он участвует в процессах виноделия и выступает там в роли консерванта (E220), иногда им протравливают овощехранилища и склады, так как он уничтожает микроорганизмы. Материалы, которые нельзя подвергать отбеливанию хлором, обрабатывают оксидом серы.
Общие данные о серном ангидриде
Серный газ, или, как его называют, серный ангидрид, – это высший оксид серы с химической формулой SO3. Жидкость с удушливым запахом, легколетучая при стандартных условиях. Способна застывать, образовывая смеси кристаллического типа из его твердых модификаций, при температуре от 16.9 °C и ниже.
Детальный разбор высшего оксида
При окислении SO2 воздухом под воздействием высоких температур, необходимым условием является наличие катализатора, например V2O5, Fe2O3, NaVO3 или Pt.
Термическое разложение сульфатов либо взаимодействие озона и SO2:
Окисление SO2 при помощи NO2:
К физическим качественным характеристикам относятся: наличие в состоянии газа плоского строения, тригонального типа и D3h симметрии, во время перехода от газа к кристаллу или жидкости образует тример циклического характера и зигзагообразную цепь, имеет ковалентную полярную связь.
В твердой форме SO3 встречается в альфа, бета, гамма и сигма формах, при этом он имеет, соответственно, разную температуру плавления, степень проявления полимеризации и разнообразную кристаллическую форму. Существование такого количества видов SO3 обусловлено образованием связей донорно-акцепторного типа.
К свойствам ангидрида серы можно отнести множество его качеств, основными из них являются:
Способность взаимодействовать с основаниями и оксидами:
Высший серный оксид SO3 имеет достаточно большую активность и создает серную кислоту, взаимодействуя с водой:
Вступает в реакции взаимодействия с хлороводородом и образует хлоросульфатную кислоту:
Для оксида серы характерным является проявление сильных окислительных свойств.
Применение серный ангидрид находит в создании серной кислоты. Небольшое его количество выделяется в окружающую среду во время использования серных шашек. SO3, образуя серную кислоту после взаимодействия с влажной поверхностью, уничтожает разнообразные опасные организмы, например грибки.
Подводя итоги
Оксид серы может находиться в разных агрегатных состояниях, начиная с жидкости и заканчивая твердой формой. В природе встречается редко, а способов его получения в промышленности довольно много, как и сфер, где его можно использовать. Сам оксид имеет три формы, в которых он проявляет различную степень валентности. Может быть очень токсичным и вызывать серьезные проблемы со здоровьем.
Оксид серы(IV)
| Оксид серы(IV) | |
 | |
 | |
| Общие | |
|---|---|
| Систематическое наименование | Оксид серы (IV) |
| Химическая формула | SO2 |
| Физические свойства | |
| Состояние (ст. усл.) | бесцветный газ |
| Отн. молек. масса | 64.054 а. е. м. |
| Молярная масса | 64.054 г/моль |
| Плотность | 0,002927 г/см³ |
| Термические свойства | |
| Температура плавления | −75,5 °C |
| Температура кипения | −10,01 °C |
| Химические свойства | |
| Растворимость в воде | 11,5 г/100 мл |
| Классификация | |
| Рег. номер CAS | [7446-09-5] |
Окси́д се́ры (IV) (диокси́д се́ры, се́рнистый газ, се́рнистый ангидри́д) — SO2. В нормальных условиях представляет собой бесцветный газ с характерным резким запахом (запах загорающейся спички). Под давлением сжижается при комнатной температуре. Растворяется в воде с образованием нестойкой се́рнистой кислоты; растворимость 11,5 г/100 г воды при 20 °C, снижается с ростом температуры. Растворяется также в этаноле, се́рной кислоте. SO2 — один из основных компонентов вулканических газов.
Содержание
Получение
Промышленный способ получения — сжигание серы или обжиг сульфидов, в основном — пирита:
В лабораторных условиях SO2 получают воздействием сильных кислот на сульфиты и гидросульфиты. Образующаяся сернистая кислота H2SO3 сразу разлагается на SO2 и H2O:

Также диоксид серы можно получить действием концентрированной серной кислоты на малоактивные металлы при нагревании:
Химические свойства
Относится к кислотным оксидам. Растворяется в воде с образованием сернистой кислоты (при обычных условиях реакция обратима):
Со щелочами образует сульфиты:
Химическая активность SO2 весьма велика. Наиболее ярко выражены восстановительные свойства SO2, степень окисления серы в таких реакциях повышается:


Последняя реакция является качественной реакцией на сульфит-ион SO3 2− и на SO2 (обесцвечивание фиолетового раствора).
В присутствии сильных восстановителей SO2 способен проявлять окислительные свойства. Например, для извлечения серы из отходящих газов металлургической промышленности используют восстановление SO2 оксидом углерода(II):
Или для получения фосфорноватистой кислоты:
Применение
Физиологическое действие
SO2 очень токсичен. Симптомы при отравлении сернистым газом — насморк, кашель, охриплость, сильное першение в горле и своеобразный привкус. При вдыхании сернистого газа более высокой концентрации — удушье, расстройство речи, затруднение глотания, рвота, возможен острый отёк лёгких.
При кратковременном вдыхании оказывает сильное раздражающее действие, вызывает кашель и першение в горле.
Интересно, что чувствительность по отношению к SO2 весьма различна у отдельных людей, животных и растений. Так, среди растений наиболее устойчивы по отношению к сернистому газу берёза и дуб, наименее — роза, сосна и ель.
Воздействие на атмосферу
Из-за образования в больших количествах в качестве отходов диоксид серы является одним из основных газов, загрязняющих атмосферу.
Наибольшую опасность представляет собой загрязнение соединениями серы, которые выбрасываются в атмосферу при сжигании угольного топлива, нефти и природного газа, а также при выплавке металлов и производстве серной кислоты.
Наибольших концентраций сернистый газ достигает в северном полушарии, особенно над территорией США, Европы, Китая, европейской части России и Украины. В южном полушарии содержание его значительно ниже.
Оксиды серы. Серная кислота
Сера с кислородом образует два оксида: SO2 – оксид серы (IV) и SO3 – оксид серы (VI).
Оксид серы (IV) — SO2 (сернистый газ, сернистый ангидрид)
Сернистый газ – это бесцветный газ с резким запахом, ядовит. Тяжелее воздуха более чем в два раза. Хорошо растворяется в воде. При комнатной температуре в одном объёме воды растворяется около 40 объёмов сернистого газа, при этом образуется сернистая кислота H2SO3.
Химические свойства
Сернистый газ – типичный кислотный оксид. Он взаимодействует:
а) с основаниями, образуя два типа солей: кислые (гидросульфиты) и средние (сульфиты):
б) с основными оксидами:
Сернистая кислота существуют только в растворе, относится к двухосновным кислотам. Сернистая кислота обладает всеми общими свойствами кислот.
Окислительно – восстановительные свойства
В окислительно-восстановительных процессах сернистый газ может быть как окислителем, так и восстановителем, потому что атом серы в этом соединении имеет промежуточную степень окисления +4.
Как окислитель SO2 реагирует с более сильными восстановителями, например с сероводородом:
Как восстановитель SO2 реагирует с более сильными окислителями, например с кислородом в присутствии катализатора, с хлором и т.д.:
Получение
1) Сернистый газ образуется при горении серы:
2) В промышленности его получают при обжиге пирита:
3) В лаборатории сернистый газ можно получить:
а) при действии кислот на сульфиты:
б) при взаимодействии концентрированной серной кислоты с тяжелыми металлами:
Применение
Сернистый газ находит широкое применение в текстильной промышленности для отбеливания различных изделий. Кроме того, его используют в сельском хозяйстве для уничтожения вредных микроорганизмов в теплицах и погребах. В больших количествах SO2 идет на получение серной кислоты.
Оксид серы (VI) – SO3 (серный ангидрид)
Серный ангидрид SO3 – это бесцветная жидкость, которая при температуре ниже 17 о С превращается в белую кристаллическую массу. Очень хорошо поглощает влагу (гигроскопичен).
Химические свойства
Как типичный кислотный оксид серный ангидрид взаимодействует:
а) с основаниями, образуя два типа солей – кислые (гидросульфиты) и средние (сульфаты):
Особым свойством SO3 является его способность хорошо растворяться в серной кислоте. Раствор SO3 в серной кислоте имеет название олеум.
Оксид серы (VI) характеризуется сильными окислительными свойствами (обычно восстанавливается до SO2):
Получение и применение
Серный ангидрид образуется при окислении сернистого газа:
В чистом виде серный ангидрид практического значения не имеет. Он получается как промежуточный продукт при производстве серной кислоты.
Серная кислота H2SO4
Упоминания о серной кислоте впервые встречаются у арабских и европейских алхимиков. Ее получали, прокаливая на воздухе железный купорос (FeSO4∙7H2O): 2FeSO4 = Fe2O3 + SO3↑ + SO2↑ либо смесь серы с селитрой: 6KNO3 + 5S = 3K2SO4 + 2SO3↑ + 3N2↑, а выделяющиеся пары серного ангидрида конденсировали. Поглощая влагу, они превращались в олеум. В зависимости от способа приготовления H2SO4 называли купоросным маслом или серным маслом. В 1595 г. алхимик Андреас Либавий установил тождественность обоих веществ.
Долгое время купоросное масло не находило широкого применения. Интерес к нему сильно возрос после того, как в XVIII в. был открыт процесс получения из индиго индигокармина – устойчивого синего красителя. Первую фабрику по производству серной кислоты основали недалеко от Лондона в 1736 г. Процесс осуществляли в свинцовых камерах, на дно которых наливали воду. В верхней части камеры сжигали расплавленную смесь селитры с серой, затем туда запускали воздух. Процедуру повторяли до тех пор, пока на дне ёмкости не образовывалась кислота требуемой концентрации.
В XIX в. способ усовершенствовали: вместо селитры стали использовать азотную кислоту (она при разложении в камере даёт NO2). Чтобы возвращать в систему нитрозные газы были сконструированы специальные башни, которые и дали название всему процессу – башенный процесс. Заводы, работающие по башенному методу, существуют и в наше время.

Серная кислота – это тяжелая маслянистая жидкость без цвета и запаха, гигроскопична; хорошо растворяется в воде. При растворении концентрированной серной кислоты в воде выделяется большое количество тепла, поэтому ее надо осторожно приливать в воду (а не наоборот!) и перемешивать раствор.
Раствор серной кислоты в воде с содержанием H2SO4 менее 70% обычно называют разбавленной серной кислотой, а раствор более 70% — концентрированной серной кислотой.
Химические свойства
Разбавленная серная кислота проявляет все характерные свойства сильных кислот. Она реагирует:
Процесс взаимодействия ионов Ва 2+ с сульфат-ионами SO4 2+ приводит к образованию белого нерастворимого осадка BaSO4. Это качественная реакция на сульфат-ион.
Окислительно – восстановительные свойства
В разбавленной серной кислоте растворяются металлы, которые в электрохимическом ряду напряжений находятся до водорода. При этом образуются сульфаты металлов и выделяется водород:
Металлы, которые в электрохимическом ряду напряжений находятся после водорода, не реагируют с разбавленной серной кислотой:
Концентрированная серная кислота является сильным окислителем, особенно при нагревании. Она окисляет многие металлы, неметаллы и некоторые органические вещества.
При взаимодействии концентрированной серной кислоты с металлами, которые в электрохимическом ряду напряжений находятся после водорода (Cu, Ag, Hg), образуются сульфаты металлов, а также продукт восстановления серной кислоты – SO2.

Более активными металлами (Zn, Al, Mg) концентрированная серная кислота может восстанавливаться до свободной серы или сероводорода. Например, при взаимодействии серной кислоты с цинком, магнием, алюминием в зависимости от концентрации кислоты одновременно могут образовываться различные продукты восстановления серной кислоты – SO2, S, H2S:
На холоде концентрированная серная кислота пассивирует некоторые металлы, например алюминий и железо, поэтому ее перевозят в железных цистернах:
Концентрированная серная кислота окисляет некоторые неметаллы (серу, углерод и др.), восстанавливаясь до оксида серы (IV) SO2:
Получение и применение

В промышленности серную кислоту получают контактным способом. Процесс получения происходит в три стадии:
Полученный олеум перевозят в железных цистернах. Из олеума получают серную кислоту нужной концентрации, приливая его в воду. Это можно выразить схемой:
Серная кислота находит разнообразное применение в самых различных областях народного хозяйства. Ее используют для осушки газов, в производстве других кислот, для получения удобрений, различных красителей и лекарственных средств.
Соли серной кислоты

Большинство сульфатов хорошо растворимы в воде (малорастворим CaSO4, еще менее PbSO4 и практически нерастворим BaSO4). Некоторые сульфаты, содержащие кристаллизационную воду, называются купоросами:
CuSO4 ∙ 5H2O медный купорос
FeSO4 ∙ 7H2O железный купорос
Соли серной кислоты имеют все общие свойства солей. Особенным является их отношение к нагреванию.
Сульфаты активных металлов (Na, K, Ba) не разлагаются даже при 1000 о С, а других (Cu, Al, Fe) – распадаются при небольшом нагревании на оксид металла и SO3:
Скачать:
Скачать бесплатно реферат на тему: «Производство серной кислоты контактным способом» Производство-серной-кислоты-контактным-способом.docx (237 Загрузок)
Скачать рефераты по другим темам можно здесь
*на изображении записи фотография медного купороса
Похожее
Добавить комментарий Отменить ответ
Репетитор по химии. Занятия проходят онлайн по Скайпу. По всем вопросам пишите в Ватсапп: +7 928 285 70 42
Диоксид серы: опасное вещество или полезная добавка?
Покупатели часто спрашивают нас о таком веществе, как диоксид серы — главным образом потому, что он почти всегда указывается в составе вина, как консервант. Людей интересует, зачем он нужен в напитке, вреден ли он? Тема «диоксида серы» на самом деле очень интересна, особенно учитывая, что он встречается также в сухофруктах, соках, лимонадах, изделиях из картофеля и других продуктах. Маркируется вещество кодом Е220.
Диоксид серы с точки зрения химии 
Для консервирования вина сернистый газ использовали еще в древней Греции — горящей серой окуривали изнутри амфоры, в которые потом наливали вино. Интересно, что и в наше время один из способов получения SO2 — такое же сжигание серы, как и многие века назад. Другой способ — обжиг сульфидных руд. Очистка газа производится путем его сжижения или поглощением холодной водой, а затем десорбцией при нагреве.
Свойства диоксида серы

Небольшое количество диоксида серы — от 40 до 200 мг/л, не вызывает гибель культурных дрожжей, «отвечающих» за преобразование виноградного сока в вино, тогда как уксуснокислые бактерии и вызывающие плесень грибки замедляют рост или погибают. Все это делает сернистый ангидрид консервантом, особенно востребованным именно в виноделии. О том, что без его применения сложно сделать качественные и обладающие большим потенциалом хранения вина, писал еще знаменитый химик Луи Пастер, посвятивший виноделию несколько серьезных исследований. Интересно, что лучшего консерванта для вина, чем диоксид серы, не сегодняшний день так и не придумали.
Так вреден ли диоксид серы для человека?
Только в больших количествах, а также аллергикам и астматикам. Вещество разрушает витамин В1 и дисульфидные мостики в белках, что, естественно, вредит здоровью. Легкое отравление двуокисью серы может вызвать насморк, кашель, першение в горле, хрипоту, боль в животе, расстройство пищеварения, головную боль.
В случае более сильного отравление возможны затруднения речи, глотания и дыхания, рвота и отек легких. Правда, отравиться диоксидом серы, содержащимся в вине или пищевых продуктах, не аллергику и не астматику сложно — его используют в чрезвычайно малом количестве, не оказывающем негативного влияния на здоровье. Если же вдруг вы купили некачественное вино или еду, в которой количество сернистого ангидрида превышает допустимые нормы, вы почувствуете резкий запах серы. В этом случае продукт лучше не употреблять.
Есть мнение, что именно от диоксида серы в вине после употребления этого напитка может болеть голова. Это неверно. Точнее, готова от диоксида может болеть только у аллергиков, а у остальных от вина голова болит по другим причинам. Это доказывает хотя бы тот факт, что, например, в 100 гр сушеной кураги содержится в разы больше SO2, чем в таком же количестве вина, но от кураги голова обычно не болит.
Еще один факт: вин без сернистого ангидрида не бывает! Даже так называемые органические и биодинамические вина, зачастую производящиеся вообще без добавок, содержат его в минимальном количестве, так как он вырабатывается в процессе дрожжевого брожения.
Вывод: диоксид серы помогает сохранить свежими и внешне привлекательными многие продукты и напитки. В качественных продуктах его настолько мало, что он не может нанести вред здоровому, не страдающему аллергией или астмой человеку.