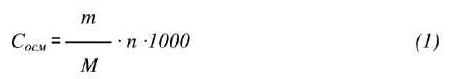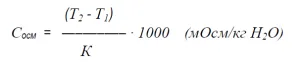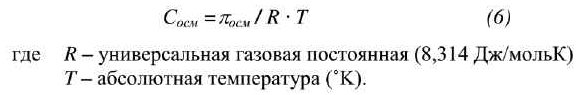Что такое осмолярность и осмоляльность
Что такое осмолярность и осмоляльность
Если в условиях, к раствору хлорида натрия приложить давление, осмос воды в этот раствор замедлится, прекратится или пойдет в противоположном направлении. Точную величину давления, необходимого для прекращения осмоса, называют осмотическим давлением раствора хлорида натрия.
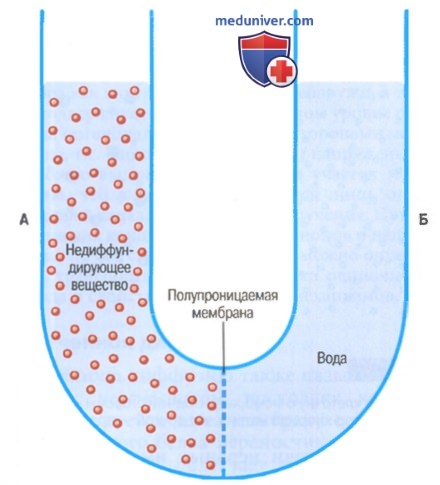
Принцип перепада давления, противостоящего осмосу, демонстрируется на рисунке, где показана избирательно проницаемая мембрана, разделяющая два столба жидкости, один из которых содержит чистую воду, а другой — воду и любое растворенное вещество, не проникающее через мембрану.
Осмос воды из отсека Б в отсек А ведет ко все большему перепаду уровней столбов жидкости до тех пор, пока в итоге разность давлений по обе стороны мембраны не станет достаточно большой, чтобы противостоять осмотическому эффекту. Разность давлений через мембрану в этот момент эквивалентна осмотическому давлению раствора, содержащего не проникающее через мембрану вещество.
Значение количества осмотических частиц (молярной концентрации) в определении осмотического давления. Осмотическое давление, создаваемое растворенными частицами, независимо от того, являются ли они молекулами или ионами, определяется количеством частиц на единицу объема жидкости, но не их массой, т.к. каждая частица в растворе, независимо от ее массы, оказывает в среднем одинаковое давление на мембрану.
Так, большие частицы, имеющие большую массу (т), движутся с меньшей скоростью (v), чем малые частицы. Малые частицы движутся с более высокой скоростью, и средняя кинетическая энергия (к), определяемая уравнением: k=mv 2 /2, одинакова как для каждой малой, так и каждой большой частицы. Следовательно, фактором, определяющим осмотическое давление раствора, является его концентрация, выраженная количеством частиц (что для недиссоциирующих веществ аналогично молярной концентрации), но не показателем массы растворенного вещества.
Осмоляльность. Осмоль. При определении концентрации раствора в показателях количества частиц вместо граммов используют единицу, называемую осмолем.
Один осмоль является 1 грамм-молекулой осмотически активного растворенного вещества. Так, 180 г глюкозы, т.е. 1 грамм-молекула глюкозы, эквивалентны 1 осмолю глюкозы, поскольку глюкоза не диссоциирует на ионы. Если растворенное вещество диссоциирует на 2 иона, 1 грамм-молекула растворенного вещества будет соответствовать 2 осмолям, поскольку число осмотически активных частиц в этом случае вдвое больше, чем для недиссоциирующего вещества.
При полной диссоциации 1 грамм-молекула хлорида натрия, или 58,5 г, эквивалентна 2 осмолям.
Следовательно, о растворе, содержащем 1 осмоль растворенного вещества в каждом килограмме воды, говорят, что его осмоляльность равна 1 осмоль на 1 кг. Раствор, содержащий 1/1000 осмоля растворенного вещества на 1 кг, имеет осмоляльность 1 миллиосмоль (мосм) на 1 кг. Нормальная осмоляльность внеклеточной и внутриклеточной жидкостей равна примерно 300 мосм на 1 кг воды.
Связь осмоляльности с осмотическим давлением. При 37°С, т.е. при температуре, равной нормальной температуре тела, раствор с концентрацией 1 осмоль на 1 л воды создает осмотическое давление, равное 19300 мм. рт. ст. Следовательно, концентрация 1 моем на 1 л эквивалентна 79,3 мм. рт. ст. осмотического давления.
Умножение этой величины на 300 мосм, т.е. на концентрацию частиц в жидкостях организма, дает общее расчетное осмотическое давление, равное 5790 мм рт. ст., однако измеренная реальная величина давления составляет в среднем только 5500 мм рт. ст. Причина такого различия заключается в том, что многие ионы в жидкостях организма, например ионы натрия и хлора, сильно притягиваются друг к другу и, следовательно, не могут двигаться совершенно свободно, реализуя свой полный осмотический потенциал.
В связи с этим истинное осмотическое давление жидкостей организма составляет в среднем около 0,93 (93%) расчетного значения.
Термин «осмолярность». В связи со сложностью измерения воды в растворе в килограммах, что необходимо для определения осмоляльности, вместо этого показателя используют осмолярность, т.е. осмолярную концентрацию, выражаемую числом осмолей на 1 л раствора, а не количеством осмолей на 1 кг воды. Хотя, строго говоря, именно осмоли на 1 кг воды (осмоляльность) определяют осмотическое давление для таких разбавленных растворов, как жидкости организма, количественные различия между осмолярностью и осмоляльностью составляют менее 1%.
Поскольку осмолярность измерять проще, чем осмоляльность, это является обычной практикой почти всех физиологических исследований.
Формула осмолярности, как ее вычислить и разница с осмоляльностью
осмолярность является параметром, который измеряет концентрацию химического соединения в литре раствора, если он способствует коллигативному свойству, известному как осмотическое давление указанного раствора.
В этом смысле осмотическое давление раствора относится к количеству давления, необходимому для замедления процесса осмоса, которое определяется как избирательное прохождение частиц растворителя посредством полупроницаемой или пористой мембраны из раствора. от более низкой концентрации к более концентрированной.
Кроме того, единицей измерения количества растворенных частиц является осмол (символом которого является Осм), который не является частью Международной системы единиц (СИ), используемой почти во всем мире. Поэтому концентрация растворенного вещества в растворе определяется в единицах осмолей на литр (Осм / л).
формула
Как упоминалось ранее, осмолярность (также известная как осмотическая концентрация) выражается в единицах, определенных как осм / л. Это связано с его взаимосвязью с определением осмотического давления и измерением диффузии растворителя с помощью осмоса..
На практике осмотическая концентрация может быть определена как физическая величина с использованием осмометра..
Таким образом, для расчета этого параметра измерения используется следующая формула, которая учитывает все факторы, которые могут повлиять на это свойство..
В этом уравнении осмолярность определяется как сумма, полученная в результате умножения всех значений, полученных по трем различным параметрам, которые будут определены ниже..
Определение переменных в формуле осмолярности
Во-первых, это осмотический коэффициент, представленный греческой буквой φ (фи), который объясняет, как далеко удаляется решение идеального поведения, или, другими словами, степень неидеальности, которую растворенное вещество проявляет в решении.
Проще всего, φ относится к степени диссоциации растворенного вещества, которая может иметь значение от нуля до единицы, где максимальное значение единицы представляет собой диссоциацию 100%; то есть абсолют.
В некоторых случаях, таких как сахароза, эта величина превышает единицу; в то время как в других случаях, таких как влияние солей, влияние электростатических взаимодействий или сил вызывает осмотический коэффициент со значением, меньшим единицы, даже если происходит абсолютная диссоциация.
С другой стороны, значение n указывает количество частиц, в которых молекула может быть диссоциирована. В случае ионных частиц в качестве примера приведен хлорид натрия (NaCl), значение n которого равно двум; тогда как в неионизированной молекуле глюкозы значение n равно единице.
Наконец, значение с представляет концентрацию растворенного вещества, выраженную в мольных единицах; и нижний индекс i относится к идентичности конкретного растворенного вещества, но он должен быть одинаковым при умножении трех факторов, упомянутых выше, и, таким образом, получении осмолярности.
Как рассчитать?
В случае ионного соединения KBr (известного как бромид калия), если у вас есть раствор с концентрацией, равной 1 моль / л KBr в воде, предполагается, что он имеет осмолярность, равную 2 осмоль / л..
Аналогично для раствора с концентрацией, равной 1 моль / л BaCl2 (известный как хлорид бария) в воде, он имеет осмолярность, равную 3 осмоль / л.
С другой стороны, неионные вещества не подвергаются такой диссоциации и генерируют один осмол на каждый моль растворенного вещества. В случае раствора глюкозы с концентрацией, равной 1 моль / л, это равняется 1 осмоль / л раствора.
Различия между осмолярностью и осмоляльностью
Осмол определяется как количество частиц, которые растворяются в объеме, равном 22,4 л растворителя, при температуре 0 ° С и которые вызывают образование осмотического давления, равного 1 атм. Следует отметить, что эти частицы считаются осмотически активными.
В этом смысле свойства, известные как осмолярность и осмоляльность, относятся к одному и тому же измерению: концентрация растворенного вещества в растворе или, другими словами, содержание общих частиц растворенного вещества в растворе..
Принципиальное различие, которое установлено между осмолярностью и осмоляльностью, заключается в единицах, в которых каждый представлен:
Осмолярность выражается в количестве вещества на объем раствора (то есть, осмоль / л), тогда как осмолярность выражается в количестве вещества на массу растворителя (то есть, осмоль / кг раствора)..
На практике оба параметра используются безразлично, даже проявляя себя в разных единицах, из-за того, что между суммарными величинами разных измерений существует незначительная разница.
Что такое осмолярность и осмоляльность
Осмоляльность, осмолярность и жидкий гомеостаз
Осмоляльность, осмолярность и жидкий гомеостаз
Наши тела управляют миллионами химических реакций каждый день. Эти реакции зависят от концентрации жидкости в наших клетках и от того, как наша кровь контролируется весь день, каждый день. Как оно работает? Например, вызывая у нас жажду, когда жидкость стремится стать более концентрированной и заставляя нас выделять больше мочи, когда она становится менее концентрированной.
Однако иногда, когда вы болеете, естественные механизмы баланса вашего тела расстраиваются. В этих ситуациях вам может потребоваться регулярный мониторинг крови и лечение, чтобы исправить дисбаланс.
Что такое осмоляльность и осмолярность?
осмоляльность
Осмоляльность жидкости является мерой количества частиц за килограмм жидкости что они растворяются в (растворенное вещество). Количество частиц измеряется в миллимолях, что широко используется в химии. Измерение дано в миллиосмолях на килограмм, или кратко в мосмоль / кг.
Осмоляльность не зависит от температуры жидкости. Например, если вы растворяете 100 г соли в 1 кг воды, осмоляльность будет одинаковой независимо от того, была ли вода около точки замерзания или при нагревании тела. В этом разница между осмоляльностью и осмолярностью.
осмолярность
Осмолярность жидкости является мерой количества частиц за литр жидкости что они растворяются в (растворенное вещество). Количество частиц измеряется в миллимолях, что является еще одним измерением, широко используемым в химии. Измерение дается в миллимолях на литр или в ммоль / л для краткости.
Поскольку осмолярность изменяется с температурой, термин осмоляльность является предпочтительным в медицине.
Какова нормальная осмоляльность биологических жидкостей?
Осмоляльность сыворотки очень близка к осмоляльности внутри клеток, из которых состоит наше тело. Это потому, что стенки наших клеток проницаемы для микроскопических частиц (ионов и анионов) и для воды. Проницаемость означает, что она позволяет этим частицам и воде свободно перемещаться внутрь и наружу через клеточные стенки. Это сохраняет осмоляльность одинаковой на обеих сторонах клеточных стенок по всему телу. Это важно, так как клетки не будут работать должным образом, если этого не произойдет.
Иногда осмоляльность стула (фекалии) также может быть проверена.
Почему измеряется осмоляльность?
Осмоляльность измеряется, когда врачи обеспокоены тем, что ваш баланс жидкости по какой-то причине может измениться. Это может быть связано с болезнью или побочным эффектом лекарств. Это может быть даже из-за того, что вы перегружали свою систему, выпивая слишком много воды.
Они могут также захотеть измерить его, чтобы контролировать эффекты лекарств, предназначенных для изменения осмоляльности тканей вашего тела. Маннит используется для этого эффекта, чтобы уменьшить отек мозга, если у вас была травма головы или операция на головном мозге.
Что такое жидкий гомеостаз?
Как организм поддерживает жидкий гомеостаз?
У нормальных, здоровых людей осмоляльность жидкостей организма очень тесно регулируется организмом.
Как осмоляльность повышается
Как осмоляльность снижается
И так продолжается весь день, каждый день: ваш мозг и ваши почки плотно контролируют среду внутри ваших клеток.
Вам нужно восемь стаканов воды в день?
Существует миф о том, что нам нужно пить от 1,5 до 2 литров воды в день. Неизвестно, откуда взялась эта цифра, но она была описана как «не только чепуха, но… полностью опровергнутая чепуха». Это, безусловно, фаворит индустрии бутилированной воды. Питьевая вода определенно лучше для нас, чем пить сладкие напитки, но для тех из нас, кому посчастливилось жить в развитом мире, запасы воды тщательно контролируются и очень безопасны.
Как нарушается жидкий гомеостаз?
Есть некоторые условия и ситуации, когда жидкий гомеостаз может пойти не так. Эффект может быть слишком высоким (гиперосмоляльность) или слишком низким (гипоосмоляльность).
Что заставляет осмоляльность становиться слишком высокой?
Недостаточно антидиуретического гормона (или он утратил свое действие)
Потеря жидкости организма
Что вызывает слишком низкую осмоляльность?
Слишком много антидиуретического гормона
Пить слишком много воды
Питье чрезмерного количества воды может нарушить жидкий гомеостаз организма, что приводит к водной интоксикации.
Эффект этих проблем обусловлен очень низкой осмоляльностью натрия (Na + ). Это называется гипонатриемия, и, когда она тяжелая, может привести к головной боли, головокружению, дезориентации и спутанности сознания. В конечном итоге это может привести к коме и смерти.
Для получения дополнительной информации см. Отдельную листовку под названием Гипонатриемия.
Считаете ли вы эту информацию полезной? да нет
Спасибо, мы только что отправили электронное письмо с опросом, чтобы подтвердить ваши предпочтения.
Дальнейшее чтение и ссылки
Маккартни М ; Воздействие воды? BMJ. 2011 июл 12343: d4280. doi: 10.1136 / bmj.d4280.
Гипонатриемия ; NICE CKS, март 2015 г. (только для Великобритании)
Хью-Батлер Т., Лой В., Пани А. и др. ; Гипонатриемия, связанная с упражнениями: обновление 2017 года. Фронт Мед (Лозанна). 2017 март 34:21. doi: 10.3389 / fmed.2017.00021. eCollection 2017.
Физиология и нарушения водно-солевого обмена (методические материалы к практическим и семинарским занятиям)
Информация
Справочное пособие содержит информацию о физиологии водно-солевого обмена (ВСО). Также представлена информация о методах клинической и лабораторной диагностики нарушений ВСО. Перечислены варианты дисгидрий и методы лечения. Предназначается для врачей всех специальностей, курсантов ФПК и студентов медвузов.
Вода организма
Электролитный состав организма
Факторы, влияющие на перемещение внеклеточной воды в организме
Как уже упоминалось выше, вода является транспортной средой, переносящей питательные вещества и кислород к клеткам и уносящей продукты метаболизма от клеток через интерстициальное пространство в кровоток. Возникает вопрос – каким образом вода «знает» куда и что переносить?
Физиология рассматривает три фактора, определяющих целенаправленное движение воды при транскапиллярном обмене:
2. Часть осмотического давления, создаваемую в биологических жидкостях белками, называют коллоидно-осмотическим (онкотическим) давлением (КОД).
Оно составляет примерно 0,7% осмотического давления (или осмотической концентрации), т. е. около 25 мм рт. ст. (2 мосмоль/кг), но имеет исключительно большое функциональное значение в связи с высокой гидрофильностью белков и неспособностью их свободно проходить через полупроницаемые биологические мембраны.
Механизмы поддержания внутриклеточного объема жидкости и внутриклеточного ионного состава
«Натриевый насос». Мембранная проницаемость Na+ в общем в 10-20 раз меньше, чем К+. Однако наличие градиента концентраций Na+ во вне- и внутриклеточном пространствах и отрицательный внутриклеточный заряд могли бы обеспечить силу, способную двигать Na+ в сторону клетки.
В действительности этого не происходит, поскольку такая сила оказывается сбалансированной другой, действующей в обратном направлении и называемой натриевым насосом. Энергия натриевого насоса, являющегося специфическим свойством клеточной мембраны, обеспечивается гидролизом аденозинтрифосфата (АТФ) и направлена на выталкивание Na+ из клетки [Whittman R., Wheeler К. Р., 1970].
Эта же энергия способствует движению К+ внутрь клетки. Установлено, что противоположно направленные движения К+ и Na+ осуществляются в пропорции 2:3. По мнению М. W. В. Bradbury (1973), с физиологической точки зрения для К+ этот механизм не столь существен, так как последний в норме обладает высокой способностью проникать через клеточную мембрану. Описанный механизм является основным для обеспечения постоянства концентрации клеточных и внеклеточных компонентов. Принципиально важен тот момент, что осмолярность внутриклеточной воды величина достаточно постоянная и не зависящая от осмолярности внеклеточного пространства. Это постоянство обеспечивается энергозависимым механизмом.
Осмолярность (ОФС.1.2.1.0003.15). Методика определения
» data-shape=»round» data-use-links data-color-scheme=»normal» data-direction=»horizontal» data-services=»messenger,vkontakte,facebook,odnoklassniki,telegram,twitter,viber,whatsapp,moimir,lj,blogger»>
Осмолярность (ОФС.1.2.1.0003.15)
ОБЩАЯ ФАРМАКОПЕЙНАЯ СТАТЬЯ
Взамен ГФ XII, ч. 1, ОФС 42-0047-07
Осмолярность – это характеристика растворов, выражающая их осмотическое давление через суммарную концентрацию кинетически активных частиц в единице объема раствора (мОсм/л).
Существующие инструментальные методы позволяют определять не осмолярность, а осмоляльность – концентрацию кинетически активных частиц на килограмм растворителя (мОсм/кг).
Кинетически активные частицы – это молекулы, ионы или ионные комплексы одного или нескольких растворенных веществ, свободно распределенные во всем объеме растворителя и обладающие способностью к хаотическому перемещению внутри раствора.
Осмолярность и осмоляльность характеризуют создаваемое растворами осмотическое давление.
Осмолярность является одной из важнейших характеристик инфузионных растворов. На этикетках растворов для инфузий должно быть указано теоретическое значение их осмолярности. В случае, когда теоретическая осмолярность не может быть рассчитана, указывают среднее значение осмоляльности для данного лекарственного средства.
Теоретическая осмолярность может быть рассчитана по формуле:
Сосм – осмолярность раствора, миллиосмоль на литр (мОсм/л);
m – содержание вещества в растворе, г/л;
M – молярная масса вещества, г;
n – суммарное число ионов, образующихся из одной молекулы растворенного вещества в результате диссоциации (n = 1 для недиссоциирующих веществ, n = 2, 3 для веществ, образующих при растворении соответствующее количество ионов).
На практике, количество частиц (n) несколько меньше теоретически рассчитанного и приближенно может быть описано формулой:
n — реальное количество частиц, образующихся при растворении данного вещества;
nо — теоретически рассчитанное количество частиц (n=1,2,3…);
φ— молярный осмотический коэффициент, учитывающий взаимодействие между частицами в растворе и зависящий только от количества растворенного вещества.
Коэффициент φ определяется экспериментально.
Растворы, равные по осмолярности 0,9 % раствору натрия хлорида, называют изотоническими. Для изотонических растворов теоретически рассчитанные значения осмолярности находятся в пределах 239 – 376 мОсм/л.
Осмолярность растворов, состоящих из нескольких компонентов, может быть определена как сумма осмолярностей всех компонентов.
Концентрацию инфузионных растворов принято выражать как массо-объемную (в г/л), поэтому удобным представляется рассчитывать содержание кинетически активных частиц в миллиосмолях на литр (осмолярность), а не на килограмм (осмоляльность) раствора.
Различиями между значениями осмолярности и осмоляльности растворов с осмолярностью, близкой к осмолярности 0,7-1,1 % раствора натрия хлорида или ниже, можно пренебречь (теоретическое значение осмотического давления 0,9 % раствора натрия хлорида – 308 мОсм/л; экспериментальное значение – 286 мОсм/л); для более концентрированных растворов (например, 10 % раствора натрия хлорида) осмолярность может быть определена по формуле:
С(мОсм/л) = С(мОсм/кг) ∙ ρ (3)
где: ρ – плотность раствора, кг/л.
Примечания.
Определение осмоляльности водных растворов
Для определения осмоляльности могут быть использованы следующие методы: криоскопический, мембранная и паровая осмометрия.
Криоскопический метод
Метод основан на понижении точки замерзания растворов по сравнению с точкой замерзания чистого растворителя.
1 осмоль на килограмм воды понижает точку замерзания на 1,86 °С. Измерение этих изменений лежит в основе криоскопического метода.
Данная зависимость может быть выражена следующей формулой:
Сосм — осмоляльность раствора (мОсм/кг)
Т2 — температура замерзания чистого растворителя (˚С);
Т1 — температура замерзания испытуемого раствора (˚С);
К — криометрическая постоянная растворителя (для воды: 1,86).
В настоящее время определение осмоляльности растворов проводится с использованием автоматических криоскопических осмометров.
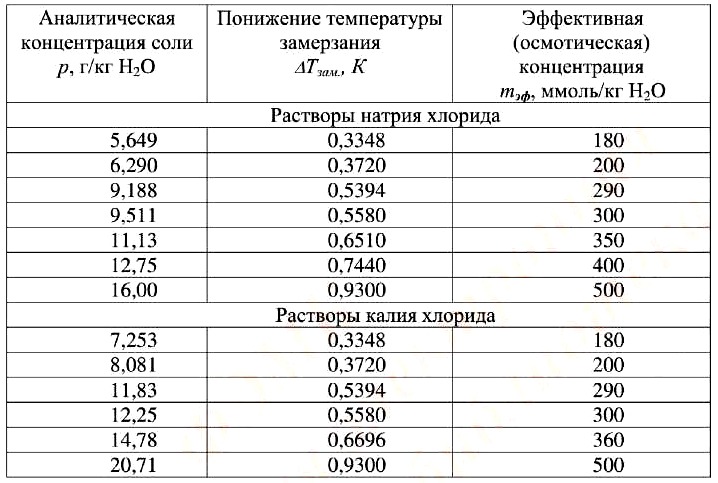
Необходимое количество испытуемого раствора помещают в ячейку прибора. Далее проводят измерение согласно инструкции, прилагаемой к прибору. При необходимости прибор калибруют с помощью стандартных растворов натрия или калия хлорида, которые перекрывают определяемый диапазон осмоляльности (таблица 1).
Таблица 1. Стандартные справочные значения понижения температуры замерзания и эффективности осмотической концентрации водных растворов натрия и калия хлоридов
Метод мембранной осмометрии
Метод основан на использовании свойства полупроницаемых мембран избирательно пропускать молекулы веществ.
Движущей силой процесса является процесс осмоса. Растворитель проникает в испытуемый раствор до установления равновесия; возникающее при этом дополнительное гидростатическое давление приближенно равно осмотическому давлению и может быть рассчитано по формуле:
Осмоляльность может быть рассчитана по формуле:
Примечание. Данный метод применим только для растворов высокомолекулярных веществ (10 4 – 10 6 г/моль). При анализе растворов, содержащих электролиты и другие низкомолекулярные вещества, будет определяться только осмотическое давление, создаваемое высокомолекулярными компонентами раствора.
Определение осмоляльности испытуемого раствора проводят с помощью мембранного осмометра. Предварительную калибровку прибора и измерения проводят в соответствии с инструкцией к прибору.
Метод паровой осмометрии
1 осмоль на килограмм воды понижает давление пара на 0,3 мм рт. ст. при температуре 25 °С. Измерение этих изменений лежит в основе метода паровой осмометрии.
Метод основан на измерении разности температур, которая возникает на термисторах, помещенных в измерительную ячейку, насыщенную парами растворителя в случае, если на один из них нанесена капля чистого растворителя, а на другой — испытуемого раствора. Разница температур возникает по причине конденсации паров растворителя на капле раствора, так как давление пара растворителя над этой поверхностью меньше. При этом температура капли раствора повышается за счет экзотермического процесса конденсации до тех пор, пока давление пара над каплей раствора и давление чистого растворителя в ячейке не сравняются. При нанесении на оба термистора чистого растворителя разность температур равна нулю. Разность температур практически пропорциональна моляльной концентрации раствора.
Определение осмоляльности испытуемого раствора проводят с помощью парового осмометра. Предварительную калибровку прибора и измерения проводят в соответствии с инструкцией к прибору.