Что такое оссификация костей
Оссификация
Оссификация (остеогенез, формирование костей) — процесс формирования костной ткани. Различают два способа оссификации — на основе примитивной соединительной ткани — мезенхимы (эндесмальная оссификация) и на основе хряща (энхондральная). [1] [2]
Содержание
Закономерности оссификации
По В. С. Сперанскому (1998), отмечаются следующие закономерности оссификации:
Эндесмальная оссификация
Эндесмальная оссификация (прямой остеогенез) осуществляется в костях, образующихся напрямую из соединительной ткани («первичных костях»), к которым относят кости лицевого черепа и крыши черепа. Эндесмальная оссификация осуществляется из точек окостенения, образующихся в центре мезенхимальной закладки. Точки окостенения растут в глубину и поверхностно, формируют радиально-направленные костные перекладины, соединяющиеся костными балками. Большинство покровных костей обладают несколькими точками окостенения, сливающимися в процессе оссификации. Неоссифицированный поверхностный слой мезенхимы формирует надкостницу. [2]
Энхондральная оссификация
Энхондральная оссификация (непрямой остеогенез) происходит в так называемых вторичных костях, проходящих соединительнотканную, хрящевую и костную стадии. К ним относятся кости основания черепа, туловища и конечностей. В ходе эмбриогенеза из мезенхимы формируется хрящевая модель, по форме соответствующая будущей кости. Хрящевая модель образуется гиалиновым хрящом, покрытым надхрящницей. Вслед за этим начинается перихондральное окостенение — в области диафиза между надхрящницей и хрящом из мезенхимы формируется перихондральная грубоволокнистая костная манжетка. Надхрящница на этом этапе превращается в надкостницу. В центре диафиза хрящевой модели происходит дистрофия, дегенерация и обызвествление хряща. Из надкостницы к центру диафиза врастают кровеносные сосуды, сопровождаемые малодифференцированными мезенхимальными клетками. В центре диафиза образуются точки окостенения, после чего происходит энхондральное окостенение с формированием пластинчатой костной ткани, распространяющимся в направлении к эпифизам; образуется костномозговой канал. Перихондральная грубоволокнистая костная манжетка заменяется пластинчатой костной тканью (периостальное окостенение). В эпифизах из точек окостенения происходит энхондральная оссификация — в дистрофически измененный хрящ врастают сосуды и образуется губчатое вещество. Между эпифизами и диафизами сохраняются зоны, сформированные гиалиновым хрящом (эпифизарные пластинки), благодаря которым кость растёт в длину. С завершением энхондральной оссификации в эпифизе эпифизарные пластинки также подвергаются оссификации; с исчезновением хрящевых прослоек рост кости в длину прекращается. [3] Помимо главных точек окостенения различают добавочные, появляющиеся значительно позже главных. [2]
Гетеротопическая оссификация
Гетеротопическая оссификация — процесс формирования костной ткани в нетипичных местах (внескелетно). Часто с оссификацией путают кальцификацию (обызвествление). Остеогенез сопровождается кальцификацией, однако кальцификация причиной остеогенеза не является.
Травматический оссифицирующий миозит – это заболевание, при котором после травмы в мышечной ткани формируется зона кальцификации. Провоцируется значительным однократным повреждением или повторной микротравматизацией. Сопровождается появлением быстро растущего, твердого, резко болезненного образования в толще мышцы, ограничением движений. В последующем боли уменьшаются, участок кальцификации рассасывается или окостеневает. При адекватном лечении функция конечности восстанавливается. Диагноз выставляется на основании клинических данных, результатов рентгенографии и других визуализационных методик. Лечение – массаж, физиотерапия. Операции требуются редко.
МКБ-10
Общие сведения
Оссифицирующий миозит травматического генеза (гетеротопическая оссификация, кальцификация и оссификация мышцы, травматическая параоссальная костная формация) – самая распространенная разновидность данной патологии. В отличие от врожденной генерализованной формы миозита протекает с локальным поражением одного мускула, имеет благоприятный исход. Чаще всего формируется в области плеча, второе место по распространенности занимает оссифицирующий миозит области тазобедренного сустава. Страдают преимущественно молодые мужчины спортивного телосложения с хорошо развитой мускулатурой.
Причины
В анамнезе больных имеется четкая связь с травматическим повреждением, но пусковые факторы миозита точно не установлены. Оссифицирующее поражение мускула возникает в следующих случаях:
Многие авторы указывают, что наряду с характером повреждения и значительной мышечной массой пациентов существенную роль играют особенности реабилитации, в частности – преждевременное увеличение объема движений и слишком энергичный массаж.
Патогенез
Очаг окостенения появляется на месте гематомы или кровоизлияния, происходит не непосредственно из мышечной ткани, а из соединительнотканных прослоек в толще мускула. Причиной его формирования является метаплазия фиброзной ткани, которая минерализуется и постепенно приобретает структуру губчатой кости. Размеры оссифицирующей формации обычно превышают 5 см.
Иногда вокруг основной зоны поражения выявляются мелкие островки аналогичного строения. Процесс оссификации начинается через 20-30 дней, реже – со второй недели после травмы и завершается спустя 3-6 или более месяцев. К этому моменту на поверхности очага образуется кортикальный слой, участок приобретает полное сходство с обычной костью.
Симптомы оссифицирующего миозита
Общим признаком заболевания является появление растущего опухолевидного образования, сопровождающееся болями и нарушением функции конечности. Образование имеет костную плотность, резко болезненно при пальпации. Болевой синдром усиливается при движениях. Через несколько месяцев боли постепенно стихают, ограничение движений нередко сохраняется. Степень нарушения функций зависит от объема и расположения очага, наличия или отсутствия его связи с надкостницей и других факторов.
Оссифицирующий миозит плеча
Возникает в области плечевой мышцы, чаще всего – после заднего вывиха локтевой кости или обеих костей предплечья. Вероятность развития не зависит от качества и времени вправления. Оссифицирующая формация проявляется формированием твердой припухлости и болями по передней поверхности плеча в нижней трети или ближе к локтевому суставу, ограничением сгибания предплечья.
Оссифицирующий миозит тазобедренного сустава и бедра
Провоцирующим фактором становится эндопротезирование тазобедренного сустава, перелом или вывих бедренной кости, обширные ушибы ягодичной области. В зависимости от вида травмы поражаются различные мышцы – четырехглавая, средняя ягодичная, приводящие. При вовлечении средней ягодичной мышцы участок затвердения обнаруживается в верхней или наружной части ягодицы, снаружи над тазобедренным суставом. Страдает отведение и вращение.
Оссификаты в зоне квадрицепса располагаются на передней поверхности: чуть ниже ТБС при вывихах, в средней или нижней части сегмента – при переломах. Развитие заболевания сопровождается ограничением сгибания голени и разгибания бедра, серьезно нарушается функция ходьбы. При вовлечении приводящих мускулов оссифицирующий миозит поражает передневнутреннюю поверхность тазобедренного сустава или внутреннюю поверхность бедра в верхней половине сегмента. Выявляется ограничение разгибания и приведения, поворота ноги кнаружи.
У футболистов оссифицирующие гетеротопии обычно появляются по наружной поверхности бедра, развиваются в результате столкновений. Страдают латеральная широкая (наружная часть квадрицепса), двуглавая, полусухожильная или полуперепончатая мышцы. Возможны нарушения разгибания, сгибания или вращения голени, разгибания бедра и туловища.
Осложнения
Обширные и гетеротопические очаги сопровождаются развитием контрактуры близлежащего сустава. В тяжелых случаях формируется внесуставной анкилоз. Перечисленные осложнения существенно ограничивают трудоспособность и возможности самообслуживания пациентов с миозитом, становятся причиной инвалидности.
Диагностика
Больным, перенесшим значительную однократную травму, диагноз выставляется курирующими врачами-травматологами, поскольку оссифицирующий процесс развивается в период лечения и реабилитации. При повторной микротравматизации пациенты могут обращаться к ортопедами или онкологам. План обследования включает следующие мероприятия:
Дифференциальную диагностику проводят с остеосаркомой. Признаками оссифицирующего миозита являются изоляция от кости и отсутствие изменений близлежащей кости по данным визуализационных методик. В сомнительных случаях рекомендовано гистологическое исследование тканей оссификата.
Лечение травматического оссифицирующего миозита
На начальной стадии показаны консервативные мероприятия. При недавних крупных травмах лечение осуществляется в травматологическом отделении, в последующем пациент переводится под амбулаторное наблюдение. После окончательного оформления очага при ограничении функций и отсутствии признаков рассасывания проводятся хирургические вмешательства.
Консервативная терапия
Важнейшими элементами лечения являются специальный режим и тщательный подбор методов реабилитации. При прогнозировании возможного развития оссифицирующего миозита или появлении первых симптомов необходима иммобилизация конечности с последующей постепенной разработкой без форсирования физической активности.
Нагрузка на пораженный сегмент должна быть безболевой. Рекомендуется активная гимнастика. Пассивные форсированные упражнения и массаж на стадии формирования очага противопоказаны, поскольку могут спровоцировать увеличение оссификата. После «созревания» костного включения рекомендованы массаж и физиотерапия. В отдельных случаях, в том числе – при рецидивах после удаления зоны окостенения применяется рентгенотерапия.
Хирургическое лечение
Оперативные вмешательства показаны после появления структурированного участка костной ткани. При планировании операции необходимо учитывать возможность рецидива, поэтому данный метод лечения рекомендован только в случае существенного нарушения функции конечности, ограничения трудоспособности.
Гетеротопический очаг иссекают вместе с капсулой, стараясь минимально травмировать окружающие ткани. Выполняют тщательный гемостаз. Образовавшуюся полость ушивают, устанавливают вакуумный дренаж, чтобы не допустить формирования гематомы, которая может стать источником рецидива.
Прогноз
Прогноз обычно благоприятный. При планомерном комплексном консервативном лечении большинство оссификатов рассасывается или уменьшается в размерах, функции конечности восстанавливаются. При околосуставной локализации, распространении окостенения на всю мышцу или ее значительную часть возможны снижение или утрата трудоспособности.
Профилактика
Превентивные мероприятия включают предупреждение травматизма, ранее начало лечения переломов и вывихов, обязательное вскрытие и адекватное дренирование крупных гематом в мышечных массивах. Большое значение имеет продуманная постепенная реабилитация, исключающая использование форсированных методов восстановления функции конечности.
Как научиться жить с диагнозом прогрессирующая оссифицирующая фибродисплазия?
ДОСТУПНЫЕ ЦЕНЫ НА КУРС ЛЕЧЕНИЯ
Мягко, приятно, нас не боятся дети
ДОСТУПНЫЕ ЦЕНЫ НА КУРС ЛЕЧЕНИЯ
Мягко, приятно, нас не боятся дети
Исторические данные и клиническая картина
Случаи выявления диагноза фиксируются один на два миллиона. Один из самых первых пациентов, пораженных данным заболеванием, был зарегистрирован в 1648 году. На сегодняшний день насчитывается не более 300 случаев.
Источником возникновения недуга выступает мутирование клеток на генетическом уровне.
Симптомы фибродисплазии
Нередко фибродисплазию ошибочно принимают за раковую опухоль, так как при ней тоже происходит отечность тканей. Но, при попытке удаления оссификатов ситуация только усугубляется, провоцируя рост новых образований.
Проведение лабораторного обследования и профилактика заболевания
При обнаружении вышеперечисленных признаков прогрессирующей оссифицирующей фибродисплазии необходимо незамедлительно обратиться к специалисту и ни в коем случае не заниматься самолечением. Врач назначит пройти генетическое тестирование, по результатам которого предполагаемый диагноз либо подтвердится, либо будет опровергнут.
Сегодня молекулярно-генетическое исследование входит в перечень услуг большинства диагностических центров. Это несложная процедура и осуществляется путем забора крови с утра на голодный желудок. Важно учесть, что за сутки до анализа нельзя принимать алкогольные напитки. Результаты тестирования будут готовы примерно через семь дней.
Лишь только при обнаружении мутирующего гена ACVR1, отвечающего за формирование и восстановление костной системы, врач имеет право подтвердить диагноз.
Люди, страдающие этим недугом, должны быть крайне аккуратны в обыденной жизни, избегая ушибов, царапин, травм и даже простудных и воспалительных заболеваний. Так как эти факторы могут отрицательно повлиять на течение болезни и привести к появлению новых костных уплотнений.
Лечение фибродисплазии в перспективе
Американские исследователи при университете Томаса Джефферсона создали новый препарат, блокирующий мутацию гена ACVR1/ALK2, и опробовали его на лабораторных мышах. Он оказал эффективное воздействие на ход лечения гетеротопической оссификации: прогресс заболевания приостановился, и снизились воспалительные процессы в поврежденных заболеванием тканях. Изобретенное средство может противостоять «болезни второго скелета», образовавшейся на фоне полученных повреждений и имеющей наследственный характер. В ближайшие три-пять лет американские учёные-генетики будут продолжать тестировать препарат и совершенствовать его возможности. За более короткий промежуток времени провести исследования не представляется возможным, так как синдром каменного человека крайне редкое явление, и каждый случай уникален.
Клинические и рентгенологические проявления оссифицирующей прогрессирующей фибродисплазии у детей
Прогрессирующая оссифицирующая фибродисплазия (ФОП), оссифицирующий прогрессирующий миозит (ОПМ), болезнь Мюнхмайера, болезнь «второго скелета» — редкое, врожденное, инвалидизирующее заболевание с встречаемостью 1 на 2 млн человек.
Прогрессирующая оссифицирующая фибродисплазия (ФОП), оссифицирующий прогрессирующий миозит (ОПМ), болезнь Мюнхмайера, болезнь «второго скелета» — редкое, врожденное, инвалидизирующее заболевание с встречаемостью 1 на 2 млн человек.
Фибродисплазия характеризуется врожденной костной патологией и прогрессирующим гетеротопическим окостенением мышц, сухожилий, связок, апоневрозов [1, 2]. Нет расовой, половой или географической предрасположенности. Заболевание чаще возникает как результат спонтанной новой мутации. Наследственная передача — аутосомно-доминантная, возможен материнский мозаицизм.
В 2006 г. была обнаружена преимущественно одна и та же гетерозиготная мутация (c.617G>A; p.R206H) в глициновом и сериновом остатке (GS) области активации рецептора 1-го типа активина А (ACVR1)/активиноподобной киназы 2 (ALK2) рецептора 1-го типа костного морфогенетического протеина (КМП), расцененная как генетическая причина ФОП. Семь дополнительных мутаций были идентифицированы впоследствии в GS-области и области киназы ACVR1 у пациентов с «нетипичными» формами болезни [3, 4].
Мутация c.617G>A приводит к замене аргинина на гистидин в кодоне 206 (p.R206H). Структурное гомологичное моделирование белков предсказывает, что замена аминокислоты приводит к конформационным изменениям рецептора, что вызывает изменение его чувствительности и активности [3].
При ФОП предполагается активная выработка КМП-4 сверх порога, что объясняет избыточную оссификацию и эктопическое образование кости постнатально [4].
Врожденные фенотипы, вызванные ФОП-метаморфозом, включают ряд врожденных уродств (деформаций) и скелетных аномалий: деформированный большой палец ноги (основной диагностический признак болезни), дисплазию метафизов, короткие фаланги, короткие большие пальцы рук, синостозы — симфалангизм пальцев, сращение поверхностей шейных суставов, сращение реберно-позвоночных суставов, проксимальные медиальные берцовые остеохондромы, короткие широкие шейки плечевой кости, редкие волосы, глухоту и др. [1, 4, 5].
В отечественной литературе имеются единичные работы о развитии ФОП у детей преимущественно в школьном возрасте [6–8].
В данном сообщении мы представляем наиболее типичные клинические и рентгенологические проявления ФОП у 30 детей в возрасте от 1,5 до 14 лет, наблюдавшихся в клинике детских болезней Первого МГМУ им. И. М. Сеченова в 1968–2010 гг. и два наблюдения с выявленным геном ФОП.
Дети поступали с жалобами на появление на голове мягких эластичных образований, которые постепенно распространялись вниз и уплотнялись. Начало болезни нередко сопровождалось недомоганием, субфебрилитетом, болезненностью очагов, постепенным их уплотнением, нарастанием общей скованности и контрактурами в области крупных суставов. Быстрота распространения процесса колебалась от 2–3 месяцев до 3–5 лет.
У отдельных пациентов наблюдали самопроизвольное исчезновение и/или рецидивы очагов, у других процесс неуклонно прогрессировал. Постепенно дети как бы окутывались костным панцирем, «вторым скелетом», становились малоподвижными, с трудом самостоятельно одевались, принимали пищу, меняли положение в пространстве и в итоге становились инвалидами, зависящими от помощи взрослых (рис. 1, 2). Дети дошкольного возраста могли отставать от сверстников в развитии, старшие были более замкнутыми, но неплохо успевали в школе.
Резкая деформация скелета, кифосколиоз, контрактуры в суставах, множественные оссификаты на спине у девочки 8 и мальчика 14 лет (собственные наблюдения, 70-е годы)
Рис. 1. Фото первых пациентов с ФОП
Около половины детей имели типичный признак «классического» варианта ФОП: патологию первых пальцев стоп: укорочение, подвывихи, симфалангизм, монофалангизм и др.
Рис. 2. Контрактуры и внескелетные костные образования на спине и передней поверхности живота у двух пациенток 10 и 1,5 лет
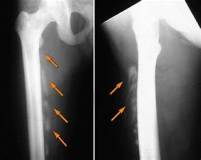
На рентгенограммах обнаруживали внескелетные, костной плотности тени (оссификаты), как единичные, так и сливающиеся между собой в обширные конгломераты. Обычно определялись множественные линейные тени костной плотности с локализацией в мягких тканях конечностей и туловища. Нередко тени переплетались между собой наподобие ветвей дерева. Наиболее частой локализацией были боковые поверхности грудной клетки и внутренние поверхности плеч с образованием синостозов между собой в виде «моста» (рис. 3). У детей младшего возраста эта локализация была первичной. Нередкими были также единичные или множественные экзостозы.
Рис. 3. Оссификаты на боковых поверхностях грудной клетки в виде моста у ребенка 2 лет
Основные лабораторные параметры, включая общие и биохимические анализы крови и мочи (в т. ч. ферменты и показатели минерального обмена), уровень гормонов щитовидной и паращитовидных желез, оставались нормальными.
Лечение проводили кортикостероидными гормонами (преднизолоном или метилпреднизолоном в дозе 0,5–1 мг/кг массы в сутки) короткими курсами, нестероидными противовоспалительными препаратами (НПВП), внутривенным введением 5% раствора динатриевой соли этилендиаминтетрауксусной кислоты (Na2 ЭДТА), 10% раствора Ксидифона внутрь и/или местно путем электрофореза или мази с Ксидифоном. В последние годы использовали бисфосфонаты нового поколения (динатрия памидронат или Аредиа, Бонефос, Бонвива и др.), антилейкотриеновые препараты (монтелукаст) и блокаторы мастоцитов (кромолин натрия).
Приводим представляющие интерес наблюдения двух пациентов, обследованных генетически в 2010 году.
Пациент 1 в 14 лет обратился в клинику в июне 2010 года.
Беременность у матери протекала нормально, но в конце появились отеки ног, А/Д — 150/100 мм рт. ст, прибавка веса 10 кг. Из-за запрокидывания головки ребенка проведено кесарево сечение (12-часовой безводный период). Вес при рождении 3200 граммов, длина 53 см, окружность головки 36 см. Рос и развивался удовлетворительно. Сидит с 6 месяцев, начал ходить с 10 месяцев, первый зуб прорезался в 4 месяца. Вес в один год 11 кг, речь с 1 года 3 месяцев. Грудное вскармливание 2 месяца, далее искусственное, диагностирована анемия легкой степени.
На все прививки, кроме реакции Манту, отмечали подъем температуры до 39–40 °C. При проведении АКДС распухала ягодица (как «стеклянная»).
Перенесенные болезни до школы — ветряная оспа, мононуклеоз, позже — ОРВИ.
В два года поставлен диагноз врожденная вальгусная деформация больших пальцев стоп, сделана операция выправления подвывиха первого пальца левой ноги (вставлена спица).
В 5 лет — диагноз болезнь Пертеса, экзостозная болезнь.
В 6 лет сделана операция по удалению «наростов» (экзостозов) с обеих сторон на задней поверхности коленных суставов. Но возник рецидив, и появились новые очаги спереди.
В 9 лет из-за ушиба (падение с велосипеда) стала плохо сгибаться в колене левая нога, стал прихрамывать.
С 11 лет выявлена двухсторонняя нейросенсорная тугоухость.
В 14 лет (апрель 2010 г.) появилось уплотнение на шее слева. На операции в кивательной мышце выявлен тяж хрящевой плотности. Материал биопсии консультирован в РОНЦ АМН РФ: данных за опухоль нет.
Консультирован в ЦИТО в мае 2010 г., установлены экзостозы и ограничение движений в левой кивательной мышце.
УЗИ левой кивательной мышцы (21.05.2010) — в средних ее отделах определяется участок измененной структуры, захватывающий всю толщу мышцы на протяжении 5,2 см с уплотнением, понижением эхогенности, не имеющий характерной волокнистой структуры; выше и ниже в мышечной ткани есть участки гиперэхогенных мышечных включений (послеоперационные изменения на фоне специфического миозита). Справа — аналогичные включения.
УЗИ передней поверхности правого бедра — на уровне верхней трети — оссификат (2,8 × 0,3 см толщины), в мягких тканях спины справа, на уровне нижних грудных позвонков — оссификат, аналогичный по структуре.
По завершении обследования и очной консультации в РОНЦ им. Н. Н. Блохина в мае 2010 года заподозрен прогрессирующий оссифицирующий миозит.
На консультации генетика установлен диагноз — «фибродисплазия прогрессирующая оссифицирующая с аутосомно-доминантным типом наследования в родословной «de novo». В фенотипе — уплотнение мышц в области шеи, спины, правого бедра, с 9 лет костно-хрящевые экзостозы в верхней трети большеберцовой кости и нижней трети левого бедра, врожденная аномалия первых пальцев кистей и стоп (укорочение, тугоподвижность в межфаланговых суставах), укорочение и расширение шейки бедренных костей.
В клинике детских болезней обследован амбулаторно (15–17.06.2010 г.).
При осмотре мальчик хорошего роста, повышенного питания (рост 160 см, вес 60 кг). Жалуется на затруднение при поворотах шеи и наклонах туловища вперед. Ощущает неловкость в спине и тазе при ходьбе и ощупывании, прихрамывает на правую ногу.
Кожа чистая со следами загара. Укорочение больших пальцев стоп и кистей с подвывихом на ногах — halux valgus (рис. 4). На шее в области левой кивательной мышцы уплотнение с рубцом в центре. Поворот влево затруднен. Наклон туловища вперед лишь до горизонтального уровня. Справа на передней поверхности бедра — уплотнение в толще мышцы. На спине справа на уровне 6-го грудного позвонка определяется костный тяж длиной около 5–7 см, вне связи с позвоночником. Лимфатические узлы не увеличены. Со стороны легких, сердца, органов брюшной полости без патологии.
На R-грамме стоп: справа — вальгусная деформация первого пальца, основная фаланга значительно укорочена, утолщена, смещена латерально (подвывих). Слева — деформация головки плюсневой кости и проксимальной фаланги первого пальца (после операции). Суставная щель неравномерно сужена (рис. 4).
Слева – деформация головки первой плюсневой кости и основной фаланги первого пальца после операции в возрасте 2 лет. Справа укорочение и подвывих основной фаланги первого пальца стопы (Halux valgus)
Рис. 4. Пациент 14 лет. Укорочение больших пальцев стоп
На рентгенограмме тазобедренных суставов с захватом 2/3 бедренных костей — головки бедренных костей уплощены, левая смещена латерально. Слева крыша вертлужной впадины скошена. Утолщение кортикального слоя в бедренных костях. В проекции шейки и верхней половины диафиза бедренной кости слева в мягких тканях определяются тени костной плотности. Справа — единичные тени в проекции шейки бедренной кости (рис. 5).
На рентгенограммах кистей соотношение костей не нарушено. Отмечается метаэпифизарный остеопороз. Пястные кости укорочены. Слева основная фаланга первого пальца укорочена, гипоплазия эпифиза. Средние фаланги V пальцев с искривленностью.
ЭхоКГ (17.06.2010 г). Размеры полостей сердца, толщина миокарда в пределах нормы. Систолическая и диастолическая функции левого желудочка не нарушены. Давление в легочной артерии в норме. По передней стенке правого желудочка минимальное расхождение листков перикарда в диастолу 1,3–1,5 мм. МАРС: добавочные базальные хорды и трабекула в полости левого желудочка. Удлинен евстахиев клапан.
Клинический диагноз: «Фибродисплазия оссифицирующая прогрессирующая. Классическая форма. Поздняя стадия. Врожденные аномалии больших пальцев стоп: укорочение и утолщение основных фаланг с подвывихом (Halux valgus) и кистей (укорочение пястных костей и основной фаланги первого пальца слева с гипоплазией эпифиза. Искривление средних фаланг V пальцев). Костно-хрящевые экзостозы слева на уровне нижней и верхней третей бедренной кости. Укорочение и расширение шейки бедренных костей. Множественные внескелетные костные образования (оссификаты) в толще мышц спины, бедер, шеи.
МАРС: добавочные базальные хорды и трабекула в полости левого желудочка, удлинение евстахиевого клапана. Двусторонняя нейросенсорная тугоухость.
В лаборатории ДНК-диагностики: найдена мутация Arg206 His в гене ACVR1».
Заключение. Ребенок наблюдался длительно с диагнозами врожденной вальгусной деформации больших пальцев стоп, экзостозной болезни, болезни Пертеса, подозрением на опухоль шеи с биопсией измененного участка кивательной мышцы; получал все прививки и вакцинации, несмотря на высокую лихорадку на каждое введение вакцин, не соблюдал необходимого щадящего двигательного режима, многократно травмировался, подвергался многочисленным лучевым исследованиям, операциям и лишь через 14 лет диагноз ФОП верифицирован и подтвержден генетически.
В настоящее время ему рекомендованы щадящий двигательный режим, отвод от всех внутримышечных инъекций, манипуляций в области нижней челюсти, профилактика ОРВИ (Арбидол, санация полости носа — промывание морской водой, капли — Маример, вакцинация при эпидемии гриппа подкожно или интраназально), плавание в бассейне с морской водой или в море, применение преднизолона (2 мг/кг 5–7 дней) и бисфосфонатов (Аредиа) при возникновении новых оссификатов, оформление инвалидности и динамическое наблюдение в специализированном стационаре.
Второй пациент — под наблюдением клиники с 1 года 3 месяцев.
В анамнезе: мать 27 лет, здорова, отец 39 лет, страдает бронхиальной астмой, алкогольной зависимостью. На 18-й неделе беременности мать перенесла грипп, в последующем из-за непропорционального развития головки была госпитализирована в отделение патологии беременности. Роды в срок, физиологические. Вес ребенка 2530 г, длина — 48 см. Оценка по шкале Апгар 8–9. Закричал сразу. Кормление грудью 8 месяцев, отмечалась гипогалактия. С раннего детства отмечено «плохое» держание головки в положении на животе, в 3 месяца — массаж из-за гипертонуса мышц шеи. Сидит с 7 месяцев, ходит с 12 месяцев, зубы с 5 месяцев.
В возрасте 5 месяцев упал с дивана без последствий. Позже в 12 месяцев повторное падение, ударился лбом. На месте ушиба возник отек размером с куриное яйцо. Получал гидрокортизон, примочки местно с эффектом.
При рентгенографии и томографии выявлена врожденная аномалия С1–С2 — деформация тел позвонков в виде платиспондилии, незаращение на уровне задних отделов (spina difida posterior), гипоплазия зубовидного отростка С2.
При ЭхоКГ размеры камер сердца выше возрастной нормы (мальчик повышенного питания: вес в 1 год 2 месяца 15 кг). Дополнительная хорда в левом желудочке.
При первичном осмотре ребенок хорошего физического развития, повышенного питания, мобилен, общителен. Имеется «скованность» и приподнятость в плечевом поясе, напряженность и уплотнение мышц шеи, ограничение в поворотах головы и наклоне назад. Движения в суставах конечностей не ограничены, деформаций нет. Приседает, ходит, бегает свободно. Кожные покровы и слизистые чистые. Зубы 10/8. По внутренним органам — без патологии, выявлена гипоспадия.
Имеются диагностические признаки классической формы ФОП — укороченные с подвывихом большие пальцы стоп (рис. 6), а также врожденная патология шейных позвонков и гипоспадия.
Рис. 6. Укорочение и вальгусная деформация первых пальцев стоп у пациента 1,5 лет
Общие анализы крови и мочи, биохимическое исследование крови в пределах нормы.
Генетическое обследование выявило наличие мутации Arg206His в гене ACVR1, характерное для классического варианта ФОП.
Клинический диагноз: «Фибродисплазия оссифицирующая прогрессирующая. Классическая форма. Ранняя стадия. Начальная фаза болезни. Рецидивирующие опухолеподобные образования на голове и в области шеи. Хрящеподобные элементы в виде продольных эластичных тяжей (теней на рентгенограммах) в мягких тканях надплечий и вдоль позвоночника. Врожденные костные аномалии: укорочение больших пальцев стоп. Недоразвитие зубовидного отростка 2-го шейного позвонка. Платиспондилия и незаращение задних отделов тел С1–С2. Гипоспадия. Мутация Arg206 His в гене ACVR1».
Ребенок наблюдается в течение года. Заболевание не прогрессирует. Периодически на голове при легких травмах возникают эластичные «опухоли», быстро исчезающие при применении мази с Ксидифоном. Дан отвод от всех внутримышечных прививок и вакцинаций. Рекомендован охранительный двигательный домашний режим. При падениях и образовании мягких опухолей на голове — мазь с Ксидифоном, внутрь НПВП, антилейкотриены. Динамическое наблюдение в клинике для коррекции терапии. Оформление инвалидности детства.
Таким образом, наши наблюдения свидетельствуют о недостаточном знакомстве с ФОП врачей различных специальностей — педиатров, хирургов, ортопедов, что приводит к длительной верификации диагноза, ненужным вмешательствам и травмам мягких тканей (операции, биопсии, внутримышечное введение лекарств, вакцинации).
Обобщая литературные и собственные данные, следует считать для диагноза главным наличие врожденной патологии больших пальцев стоп (нередко в сочетании с патологией пальцев кистей) и внескелетные оссификаты. У детей дошкольного возраста, как правило, они возникают на шее, плечевом поясе и постепенно распространяются вниз. У старших детей оссификаты могут появляться в любых участках мягких тканей (мышцах, сухожилиях и др.), чаще вследствие травм любого генеза или на фоне гриппа и ОРВИ. При подозрении на ФОП необходим поиск мутаций в гене ACVR1.
К сожалению, прогноз болезни неудовлетворительный. Очень важно соблюдать все профилактические меры для избежания любых травм мягких тканей и проводить профилактику ОРВИ и гриппа, которые могут ускорить прогрессирование болезни и спровоцировать легочно-сердечную недостаточность.
В настоящее время содружеством ученых активно разрабатываются и апробируются (в эксперименте и на животных) препараты, обладающие способностью блокировать мутации в гене ACVR1, что позволит предупредить или прервать гетерогенную оссификацию и улучшить состояние пациентов.
Литература
Первый МГМУ им. И. М. Сеченова, Медико-генетический научный центр РАМН, Москва





.png)
.png)
.png)
.png)
.png)