Что такое отечный синдром при хронической сердечной недостаточности
Лечение отечного синдрома при хронической сердечной недостаточности
*Пятилетний импакт фактор РИНЦ за 2020 г.
Читайте в новом номере
В статье освещен вопрос лечения отечного синдрома при хронической сердечной недостаточности
Для цитирования. Ефремова Ю.Е. Лечение отечного синдрома при хронической сердечной недостаточности // РМЖ. 2015. № 27. С. 1622–1624.
Согласно рекомендациям Европейского общества кардиологов, сердечная недостаточность определяется как следствие нарушений структуры и функции сердца, которые приводят к неспособности сердца доставлять кислород со скоростью, сопоставимой с метаболическими потребностями тканей, несмотря на нормальное давление наполнения [1]. Хроническая сердечная недостаточность (ХСН) – это синдром, к которому приводят различные причины поражения миокарда. Основными причинами ХСН являются ишемическая болезнь сердца и артериальная гипертония (АГ), реже – кардиомиопатии, клапанные пороки сердца, болезни перикарда и др. Частота распространенности ХСН в возрастной группе 25–54 лет составляет 1%, в группе 65–74 лет – 4–5%, около 10% – у лиц старше 75 лет. По сравнению с периодом 20-летней давности имеются данные о 4-кратном увеличении госпитализаций по поводу ХСН. Частично это объясняется увеличением средней продолжительности жизни [2]. По результатам российского эпидемиологического исследования ЭПОХА-ХСН, распространенность ХСН в России составляет в среднем 7,9%, в т. ч. клинически выраженная – 4,5%, увеличиваясь от 0,3% в возрастной группе от 20 до 29 лет до 70% у лиц старше 90 лет [3]. Наличие сердечной недостаточности повышает риск смерти в 4 раза.
Лечение пациентов с ХСН – сложная задача современной медицины, поскольку сердечная недостаточность является лишь синдромом, который может развиться как осложнение многих заболеваний сердечно-сосудистой системы. Терапия больного с ХСН в первую очередь должна включать в себя лечение основного заболевания. Основная цель лечения ХСН – снижение смертности, а также [2]:
– уменьшение клинических симптомов ХСН;
– уменьшение частоты развития основных осложнений;
– поддержание или улучшение качества жизни больного;
– улучшение функции левого желудочка;
– увеличение переносимости физической нагрузки;
– уменьшение потребности в госпитализации;
– предотвращение побочных эффектов терапии.
Медикаментозное лечение ХСН включает в себя большое количество препаратов, самыми распространенными из которых являются ингибиторы ангиотензин-превращающего фермента (ингибиторы АПФ); блокаторы рецепторов к ангиотензину II; диуретики; β-адреноблокаторы и антагонисты рецепторов минералокортикоидов (антагонисты альдостерона). Применение определенного препарата при лечении ХСН направлено на решение конкретных задач. Рассмотрим подробнее лечение отечного синдрома при ХСН с помощью диуретической терапии.
Периферические отеки при сердечной недостаточности являются следствием задержки жидкости, вызванной сниженным почечным кровотоком и нейрогормональными изменениями. Преимущественно они развиваются на нижних конечностях. При значительной задержке жидкости возможно наличие асцита и/или гидроторакса. Для лечения отечного синдрома применяются диуретики. Препараты этого класса показаны всем больным при клинических симптомах ХСН, связанных с избыточной задержкой натрия и воды в организме [4]. Диуретики применяются для симптоматического лечения ХСН. Они препятствуют задержке жидкости в организме, увеличивают экскрецию соли и воды, что приводит к уменьшению застойных явлений. На фоне их использования снижается общее периферическое сосудистое сопротивление, уменьшается пред- и постнагрузка, в связи чем уменьшается дилатация левого желудочка.
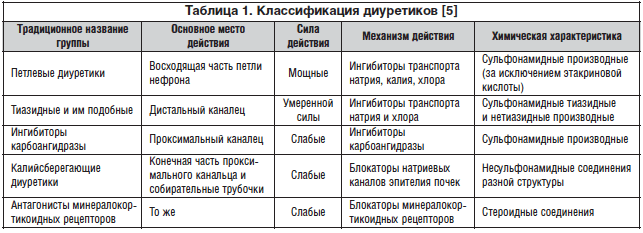
Существуют 5 классов мочегонных средств (табл. 1), которые действуют на различные части петли Генле.
При начальных стадиях ХСН возможно применение тиазидных диуретиков. При тяжелой ХСН возможна комбинация петлевых и тиазидных диуретиков, что приводит к усилению мочегонного эффекта. При выраженном отечном синдроме и/или декомпенсации ХСН целесообразно введение диуретиков парентерально. Петлевые диуретики фуросемид и торасемид являются наиболее часто используемыми диуретиками при ХСН.
Торасемид используется в клинической практике с 1980-х гг. При отечном синдроме данный препарат назначается по 5 мг утром после еды; при необходимости дозу увеличивают до 20 мг 1 р./сут. По сравнению с фуросемидом торасемид характеризуется более высокой биодоступностью, которая не уменьшается при отечном синдроме, меньше влияет на концентрацию в плазме калия, магния, действует длительнее и обладает антиальдостероновыми свойствами (блокада рецепторов альдостерона на мембранах эпителиальных клеток почечных канальцев и снижение секреции альдостерона в надпочечниках). К плейотропным свойствам торасемида относят способность данного препарата ингибировать синтез и депозицию коллагена 1 типа в миокарде у пациентов с ХСН. Кроме того, в отличие от пациентов, получающих фуросемид, у пациентов в группе торасемида снижается концентрация в сыворотке крови C–терминального пропептида проколлагена 1 типа (маркера миокардиального фиброза) [6]. Торасемид снижает смертность, а также частоту и продолжительность госпитализаций по поводу ХСН. Кроме того, он приводит к повышению переносимости физической нагрузки, улучшает функциональный класс (ФК) ХСН (по NYHA) и качество жизни пациентов.
В исследовании TORIC среди 1377 пациентов с ХСН торасемид привел к достоверному снижению сердечно-сосудистой смертности в сравнении с фуросемидом [7]. В этом исследовании были проанализированы результаты 9–месячного сравнительного лечения торасемидом в суточной дозе 10 мг и фуросемидом 40 мг больных с ХСН. В группе больных, получавших терапию торасемидом, значительно чаще улучшился ФК недостаточности кровообращения и достоверно снизилась сердечно-сосудистая и общая смертность.
В последнее время на российском рынке лекарственных средств появился торасемид замедленного высвобождения – Бритомар®. Препарат обеспечивает постепенное высвобождение активного вещества. Благодаря этому снижаются колебания концентрации препарата в крови по сравнению с обычной формой. Бритомар® – таблетка на основе гидрофильной матрицы из гуаровой камеди, которая является натуральным водорастворимым полимером, получаемым из семян растения семейства бобовых. В фармацевтической промышленности гуаровая камедь широко используется при создании лекарственных форм с пролонгированным высвобождением. В желудочно-кишечном тракте она образует подобие губки, которая обеспечивает замедленное высвобождение препарата. Лекарственное вещество высвобождается более длительно, благодаря этому диурез начинается примерно через 1 ч после приема препарата, достигая максимума через 3–6 ч, длится эффект от 8 до 10 ч. Замедленное высвобождение препарата позволяет добиться дополнительных клинических преимуществ в лечении отечного синдрома при ХСН.
Торасемид при долгосрочном применении не вызывает изменений уровня калия крови, не оказывает заметного влияния на уровень кальция и магния, показатели гликемического и липидного профиля [8]. Препарат не взаимодействует с антикоагулянтами (варфарином), сердечными гликозидами или органическими нитратами, другими препаратами, наиболее часто применяемыми при лечении ХСН, такими как β-адреноблокаторы, иАПФ, блокаторы рецепторов к ангиотензину II и антагонисты рецепторов минералокортикоидов.
Торасемид пролонгированного действия в сравнении с другими мочегонными препаратами изучался в ряде исследований. Так, в российском одноцентровом рандомизированном открытом исследовании изучалась сравнительная эффективность торасемида пролонгированного действия и фуросемида у пациентов с ХСН II–III ФК, отечным синдромом и повышенным уровнем натрийуретических пептидов [9]. В исследование были включены 40 пациентов с ХСН ишемической этиологии с фракцией выброса левого желудочка менее 40%, разделенных методом рандомизации на 2 равные группы: 1-я получала торасемид пролонгированного действия (Бритомар®), 2-я – фуросемид. В обеих группах на фоне лечения наблюдали достоверное улучшение переносимости физической нагрузки, улучшение качества жизни больных, снижение концентрации натрийуретических гормонов. В группе торасемида замедленного высвобождения были выявлены тенденция к более значимому улучшению качества жизни (р=0,052) и достоверно более значимое снижение уровней NT-промозгового натрийуретического пептида (р Литература
Патогенез и возможности современного лечения отечного синдрома при хронической сердечной недостаточности
Хроническая сердечная недостаточность (ХСН) является конечным звеном сердечно-сосудистого континуума и одной из ведущих причин внезапной сердечной смерти (ВСС). В 2005 г. American Heart Association и American College of
Хроническая сердечная недостаточность (ХСН) является конечным звеном сердечно-сосудистого континуума и одной из ведущих причин внезапной сердечной смерти (ВСС). В 2005 г. American Heart Association и American College of Cardiology (AHA/ACC) выпустили клинические рекомендации по лечению больных ХСН в зависимости от ее стадии. В новой классификации, представленной в табл. 1, традиционная градация по функциональному классу Нью-Йоркской ассоциации сердца (NYHA) была дополнена стадиями развития ХСН, вследствие чего произошло разделение на пациентов, имеющих риск возникновения ХСН (стадии А и В), и пациентов с клиническими проявлениями ХСН (стадии С и D).
Патофизиология отеков при ХСН
У здоровых людей объем циркулирующей крови (ОЦК) и межклеточное пространство, составляющие вместе объем внеклеточной жидкости (ОВЖ) в организме, являются величиной постоянной, несмотря на потребление и потерю натрия и воды. Поскольку среди всех катионов внеклеточной жидкости 90% представляют собой ионы натрия, то они фактически и контролируют ОВЖ. Контроль ОВЖ зависит от натриевого баланса, за который отвечают почки. Если ОВЖ увеличивается у здорового человека, то почки экскретируют избыточное количество натрия и воды. У пациентов с ХСН почки избыточно задерживают натрий даже при увеличении ОВЖ.
Задержка натрия и воды не обязательно может происходить вследствие снижения сердечного выброса, т. к. отечный синдром может возникать также при состояниях, при которых сердечный выброс повышен: при тяжелой анемии, тиреотоксикозе, хронической артериовенозной фистуле, болезни Педжета и квашиоркоре [1]. Кроме того, задержка натрия не связана со снижением ОЦК, поскольку при ХСН ОЦК увеличивается. Таким образом, очевидно, что задержка натрия и воды при ХСН является частью глобального механизма, который предпринимает организм для поддержания нормального артериального давления (АД).
Данные, полученные на пациентах с нелеченной тяжелой дисфункцией левого желудочка, позволили по-новому взглянуть на патофизиологию развития отеков при ХСН [2]. Несмотря на 50-процентное снижение сердечного выброса, АД у пациентов сохранялось нормальным благодаря повышенному общему периферическому сосудистому сопротивлению. Общий объем жидкости в организме был выше нормы на 16%, и большая его часть находилась в межклеточном пространстве, а ОЦК был увеличен на 34%. Эффективный почечный кровоток был снижен на 30% вследствие сильно выраженной вазоконстрикции почечных артерий. Скорость клубочковой фильтрации была снижена в меньшей степени, что свидетельствовало о том, что спазм эфферентных сосудов был выражен больше, чем афферентных. Концентрация норадреналина была в 6 раз, а активность ренина плазмы — в 9 раз выше верхних границ нормы, альдостерон был в 6 раз больше нормы, а предсердный натрийуретический пептид — в 15 раз. Поэтому оказалось, что натрийзадерживающее действие катехоламинов и ренин-ангиотензиновой системы превалировало над натрийуретическим эффектом предсердного натрийуретического пептида на поздних стадиях ХСН.
Считается, что снижение почечного кровотока активирует секрецию ренина при ХСН, вследствие чего происходит повышение продукции ангиотензина II и альдостерона. Они, в свою очередь, увеличивают реабсорбцию натрия и воды в почечных канальцах, а также приводят к развитию гипертрофии левого желудочка и фиброзу миокарда.
Хотя диуретики напрямую не влияют на патологические процессы, происходящие при ХСН, они остаются основой симптоматической терапии по уменьшению объема внеклеточной жидкости, уменьшая выраженность застойных явлений в легких и периферических отеков.
Петлевые диуретики
Наиболее часто при ХСН используются диуретики, влияющие на восходящую петлю Генле канальцевого аппарата почек. В большей степени натрий реабсорбируется в проксимальных канальцах (60–65%) и в петле Генле (20%). При использовании в максимальных дозах петлевые диуретики могут привести к экскреции 20–25% реабсорбированного натрия [3].
Короткодействующие диуретики, такие как фуросемид, приводят к выраженному натрийурезу в течение 6 часов после назначения. Тем не менее, экскреция натрия в остальные 18 часов дня снижается до очень низкого уровня, поскольку потеря жидкости, вызванная фуросемидом, приводит к активации натрийсберегающих механизмов, которые запускают ренин-ангиотензин-альдостероновую (РААС) и симпатическую нервную системы. Повышенные концентрации таких нейрогормонов, как ангиотензин II, альдостерон и норадреналин, вызывают усиление реабсорбции натрия в канальцах [4–6], приводя, таким образом, к еще большей задержке натрия в организме. Следовательно, если пациент не находится на гипосолевой диете, то, несмотря на проведение диуретической терапии, он практически не будет выделять из организма натрий. Возможные решения данной проблемы включают в себя жесткое соблюдение гипосолевой диеты (не более 2–3 г/сутки), прием диуретиков дважды в день или увеличение дозы диуретиков. Максимальный диурез в течение дня происходит после первой дозы диуретиков, но активация натрий-сберегающих механизмов может ограничить ответ на прием второй дозы. Совместное применение диуретиков и ингибиторов ангиотензин-превращающего фермента (ИАПФ), занимающих первую строчку препаратов, использующихся для лечения ХСН, позволяет уменьшить ответную активацию РААС и, как следствие, усилить диуретический эффект от второй дозы диуретика в течение дня.
У пациентов с поздними стадиями ХСН и гиперсекрецией ренина внутривенное введение петлевых диуретиков может привести к резкому возрастанию уровня ренина и норадреналина в плазме и, следовательно, к спазму артериол и подъему АД. Данное повышение постнагрузки может способствовать кратковременному снижению сердечного выброса и повышению давления заклинивания легочной артерии, что клинически может выражаться в усугублении одышки, которая продолжается в течение часа после начала диуретической терапии, после чего выброс вазоконстрикторов резко снижается [7].
Нарушения электролитного баланса, в частности гипокалиемия, являются наиболее частым побочным эффектом петлевых диуретиков. Из-за него на фоне терапии этим классом препаратов может увеличиваться смертность за счет жизнеопасных аритмий. Так, в исследовании SOLVD [8] лечение диуретиками сопровождалось повышением общей смертности, сердечно-сосудистой смертности и числа внезапных сердечных смертей. Другие побочные эффекты включают гиперурикемию, а также ототоксичность и нарушение толерантности к глюкозе (редко).
Биодоступность фуросемида, принятого перорально, составляет только 50%, при этом существует большая вариабельность данного показателя у разных пациентов [9]. В основном, доза перорально назначаемого фуросемида должна быть в два раза больше, чем назначавшаяся до этого внутривенная доза.
В этой связи особый интерес вызывают новые петлевые диуретики, такие как торасемид, которые имеют ряд преимуществ по сравнению с другими петлевыми диуретиками (табл. 2). В отличие от фуросемида, параметры, характеризующие распределение торасемида в организме, практически не изменяются в зависимости от приема пищи и уровня альбумина в плазме. Возможным дополнительным преимуществом фуросемида является его способность блокировать рецепторы альдостерона и препятствовать дальнейшему прогрессированию фиброза миокарда [10].
В постмаркетинговом исследовании TORIC (TOrasemide In Congestive Heart Failure) проводилось сравнение эффективности и безопасности торасемида (10 мг/сутки), фуросемида (40 мг/сутки) и других диуретиков у 1377 пациентов с ХСН II–III функционального класса по NYHA. Торасемид по эффективности превзошел фуросемид и другие диуретики. Так, уменьшение функционального класса ХСН произошло у 45,8% и 37,2% в группах торасемида и фуросемида соответственно (р = 0,00017). Кроме того, торасемид реже вызывал гипокалиемию, по сравнению с фуросемидом (у 12,9% и 17,9% соответственно; р = 0,013). Положительное влияние торасемида на прогноз у больных ХСН подтверждалось более чем в два раза меньшей смертностью по сравнению с группой, получавшей фуросемид и другие диуретики [11].
В крупном рандомизированном исследовании PEACH (PharmacoEconomic Assessment of torаsemide and furosemide in the treatment of patients with Congestive Нeart failure) сравнивали влияние торасемида и фуросемида на конечные точки и качество жизни у больных ХСН II–III функционального класса по NYHA [12]. Продолжительность лечения составляла 6 месяцев. Различий в эффективности двух препаратов в отношении функциональных классов, частоты госпитализаций и смертности обнаружено не было. Несмотря на большую стоимость лечения торасемидом, оно было не менее экономически эффективным, чем лечение фуросемидом. Причиной этого была большая стоимость госпитализаций и визитов к врачу больных, принимавших фуросемид. Торасемид оказывал более благоприятное влияние и на качество жизни у данной группы больных.
В ряде исследований была также продемонстрирована высокая эффективность торасемида при выраженной (клиренс эндогенного креатинина
Д. А. Напалков, кандидат медицинских наук, доцент ММА им. И. М. Сеченова, Москва
Оптимизация лечения отечного синдрома у больных с хронической сердечной недостаточностью
*Пятилетний импакт фактор РИНЦ за 2020 г.
Читайте в новом номере
В статье представлены механизмы развития синдрома задержки жидкости у больных с хронической сердечной недостаточностью (ХСН). Приводится классификация диуретических средств в зависимости от точек приложения их действия в нефроне. Особое внимание уделено негативной роли гиперальдостеронизма при ХСН и возможности его контроля при применении торасемида и эплеренона. На основании многочисленных многоцентровых клинических исследований показано преимущество применения петлевого диуретика с антиальдостероновым эффектом — торасемида и антагониста минералокортикоидных рецепторов — эплеренона в комплексной терапии ХСН. Подчеркивается, что после приема начальной дозы торасемида диуретические и антигипертензивные эффекты проявляются сразу, а реализиция антифибротического действия требует определенного времени, что обусловлено сменой коллагена, происходящей за 6–9 мес. непрерывной терапии препаратом. В связи с этим необходимо учитывать длительное, порой пожизненное, применение торасемида при ведении больных с ХСН, артериальной гипертонией и поражением органов-мишеней. В статье представлены данные в рамках доказательной медицины о высокой клинической эффективности применения эплеренона у больных с ХСН и сниженной фракцией выброса при наличии или отсутствии инфаркта миокарда. Таким образом, применение торасемида и эплеренона приводит к улучшению не только качества жизни тяжелых больных, но и прогноза заболевания.
Ключевые слова: хроническая сердечная недостаточность, отечный синдром, торасемид, Тригрим, эплеренон, Эспиро.
Для цитирования: Евдокимова А.Г., Коваленко Е.В., Евдокимов В.В., Михайлова И.М. Оптимизация лечения отечного синдрома у больных с хронической сердечной недостаточностью. РМЖ. 2018;11(I):47-53.
Optimization of the treatment of edema syndrome in patients with chronic heart failure
A.G. Yevdokimova, E.V. Kovalenko, V.V. Yevdokimov, I.M. Mikhailova
A.I. Yevdokimov Moscow State University of Medicine and Dentistry
The article considers the mechanisms of the fluid retention syndrome in patients with chronic heart failure (CHF). The classification of diuretics is given depending on the points of application of their action in the nephron. Particular attention is paid to the negative role of hyperaldosteronism in CHF and the possibility of its control when using torasemide and eplerenone. Based on numerous, multicenter clinical studies, the advantage of using a loop diuretic with an antialdosterone effect — torasemide and an antagonist of mineral corticoid receptors — eplerenone in the complex therapy of CHF is shown. It is emphasized that after intaking the initial dose of torasemide, diuretic and antihypertensive effects appear immediately, and the antifibrotic effect requires a certain time, which is due to a change in collagen occurring during 6-9 months of continuous drug therapy. In connection with this, it is necessary to take into account the long-term, sometimes lifelong, use of torasemide in the management of patients with CHF, arterial hypertension and defeat of target organs. The article presents data, within the framework of evidence-based medicine, on the high clinical efficacy of eplerenone in patients with CHF and a reduced ejection fraction with or without myocardial infarction. Thus, the use of torasemide and eplerenone helps not only to improve the quality of life of serious patients, but also the prognosis.
Key words: chronic heart failure, edema syndrome, torasemide, Trigrim, eplerenone, Espiro.
For citation: Yevdokimova A.G., Kovalenko E.V., Yevdokimov V.V., Mikhailova I.M. Optimization of the treatment of edema syndrome in patients with chronic heart failure // RMJ. 2018. № 11(I). P. 47–53.
В статье представлены механизмы развития синдрома задержки жидкости у больных ХСН. Показано преимущество применения петлевого диуретика с антиальдостероновым эффектом — торасемида и антагониста минералокортикоидных рецепторов — эплеренона в комплексной терапии ХСН.
Введение
Патогенез развития отечного синдрома при ХСН
Принципы диуретической терапии
Согласно результатам трех эпидемиологических исследований («ЭПОХА-ХСН», «ЭПОХА-Госпиталь-ХСН» и «ЭПОХА-Декомпенсация-ХСН»), назначение рекомендованной терапии ХСН в полном объеме на госпитальном этапе лечения происходит чаще, чем на амбулаторном. После выписки из стационара, где больные находились на лечении по поводу декомпенсации ХСН, более половины пациентов (54,7%) прекращали прием антагонистов минералокортикоидных рецепторов (АМКР). Отсутствие адекватного проведения базисной и диуретической терапии ХСН является одной из причин повторных госпитализаций. Установлено, что с каждой последующей госпитализацией значительно возрастает риск смерти. Прибавка в весе более 2 кг за неделю, появление ортопноэ, кашля, приступов одышки в ночные часы, влажных хрипов в легких, набухания яремных вен, периферических отеков у больных с ХСН являются признаками задержки жидкости в организме и требуют незамедлительной коррекции проводимой терапии. При синдроме задержки жидкости препаратами выбора являются диуретики, которые назначаются всем пациентам при ХСН со сниженной фракцией выброса (ФВ) с отечным синдромом вне зависимости от ФК, обязательно в сочетании с блокаторами РААС для уменьшения симптомов, повышения толерантности к физической нагрузке и сокращения риска госпитализации. Пациентам с ХСН с сохранной ФВ или СН с промежуточной ФВ применение диуретиков рекомендуется только при наличии застойных явлений для уменьшения симптомов [2]. Диуретики восстанавливают нормальное соотношение натрия и воды в моче. Выделяют несколько групп мочегонных препаратов в зависимости от точки приложения воздействия в нефроне. Характеристика основных представителей различных групп мочегонных средств дана в таблице 1 [3, 4]. 
На начальных стадиях ХСН возможно эффективное назначение тиазидных диуретиков. Однако при более тяжелых стадиях ХСН и значительном снижении скорости клубочковой фильтрации (СКФ), когда тиазидные диуретики перестают работать, целесообразно применение петлевых мочегонных средств. Ведение больных с декомпенсацией ХСН требует обязательного соблюдения основных принципов диуретической терапии. Начинать лечение следует с минимальных доз с постепенным повышением до эффективной под контролем клинического статуса, суточного диуреза, электролитного баланса, СКФ. Дегидратационная терапия включает два этапа. На первом этапе желательно избегать применения ударных доз и быстрой дегидратации, чтобы не спровоцировать гиперактивацию нейрогормонов с развитием синдрома «рикошета» и дизэлектролитемии. Целью активного этапа лечения является достижение положительного диуреза: количество выделенной мочи должно превышать объем выпитой жидкости на 1–2 л с ежедневной потерей массы тела примерно на 1 кг. Как правило, это достигается назначением средних или иногда максимальных доз диуретиков. На втором этапе поддерживающей терапии рекомендуется регулярный, желательно ежедневный, прием мочегонных препаратов в минимально эффективных дозах для поддержания сбалансированного диуреза и стабильной массы тела. Возможно развитие резистентности к диуретической терапии. Основными причинами этого состояния могут быть нарушения электролитного баланса (гипокалиемия 5,5 ммоль/л) в группе эплеренона у 158 (11,8%) пациентов по сравнению с таковым при приеме плацебо у 96 больных (7,2%) (p Литература
Только для зарегистрированных пользователей