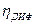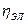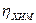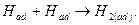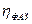Что такое перенапряжение в химии
Виды перенапряжения



В соответствии с возможным характером элементарных стадий рассматривают несколько видов перенапряжения
1) Диффузионное перенапряжение
Диффузионным перенапряжением называют вид перенапряжения, связанный с торможением подвода реагентов к электроду или отвода продуктов реакции.
2) Электрохимическое перенапряжение
Электрохимическим перенапряжением называют вид перенапряжения, связанный со стадией замедленного (то есть имеющего конечную скорость) перехода электронов от элетрода к реагирующей частице или от реагирующей частицы к электроду.
Используются также термины перенапряжение перехода, активационное перенапряжение и перенапряжение разряда.
3) Перенапряжение химической реакции
Перенапряжением химической реакции называют вид перенапряжения, обусловленный конечной скоростью химической реакции, которая может быть одной из стадий сложного электродного процесса.
Примером может служить образование молекул адсорбированного водорода H2(ad):
4) Фазовое перенапряжения
Фазовым перенапряжением называют вид перенапряжения, связанный с торможением сложной электродной реакции на стадии образования новой лил разрушения старой фазы.
Пример: десорбция H2(ad) с поверхности электрода и образование газовой фазы H2(г):
Перенапряжение (электрохимич.)
Перенапряж е ние электрохимическое, отклонение электродного потенциала от его равновесного (по отношению к приэлектродному составу раствора) термодинамического значения при поляризации электрода внешним током. При заметном удалении от равновесия перенапряжение ( h ) и плотность поляризующего тока (i) обычно связаны соотношением h = а + b lg i (уравнение Тафеля), где а и b — эмпирические постоянные. Перенапряжение зависит от температуры, природы электродного материала и состава раствора. Перенапряжение необходимо для ускорения нужной электродной реакции. Если скорость электродной реакции в целом определяется скоростью собственно электрохимической стадии, связанной с переносом заряда, то перенапряжение усиливает электрическое поле, действующее на разряжающиеся частицы, благодаря чему снижается энергия активации разряда. Поскольку электрическое поле в значительной степени обусловлено строением двойного электрического слоя, перенапряжение оказывается зависящим от концентрации постороннего электролита и адсорбирующихся веществ, влияющих на распределение потенциала в двойном слое. На повышении перенапряжения основано действие многих ингибиторов коррозии металлов (см. Ингибиторы химические), что является одной из положительных сторон перенапряжения. В то же время перенапряжение в промышленном электролизе, неизбежно связанное с дополнительным расходом энергии, приводит к увеличению себестоимости продукции.
Лит.: Кинетика электродных процессов М., 1952 (авторский колл. под рук. А. Н. Фрумкина); Скорчеллетти В. В. Теоретическая электрохимия, Л., 1959; Антропов Л. И., Теоретическая электрохимия, 2 изд., М., 1969.
Потенциал разложения. Перенапряжение



Для того чтобы электролиз протекал с заметной скоростью, на клеммах электролитической ванны необходимо поддерживать определенное напряжение.
Та наименьшая величина электродного потенциала, при котором протекает процесс электролиза, называется потенциалом разложения Еразл. Эта величина измеряется в вольтах и находят её обычно опытным путем.
Например, для электролиза раствора хлорида никеля (II) NiCl2 c нерастворимым анодом теоретическое значение потенциала разложения Еразл(теор) = 1,59 В. Практически же найденная величина составила Еразл(практ) = 1,85 В.
Разность между потенциалом разложения, фактически необходимым для проведения электролиза в данной электрохимической системе, и её теоретическим значением называется перенапряжением Еп:
Еп = Еразл(практ) – Еразл(теор)
Еп = 1,85 – 1,59 = 0,26 В.
Следовательно, в данном случае перенапряжение составляет 0,26 В. Это вызвано процессами внутреннего сопротивления электролита и процессами поляризации, происходящими на аноде и катоде в ходе электролиза.
Перенапряжение ведет к перерасходу электрической энергии. Однако это компенсируется той пользой, которую оно приносит. А именно, благодаря перенапряжению оказалось возможным выделять при электролизе из водных растворов солей такие металлы, как Mn, Zn, Fe, Ni, Sn, Pb, т. к. перенапряжение этих металлов меньше, чем перенапряжение водорода на них. При электролизе из двух конкурирующих ионов на электроде будет разряжаться в первую очередь тот ион, у которого перенапряжение меньше.
Перенапряжение бывает анодным (на аноде) и катодным (на катоде). Именно явлением перенапряжения можно объяснить последовательность разрядки ионов на катоде и аноде при электролизе водных растворов соединений.
Последовательность электродных процессов
Часто в растворах электролитов присутствуют несколько видов катионов и анионов и недиссоциированных молекул, поэтому возможно протекание нескольких электродных реакций из-за конкуренции ионов, устремляющихся к электродам.
Катодные процессы. На катоде при электролизе растворов соединений протекают восстановительные процессы в зависимости от активности металлов.
Все металлы в ряду напряжений можно разделить на три части:
активные металлы (от Li до Al включительно);
В Химия. Учеб. пособие
ЭЛЕКТРОХИМИЧЕСКИЕ ПРОЦЕССЫ
9 Электролиз. Токи обмена. Поляризация электрода, перенапряжение. Концентрационная и электрохимическая поляризация
Электролиз. Токи обмена. Поляризация электрода, перенапряжение. Концентрационная и электрохимическая поляризация. Напряжение разложения.
КИНЕТИКА ЭЛЕКТРОХИМИЧЕСКИХ ПРОЦЕССОВ.
Равновесные состояния процессов внутри электролитов (электролитическая диссоциация, гидролиз, сольватация и др.) и процессов на электродах (электрохимические реакции и характеризующие их обратимые электродные потенциалы) не зависят от времени, к ним применимы оба закона термодинамики. Поэтому соответствующие закономерности называются термодинамическими, а посвященный им раздел электрохимии – термодинамикой электрохимических процессов. Для электродных процессов равновесие характеризуется отсутствием электрического тока.
Процесс прохождения электрического тока конечной силы не является равновесным, и явления, связанные с прохождением тока, зависят от времени и от силы тока, величина которого может быть регулируема извне. Раздел электрохимии, рассматривающий неравновесные, главным образом стационарные процессы, протекающие на электродах во времени, называется кинетикой электрохимических (электродных) процессов или просто электрохимической кинетикой.
Электрический ток может протекать в результате замыкания электрохимического элемента, образуемого электродами и электролитом, или под влиянием приложенной к системе электроды – электролит внешней разности потенциалов. В последнем случае явления, происходящие на границах электрод – электролит, называются электролизом и состоят в выделении веществ (металлы, газы) из электролита на электроде, в растворении вещества электрода и в изменении состава электролита.
Электрохимическая кинетика основывается как на общих положениях химической кинетики, так и на частных закономерностях, характерных только для электрохимических процессов. Так, для электрохимии справедливы основной постулат химической кинетики, применимость понятия энергии активации для многих электрохимических процессов, положительное влияние температуры на скорость электролиза и т.п.
Достаточно отчетливо выражена и специфичность электрохимических процессов :
Рекомендуемые файлы
1. Электрохимическим путем можно проводить и такие реакции, которые химическим путем при обычной Т не идут (например, реакция разложения воды при обычной Т не идет, а электролизом вода легко разлагается). Самопроизвольные реакции всегда сопровождаются уменьшением свободной энергии; электрохимическим же путем можно проводить реакции, сопровождающиеся увеличением свободной энергии, т.е. возможности электросинтеза шире, чем возможности обычного химического синтеза. Необходимая свободная энергия доставляется системе извне в виде энергии электрического тока.
2. Суммарную скорость электрохимического процесса можно не только легко определить по величине силы тока, протекающего в цепи, но и регулировать путем изменения силы тока.
3. Скорость электрохимического процесса зависит от ЭДС и существенно зависит от условий диффузии ионов. Диффузия ионов часто оказывает определяющее влияние на скорость электродного процесса.
4. Энергия активации электрохимического процесса часто связана с падением потенциала в ДЭС.
Равновесие между раствором и электродом, имеющим определенный потенциал, является динамическим : происходит непрерывный обмен заряженными частицами между электродом и раствором. При равновесии скорости перехода частиц в противоположных направлениях одинаковы. Количество электричества, переходящее в этих условиях в единицу времени от электрода к раствору и обратно, называется током обмена. Существование тока обмена можно доказать методом изотопных индикаторов.
При прохождении электрического тока через границу электрод – раствор двухсторонний ток обмена имеется, но на него накладывается, как правило, несравненно больший односторонний ток, определяемый ЭДС элемента или приложенной внешней разностью потенциалов.
Электрический ток вызывает изменения на поверхности электродов, зависящие от многих факторов и прежде всего от силы тока. Изменение электрического состояния электрода (его потенциала, плотности заряда ДЭС) под влиянием проходящего через границу раздела электрического тока называется поляризацией электрода. При поляризации потенциал электрода изменяется по сравнению с тем «равновесным» значением, которое он имел в данном растворе при отсутствии тока :
Dj – электродная поляризация; ji – потенциал электрода «под током»; jp – равновесный электродный потенциал. Т.к. при наложении катодного тока потенциал смещается в отрицательную сторону, а при наложении анодного – в положительную, то катодная электродная поляризация всегда отрицательна, а анодная всегда положительна :
Любой электродный процесс представляет собой сложную гетерогенную реакцию, состоящую из ряда последовательных стадий. По крайней мере на некоторых из них она может протекать по двум или нескольким параллельным путям. Природа и число стадий каждой электрохимической реакции зависят от ее характера.
Из химической кинетики известно, что скорость последовательной реакции определяется скоростью наиболее медленной из ее последовательных стадий, а из ряда параллельных путей наиболее вероятен путь с наименьшими торможениями. Эти же представления справедливы и в случае электрохимических процессов. Стадия, определяющая скорость всего электродного процесса, называется замедленной или лимитирующей стадией. Замедленность той или иной стадии является непосредственной причиной поляризации электрода. Если известна природа замедленной стадии, т.е. ясна причина, обусловливающая появление поляризации, то вместо термина «поляризация» употребляют термин (электродное) перенапряжение (h). Т.о., перенапряжение – это поляризация электрода, обусловленная замедленным протеканием вполне определенной стадии суммарного электродного процесса.
В общем случае смещение потенциала электрода под током от равновесного значения представляет собой результат наложения всех видов перенапряжения:
Однако можно найти такие электродные процессы и создать такие условия, при которых преобладающее значение будет иметь какой-либо один вид перенапряжения.
Концентрационная поляризация обусловлена уменьшением в процессе электролиза концентрации ионов, определяющих потенциал у поверхности электрода; в результате этого изменяется равновесный потенциал электрода. Влиянием концентрационной поляризации на потенциал электрода под током можно пренебречь лишь при малых плотностях тока (т.е при малых скоростях электрохимической реакции). Напротив, при высоких плотностях тока стадии доставки могут определять скорость всего электродного процесса.
Рассмотрим процесс электролиза раствора AgNO3 с концентрацией с о (Моль/л) в присутствии значительного количества KNO3. Катод – серебряная проволока, анод – Pt-жесть с очень большой поверхностью. В отсутствие тока потенциал катода может быть вычислен по уравнению Нернста :
j = j о + 
ji = j о + 
По мере прохождения тока градиент концентрации у катода увеличивается, и подача ионов из глубины раствора путем диффузии усиливается. Через некоторое время создаются такие условия, при которых количество разряжающихся ионов становится равным количеству ионов, которое подводится к поверхности электрода. Устанавливается некоторое стационарное (т.е. не изменяющееся во времени) распределение ионов у катода.
ni = DS
D – коэффициент диффузии разряжающегося иона;
S – площадь поверхности электрода;
l – толщина диффузионного слоя (слоя, в котором происходит уменьшение концентрации от с о до с ( S ) ).
I = zF DS
При увеличении силы тока величина с ( S ) уменьшается и при достижении некоторого предельного значения силы тока, называемого предельным током диффузии Iд, становится равной нулю. Поэтому предельный ток диффузии равен :
Iд = zF DS
Из двух предыдущих уравнений также получим :
с ( S ) = с о
Подставив полученное выражение для с ( S ) в уравнение для ji и вычтя из результата уравнение для j, найдем, что сдвиг потенциала, обусловленный концентрационной поляризацией, будет равен
Dj = 
Величины Dj обоих электродов складываются в ЭДС концентрационной поляризации, направленную против приложенной к электролитической ванне разности потенциалов, поэтому последняя должна быть увеличена на ЭДС концентрационной поляризации, чтобы была получена необходимая для электролиза сила тока. Т.к. в электрохимических производствах при электролизе применяют токи большой плотности, возникают значительные ЭДС поляризации, что увеличивает расход электрической энергии, поэтому устранение или уменьшение концентрационной поляризации является важной практической проблемой. Одной из основных мер уменьшения концентрационной поляризации является перемешивание растворов. Возникновение концентрационной поляризации снижает ЭДС химических источников тока при их работе. Избежать этого удается путем создания особых условий эксплуатации источников тока или применения насыщенных растворов солей с избытком твердой соли (элемент Вестона).
Любой электродный процесс обязательно включает в себя одну или несколько стадий, на которых частицы либо присоединяют к себе электроны (акт восстановления), либо теряют их (акт окисления). Однако сущность собственно электрохимической стадии не сводится только к изменению валентного состояния частицы или только к переносу заряда через границу раздела электрод–электролит. Приобретение (или потеря) частицей электрона приводит одновременно к изменению ее физико-химического и энергетического состояния. Так, например, в ходе реакции
приобретение электрона частицей Н3О + означает не только изменение заряда от величины z1 = 1 до величины z2 = 0, но и превращение гидратированного протона в адсорбированный на электроде атом водорода, т.е. разрыв связей между ионом водорода и растворителем и создание связи между атомом водорода и металлом.
При осаждении металла из раствора его простой соли металлический ион из аквакомплекса переходит в состояние адатома (или адиона)
с последующим его вхождением в решетку металла.
Т.о., приобретение или потеря частицей заряда всегда сопровождаются перестройкой ее структуры и изменением ее природы. Чем глубже эти изменения, тем больше должна быть энергия активации и тем ниже скорость собственно электрохимической стадии, т.е. тем вероятнее, что именно она определяет скорость всего электродного процесса и обусловливает появление электрохимического перенапряжения.
Теория электрохимического перенапряжения была разработана применительно к процессу катодного выделения водорода, а затем распространена на другие электродные процессы. Первая попытка количественного оформления теории замедленного разряда была предпринята Эрдей-Грузом и Фольмером в 1930 г. Эрдей-Груз и Фольмер вывели формулу, связывающую потенциал электрода под током с плотностью тока. Выведенная ими формула является основным уравнением электрохимического перенапряжения и согласуется с эмпирическим уравнением для перенапряжения водорода. Однако теория замедленного разряда в ее первоначальном виде содержала ряд недостаточно обоснованных допущений и не могла удовлетворительно описать всю совокупность опытных данных. Наибольший вклад в теорию замедленного разряда был внесен А.Н.Фрумкиным (1933), который впервые учел влияние строения ДЭС на кинетику электрохимических процессов. Его идеи во многом определили основное направление развития электрохимической науки и ее современное состояние.
Минимальная разность потенциалов, которую необходимо создать между электродами, чтобы электролиз начался, называется напряжением разложения электролита. При отсутствии перенапряжения на электродах напряжение разложения равно сумме равновесных потенциалов электродов, образующихся после начала электролиза (например, при электролизе НCl равно сумме равновесных потенциалов хлорного и водородного электродов). При наличии же перенапряжения хотя бы на одном электроде напряжение разложения больше суммы равновесных потенциалов.
Если при электролизе на электродах образуются твердые или жидкие растворы, и особенно при выделении газов, напряжение разложения зависит от формы и размеров электродов, характера их поверхности, условий удаления газов и многих других обстоятельств. Поэтому величина напряжения разложения не может служить однозначной характеристикой электролита при различных условиях.
Оказалось, что напряжения разложения при электролизе кислородсодержащих кислот и щелочей средних концентраций на платиновых электродах близки по своим значениям. По-видимому, при электролизе целого ряда веществ протекают одинаковые процессы как на катоде, так и на аноде. Действительно, в этих растворах на катоде выделяется водород, а на аноде – кислород. В растворах кислот разряжаются ионы гидроксония :
В растворах щелочей также происходит разряд ионов гидроксония, а не ионов щелочного металла. Однако вследствие незначительной концентрации Н3О + при большой силе тока водород в щелочи выделяется путем непосредственного разложения молекул воды, адсорбированных на электроде :
В растворах щелочей и солей щелочных металлов присутствуют два сорта катионов (например, К + и Н3О + ). При изменении потенциала электрода в отрицательную сторону вначале достигается потенциал разряда ионов гидроксония, который в нейтральном растворе при Р = 1 атм равен всего – 0,4 В, и начинается процесс выделения водорода. Разряд же ионов калия (см. таблицу стандартных электродных потенциалов) может происходить лишь при высоких отрицательных потенциалах (при 
Выделение кислорода на аноде из щелочных растворов может быть следствием единственно возможной электродной реакции – разряда ионов гидроксила :
При электролизе кислот, где концентрация ионов гидроксила очень мала, кислород выделяется в результате непосредственного разложения молекул воды на аноде :
Ещё посмотрите лекцию «Эффективность здравоохранения» по этой теме.
Т.о., при электролизе кислородсодержащих кислот, щелочей и соответствующих солей щелочных и щелочноземельных металлов на электродах протекает единственный процесс разложения воды, т.е. выделение кислорода и водорода. Роль остальных ионов сводится лишь к обеспечению достаточной для электролиза электропроводности. Следует отметить, что близость напряжения разложения при электролизе кислот и щелочей наблюдается только при использовании электродов из определенных металлов (Pt, Pd), на которых мало перенапряжение водорода.
В растворах солей металлов менее электроотрицательных, чем водород, на катоде может выделяться уже металл. При электролизе кислот, не содержащих кислорода, и их солей на аноде, как правило, разряжаются соответствующие анионы.