Что такое пируэтная аритмия
Желудочковая тахикардия типа «пируэт»: диагностика и лечение
Аритмия – это сбой в работе сердца, при котором фиксируется учащение ритма или нарушение проводимости. Нарушение насчитывает несколько видов разного характера. Особой формой считается патология типа пируэт, принадлежащая к желудочковой тахикардии. Бывает приступообразной с самоликвидацией, но в любой момент может перейти в опасную для жизни фибрилляцию желудочков (ФЖ). Чаще всего возникает после перерыва в ритме сердца вследствие брадикардии или длительной компенсаторной паузы после экстрасистолы.
Причины
«Пируэтная» тахикардия, характеризующаяся удлиненным интервалом QT, может быть врожденной или приобретенной в результате действия лекарственных препаратов. Генетические варианты включают:
Наследственные факторы встречаются редко, чаще на возникновение патологии влияет применение лекарств. К ним относят:
Провоцирующими факторами могут быть неполноценное питание или голодание, алкоголизм, эндокринные и сердечно-сосудистые болезни, субарахноидальное кровоизлияние. Имеющиеся генетические патологии, врожденные пороки сердца, сопутствующие соматические дефекты могут вызывать приступ. Выше перечислены наиболее распространенные причины, но каждый случай должен рассматриваться лечащим врачом индивидуально.
Патофизиология: механизм возникновения нарушений
Аритмия «пируэт» развивается за счет продления фазы реполяризации. На электрокардиограмме, кроме удлинения интервала QT, отмечается наличие заметных волн U в покое. Эти изменения ЭКГ отражают длительную реполяризацию с развитием ранней последующей деполяризации.
Патология может приводить к кровоизлияниям в ткань желудочка, вызывая инфаркт миокарда.
В миокарде происходит реполяризация, когда количество положительных ионов (в основном калия) превышает численность ионов натрия и кальция, концентрация которых должна снижаться. Дисфункция калиевого канала вызывает внутриклеточный избыток положительного заряда, что задерживает реполяризацию желудочков. Такое состояние миокарда приводит к возникновению специфического типа рецидивирующей аритмии. Это и есть «пируэтная» тахикардия.
Симптомы
Пациенты часто жалуются на обмороки. Потеря сознания объясняется тем, что сердце сокращается с частотой 200-250 ударов в минуту и не обеспечивает достаточного кровоснабжения головного мозга. Больные, которые остаются в сознании, ощущают сильное сердцебиение. Также может быть боль в груди, чувство нехватки воздуха. Иногда продление интервала QT диагностируется после восстановления ритма. Следует немедленно вызвать «Скорую помощь», а до приезда медиков проводить непрямой массаж сердца.
Если Вы хотите знать о тахикардии все, советуем посмотреть видео ниже по ссылке. Причины, симптомы, диагностика и признаки того, что пора к врачу — обо всем этом за 7 минут. Приятного просмотра!
Диагностика
Диагноз ставят на основании ЭКГ. На пленке хорошо видны волнообразные вершины комплексов QRS. Сами комплексы меняют свою ориентацию вокруг изолинии. На электрокардиограмме вне приступа присутствует увеличенный интервал QT. В норме его значение составляет в пределах 0,44 с. Следует обратить внимание на семейный анамнез: если у кого-то из родственников этот интервал увеличен, то риск развития пируэтной тахикардии возрастает.
Такая тахикардия часто длится недолго и проходит самостоятельно, но иногда приводит к дестабилизации гемодинамики с последующим коллапсом. Также она может перерасти в фибрилляцию желудочков. В таком случае потребуется незамедлительная помощь: непрямой массаж сердца и стимуляция деятельности миокарда разрядом электрического тока.
ЭКГ пациента с гипокалиемией показан на фото ниже: у больного произошел краткий самозавершающийся пароксизм пируэтной тахикардии с эффектом наслоения «R на T».
Клинический случай
Пациентка 56 лет вызвала кардиобригаду СМП. Жалобы: головная боль и дискомфорт в грудной клетке. Данное состояние длится несколько часов до вызова. В анамнезе гипертоническая болезнь, но регулярного лечения больная не проводит. Иногда, при скачках АД выше 200/120, принимает Каптоприл в дозе 25-50 мг. Перед возникшими жалобами употребила около 1 литра вина. Со слов, периодически злоупотребляет спиртными напитками.
На момент осмотра продуктивному контакту доступна. Кожные покровы, дыхание, живот – без особенностей. Сердечная деятельность ритмичная, тоны приглушены. АД 160/90, ЧСС=Ps 90 в минуту. Живот мягкий, безболезненный. Симптом «поколачивания» отрицательный с обеих сторон. Физиологические отправления в норме. ЭКГ больной представлено ниже:
Во время записи пленки пациентка заявила, что стала очень плохо себя чувствовать и кружится голова. На ЭКГ – пируэтная тахикардия, перешедшая тут же в крупноволновую фибрилляцию предсердий.
Лечение
Современная доказательная медицина дает рекомендации по сокращению интервала QT и изменениям процессов реполяризации и деполяризации. Такие протоколы подтверждены экспериментально клиническими испытаниями.
Для восстановления ритма используют препараты:
Магнезия — это препарат выбора при тахикардии типа «пируэт». Рекомендован даже при изначально достаточном уровне магния в плазме. Лекарство в дозе 2 г взрослым и 25-50 мг/кг детям вводится внутривенно в течение одной-двух минут при внезапном приступе, влекущем опасные для жизни нарушения гемодинамики. Исследования in vitro показали, что магний снижает амплитуду ранней деполяризации до подпороговых уровней путем блокирования кальция в организме. Поэтому введение препарата должно сопровождаться коррекцией гипокалиемии до концентрации К в сыворотке более 4,5 ммоль/л. Применяется внутривенное вливание поляризующей смеси, содержащей магний и калий.
Эсмолол – это кардиоселективный β-адреноблокатор, вводится внутривенно. Особенность препарата – быстро действует и стремительно покидает организм. Пропранолол обладает аналогичными свойствами, но его эффект более стойкий и не проходит за короткое время. Поэтому в клинической практике чаще используют Эсмолол.
Лидокаин – это блокатор натриевых каналов. Нагрузочная доза – 2 мг/кг, далее вводят по необходимости. Считается, что препарат косвенно подавляет развитие аритмии путем сокращения продолжительности потенциала действия. Тем не менее исследования показывают успех применения лекарства только в 50% зарегистрированных случаев.
Последующая терапия и профилактика
Последующая терапия направлена на профилактику возобновления фибрилляции желудочков. Ведь итог может быть без своевременной помощи летальным. Международные организации здоровья сердца рекомендуют регулярный прием β-адреноблокаторов. Результативность их применения составляет 68–90 %. Также хороший эффект дают блокаторы натриевых каналов, например, Мекситилен.
При сохранении синкопальных состояний на фоне терапии β-блокаторами показана имплантация кардиостимулятора-дефибриллятора. Необходимо помнить, что эта операция не означает отмену медикаментозного лечения.
Основной совет пациентам и их родственникам: следует знать список лекарств, удлиняющих интервал QT, и избегать их приема.
Крайняя мера лечения – это левосторонняя симпатэктомия на уровне шейно-грудного отдела.
Для подготовки материала использовались следующие источники информации.
Что такое пируэтная аритмия
1) Московский государственный медико-стоматологический университет им. А.И. Евдокимова, Москва, Россия; 2) Российский национальный исследовательский медицинский университет им. Н.И. Пирогова – ОСП «Российский геронтологический научно-клинический центр», Москва, Россия
Полиморфная желудочковая тахикардия (тахикардия типа «пируэт», Torsades de Pointes, TdP), обладающая потенциальной способностью к развитию внезапной сердечной смерти, представляет реальную угрозу для жизни человека. Известно, что возникновение TdP тесно ассоциировано с удлинением интервала QT. Лекарственная обусловленность – одна из наиболее частых причин развития приобретенных удлинений интервала QT и TdP. Абсолютное большинство существующих в настоящее время групп фармакологических препаратов имеет представителей, обладающих способностью к развитию удлинения интервала QT и TdP. Наиболее известными и часто используемыми из них являются антиаритмики (IA-, IC- и III классов), антипсихотики, антидепрессанты, антибиотики (макролиды и фторхинолоны), антигистаминные средства, противоопухолевые и противогрибковые препараты, прокинетики, гиполипидемические средства и диуретики, исключая калийсберегающие. К факторам риска развития лекарственно-индуцированной TdP относят пожилой возраст, брадикардию, одновременное применение >1 препарата, способствующее развитию удлинения интервала QTc/TdP, повышение концентрации в плазме крови QT-удлиняющих лекарственных средств из-за лекарственных взаимодействий или неадекватной коррекции дозы при дисфункции почек/печени, женский пол, сердечную недостаточность со сниженной фракцией выброса, лекарственно-индуцированную TdP в анамнезе, гипокальциемию, гипокалиемию, гипомагниемию, увеличение интервала OTc на >60 мс по сравнению с исходным показателем, интервал QTc >500 мс,
быструю внутривенную инфузию лекарственных средств, удлиняющих QTc, сепсис, а также само удлинение интервала QTc, зафиксированное на электрокардиограмме. Оценка потенциальной способности препарата, назначаемого пациенту, к развитию TdP, выявление и коррекция факторов риска, повышающих вероятность развития лекарственно-обусловленного TdP, изучение исходной и последующее мониторирование электрокардиограммы и осведомленность пациента, принимающего препарат с TdP-развивающей способностью, о возможности и особенностях проявления TdP являются важнейшими профилактическими мероприятиями, способными предотвращать аритмогенные эффекты лекарственных средств.
Для цитирования: Остроумова О.Д., Голобородова И.В. Лекарственно-индуцированная тахикардия типа «пируэт». Фарматека. 2019;26(9):11–20. DOI: https://dx.doi.org/10.18565/pharmateca.2019.9.11-20
Введение
Полиморфная желудочковая тахикардия, или тахикардии типа «пируэт» (Torsades de Pointes, TdP), являясь потенциально жизнеугрожающей тахиаритмией, способной приводить к развитию внезапной сердечной смерти (ВСС), тесно ассоциирована с удлинением интервала QT [1, 2]. Известны две большие этиологические группы, обусловливающие развитие удлинения интервала QT и TdР: врожденные и приобретенные [3]. Среди приобретенных причин наиболее часто встречается лекарственно-обусловленное развитие удлинения интервала QT и TdР [4].
Распространенность
К настоящему времени известно, что препараты, способствующие пролонгации интервала QT и развитию TdР, имеются практически во всех существующих группах лекарственных средств (ЛС), составляя от 2 до 3% от общего числа используемых препаратов [5]. При этом распространенность лекарственно-индуцированного удлинения интервала QT и TdР в общей популяции остается неизвестной и требует дальнейшего изучения. В литературе имеются лишь данные, касающиеся распространенности лекарственно-индуцированного удлинения интервала QT и развития TdР в отдельных странах. Так, исследование Управления по контролю над лекарственными средствами и продуктами медицинского назначения Швеции (Swedish Medical Products Agency, MPA; Swedish) [6] предприняло попытку определить общее число случаев развития лекарственно-индуцированных желудочковых аритмий, наблюдая в течение 28 дней за 4,2 млн пациентов в 32 лечебных учреждениях. Были зафиксированы все эпизоды желудочковых аритмий, обусловленных ЛС и выявленных при поступлении, а также при мониторировании ЭКГ в процессе лечения. Полученный показатель составил 3,3 случая на 1 млн пациентов в течение 28-дневного срока наблюдения, или 4 случая на 100 тыс. человек в год. Другое шведское исследование, выполненное С. Astrom-Lilja et al. [7], проанализировав данные системы сообщений о побочных эффектах ЛС с 1991 по 2006 г., выявило, что из 61788 зафиксированных случаев, 101 был лекарственно-индуцированной TdР. Исследование G. Sarganas et al. [8] показало, что в 2014 г. в Берлине регистрировалось 2,5 случая лекарственно-индуцированного удлинения QT/TdР на 1 млн мужского населения города и 4 на 1 млн женского. А в популяционном исследовании на юго-западе Франции показатель развития лекарственно-индуцированной TdР оценивался в 5–7% от всех случаев желудочковых тахиаритмий или ВСС [9].
Имеются данные о том, что удлинение интервала QT наиболее распространено среди госпитализированных больных, особенно среди пациентов отделений интенсивной терапии [10], составив от 28 до 52% [11, 12]. Случаи развития TdP среди госпитализированных пациентов изучены гораздо меньше. D. Pickhamm et al. [13], наблюдавшие пациентов отделений интенсивной терапии в течение 2 месяцев, сообщают об 1 случае на 154 пациента (0,6%), что составило 1 из 16 случаев остановки сердечной деятельности в этих отделениях.
Лекарственные средства, прием которых ассоциирован с развитием TdР
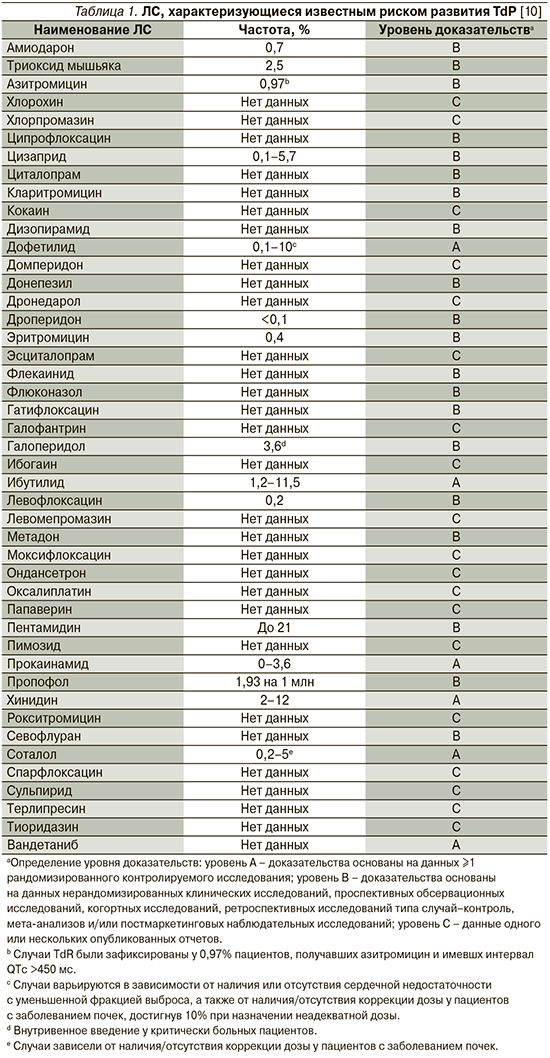
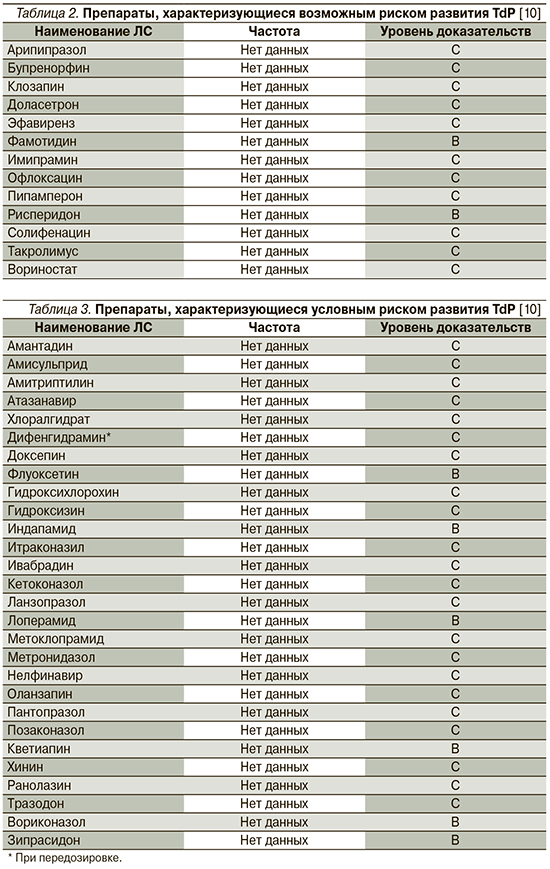
К наиболее известным и часто используемым как в амбулаторной, так и в стационарной практике группам ЛС, имеющим представителей, способствующих развитию удлинения интервала QT/TdР, относятся антиаритмики (IA-, IC- и III классов), антипсихотики, антидепрессанты, антибактериальные препараты (макролиды и фторхинолоны), антигистаминные средства, противоопухолевые, противогрибковые препараты, прокинетики, гиполипидемические средства, диуретики (кроме калий-сберегающих). Перечень ЛС, способствующих развитию TdP, постоянно обновляется, а усилия специалистов Аризонского университета (Arizona Center for Education and Research on Therapeutics, AzCERT), разработавших веб-сайт CredibleMeds.org, позволяют следить за актуальным списком препаратов, ассоциированных с развитием TdP. Все препараты, представленные на сайте, подразделены на группы в зависимости от того, ассоциированы ли они с известным, возможным или условным рисками развития удлинения QT/TdР. ЛС с известным риском – это ЛС, в отношении которых имеются существенные доказательства, подтверждающие их QT-удлиняющее действие и четкую связь с риском развития TdР, даже когда препараты принимаются четко в соответствии с инструкцией, указанной в официальной маркировке. Список ЛС с возможным риском включает ЛС, для которых имеются существенные доказательства, согласно которым они могут стать причиной удлинения интервала QT, но в настоящее время нет достаточных доказательств, что эти ЛС при использовании, согласно официальной маркировке, ассоциированы с риском возникновения TdР. Наконец, для ЛС с условным риском имеются существенные доказательства того, что их прием ассоциирован с риском TdР, но только при определенных условиях (например, передозировка ЛС, гипокалиемия, врожденное удлинение QT или в случае лекарственного взаимодействия). Перечни препаратов с известным, вероятным и возможным рисками развития TdР, а также число случаев развития TdP, ассоциированных с приемом того или иного препарата, представлены в табл. 1–3.
Известно, что использование отдельных антипсихотиков ассоциировано с повышенным риском ВСС в результате развития TdP [10]. Так, в популяционном исследовании типа случай–контроль S.M. Straus et al. [14] изучили 150 медицинских карт и обнаружили, что использование антипсихотических препаратов было ассоциировано со значительным увеличением риска ВСС (отношение шансов [ОШ] – 3,3; 95% доверительный интервал [ДИ] – 1,8–6,2), причем риск был наивысшим среди пациентов, получавших препараты бутирофенона (галоперидол).
О повышенном риске ВСС сообщили W.A. Ray et al. [15] по данным ретроспективного когортного исследования, причем риск был ассоциирован с использованием как типичных, так и атипичных антипсихотических препаратов, аналогичные результаты были получены и в других исследованиях [16, 17], а C.S. Wu et al. [18] обнаружили, что прием антипсихотических препаратов с наибольшей способностью к ингибированию IKr ассоциирован с самым высоким риском желудочковых аритмий и/или ВСС. Мета-анализ F. Salvo et al. [19] показал, что разные антипсихотические средства были ассоциированы с различным уровнем риска развития ВВС и распределились следующим образом: тиоридазин>клозапин>риссперидон>галоперидол>оланзапин>кветиапин.
Прием макролидных антибиотиков также ассоциирован с повышенным риском ВСС. J.Y. Cheng et al. [20] провели мета-анализ 33 исследований, включивших почти 21 млн пациентов, оценивавших связь между приемом макролидных антибиотиков и сердечно-сосудистым риском. Было выявлено, что больные, принимавшие макролиды, имели повышенный риск ВВС или желудочковых тахиаритмий (2,42; 95% ДИ – 1,61–3,63), ВВС (2,52; 95% ДИ – 1,91–3,31) и сердечно-сосудистой смерти (1,31; 95% ДИ – 1,06–1,62) по сравнению с лицами, не принимавшими макролидные антибиотики.
В исследовании W.A. Ray et al. [21] было обнаружено, что в группе пациентов, получавших эритромицин, скорректированный показатель ВСС был в 2 раза выше, чем у лиц, не применявших данный препарат. Кроме того, скорректированная частота ВСС была в 5 раз выше среди пациентов, которые помимо эритромицина одновременно использовали и препараты, подавляющие активность ферментов системы цитохрома-P450. Аналогичное исследование пациентов, принимавших азитромицин, выявило у последних повышенный риск сердечно-сосудистой смерти (отношение рисков [ОР] – 2,88; 95% ДИ – 1,79–4,63; p 1 ЛС, способствующих развитию удлинения интервала QTc/TdP, повышение концентрации в плазме крови QT-удлиняющих ЛС вследствие лекарственного взаимодействия или неадекватной коррекции дозы при дисфункции почек/печени, женский пол, СН со сниженной фракцией выброса (ФВ), лекарственно-индуцированная TdP в анамнезе, гипокальциемия, гипокалиемия, гипомагниемия, увеличение интервала QTc на >60 мс по сравнению с исходным показателем, интервал QTс >500 мс, быстрая внутривенная инфузия ЛС, удлиняющих QTc, сепсис, наконец, самоудлинение интервала QTc на ЭКГ также определяется как фактор риска развития TdP.
В литературе представлено множество исследований, доказывающих заметное влияние факторов риска на вероятность развития TdP. Так, риск TdP заметно возрастает, когда интервал QTc превышает 500 мс, а при продолжительности интервала QTc 60 мс по сравнению с исходным значением [28]. Возвращаясь к исследованию [25], можно обнаружить, что из 249 пациентов с развившейся TdP, индуцированной ЛС, более двух третей были женщины, 41% имели заболевания сердечно-сосудистой системы (инфаркт миокарда, СН, кардиомиопатия), 28% – гипокалиемию, 19% – передозировку ЛС или отсутствие коррекции дозы при дисфункции печени/почек, 18% – отягощенный семейный анамнез по синдрому удлиненного интервала QT, лекарственно-индуцированный TdP/удлинение интервала QT в анамнезе, 35% – лекарственные взаимодействия.
Причины повышенного риска лекарственно-индуцированной TdP у лиц с наличием тех или иных факторов риска продолжают изучаться. Предполагается, что у женщин повышенный риск развития TdP обусловлен проаритмогенным эффектом эстрогена, в то время как мужчины защищены антиаритмогенными эффектами тестостерона [30, 31]. Известно, что базовая продолжительность интервала OTc у женщин больше, чем у мужчин, что проявляется именно в период полового созревания [32, 33]. В исследовании R.R. Makkar et al. [34] из 332 пациентов с TdP, ассоциированной с приемом антиаритмических ЛС, 70% были женщинами. Другие исследования подтвердили предрасположенность женщин к развитию TdP, связанной с использованием азимилида, дофетилида, эритромицина, ибутилида, хинидина, соталола и терфенадина [35–38].
СН со сниженной ФВ является одним из основных факторов риска развития лекарственно-индуцированной TdP [10]. Механизмы, лежащие в основе повышенного риска развития TdP у этой группы пациентов, продолжают изучаться. Предполагается, что у лиц с СН со сниженной ФВ происходит подавление активности калиевых каналов, что способствует удлинению желудочковой реполяризации [10].
Лекарственные взаимодействия – важный фактор риска развития лекарственно-индуцированного TdP [10].
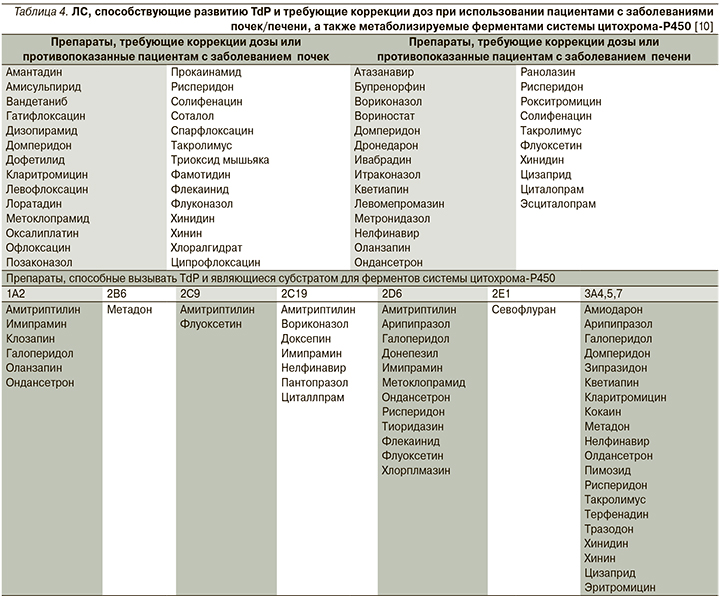
В литературе описаны многочисленные случаи TdP, развившегося в результате повышения концентрации в плазме ЛС, являвшегося субстратом для системы цитохрома-Р450, при использовании в комбинации с препаратом, ингибирующим ее активность. Так, база данных FDA США располагает сведениями о 25 случаях развития TdP, связанных с терфенадином, при этом 9 пациентов получали сопутствующую терапию кетоконазолом или итраконазолом, которые, как известно, ингибируют метаболизм терфенадина [38]. ЛС, связанные с риском развития TdP, являющиеся субстратом для системы цитохрома-P450, перечислены в табл. 4.
Считается, что использование комбинаций препаратов, пролонгирующих интервал QT, может увеличить риск развития TdP, хотя результаты исследований, посвященных данному вопросу, весьма противоречивы [39–42]. Известно, что одновременное применение нескольких препаратов, продлевающих интервал QТ, является относительно распространенным явлением. Так, ретроспективное когортное исследование L.H. Curtis et al. [39] показало, что из 1,1 млн пациентов с выписанным рецептом на QT-пролонгирующий препарат 9,4% получили рецепт на второй препарат, также продлевающий интервал QT или ухудшающий метаболизм QT-удлиняющего ЛС. А в исследовании K.Y. Tay et al. [40] обнаружено, что 15% рецептов, выписанных в отделении неотложной помощи, включили ЛС, удлиняющие интервал QTс, при этом около 10% из них включили ≥2 препаратов, увеличивающих продолжительность интервала QTс.
J.E. Tisdale et al. [29], проанализировав данные пациентов отделений интенсивной терапии, получавших ≥2 ЛС, удлиняющих интервал QTc, установили, что ОШ развития TdP у таких пациентов по сравнению с лицами, не получавшими терапии QT-удлиняющим ЛС, было равно 2,6 (95% ДИ – 1,9–5,6; р=0,02). Однако данных, свидетельствующих о том, что использование комбинации препаратов, удлиняющих интервал QTс или увеличивающих риск развития TdP, сопровождалось более высоким риском развития удлинения QTс/TdP по сравнению с монотерапией, получить не удалось [10]. В обзоре литературы [41] было показано, что назначение нескольких препаратов антипсихотического спектра не сопровождалось удлинением интервала QTc. В популяционном когортном исследовании M.N. Niemeijer et al. [42], в котором участвовали 13 тыс. пациентов, обнаружено, что добавление к первоначальной терапии второго или третьего препарата, продлевающего интервал QTc, оказало очень небольшое дополнительное удлиняющее влияние на него.
Опубликованные в литературе данные свидетельствуют о том, что у части пациентов с лекарственно-индуцированной TdP имелась генетическая предрасположенность [43, 44]. К настоящему времени выявлено 15 специфических генетических дефектов, лежащих в основе синдрома врожденного удлинения интервала QT [43]. Мутации генов, которые предрасполагают к развитию врожденного синдрома удлинения интервала QT, были обнаружены у 10–15% пациентов, перенесших TdP, индуцированную ЛС [44].
Профилактика лекарственно-обусловленных TdР
Риск развития лекарственно-обусловленной TdP может быть предупрежден путем выявления и минимизации влияния факторов риска, ассоциированных с развитием TdP [45]. При этом необходимо [10]:
1. Trinkley K.E., Page II R.L., Lien H., et al. QT interval prolongation and the risk of torsades de pointes: essentials for clinicians. Curr Med Res Opin. 2013;29:1719–26. Doi: 10.1185/03007995.2013.840568.
2. Schwartz P.J., Woosley R.L. Predicting the unpredictable: drug-induced QT prolongation and torsades de pointes. J Am Coll Cardiol. 2016;67:1639–50. Doi: 10.1016/j.jacc.2015.12.063.
3. Остроумова О.Д. Удлинение интервала QT. РМЖ. 2001;18:750–54.
4. Woosley R.L., Heise C.W., Gallo T., et al. CredibleMeds. Avaiable from URL: https://crediblemeds.org/
5. Yap Y.G., Camm A.J. Drug induced QT prolongation and torsades de pointes. Heart. 2003;89(11):1363–13. Doi: 10.1136/heart.89.11.1363.
6. Darpo B. Spectrum of drugs prolonging QT interval and the incidence of torsades de pointes. Eur Heart J. 2001;3(K):K70–80. Doi: 10.1016/S1520-765X.
7. Astrom-Lilja C., Odeberg J.M., Ekman E., et al. Drug-induced torsades de pointes: a review of the Swedish pharmacovigilance data-base. Pharmacoepidemiol Drug Saf. 2008;17:587–92. Doi: 10.1002/pds.1607.
8. Sarganas G., Garbe E., Klimpel A., et al. Epidemiology of symptomatic drug-induced long QT syndrome and torsade de pointes in Germany. Europace. 2014;6:101–8. Doi:10.1093/europace/eut214.
9. Molokhia M., Pathak A., Lapeyre-Mestre M., et al. Case ascertainment and estimated incidence of drug-induced long-QT syndrome: study in Southwest France. Br J Clin Pharmacol. 2008;66:386–95. Doi: 10.1111/j.1365-2125.2008.03229.x.
10. Tisdale J.E., Miller D.A. Drug-induced Diseases: Prevention, Detection, and Management. USA: American Society of Health-System Pharmacists. 2005. 870 p.
11. Tisdale J.E., Wroblewski H.A., Overholser B.R., et al. Prevalence of QT-interval prolongation in patients admitted to cardiac care units and frequency of subsequent administration of QT-interval prolonging drugs. Drug Saf. 2012;35:459–70. Doi: 10.2165/11598160-000000000-00000.
12. Hoogstraaten E., Rijkenberg S., van der Voort P.H.J. Corrected QT-interval prolongation and variability in intensive care patients. J Crit Care. 2014;29:835–39. Doi: 10.1016/j.jcrc.2014.05.005.
13. Pickham D., Helfenbein E., Shinn J.A., et al. High prevalence of corrected QT interval prolongation in acutely ill patients is associated with mortality: results of the QT in Practice (QTIP) study. Crit Care Med. 2012;40:394–99. Doi: 10.1097/CCM.0b013e318232db4a.
14. Straus S.M., Bleumink G.S., Dieleman J.P., et al. Antipsychotics and the risk of sudden cardiac death. Arch Intern Med. 2004;164:1293–97. Doi: 10.1001 / archinte.164.12.1293.
15. Ray W.A., Chung C.P., Murray K.T., et al. Atypical antipsychotic drugs and the risk of sudden cardiac death. N Engl J Med. 2009;360:225–35. Doi: 10.1056/NEJMoa0806994.
16. Jones M.E., Campbell G., Patel D., et al. Risk of mortality (including sudden cardiac death) and major cardiovascular events in users of olanzapine and other antipsychotics: a study with the General Practice Research Database. Cardiovasc Psychiatry Neurol. 2013;2013:647476. Doi: 10.1155/2013/647476.
17. Weeke P., Jensen A., Folke F., et al. Antipsychotics and associated risk of out-of-hospital cardiac arrest. Clin Pharmacol Ther. 2014;96:490–97. Doi: 10.1038/clpt.2011.368.
18. Wu C.S., Tsai Y.T., Tsai H.J. Antipsychotic drugs and the risk of ventricular arrhythmia and/or sudden cardiac death: a nation-wide case-crossover study. J Am Heart Assoc. 2015;4:e001568. Doi: 10.1161/JAHA.114.001568.
19. Salvo F., Pariente A., Shakir S., et al. Sudden cardiac and sudden unexected death related to antipsychotics: a meta-analysis of observational studies. Clin Pharmacol Ther. 2016;99:306–14. Doi: 10.1002/cpt.250.
20. Cheng J.Y., Nie X.Y., Chen X.M., et al. The role of macrolide antibiotics in increasing cardiovascular risk. J Am Coll Cardiol. 2015;66:2173–84. Doi: 10.1016/j.jacc.2015.09.029.
21. Ray W.A., Murray K.T., Meredith S., et al. Oral erythromycin and the risk of sudden death from cardiac causes. N Engl J Med. 2004;351:1089–96. Doi:10.1056 / NEJMoa040582.
22. Rao G.A., Mann J.R., Shoaibi A., et al. Azithromycin and levofloxacin use and increased risk of cardiac arrhythmia and death. Am Fam Med. 2014;12:121–27. Doi: 10.1370 / afm.1601.
23. Schembri S., Williamson P.A., Short P.M., et al. Cardiovascular events after clarithromycin use in lower respiratory tract infections: analysis of two prospective cohort studies. BMJ. 2013;346:f1235. Doi: 10.1136/bmj.f1235.
24. Alkan Y., Haefeli W.E., Burhenne J., et al. Voriconazole-induced QT interval prolongation and ventricular tachycardia: a nonconcentration-dependent adverse effect. Clin Infect Dis. 2004;39:e49–52. Doi: 10.1086/423275.
25. Zeltser D., Justo D., Halkin A., et al. Torsade de pointes due to noncardiac drugs: most patients have easily identifiable risk factors. Medicine. 2003;82:282–90. Doi:0.1097/01.md.0000085057.63483.9b.
26. Moss A.J., Schwartz P.J., Crampton R.S., et al. The long QT syndrome. Prospective longitudinal study of 328 families. Circulation. 1991;84:1136–44.
27. US Department of Health and Human Services (DHHS), Food and Drug Administration, Center for Drug Evaluation and Research *CDER), Center for Biologics Evaluation and Research (CBER). Guidance for industry. E14 clinical evaluation of QT/QTc interval prolongation and proarrhythmic potential for nonantiarrhythmic drugs. Rockville, MD: DHHS. 2005.
28. Pratt C.M., Al-Khalidi H.R., Brum J.M., et al. Cumulative experience of azimilide-associated torsades de pointes ventricular tachycardia in the 19 clinical studies comprising the azimilide database. J Am Coll Cardiol. 2006;48:471–77.
29. Tisdale J.E., Jaynes H.A., Kingery J.R., et al. Development and validation of a risk score to predict QT interval prolongation in hospitalized patients. Circ Cardiovasc Qual Outcomes. 2013;6:479–87. Doi:10.1161/CIRCOUTCOMES.113.000152.
31. Hreiche R., Morissette P., Turgeon J. Drug-induced long QT syndrome in women: review of current evidence and remaining gaps. Gend Med. 2008;5:124–35. Doi: 10.1016/j.genm.2008.05.005.
32. Ebert S.N., Liu X-K, Woosley R.L. Female gender as a risk factor for drug-induced cardiac arrhythmias: evaluation of clinical and experimental evidence. J Wornens Health. 1998;7:547–57. Doi: 10.1089/jwh.1998.7.547.
34. Makkar R.R., Fromm B.S., Steinman R.T., et al. Female gender as a risk factor for torsades de pointes associated with cardiovascular drugs. JAMA. 1993;270:2590–97. Doi:10.1001/jama.1993.03510210076031.
36. Gowda R.M., Khan I.A., Punukollu G., et al. Female preponderance in ibutilide-induced torsade de pointes. Int J Cardiol. 2004;95:219–22. Doi:10.1016/j.ijcard.2003.04.034.
37. Roden D., Woosley R., Primm R. Incidence and clinical features of the quinidine-associated long-QT syndrome: implications for patient care. Am Heart J. 1986;111:1088–93. Doi:10.1016/0002-8703(86)90010-4.
38. Woosley R.L., Chen Y., Freiman J.P., et al. Mechanisms of the cardiotoxic actions of terfenadine. JAMA. 1993;269:1532–36. Doi: 10.1001 / jama.1993.03500120070028.
39. Curtis L.H., Ostbye T., Sendersky V., et al. Prescription of QT-prolonging drugs in a cohort of about 5 million outpatients. Am J Med. 2003;114:135–41. Doi: 10.1016/S0002-9343 (02)01455-9.
40. Tay K.Y., Ewald M.B., Bourgeois F.T. Use of QT-prolonging medications in US emergency departments, 1995-2009. Pharmacoepidemiol Drug Saf. 2014;23:9–17. Doi: 10.1002/pds.3455.
41. Takeuchi H., Suzuki T., Remington G., et al. Antipsychotic polypharmacy and corrected QT interval: a systematic review. Can J Psychiatr. 2015;60:215–22. Doi: 10.1177/070674371506000503.
42. Niemeijer M.N., van den Berg M.E., Franco O.H.,et al. Drugs and ventricular repolarization in a general population: the Rotterdam Study. Pharmacoepidemiol Drug Saf. 2015;24:1036–41. Doi: 10.1016/j.hrthm.2015.07.011.
43. Nakano Y., Shimizu W. Genetics of long-QT syndrome. J Hum Genet. 2016;61:51–5. Doi: 10.1038/jhg.2015.74.
44. Yang P., Kanki H., Drolet B., et al. Allelic variants in long-QT disease genes in patients with drug-associated torsades de pointes. Circulation. 2002;105:1943–48. Doi:10.1161/01.CIR.0000014448.19052.4C.
45. Остроумова О.Д., Голобородова И.В. Лекарственно-индуцированное удлинение интервала QT: распространенность, факторы риска, лечение и профилактика. Consilium medicum. 2019;5:62–67.