Что такое плазмиды бактерий
Что такое плазмиды бактерий
Микробиология
Предметом изучения микробиологии
Плазмиды
Плазмиды бактерий представляют собой двунитевые молекулы ДНК размером от 10^6 до 10^8 Д, несущие от 40 до 50 генов. Количество плазмид в бактериальной клетке может быть от 1 до 200. Выделяют плазмиды, находящиеся в виде отдельной замкнутой молекулы ДНК (эписомы) и встроенные в хромосому бактерии (интегрированные плазмиды). Плазмиды выполняют регуляторные и кодирующие функции. Первые направлены на компенсацию метаболических дефектов, вторые вносят в бактерию информацию о новых признаках. Как составляющая часть генетического материала бактерии плазмиды играют важную роль в ее жизнедеятельности, детерминируя такие характеристики, как способность продуцировать экзотоксины, ферменты или бактериоцины, устойчивость к лекарственным препаратам и т.д.
Удвоение ДНК некоторых плазмид индуцирует деление бактерий, т.е. увеличивает их «плодовитость». Такие плазмиды обозначают как F-плазмиды или F-факторы (от англ. fertility – плодовитость). Плазмиды, детерминирующие устойчивость к лекарственным препаратам, называются R-плазмидами или R-факторами (от англ. resistance – устойчивость). Многие R-плазмиды являются трансмиссивными и, распространяясь в популяции бактерий, делают бактерию недоступной к воздействию бактериальных препаратов. Плазмиды патогенности контролируют вирулентные свойства микроорганизмов, детерминируя синтез факторов патогенности. Так, например, Ent-плазмида определяет синтез энтеротоксина.
Конъюгативные (трансмиссивные) плазмиды переносятся от бактерии к бактерии внутри вида или между представителями близкородственных видов в процессе конъюгации. Чаще всего конъюгативными плазмидами являются F- или R-плазмиды. Подобные плазмиды относительно крупные (25-150 млн Д) и часто выявляются у грамотрицательных палочек.
Неконъюгативные плазмиды обычно имеют небольшие размеры и характерны для грамположительных кокков, но встречаются также у некоторых грамотрицательных микроорганизмов (например, у Haemophilus influenzae, Neisseria gonorrhoeae). Мелкие плазмиды могут присутствовать в больших количествах (более 30 на клетку), так как только наличие такого количества обеспечивает их распределение в потомстве во время клеточного деления.
Что такое плазмиды бактерий
Внехромосомные факторы наследственности бактерий представлены плазмидами, вставочными последовательностями и транспозонами. Все они образованы молекулами ДНК, различающимися между собой по молекулярной массе, кодирующей ёмкости, способности к автономному реплицированию и др.
Плазмиды бактерии. Виды плазмид. Функции плазмид бактерий.
Плазмиды — фрагменты ДНК с молекулярной массой порядка 10 6
10 8 D, несущие от 40 до 50 генов. Выделяют автономные (не связанные с хромосомой бактерии) и интегрированные (встроенные в хромосому) плазмиды.
• Автономные плазмиды существуют в цитоплазме бактерий и способны самостоятельно репродуцироваться; в клетке может присутствовать несколько их копий.
• Интегрированные плазмиды репродуцируются одновременно с бактериальной хромосомой. Интеграция плазмид происходит при наличии гомологичных последовательностей ДНК, при которых возможна рекомбинация хромосомной и плазмидной ДНК (что сближает их с профагами).
• Плазмиды также подразделяют на трансмиссивные (например, F- или R-плазмиды), способные передаваться посредством конъюгации, и нетрансмиссивные.
Плазмиды выполняют регуляторные или кодирующие функции. Регуляторные плазмиды участвуют в компенсировании тех или иных дефектов метаболизма бактериальной клетки посредством встраивания в повреждённый геном и восстановления его функций. Кодирующие плазмиды привносят в бактериальную клетку новую генетическую информацию, кодирующую новые, необычные свойства (например, устойчивость к антибиотикам).
В соответствии с определёнными признаками, кодируемыми плазмидными генами, выделяют следующие группы плазмид:
F-плазмиды. При изучении процесса скрещивания бактерий оказалось, что способность клетки быть донором генетического материала связана с присутствием особого F-фактора [от англ. fertility, плодовитость]. F-плазмиды контролируют синтез F-пилей, способствующих спариванию бактерий-доноров (F+) с бактериями-реципиентами (F»). В связи с этим можно указать, что сам термин «плазмида» был предложен для обозначения «полового» фактора бактерий (Джошуа Лёдерберг, 1952). F-плазмиды могут быть автономными и интегрированными. Встроенная в хромосому F-плазмида обеспечивает высокую частоту рекомбинации бактерий данного типа, поэтому их также обозначают как Hfr-плазмиды от англ. high frequency of recombinations, высокая частота рекомбинаций].
R-плазмиды [от англ. resistance, устойчивость] кодируют устойчивость к лекарственным препаратам (например, к антибиотикам и сульфаниламидам, хотя некоторые детерминанты устойчивости правильнее рассматривать как связанные с транспозонами [см. ниже]), а также к тяжёлым металлам. R-плазмиды включают все гены, ответственные за перенос факторов устойчивости из клетки в клетку.
Неконъюгативные плазмиды обычно характерны для грамположительных кокков, но встречаются также у некоторых грамотрицательных микроорганизмов (например, у Haemophilus influenzae, Neisseria gonorrhoeae). Они обычно имеют небольшие размеры (молекулярная масса примерно 1 — 10*10 6 D). Обнаруживают большое количество мелких плазмид (более 30 на клетку), так как только наличие такого количества обеспечивает их распределение в потомстве при клеточном делении. Неконъюгативные плазмиды могут быть также перенесены из клетки в клетку при наличии в бактерии одновременно конъюгативных и неконъюгативных плазмид. При конъюгации донор может передать и неконъюгативные плазмиды за счёт связывания генетического материала последних с конъюгативной плазмидой.
Плазмиды бактериоциногении кодируют синтез бактериоцинов — белковых продуктов, вызывающих гибель бактерий того же или близких видов. Многие плазмиды, кодирующие образование бактериоцинов, также содержат набор генов, ответственных за конъюгацию и перенос плазмид. Подобные плазмиды относительно крупные (молекулярная масса 25-150*10 6 D), их довольно часто выявляют у грамотрицательных палочек. Большие плазмиды обычно присутствуют в количестве 1
2 копий на клетку. Их репликация тесно связана с репликацией бактериальной хромосомы.
Плазмиды патогенности контролируют вирулентные свойства многих видов, особенно энтеробактерий. В частности F-, R-плазмиды и плазмиды бактериоциногении включают tox+-транспозоны (мигрирующий генетический элемент, см. ниже), кодирующие токсинообразова-ние. Нередко tox+-транспозоны кодируют синтез интактных протоксинов (например, дифтерийного или ботулинического), активируемых клеточными протеазами, образование которых контролируют гены бактериальных хромосом.
Скрытые плазмиды. Криптические (скрытые) плазмиды не содержат генов, которые можно было бы обнаружить по их фенотипическому проявлению.
Плазмиды биодеградации. Обнаружен также ряд плазмид, кодирующих ферменты деградации природных (мочевина, углеводы) и неприродных (толуол, камфора, нафталин) соединений, необходимых для использования в качестве источников углерода или энергии, что обеспечивает им селективные преимущества перед другими бактериями данного вида. Патогенным бактериям подобные плазмиды придают преимущества перед представителями аутомикрофлоры.
— Вернуться в оглавление раздела «Микробиология.»
Плазмида – определение, типы и функции
Определение плазмиды
Плазмида – это маленький круглый ДНК, отличающийся от хромосомной ДНК, которая является генетическим материалом, обнаруженным в организм Хромосомы. Он реплицируется независимо от хромосомной ДНК. Плазмиды в основном находятся в бактерии, но они также могут быть найдены в архее и многоклеточный организмы. Плазмиды обычно несут по крайней мере один ген и многие из генов, которые несут плазмиды, полезны для их организмов-хозяев. Хотя они имеют отдельные гены от своих хозяев, они не считаются независимой жизнью.
Функции плазмид
Плазмиды имеют много разных функций. Они могут содержать гены, которые увеличивают выживание организма, убивая других организмов или защищая хозяина клетка производя токсины. Некоторые плазмиды облегчают процесс репликации в бактериях. Поскольку плазмиды настолько малы, они обычно содержат только несколько генов со специфической функцией (в отличие от большого количества некодирующей ДНК). Несколько плазмид могут сосуществовать в одной и той же клетке, каждая с различными функциями. Функции более подробно описаны в разделе «Конкретные типы плазмид» ниже.
Общие типы плазмид
Конъюгированные и неконъюгированные
Существует много способов классификации плазмид от общих до специфических. Один из способов состоит в том, чтобы сгруппировать их как сопряженные или не сопряженные. Бактерии размножаются путем полового конъюгирования, которое представляет собой передачу генетического материала из одной бактериальной клетки в другую, либо через прямой контакт, либо через мост между двумя клетками. Некоторые плазмиды содержат гены, называемые переносящими генами, которые облегчают начало конъюгации. Неконъюгативные плазмиды не могут начать процесс конъюгации, и они могут быть переданы только посредством полового конъюгации с помощью конъюгативных плазмид.
несовместимость
Другая классификация плазмид относится к группе несовместимости. В бактерии разные плазмиды могут сосуществовать, только если они совместимы друг с другом. Несовместимая плазмида будет удалена из бактериальной клетки. Плазмиды несовместимы, если они имеют одинаковую стратегию размножения в клетке; это позволяет плазмидам заселять определенную территорию внутри нее без вмешательства других плазмид.
Конкретные типы плазмид
Существует пять основных типов плазмид: F-плазмиды фертильности, плазмиды устойчивости, плазмиды вирулентности, деградирующие плазмиды и плазмиды Col.
Плодородие F-плазмиды
Плазмиды фертильности, также известные как F-плазмиды, содержат переносящие гены, которые позволяют переносить гены от одной бактерии к другой через конъюгацию. Они составляют широкую категорию конъюгативных плазмид. F-плазмиды представляют собой эпизоды, которые являются плазмидами, которые могут быть встроены в хромосомную ДНК. Бактерии, которые имеют F-плазмиду, известны как F-положительные (F +), а бактерии без нее – F-отрицательные (F–). Когда бактерия F + конъюгирует с бактерией F–, образуются две бактерии F +. В каждой бактерии может быть только одна F-плазмида.
Плазмиды сопротивления
Резистентные или R-плазмиды содержат гены, которые помогают бактериальной клетке защищаться от факторов окружающей среды, таких как яды или антибиотики. Некоторые резистентные плазмиды могут переносить себя посредством конъюгации. Когда это происходит, штамм бактерий может стать устойчивым к антибиотикам. В последнее время тип бактерии, вызывающей гонорею, передаваемую половым путем, стал настолько устойчивым к классу антибиотиков, называемых хинолонами, что Всемирная организация здравоохранения начала рекомендовать новый класс антибиотиков, называемый цефалоспоринами. Бактерии могут даже стать устойчивыми к этим антибиотикам в течение пяти лет. Согласно NPR, чрезмерное использование антибиотиков для лечения других инфекций, таких как инфекции мочевыводящих путей, может привести к распространению устойчивых к лекарствам штаммов.
Плазмиды вирулентности
Когда плазмида вирулентности находится внутри бактерии, она превращает эту бактерию в патоген, который является возбудителем болезни. Бактерии, вызывающие заболевание, могут легко распространяться и размножаться среди пораженных людей. Бактерия Escherichia coli (E.coli) имеет несколько плазмид вирулентности. Кишечная палочка естественным образом обнаруживается в кишечнике человека и у других животных, но некоторые штаммы кишечной палочки могут вызывать сильную диарею и рвоту. Salmonella enterica – еще одна бактерия, которая содержит плазмиды вирулентности.
Разлагающие плазмиды
Разлагающие плазмиды помогают бактерии-хозяину переваривать соединения, которые обычно не встречаются в природе, такие как камфора, ксилол, толуол и салициловая кислота. Эти плазмиды содержат гены для специальных ферментов, которые расщепляют определенные соединения. Деградирующие плазмиды являются конъюгативными.
Col плазмиды
Col-плазмиды содержат гены, которые вырабатывают бактериоцины (также известные как колицины), которые являются белками, которые убивают другие бактерии и таким образом защищают бактерию-хозяина. Бактериоцины обнаружены во многих типах бактерий, включая кишечную палочку, которая получает их из плазмиды ColE1.
Применение плазмид
Люди разработали множество способов использования плазмид и создали программное обеспечение для записи последовательностей ДНК плазмид для использования во многих различных методах. Плазмиды используются в генная инженерия усиливать или производить много копий определенных генов. В молекулярном клонировании плазмида является типом вектора. Вектор представляет собой последовательность ДНК, которая может транспортировать чужеродный генетический материал из одной клетки в другую, где гены могут быть дополнительно экспрессированы и реплицированы. Плазмиды полезны при клонировании коротких сегментов ДНК. Также плазмиды можно использовать для репликации белков, таких как белок, который кодирует инсулин, в больших количествах. Кроме того, плазмиды исследуются как способ переноса генов в клетки человека в рамках генной терапии. В клетках может отсутствовать специфический белок, если у пациента есть наследственное заболевание с участием гена мутация, Вставка плазмиды в ДНК позволит клеткам экспрессировать белок, которого им не хватает.
викторина
1. Какой НЕ является одним из пяти основных типов плазмид?A. Плодородие F-плазмидыB. ДНК плазмидыC. Col плазмидыD. Плазмиды вирулентности
Ответ на вопрос № 1
В верно. К пяти основным типам плазмид относятся F-плазмиды фертильности, плазмиды Col, плазмиды вирулентности, деградирующие плазмиды и плазмиды устойчивости. Все плазмиды состоят из ДНК.
2. Что такое неконъюгативная плазмида?A. Плазмида, которая не может быть воспроизведенаB. Плазмида, которая не может вызвать процесс полового конъюгацииC. Плазмида, которая кодирует токсины, которые убивают конъюгативные плазмидыD. Плазмида, которая предотвращает процесс полового конъюгации
Ответ на вопрос № 2
В верно. Неконъюгирующая плазмида не может сама начать половое сопряжение; он должен полагаться на конъюгативные плазмиды, которые могут запустить этот процесс, для репликации.
Ответ на вопрос № 3
D верно. Деградирующие плазмиды кодируют ферменты, которые помогают переваривать необычные соединения, такие как салициловая кислота. Выбор A является функцией F-плазмид фертильности, B является функцией плазмид Col, а C является функцией плазмид вирулентности.
Что такое плазмиды бактерий
11. Плазмиды бактерий,их функции и свойства. Использование плазмид в генной инженерии. Медицинская биотехнология, ее задачи и достижения.
Плазмиды представляют собой двухцепочечные молекулы ДНК размером от 103 до 106 н.п. Они могут быть кольцевой формой и линейными. Плазмиды кодируют не основные для жизнедеятельности бактериальной клетки функции, но придающие бактерии преимущества при попадании в неблагоприятные условия существования.
Среди фенотипических признаков, сообщаемых бактериальной клетке плазмидами, можно выделить следующие:
• устойчивость к антибиотикам;
• продукцию факторов патогенности;
• способность к синтезу антибиотических веществ;
• расщепление сложных органических веществ;
• образование ферментов рестрикции и модификации. Репликация плазмид происходит независимо от хромосомы с участием того же набора ферментов, который осуществляет репликацию бактериальной хромосомы (см. раздел 3.1.7 и рис. 3.5).
Некоторые плазмиды находятся под строгим контролем. Это означает, что их репликация сопряжена с репликацией хромосомы так, что в каждой бактериальной клетке присутствует одна или, по крайней мере, несколько копий плазмид.
Число копий плазмид, находящихся под слабым контролем, может достигать от 10 до 200 на бактериальную клетку.
Для характеристики плазмидных репликонов их принято разбивать на группы совместимости. Несовместимость плазмид связана с неспособностью двух плазмид стабильно сохраняться в одной и той же бактериальной клетке. Несовместимость свойственна тем плазмидам, которые обладают высоким сходством репликонов, поддержание которых в клетке регулируется одним и тем же механизмом.
Плазмиды, которые могут обратимо встраиваться в бактериальную хромосому и функционировать в виде единого репликона, называются интегративными или эписомами.
Плазмиды, способные передаваться из одной клетки в другую, иногда даже принадлежащую иной таксономической единице, называются трансмиссивными (конъюгативными). Трансмиссивность присуща лишь крупным плазмидам, имеющим tra-оперон, в который объединены гены, ответственные за перенос плазмиды. Эти гены кодируют половые пили, которые образуют мостик с клеткой, не содержащей трансмиссивную плазмиду, по которой плазмидная ДНК передается в новую клетку. Этот процесс называется конъюгацией (подробно он будет рассмотрен в разделе 5.4.1). Бактерии, несущие трансмиссивные плазмиды, чувствительны к «мужским» нитевидным бактериофагам.
Плазмиды, детерминирующие синтез факторов патогенности, в настоящее время обнаружены у многих бактерий, являющихся возбудителями инфекционных заболеваний человека. Патогенность возбудителей шигеллезов, иерсиниозов, чумы, сибирской язвы, иксодового бореллиоза, кишечных эшерихиозов связана с наличием у них и функционированием плазмид патогенности.
Некоторые бактериальные клетки содержат плазмиды, детерминирующие синтез бактерицидных по отношению к другим бактериям веществ. Например, некоторые Е. coli владеют Col-плазмидой, определяющей синтез колицинов, обладающих микробоцидной активностью по отношению к колиформным бактериям. Бактериальные клетки, несущие такие плазмиды, обладают преимуществами при заселении экологических ниш.
Плазмиды используются в практической деятельности человека, в частности в генной инженерии при конструировании специальных рекомбинантных бактериальных штаммов, вырабатывающих в больших количествах биологически активные вещества (см. главу 6).
Биотехнология представляет собой область знаний, которая возникла и оформилась на стыке микробиологии, молекулярной биологии, генетической инженерии, химической технологии и ряда других наук. Рождение биотехнологии обусловлено потребностями общества в новых, более дешевых продуктах для народного хозяйства, в том числе медицины и ветеринарии, а также в принципиально новых технологиях. Биотехнология — это получение продуктов из биологических объектов или с применением биологических объектов. В качестве биологических объектов могут быть использованы организмы животных и человека (например, получение иммуноглобулинов из сывороток вакцинированных лошадей или людей; получение препаратов крови доноров), отдельные органы (получение гормона инсулина из поджелудочных желез крупного рогатого скота и свиней) или культуры тканей (получение лекарственных препаратов). Однако в качестве биологических объектов чаще всего используют одноклеточные микроорганизмы, а также животные и растительные клетки.
Клетки животных и растений, микробные клетки в процессе жизнедеятельности (ассимиляции и диссимиляции) образуют новые продукты и выделяют метаболиты, обладающие разнообразными физико-химическими свойствами и биологическим действием.
Биотехнология использует эту продукцию клеток как сырье, которое в результате технологической обработки превращается в конечный продукт. С помощью биотехнологии получают множество продуктов, используемых в различных отраслях:
• медицине (антибиотики, витамины, ферменты, аминокислоты, гормоны, вакцины, антитела, компоненты крови, диагностические препараты, иммуномодуляторы, алкалоиды, пищевые белки, нуклеиновые кислоты, нуклеозиды, нуклеотиды, липиды, антиметаболиты, антиоксиданты, противоглистные и противоопухолевые препараты);
• ветеринарии и сельском хозяйстве (кормовой белок: кормовые антибиотики, витамины, гормоны, вакцины, биологические средства защиты растений, инсектициды);
• пищевой промышленности (аминокислоты, органические кислоты, пищевые белки, ферменты, липиды, сахара, спирты, дрожжи);
• химической промышленности (ацетон, этилен, бутанол);
• энергетике (биогаз, этанол).
Следовательно, биотехнология направлена на создание диагностических, профилактических и лечебных медицинских и ветеринарных препаратов, на решение продовольственных вопросов (повышение урожайности, продуктивности животноводства, улучшение качества пищевых продуктов — молочных, кондитерских, хлебобулочных, мясных, рыбных); на обеспечение многих технологических процессов в легкой, химической и других отраслях промышленности. Необходимо отметить также все возрастающую роль биотехнологии в экологии, так как очистка сточных вод, переработка отходов и побочных продуктов, их деградация (фенол, нефтепродукты и другие вредные для окружающей среды вещества) осуществляются с помощью микроорганизмов.
В настоящее время в биотехнологии выделяют медико-фармацевтическое, продовольственное, сельскохозяйственное и экологическое направления. В соответствии с этим биотехнологию можно разделить на медицинскую, сельскохозяйственную, промышленную и экологическую. Медицинская в свою очередь подразделяется на фармацевтическую и иммунобиологическую, сельскохозяйственная — на ветеринарную и биотехнологию растений, а промышленная — на соответствующие отраслевые направления (пищевая, легкая промышленность, энергетика и т. д.).
Биотехнологию также подразделяют на традиционную (старую) и новую. Последнюю связывают с генетической инженерией. Общепризнанное определение предмета «биотехнология» отсутствует и даже ведется дискуссия о том, наука это или производство.
Молекулярное клонирование, или как засунуть в клетку чужеродный генетический материал
Молекулярное клонирование, или как засунуть в клетку чужеродный генетический материал
Клонирование овечек имеет лишь самое опосредованное отношение к молекулярному клонированию. На фоне овечки Долли показана плазмида phMYT1L-N106.
коллаж автора статьи
Автор
Редакторы
Статья на конкурс «био/мол/текст»: Огромное количество биологических исследований начинается с того, что в клетку вносится чужеродный генетический материал. Это действие называется молекулярным клонированием. С его помощью можно получить генетически модифицированные организмы, включить и выключить отдельные гены или определить роль конкретного белка в каком-нибудь процессе. Можно сказать, что молекулярное клонирование — это краеугольный камень, основа основ, фундамент, без которого множество замечательных методик было бы неосуществимо. Однако засунуть в клетку «неродную» ДНК не так-то просто: это длинный, трудоемкий и многоэтапный процесс. Молекулярному клонированию посвящены толстые книги, но, тем не менее, я попробую хотя бы немного рассказать о том, что это такое, и что нужно для того, чтобы все получилось.
«Био/мол/текст»-2011
Эта статья представлена на конкурс научно-популярных работ «био/мол/текст»-2011 в номинации «Лучшая обзорная статья».
Вставка
Раз мы собираемся вставлять в клетки какой-то ген, то самый первый, очевидный шаг, который нам нужно сделать, — этот ген как-нибудь получить, причем желательно в больших количествах (поскольку все методики несовершенны, бóльшая часть копий этого гена бесследно пропадет по дороге нецелевым способом). Чужеродный ген, вносимый в клетку, называется «геном-вставкой» или просто «вставкой». Получить его можно несколькими способами.
Во-первых, мы можем просто выделить его из того генома, к которому он принадлежит. Допустим для простоты, что наша вставка — это какой-нибудь ген слона. Тогда нам нужно:
Подробнее с методом ПЦР и другими основными молекулярно-биологическими методиками можно ознакомиться в статье «Важнейшие методы молекулярной биологии и генной инженерии»; с геномными исследованиями — в статье «Геном человека: как это было и как это будет». — Ред.
Во-вторых, вполне возможно, что нужный нам ген уже был выделен из генома слона и присутствует в библиотеке генов. Тогда нашу вставку можно будет получить оттуда (с этим, на самом деле, тоже придется повозиться, но меньше, чем в первом случае).
И наконец, в-третьих, не обязательно использовать в качестве вставки уже существующий ген. Если исследователь собирается работать с каким-нибудь геном, который является плодом его фантазии и не встречается в природе, то он может синтезировать его искусственно.
Вектор
Запускание в клетку «одинокой» вставки (то есть, гена самого по себе, безо всякого сопровождения) — дело совершенно бесперспективное. В клетке плавает множество расщепляющих ДНК ферментов (нуклеаз), которые с радостью набросятся на беззащитную вставку и разрежут ее на кусочки, в результате чего она бесславно исчезнет, не успев совершить ничего полезного, а клонирование провалится.
Поэтому, чтобы защитить вставку, ее встраивают в специальное «транспортное средство», которое называется вектором. В самом элементарном случае вектор — это просто последовательность ДНК, в которую вшивается наша вставка, и которая помогает ей не пропасть в клетке и выполнить свое предназначение. Существует несколько видов векторов, но среди исследователей самой большой (и заслуженной) любовью пользуется один из них — плазмиды. С них-то мы и начнем.
Плазмида
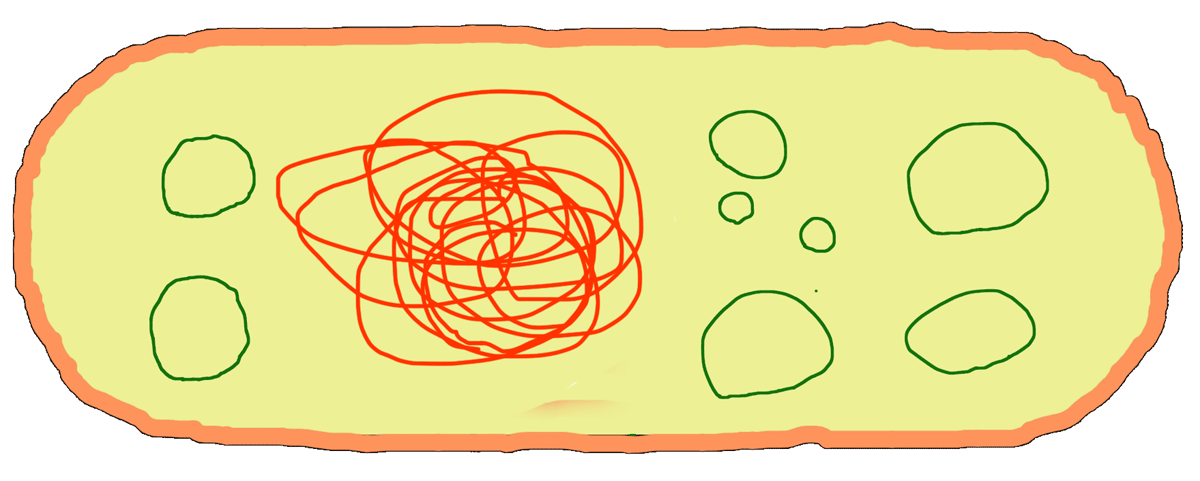
Плазмида — это довольно короткая и обычно кольцевая молекула ДНК, которая плавает в цитоплазме бактериальной клетки (зеленые кружочки на рис. 1). Плазмиды не связаны с бактериальной хромосомой, они могут реплицироваться независимо от нее, могут «выплевываться» бактерией в окружающую среду или, наоборот, из этой окружающей среды «проглатываться». С помощью плазмид бактерии обмениваются друг с другом генетической информацией, — например, передают соседям устойчивость к какому-нибудь антибиотику.
Рисунок 1. В бактериальной клетке наряду с бактериальной хромосомой плавает еще и множество плазмид.
рисунок автора статьи
Плазмиды существуют внутри бактерий в естественных условиях, поэтому никто не может помешать исследователю искусственно синтезировать плазмиду, которая будет обладать нужными для него свойствами, вшить в нее вставку (или несколько) и запустить в клетку. Плазмида — это, можно сказать, «болванка» для молекулярного биолога. Поэтому плазмиды стараются сделать как можно более универсальными и подходящими для всех случаев жизни.
Для того, чтобы из плазмиды получился рабочий вектор, она должна обладать некоторыми важными характеристиками.
Размножение
Прежде всего, плазмида обязательно должна в клетке размножаться, реплицироваться, потому что иначе она быстро подвергнется деградации, а вместе с ней исчезнет и ген-вставка. Для этого в ней должна быть специальная последовательность под названием «точка начала репликации», с которой и начинается удвоение ДНК. У разных видов живых существ эти точки имеют разную нуклеотидную последовательность. Поэтому, если мы хотим создать плазмиду, которая бы реплицировалась сразу в двух видах клеток (например, и в дрожжевых, и в бактериальных), то нам надо вставить в нее две точки начала репликации.
Разрезание
Кроме того, в ДНК плазмиды должны быть участки, в которых ее можно будет разрезать, чтобы вшить туда вставку. В качестве «ножниц» используются особые ферменты — рестриктазы. Они прекрасны тем, что режут ДНК не где попало, а в строго определенных местах, которые называются сайтами рестрикции (каждая рестриктаза распознает только свой сайт и только в нем (или возле него) разрезает ДНК). Обычно в плазмиду ставят множество разных сайтов рестрикции, расположенных в разных точках, — благодаря этому ее можно будет разрезать в нужном месте нужной рестриктазой. Участок ДНК, на котором собрано несколько сайтов рестрикции, называется полилинкером.
Селекция
Процесс, при котором бактерия «глотает» плазмиду, именуется трансформацией. В естественных условиях трансформироваться может в каждый момент времени не вся популяция бактерий, а только ее часть — компетентные клетки. Существуют лабораторные методы, с помощью которых можно искусственно увеличить количество компетентных клеток (некоторые из них описаны ниже в главе «Как засунуть вектор в клетки»), однако, все равно, стопроцентная компетентность для бактериальной культуры — вещь недостижимая.
Так что, добавляя плазмиду к бактериям, мы заранее должны смириться с тем, что бóльшая часть бактериальных клеток так и останется бесплазмидной, нетрансформированной. Поэтому нам придется отделять зерна от плевел, — то есть, трансформированные клетки от всех остальных. Для этого используется простой, но остроумный прием.
Допустим, мы встроили в нашу плазмиду ген устойчивости к какому-нибудь антибиотику (такой ген называется селективным маркером). Теперь клетки, которые «съели» плазмиду, будут неуязвимы для этого антибиотика и смогут спокойно жить в его присутствии. В результате, чтобы выделить из всех бактерий, к которым мы добавили плазмиду, те, которые смогли эту плазмиду использовать по назначению, нам достаточно будет добавить к бактериальной культуре соответствующий антибиотик. Те клетки, которые нам нужны, смогут существовать и делиться в присутствии этого антибиотика, а остальные этого делать не смогут.
Существуют и другие способы провести селекцию. Можно, например, поместить сайт рестрикции не внутрь гена антибиотика, а внутрь какого-нибудь «заметного» гена (скажем, такого, в присутствии которого бактериальные культуры меняют цвет). В результате можно будет отличить нужные колонии от ненужных просто на глаз, безо всяких манипуляций. По такому принципу работает, например, очень модная сейчас система бело-голубой селекции.
Если мы собираемся работать только на бактериях, то всем вышесказанным дело и ограничится. Однако если конечная наша цель — засунуть вектор в эукариотические клетки (например, клетки млекопитающих), то нам предстоит еще один этап селекции.
Дело в том, что в большинстве эукариотических клеток плазмиды живут недолго и быстро подвергаются деградации. Поэтому, даже если мы заставили клетку «съесть» плазмиду, не стоит питать надежды, что наша вставка теперь останется в этой клетке навсегда. Скорее всего, она успеет только немного поэкспрессироваться, прежде чем содержащий ее вектор будет пойман нуклеазой и разрезан на кусочки. Однако если вектор случайно смог встроиться в геном (это событие очень редкое, но не невероятное), то наша вставка, можно сказать, пустит в этой клетке корни — причем не только в ней самой, но и во всех ее потомках. И для того, чтобы выделить из всех клеток те, которые имеют вектор в своем геноме, нам понадобится еще один селективный маркер — ген устойчивости к какому-нибудь эукариотическому антибиотику (потому что бактериальные антибиотики, как правило, на клетки эукариот не действуют). Добавив соответствующий антибиотик (например, генетицин) к среде, в которой культивируются клетки, мы через некоторое время получим популяцию только тех клеток, в геноме которых сидит наш вектор.
Промоторы
Перед каждым рабочим геном находится короткий участок ДНК под названием промотор. Именно сюда прикрепляется фермент РНК-полимераза, который синтезирует РНК на матрице ДНК, что является первым и абсолютно необходимым этапом в экспрессии гена. Если у гена нет промотора, его экспрессию запустить невозможно, и он так и останется «молчащим». Можно сказать, что ген без промотора — это все равно, что машина без педали газа. Поэтому в нашей плазмиде обязательно должен быть хотя бы один промоторный участок, под контроль которого можно будет поставить ген-вставку.
А промоторы бывают разные.
Во-первых, они различаются по своей силе. Некоторые вызывают бурную транскрипцию подконтрольного гена, другие — совсем вялую.
Во-вторых, у прокариот и эукариот промоторы отличаются. Прокариотические промоторы не работают в эукариотических клетках и наоборот. Поэтому будет Ужасной Ошибкой поставить тот ген, который должен, экспрессироваться в бактериальных клетках, под эукариотический промотор — это все равно, что оставить его без промотора вообще.
В-третьих, у эукариот есть несколько типов РНК-полимеразы — они обеспечивают синтез различных видов РНК. И каждый тип РНК-полимеразы распознает только свои промоторы и «не видит» чужие. Поэтому, в зависимости от того, какую именно РНК кодирует наша вставка (например, матричную или, наоборот, шпилечную, а может, и вовсе рибосомальную), нам нужно подбирать и тип промотора, который мы будем ставить в плазмиду.
И, наконец, в-четвертых, разные промоторы включаются по-разному. Некоторые активны постоянно. Другие активизируются только при определенных условиях — например, при повышении окружающей температуры или появлении в клетке каких-то веществ. К тому же, у многоклеточных организмов в каждой ткани включены одни промоторы и выключены другие. Можно, например, подобрать такой промотор, который будет активен только в нейронах. Или только в нейронах головного мозга. Или только в нейронах головного мозга, относящихся к одному из подкорковых ядер. Или только в крохотной субпопуляции нейронов головного мозга, относящейся к одному из подкорковых ядер. И сужать этот круг можно почти до бесконечности.
Знание всего этого дает исследователю удивительную свободу. Подобрав в плазмиду подходящий промотор, он сможет творить с экспрессией гена-вставки почти все, что ему заблагорассудится. Ну, скажем, сделать так, чтобы он экспрессировался сильно, только в мышечных клетках и только в ответ на повышение температуры.
Трансляция белка
Засовывая вектор в клетку, ученый может хотеть двух разных вещей:
В первом случае вектор называется транскрипционным, во втором — экспрессионным. Экспрессионные векторы обычно немного сложнее транскрипционных, потому что в них присутствуют:
Итак, мы подобрали все необходимые для плазмиды кусочки. Но мало просто соединить их вместе — огромную роль играет их взаимное расположение. Например, сайты рестрикции должны быть не только многочисленны и разнообразны, но и находиться в «правильных» местах. При этом надо стараться, чтобы итоговая плазмида была как можно компактней, поскольку, во-первых, так она будет стабильнее, а во-вторых, охотнее «проглотится» клеткой. Одним словом, вы уже, наверное, поняли, что дизайн хорошей плазмиды — это тонкое и филигранное искусство (рис. 2).
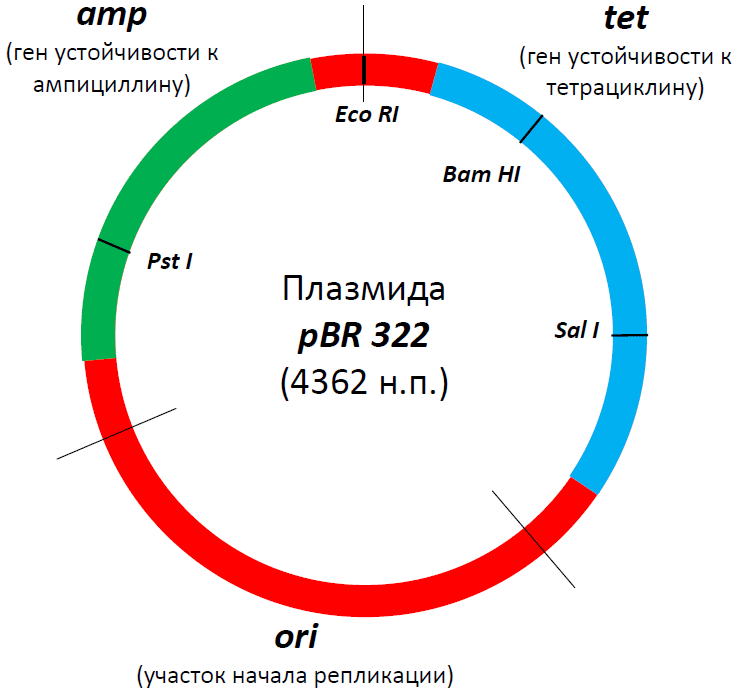
Рисунок 2. Структура знаменитой плазмиды PBR322. В свое время это была, пожалуй, самая популярная плазмида во всем научном мире, а потом она стала основой для множества плазмид нового поколения. В ней есть участок начала репликации (ori), благодаря которому она может размножаться в клетках бактерии E. coli, гены устойчивости к двум антибиотикам — ампициллину (amp) и тетрациклину (tet), а также множество сайтов рестрикции (на самом деле их больше сорока, но здесь представлены только четыре — EcoRI, SalI, PstI, BamHI). Промоторные участки, к сожалению, не показаны, но они, разумеется, тут тоже есть. Некоторые сайты рестрикции находятся в генах устойчивости к ампициллину или тетрациклину, в результате чего и тот и другой сайт можно использовать в качестве второго селективного маркера. Например, если мы разрежем ген устойчивости к ампициллину с помощью рестриктазы PstI и вошьем в это место вставку, то тетрациклин будет первым селективным маркером, ампициллин — вторым, а селекция будет выглядеть так:
Если же мы вошьем вставку внутрь гена устойчивости к тетрациклину (разрезав его с помощью рестриктаз BamHI или SalI), то нам надо будет, наоборот, сначала посадить их на среду с ампициллином, а потом — с тетрациклином.
Плазмидные базы данных
За те несколько десятилетий, что существует методика молекулярного клонирования, были синтезированы тысячи разнообразных плазмид, из которых созданы базы данных (например, AddGene). В этих базах есть плазмиды на все случаи жизни — с разными типами точек начала репликации, разными полилинкерами, разными селективными маркерами и промоторами и так далее. Есть те, в которые можно вшить не одну вставку, а несколько, а есть даже такие, которые уже несут в себе некоторые особенно популярные вставки. Поэтому, как правило, исследователи не синтезируют плазмиду для клонирования самостоятельно, а покупают уже готовую. При необходимости купленную плазмиду можно «довести до ума», вставив или убрав определенные участки (а потом эту модифицированную плазмиду тоже добавить в базу данных). Иными словами, часто задача ученого сводится просто к тому, чтобы подобрать подходящую плазмиду.
Другие векторы
Плазмида — прекрасный вектор для относительно небольших вставок. Если ген-вставка слишком велик, то плазмида утрачивает стабильность, потому что ее участки начинают «перетасовываться» друг с другом и теряться при репликации, из-за чего она постепенно укорачивается. Поэтому в качестве вектора для длинных вставок используются более устойчивые конструкции. Например:
Вставляем ген в плазмиду
Допустим, исследователь подобрал подходящую плазмиду и получил нужную вставку. Теперь нужно соединить одно с другим, чтобы затем засунуть в клетки. Для этого достаточно совершить несколько простых действий.
Как уже говорилось, в плазмиде существует несколько сайтов рестрикции — то есть, участков, в которых ее может разрезать нужная рестриктаза. Нам нужно выбрать подходящий сайт, который будет находиться в том месте, куда мы собираемся вшивать вставку, а затем обработать плазмиду соответствующей рестриктазой.
После этого той же рестриктазой нужно обработать вставку, поскольку рестриктазы обычно оставляют выступающие концы на одной из нитей ДНК, и эти концы должны быть совместимы у вставки и плазмиды, чтобы они согласились соединиться. Если на кончиках вставки нет нужных сайтов рестрикции, то можно приделать к нему короткие ДНК-фрагменты с нужными сайтами рестрикции на концах.
И наконец, нам нужно соединить в одной пробирке плазмиду и вставку (предварительно очищенные от рестриктаз) и добавить к ним ДНК-лигазу, которая умеет лигировать (то есть, сшивать воедино) две молекулы ДНК. Конечно, в результате мы получим не только желанный вектор, в котором плазмида соединена со вставкой (назовем его чеширским котом с улыбкой), но и целый коктейль побочных продуктов — пустую плазмиду (кота без улыбки), замкнутую вставку (улыбку без кота), несколько сшитых между собой вставок (много улыбок) и так далее. В ходе селекции эти ненужные продукты отсеются, и у нас в руках останется только вектор.
Выделяем вектор
Итак, вначале мы проводим селекцию.
И вот мы получили ее — бактериальную культуру, в которой живет созданный нами вектор. Вполне возможно, что это и было нашей конечной целью, и теперь мы, спокойные и счастливые, можем, например, включить в бактериях экспрессию гена-вставки и пожинать урожай синтезированных в результате белков.
Но если нам нужен чистый вектор, который можно будет потом засовывать в другие клетки, то у нас появляется проблема, которая кажется неразрешимой. Как вызволить вектор из бактерий? Ведь даже если мы выделим из этих бактерий ДНК, то помимо вектора получим еще и совершенно ненужную нам бактериальную хромосому.
Тут можно воспользоваться тем, что плазмидная ДНК имеет важные отличия от хромосомной: она, во-первых, гораздо меньше по размеру, а во-вторых, гораздо больше суперскручена. Поэтому можно подобрать такие условия, в которых бактериальные хромосомы будут осаждаться, в то время как плазмиды останутся плавать в растворе. Достаточно будет отцентрифугировать получившийся осадок (чтобы вся бактериальная ДНК прочно «упала на дно»), а затем уже из надосадочной жидкости выделить нашу плазмиду (обычно для этого используются специальные колонки, которые очень облегчают и ускоряют работу).
Как засунуть вектор в клетки
И вот наступил желанный миг. Исследователь держит в руке пробирку, в которой плещется прозрачная жидкость — столькими трудами полученный вектор. И тут перед ним встает преграда. Клетки, в которые он собирается засунуть свой вектор, отказываются его глотать.
Дело в том, что липидная мембрана, которой окружены клетки, обладает избирательной проницаемостью — то есть, она пропускает через себя одни частицы и не пропускает другие. Крупные заряженные молекулы (а именно таковой и является ДНК) через эту мембрану самопроизвольно пройти не могут. И если бактерии, например, умеют проглатывать плазмиды из внешней среды (как уже было сказано выше), то, скажем, клетки животных к этому совершенно не склонны. Поэтому для того, чтобы засунуть в клетку вектор, исследователю приходится прибегать ко множеству хитростей, о которых и будет сейчас рассказано. Но сначала — немного терминов.
Для внесения в клетку вектора есть несколько обозначений в зависимости от того, какой используется вектор и в какие клетки он вносится.
Эти термины, в общем, не очень строгие. Например, даже в некоторых солидных статьях трансдукцию иногда называют вирусной трансфекцией (а то и просто трансфекцией).
Вещества-проводники
Самый простой и очевидный путь внесения в клетку генетического материала — соединить вектор с каким-нибудь переносчиком, у которого нет проблем с проникновением через мембрану, и позволить получившемуся комплексу пролезть внутрь клетки. Это не отнимает много времени и не требует дорогостоящего оборудования. Такой способ обычно называют химической трансфекцией. В этом случае события развиваются по следующему сценарию:
К сожалению, почти на каждом из этих этапов возникают трудности. Во-первых, клетки захватывают далеко не все плавающие вокруг них комплексы. Во-вторых, не факт, что, оказавшись внутри клетки, вектор отделится от переносчика — вполне возможно, что они так и будут в обнимку плавать в цитоплазме, пока не подвергнутся деградации. В-третьих, даже если какой-то редкий комплекс умудрился проникнуть в клетку и там развалиться, это означает, что помимо вектора в клетке оказывается еще и переносчик, который может быть токсичен, вызывать побочные эффекты и вообще «замыливать» результаты экспериментов. И, наконец, в-четвертых, только небольшая часть вектора, оказавшегося внутри клетки, сможет проникнуть в ядро. Иными словами, комплексы вектора с переносчиком надо добавлять к клеткам в огромном избытке, чтобы хотя бы маленькая часть из них выполнила свое предназначение.
Утешает то, что среди производителей веществ-переносчиков огромная конкуренция, и поэтому на рынке постоянно появляются новые составы с улучшенными свойствами, которые минимизируют вышеописанные трудности. У каждого из составов есть какая-то своя «фишка», которая дает ему преимущество в конкурентной борьбе — некоторые образуют с вектором такие компактные комплексы, которым гораздо легче пробраться внутрь клетки; другие эффективнее отделяются от вектора, оказавшись в цитоплазме; третьи более универсальны и работают на огромном количестве типов клеток; четвертые, наоборот, славятся своей избирательностью и проникают только в те клетки, которые, например, экспрессируют какой-то специфический рецептор. Одним словом, если исследователь решил засунуть вектор внутрь клетки с помощью химической трансфекции, то ему просто надо выбрать из множества составов, представленных на рынке, тот, который будет лучше работать в данном конкретном случае.
Дырки в мембране
Но некоторые клетки так привередливы и капризны, что в принципе не соглашаются глотать комплексы ДНК с переносчиком (таким скверным характером славятся, например, первичные клетки — то есть, те, которые не выращивались в культуре, а были получены непосредственно от живого организма). Чтобы ввести в эти клетки генетический материал, ученому приходится прибегать к грубой силе — продырявливать мембрану и засовывать ДНК в образовавшиеся отверстия. Этот жестокий подход называется физической трансфекцией; он очень травматичен для клеток, и только некоторые из них переживут столь неделикатное обращение. Поэтому применять данную методику стоит, только если вы точно уверены, что обладаете достаточным количеством клеток и можете пожертвовать бóльшей частью из них. Ну и к тому же, вам потребуется довольно дорогое оборудование.
Наверное, самый распространенный способ продырявливания мембраны называется электропорацией. Дело в том, что у клеток, попавших в электрическое поле, в мембране возникают отверстия (которые получаются тем больше, чем сильнее приложенное к клеткам поле). Если эти отверстия малы, то клетка сможет «залечить» их; если же они слишком велики, то клетка погибнет из-за необратимого нарушения целостности мембраны. Поэтому эмпирическим путем можно подобрать оптимальную величину поля для того, чтобы клетки, с одной стороны, продырявились, а с другой — остались в живых. А когда клетки продырявлены, то добавленный к ним вектор проникает сквозь отверстия и оказывается в цитоплазме.
Кроме электропорации, есть еще несколько способов — экзотических и не очень — сделать в мембране дырки. Например, с помощью:
Ну и наконец, для самых непокорных клеток, которые не поддаются никакой из вышеописанных методик, существует прибор под названием «генная пушка». Генная пушка расстреливает упрямые клетки частичками металла (обычно используется золото) с присоединенным к ним вектором. (Источником вдохновения для изобретателей этого прибора послужил пневматический молоток.) Генная пушка подходит практически для всех типов клеток, включая растительные, окруженные твердой клеточной стенкой, которая является практически непреодолимой преградой для большинства других методик.
А вообще, почти все вышеописанные методики дают более-менее похожие результаты на большей части типов клеток, а приборы для них стоят дорого. Поэтому, как правило, лаборатория покупает прибор для какой-то одной методики, и дальше уже по этой методике и доставляет генетический материал в клетки.
Овечки в волчьей шкуре
Зачем придумывать новые и трудные пути засовывания в клетку нуклеиновых кислот, если можно воспользоваться теми элегантными способами, которые за время долгой эволюции изобрели существа (или, возможно, вещества; нельзя точно сказать, живые они или нет), для которых транспортировка своего генетического материала внутрь клетки является необходимой фазой жизненного цикла? Все, наверное, уже догадались, что речь идет о вирусах.
Вирусы — это молекулы ДНК или РНК, упакованные в белковую оболочку (а иногда завернутые в липидный слой со встроенными в него вирусными белками). Именно оболочка играет главную роль в проникновении вируса через клеточную мембрану. Поэтому если засунуть в эту оболочку невирусную нуклеиновую кислоту, то она, будто вирус, тоже сможет попасть в клетку — как овечка, одетая в волчью шкуру. На этом принципе и основано использование вирусных векторов. Пожалуй, вирус — это самое эффективное транспортное средство для доставки в клетку генетического материала. Но приготовление вирусных векторов очень хлопотно, долго и трудоемко. Да вы сейчас и сами увидите.
Итак, чтобы сделать вирусный вектор, нужно для начала подобрать подходящий вирус. Идеальный кандидат:
К сожалению, идеал недостижим, и ученым приходится выбирать из того, что есть. А именно:
Ретро
Ретровирусы долгое время были самой популярной основой для векторов. Это РНК-содержащие вирусы, которые, оказавшись в клетке, синтезируют ДНК на основе своей РНК с помощью ревертазы (собственно, поэтому они и называются «ретро», ведь синтез ДНК на основе РНК — это, в каком-то смысле, шаг назад). Ретровекторы хорошо выполняют свое предназначение, то есть, стабильно доставляют в клетку заключенный в них генетический материал, но у них есть несколько недостатков, из-за которых работать с ними неудобно.
Во-первых, они все (за одним исключением, о котором скоро будет рассказано) способны инфицировать только делящиеся клетки. Поэтому если исследователь, например, собрался изучать нейроны, которые не склонны к делению, ему надо забыть о ретровекторах и начать искать что-нибудь другое.
Во-вторых, ретровирусы встраиваются в самые непредсказуемые участки генома, каждый раз разные, и это приводит к самым непредсказуемым последствиям. Для начала, из-за этого нарушается воспроизводимость экспериментов — но это еще ладно. Беда в том, что ретровектор может вклиниться в середину какого-нибудь важного гена, из-за чего этот ген выключится, а в клетке начнутся патологические изменения, которые могут довести ее до гибели. Или, наоборот, ретровектор может случайно включить какой-нибудь совершенно ненужный ген, например, онкоген, что также приведет к очень печальным результатам (особенно если исследования проводятся не на культуре клеток, а на живом организме, и особенно если этот организм — человеческий).
Эти недостатки отвратили сердца ученых от ретровекторов и заставили их искать что-нибудь более подходящее. И найти кое-что замечательное удалось прямо внутри ретровирусного семейства.
Ленти
Лентивирусы — это род ретровирусов, который отличается от прочих представителей своего семейства некоторыми приятными с точки зрения молекулярного клонирования чертами.
Прежде всего, лентивирусы умеют заражать не только делящиеся, но и неделящиеся клетки. Эта особенность ужасна с точки зрения врача, который лечит вызванное лентивирусом заболевание, и прекрасна с точки зрения молекулярного биолога, который делает на основе лентивируса лентивектор. Ведь работая с таким вектором, ученый сможет использовать гораздо более широкий ассортимент клеточных типов, а значит, сделать гораздо больше великих открытий.
Плюс к тому, лентивекторы довольно емкие, то есть, они способны вместить в себя крупные вставки. Отчасти это связано с тем, что из их генома в целях безопасности выкидывается бóльшая часть, и в результате освобождается куча места. Ну и кроме того, лентивирусы встраиваются в чуть менее непредсказуемые участки генома, чем прочие ретровирусы, а это тоже очень здорово.
«Ленти» по латыни значит «медленный». Это слово очень точно отражает характер лентивирусов — они вызывают заболевания с необычайно длинным инкубационным периодом. Вирус СПИДа — это тоже, кстати, лентивирус.
Адено
Аденовирусы, наряду с ретровирусами, долго были самой популярной основой для векторов, но теперь потихоньку сдают свои позиции. Аденовирусы способны заражать не только делящиеся, но и неделящиеся клетки; ассортимент клеточных типов, которые они заражают, довольно широк. Но они не встраиваются в хозяйский геном, и поэтому подходят не для всех экспериментов. Кроме того, аденовирусы часто вызывают сильный иммунный ответ. Поэтому все чаще они используются не в базовых исследованиях, а для всяких прикладных целей — например, для создания вакцин.
И наконец, относительно недавно на сцене появился новый персонаж, который сразу расположил к себе ученых множеством чудесных качеств. Зовут его аденоассоциированный вирус (AAV).
AAV ведет себя настолько тихо, скромно и ненавязчиво, насколько этого вообще можно ждать от вируса. Практически единственное, что он делает, оказавшись в клетке, — это встраивается в хозяйский геном, причем почти всегда не в первое попавшееся, а в строго определенное место. Он, судя по имеющимся сейчас данным, не вызывает никаких заболеваний, поэтому и иммунный ответ на него очень слабый. К тому же, он способен заражать и делящиеся, и неделящиеся клетки. Одним словом, AAV — просто идеальная основа для вектора, хотя и он не лишен некоторых недостатков. И главный его недостаток — малая емкость. В AAV-вектор могут влезть только совсем небольшие вставки, и в этом он очень проигрывает, например, лентивекторам.
Кроме того, AAV — дефективный, несамостоятельный вирус. Он может размножаться только в клетках, которые уже заражены аденовирусом (что и отражено в его названии). Это совсем неплохая черта, если мы хотим заразить нашим вектором культуру клеток; но если мы собираемся делать вектор для генной терапии (методики лечения генетических (и не только) заболеваний, при которой организм заражается вирусным вектором, несущим необходимые этому организму гены), то такая дефективность будет нам очень мешать, потому что вирусы не смогут как следует распространяться по организму. Однако сейчас эта проблема решена, и разработаны AAV-векторы, которые способны размножаться сами по себе, безо всякой помощи.
Но вот подходящий вирус подобран. Теперь начинаются игры с его геномом.
Теперь у нас возникает небольшая проблема. Даже засунув эту плазмиду в клетку, никаких вирусов мы не получим, потому что мы уже выкинули (в пункте 1) те гены, которые нужны для их создания. Поэтому нам придется пойти на маленькую хитрость.
Мы засунем в клетки не одну плазмиду, а две. Первая, основная (назовем ее Пу), — это та, которую мы получили в пункте 3. А вторая, вспомогательная (назовем ее Ме), будет нести гены, которые мы выкинули в пункте 1. Обе плазмиды начнут размножаться в хозяйской клетке. Плазмида Ме будет экспрессировать свои белки — например, белки оболочки и белки, необходимые для самосборки вирусов. Поскольку на Пу есть участки для налипания белков оболочки, то эти белки на нее и налипнут, и в результате мы получим вирус с необходимыми генами внутри, чего мы и добивались.
Итак, наш план действий таков:
Это, конечно, только общая схема, у каждого конкретного вектора есть свои нюансы. Например, бывает, что вместо одной вспомогательной плазмиды используют две или даже три. При создании некоторых AAV-векторов упаковывающие клетки нужно заразить аденовирусом. А если мы создаем вектор для генной терапии, который должен уметь размножаться в хозяйской клетке и заражать ее соседей, то нам придется гораздо аккуратнее обращаться с вирусным геномом и расчищать в нем место с большой осторожностью, чтобы не нарушить способность вирусов к самостоятельному размножению. И так далее.
Последний шаг
Итак — ура! — тем или иным способом мы все-таки умудрились засунуть вектор в клетки. Нам остается последний шаг — нужно выбрать из всех клеток те, которые встроили векторную ДНК в свой геном.
Собственно, для этого мы и добавили в вектор последний селективный маркер — ген устойчивости к антибиотику, работающему на эукариотических клетках. Мы просто будем постоянно добавлять этот антибиотик в среду, в которой находятся наши клетки, — в результате останутся в живых и смогут делиться только те, которые имеют в геноме этот ген и всю нашу векторную ДНК впридачу.
Все! Клонирование завершено. Мы получили линию генетически модифицированных клеток, в геноме которых присутствует наша вставка. Пришло время проводить с этими клетками необходимые эксперименты.