Что тяжелее аммиак или воздух
Урок №30. Аммиак. Физические и химические свойства. Получение и применение
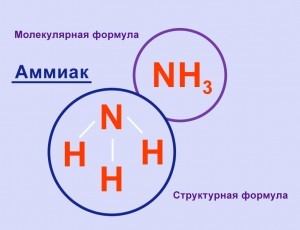
Аммиак – NH 3
Строение молекулы
Физические свойства аммиака
При нормальных условиях — бесцветный газ с резким характерным запахом (запах нашатырного спирта), почти вдвое легче воздуха, ядовит. По физиологическому действию на организм относится к группе веществ удушающего и нейротропного действия, способных при ингаляционном поражении вызвать токсический отёк лёгких и тяжёлое поражение нервной системы. Пары аммиака сильно раздражают слизистые оболочки глаз и органов дыхания, а также кожные покровы. Это мы и воспринимаем как резкий запах. Пары аммиака вызывают обильное слезотечение, боль в глазах, химический ожог конъюктивы и роговицы, потерю зрения, приступы кашля, покраснение и зуд кожи. Растворимость NH 3 в воде чрезвычайно велика — около 1200 объёмов (при 0°C) или 700 объёмов (при 20°C) в объёме воды.
Получение аммиака
В лаборатории
Для получения аммиака в лаборатории используют действие сильных щелочей на соли аммония:
NH 4 Cl + NaOH = NH 3 ↑ + NaCl + H 2 O
(NH 4 ) 2 SO 4 + Ca(OH) 2 = 2NH 3 ↑ + CaSO 4 + 2H 2 O
Внимание! Гидроксид аммония неустойчивое основание, разлагается:
NH 4 OH ↔ NH 3 ↑ + H 2 O
В промышленности
Промышленный способ получения аммиака основан на прямом взаимодействии водорода и азота:
N 2(г) + 3H 2(г) ↔ 2NH 3(г) + 45,9 кДж
катализатор – пористое железо
температура – 450 – 500 ˚С
давление – 25 – 30 МПа
Это так называемый процесс Габера (немецкий физик, разработал физико-химические основы метода).
Химические свойства аммиака
Реакции с изменением степени окисления атома азота (реакции окисления)
N -3 → N 0 → N +2
NH 3 – сильный восстановитель
4NH 3 + 3O 2 = t = 2N 2 + 6H 2 О
2. Каталитическое окисление аммиака
4NH 3 + 5O 2 = t, кат. Pt – Rh = 4NO + 6H 2 O
3. С оксидами металлов
2NH 3 + 3CuO = 3Cu + N 2 + 3H 2 O
4. С сильными окислителями
2NH 3 + 3Cl 2 = t = N 2 + 6HCl
5. Аммиак – непрочное соединение, при нагревании разлагается
2NH 3 = t = N 2 + 3H 2
Реакции без изменения степени окисления атома азота
(NH 4 ) n А – соли аммония
NH 4 ОН – гидроксид аммония (правильная запись NH 3 •H 2 O )
1. С водой образуется аммиачная вода (нашатырный спирт), обладающий основными свойствами – фенолфталеин в таком растворе окрашивается в малиновый цвет, а красная лакмусовая бумага – в синий:
NH 3 +H 2 SO 4 = NH 4 HSO 4 – гидросульфат аммония
2NH 3 +H 2 SO 4 = (NH 4 ) 2 SO 4 – сульфат аммония
Применение аммиака
Медики используют водные растворы аммиака (нашатырный спирт) в повседневной практике: ватка, смоченная в нашатырном спирте, выводит человека из обморочного состояния. Для человека аммиак в такой дозе не опасен.
ЗАДАНИЯ ДЛЯ ЗАКРЕПЛЕНИЯ
№1. Осуществить превращения по схеме:
а) Азот→ Аммиак → Оксид азота (II)
б) Нитрат аммония → Аммиак → Азот
в) Аммиак → Хлорид аммония → Аммиак → Сульфат аммония
Для ОВР составить е-баланс, для РИО полные, ионные уравнения.
№2. Напишите четыре уравнения химических реакций, в результате которых образуется аммиак.
Аммиак легче или тяжелее воздуха?
Поэтому ответ: аммиак легче воздуха.
Аммиак — бесцветный газ с резким характерным запахом нашатырного спирта.
Достаточно будет сравнить молекулярную массу аммиака и воздуха, чтобы сделать вывод, что аммиак значительно легче воздуха.
Поэтому правильный ответ: легче аммиак.
То есть, мы получаем 17 против 29. И отсюда следует, что воздух тяжелее аммиака.
Масса аммиака, равняется 17 граммов на моль, а это говорит в химии о том, что он ленче чем кислород которым мы люди дышим, ведь масса кислорода равняется 29 грамм на моль и он тяжелее, а потому аммианк в воздухе выветривается.
Это соотношение зависит от плотности вещества. Растворимость в воде этого вещества больше, чем у газов остальных. Поэтому он в сжиженном состоянии перевозится перевозится в резервуарах под давлением 28 атм. Легче воздуха пары аммиака. В два раза легче воздуха бесцветный газ с удушливым резким запахом под названием Аммиак. Он легко растворяется в воде, распространяется в верхних атмосферных слоях, поднимается в помещении до потолка вверх.
Однако при утечке аммиака образуется тяжелее окружающего воздуха аэрозольное облако воздушно-аммиачной смеси. В таком состоянии аммиак намного опаснее.
Аммиак не тяжелей воздуха, а легче.
Аммиак и легче воздуха и он же очень хорошо растворяется в воде, он бесцветный (это газ), но с резким характерным (неприятным, так точней) запахом.
Он летуч, ещё одно подтверждение тому что он легче воздуха.
Аммиак хоть это и газ, но он конечно же легче воздуха.
У аммиака противный (удушливый) очень запах, который ни с каким другим не спутаешь.
Аммиак бесцветен и способен в воде растворяться.
Бесцветный газ аммиак имеет такое свойство, как хорошая растворяемость в воде.
Этот бесцветный газ безусловно легче воздуха. Если сравнивать их молекулярную массу, то мы увидим такие показатели, как 17 (аммиак) против 29 грамм на моль у воздуха.
Почему не падает? Вероятнее всего потому, что он уже давно упал и лежит равномерно распределившись по площади всей земли, слоем толщиной примерно в сто двадцать километров. И называется этот лежащий на земле воздух атмосферой.
Памятка населению по действиям при аварии с выбросом аммиака
В Республики Карелия функционирует более 300 объектов экономики, располагающих значительными запасами опасных химических веществ. По токсичным свойствам и широкому распространению сжиженный аммиак являются одним из наиболее опасных АХОВ.
Аммиак, это бесцветный газ с резким запахом нашатырного спирта, в 1,7 раза легче воздуха, хорошо растворяется в воде. Температура кипения сжиженного аммиака – 33,35°С, так что даже зимой аммиак находится в газообразном состоянии. При температуре минус 77,7°С аммиак затвердевает. При выходе в атмосферу из сжиженного состояния аммиак дымит. Облако аммиака распространяется в верхние слои приземного слоя атмосферы. Поражающее действие в атмосфере и на поверхности объектов сохраняется в течение одного часа.
Аммиак является пожаро и взрывоопасным. Это горючий газ, который горит при наличии постоянного источника огня (при пожаре). При горении выделяет азот и водяной пар. Газообразная смесь аммиака с воздухом (при концентрациях в пределах от 15 до 28 % по объему) взрывоопасна. Температура самовоспламенения 650°С
По физиологическому действию на организм, аммиак относится к группе веществ удушающего и нейротропного действия, способных при ингаляционном поражении вызвать токсический отёк лёгких и тяжёлое поражение нервной системы. Аммиак обладает как местным, так и резорбтивным действием. Пары аммиака сильно раздражают слизистые оболочки глаз и органов дыхания, а также кожные покровы. Вызывают при этом обильное слезотечение, боль в глазах, химический ожог конъюктивы и роговицы, потерю зрения, приступы кашля, покраснение и зуд кожи. При соприкосновении сжиженного аммиака и его растворов с кожей возникает жжение, возможен химический ожог с пузырями, изъязвлениями. Кроме того, сжиженный аммиак при испарении охлаждается, и при соприкосновении с кожей возникает обморожение различной степени.
Запах аммиака ощущается при концентрации 37 мг/м3. Предельно допустимая концентрация в воздухе рабочей зоны производственного помещения составляет 20 мг/м3. Следовательно, если чувствуется запах аммиака, то работать без средств защиты уже опасно. Признаки поражения аммиаком: обильное слезотечение, боль в глазах, потеря зрения, приступообразный кашель; при поражении кожи химический ожог 1 й или 2 й степени.
Аммиак используется при производстве азотной и синильной кислот, мочевины, соды, азотсодержащих солей, удобрений, а также при крашении тканей и серебрении зеркал; как хладоагент в холодильниках; 10 % й водный раствор аммиака известен под названием «нашатырный спирт», 18–20 % й раствор аммиака называется аммиачной водой и используется в качестве удобрения. Аммиак перевозится и часто хранится в сжиженном состоянии под давлением собственных паров (6–18 кгс/см2), а также может храниться в изотермических резервуарах при давлении, близком к атмосферному давлению. При выходе в атмосферу дымит, быстро поглощается влагой.
Поведение в атмосфере. При выбросе паров в воздух очень быстро формируется первичное облако с высокой концентрацией аммиака. Образуется оно очень быстро (в течение 1–3 мин). За это время в атмосферу переходит 18–20 % вещества.
Вторичное облако возникает при испарении аммиака с площади разлива. Характеризуется оно тем, что концентрация его паров на 2–3 порядка ниже, чем в первичном облаке. Однако их продолжительность действия и глубина распространения значительно больше. В таких случаях за внешнюю границу зоны заражения принимают линию, обозначающую среднюю пороговую токсодозу – 15 (мг мин)/л. Продолжительность действия вторичного облака определяется временем испарения разлившегося вещества, которое, в свою очередь, зависит от температуры кипения и летучести вещества, температуры окружающей среды, скорости ветра и характера разлива (свободно или в поддон).
Аммиак почти в 2 раза легче воздуха, а это существенно влияет на глубину его распространения. Так, по сравнению с хлором глубина распространения первичного и вторичного облака, а также площадь зоны заражения будут примерно в 25 раз меньше.Заражает водоёмы при попадании в них.
Правила поведения людей в зоне химического заражения:
Если сигнал о заражении застал на улице, то не следует поддаваться панике. Необходимо сориентироваться, где находится источник возникновения опасности. После этого начать ускоренное движение в сторону, перпендикулярную направлению ветра. Когда на пути движения встретятся препятствия (высокий забор, река, озеро и т.п.), не позволяющие быстро выйти из опасной зоны, а поблизости находится жилое или общественного назначения здание, необходимо временно укрыться в нем. Если это аммиак, укройтесь на первом этаже. Более надежным укрытием в этом случае будут помещения жилых зданий.
Примите меры по герметизации жилых помещений от проникновения в них опасных химических веществ. Для этого заклейте или заделайте подручными средствами щели в оконных рамах, дверях, навесьте на дверные коробки плотную ткань (одеяло), предварительно смочив водой, вентиляционные отверстия прикройте бумагой, полиэтиленовой пленкой, клеенкой.
Первая медицинская помощь при отравлении аммиаком
В зоне заражения: промыть глаза и пораженные участки кожи водой, надеть противогаз и срочно выйти из зоны заражения.
Аммиак
Аммиак представляет собой бинарное неорганическое химическое соединение азота и водорода
Аммиак (Ammonia, нитрид водорода) — химическое соединение азота и водорода с формулой NH3, при нормальных условиях — бесцветный газ с резким характерным запахом.
Плотность аммиака почти в 2 раза меньше, чем у воздуха, ПДКр.з. 20 мг/м 3 — IV класс опасности (малоопасные вещества) по ГОСТ 12.1.007.
Растворимость NH3 в воде чрезвычайно велика — около 1200 объемов (при 0°C) или 700 объемов (при 20°C) в объеме воды.
В холодильной технике носит название R717, где R — Refrigerant (хладагент), 7 — тип хладагента (неорганическое соединение), 17 — молекулярная масса.
Аммиак относится к числу важнейших продуктов химической промышленности, ежегодное его мировое производство превышает 180 млн т.
Молекула аммиака имеет форму треугольной пирамиды с атомом азота в вершине. 3 неспаренных p-электрона атома азота участвуют в образовании полярных ковалентных связей с 1s-электронами 3 х атомов водорода (связи N − H), 4 я пара внешних электронов является неподеленной, она может образовать ковалентную связь по донорно-акцепторному механизму с ионом водорода, образуя ион аммония NH4+.
Несвязывающее 2х-электронное облако строго ориентировано в пространстве, поэтому молекула аммиака обладает высокой полярностью, что приводит к его хорошей растворимости в воде.
Подобно воде, жидкий аммиак сильно ассоциирован, главным образом за счет образования водородных связей.
Жидкий аммиак — хороший растворитель для очень большого числа органических, а также для многих неорганических соединений.
Твердый аммиак — кубические кристаллы.
Аммиак
Используется при производстве азотной кислоты, соды, синильной кислоты и многих других неорганических соединений; удобрений; в органическом синтезе; при крашении тканей; в качестве хладагента в холодильниках. 10%-й раствор аммиака известен под названием �нашатырный спирт�. 18-20%-й раствор аммиака называется аммиачной водой и используется в качестве удобрения.
Сжиженный аммиак при испарении охлаждается, и при соприкосновении с кожей возникает отморожение различной степени, а также возможны ожог и изъязвления.
Водород цианистый (синильная кислота)
Отравление кислотой возможно при вдыхании паров и при попадании внутрь организма. В зависимости от концентрации паров и времени их действия различают поражения легкой, средней и тяжелой степени, а также молниеносную форму.
Через кожу проникает как газообразная, так и жидкая фаза синильной кислоты. Поэтому при длительном пребывании в атмосфере с высокой (более 0,5 г/м 3 ) концентрацией кислоты в противогазе, но без средств защиты кожи, появляются признаки отравления.
Соляная кислота (концентрированная)
Концентрированный рас-твор хлористого водорода в воде с максимальной его концентрацией 38-39%. Кипит при 110 0 С. Негорючая агрессивная жидкость, реагирует с металлами с выделением водорода.
Широко применяется в промышленности. По масштабам использования из АХОВ после аммиака и хлора занимает прочное третье место. Обладает высокими токсическими свойствами, при проливах возможно образование очагов химического поражения на значительных территориях.
При контактном воздействии на коже появляются волдыри, пораженные участки имеют серо-белесоватый цвет. На слизистых оболочках глаз возникают воспалительные явления, наблюдается помутнение роговицы. При вдыхании паров наблюдается охриплость, кашель, одышка, боли в груди.
Применяется в производстве хлоридов металлов, синтетических смол, каучуков, органических красителей, гидролизного спирта, сахара, желатина, клея, для дубления и окраски кожи, при производстве активированного (активного) угля, крашения тканей, травления металлов, в металлургии и нефтедобыче.
Отравление происходит обычно не хлористым водородом, а туманом соляной кислоты, образующейся при взаимодействии газа с водяными парами воздуха. Пары действуют на организм как через органы дыхания, так и через кожу.
Для защиты кожи используют костюмы из кислотостойкой ткани, сапоги, рукавицы, перчатки из кислотостойкой резины.
Находит широкое применение в промышленности, в том числе для отбеливания тканей и бумажной массы, в производстве пластмасс, каучуков, инсектицидов, растворителей, в цветной металлургии, а также в коммунально-бытовом хозяйстве для обеззараживания питьевой воды. Ежегодное потребление хлора в мире исчисляется десятками миллионов тонн.
Защиту органов дыхания на месте аварии и на удалении от места разлива или источника заражения до 500 м должны использоваться изолирующие противогазы и дыхательные аппараты.
Фосген
Используются при получении красителей трифенилметанового ряда, поликарбонатных полимеров, полиуретанов; в производстве мочевины и других химических продуктов.
В ряде стран фосген находился на вооружении в качестве запасно-табельного отравляющего вещества.
Используется главным образом для борьбы с вредителями сельского хозяйства, а также в качестве учебного опасного химического вещества при подгонке средств индивидуальной защиты органов дыхания.
В капельно-жидком состоянии может привести к тяжелым поражениям кожи.
Формальдегид
Используется для получения феноло-формальдегидных смол, изопрена, красителей, взрывчатых веществ, лекарств, а также как дубящее, антисептическое и дезодорирующее средство.
При ингаляционном попадании наблюдаются резкий кашель и одышка, которые сопровождаются �давлением в груди�. На фоне нарушения координации движения присутствует двигательное возбуждении, присутствуют тошнота и рвота. Как следствие возникают судороги и нарушение сознания.
При воздействии на кожу наблюдаются дерматиты с образование пузырей. При ингаляционном поражениях возможны тошнота, рвота, �чувство тяжести� в брюшной полости и диарея. В большинстве случаев не наблюдается раздражение верхних дыхательных путей и слизистых оболочек глаз.
В промышленности его получают как побочный продукт при очистке нефти, природного и коксового газа. Применяется в производстве серной кислоты, серы, сульфидов, сероорганических соединений.
Применяется в качестве растворителя жиров, масел, смол, каучука и парафинов.
Используется в производстве серной кислоты, серного ангидрида, солей серной и серноватистой кислот. Применяется в бумажном и текстильном производстве, а также для дезинфекции помещений. Жидкий с ернистый ангидрид может использоваться как хладагент и растворитель.
Особо опасен при вдыхании, возможно поражение слизистых оболочек.
Наиболее частой причиной поражения организма является ингаляционное поступление, однако известны случаи крайне тяжелых и даже смертельных отравлений при кожно-резорбтивном способе попадании газа в организм человека.
При ликвидации проливов необходимо использование средств защиты кожи.
При концентрации 0,4 г/м 3 возникает опасность острого отравления.
Используется в производстве ускорителей вулканизации, средств защиты растений (инсектициды и фунгициды), лекарств, растворителей и красителей, поверхностно-активных веществ.
Опасен при вдыхании, а также в случаях попадания на кожу.
Применяется в синтезе ускорителей для каучуков, как ингибитор кислотной коррозии металлов, при производстве мыла.
Пары газа действуют раздражающе на слизистые оболочки и кожу.
Вызывает сильное раздражение верхних дыхательных путей, при попадании на кожу приводит к возникновению пузырьковых дерматитов.
При ликвидации проливов фтористого водорода обязательно использование изолирующих средств защиты кожи.