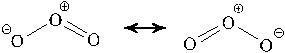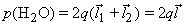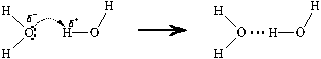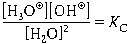Что тяжелее вода или кислород
Кислород – рождающий кислоты
Содержание
Кислород при нормальных условиях (температуре и давлении) представляет собой прозрачный газ без запаха, вкуса и цвета. Не относится к горючим газам, но способен активно поддерживать горение.
По химической активности среди неметаллов он занимает второе место после фтора.
Все элементы, кроме благородных металлов (платина, золото, серебро, родий, палладий и др.) и инертных газов (гелий, аргон, ксенон, криптон и неон), вступают в реакцию окисления и образовывают оксиды. Процесс окисления элементов, как правило, носит экзотермический (с выделением теплоты) характер. Также необходимо учитывать тот факт, что при повышении температуры, давления или использовании катализаторов – скорость реакции окисления резко возрастает.
История открытия кислорода
Открытие кислорода приписывают Джозефу Пристли (Joseph Priestley). У него была лаборатория, оборудованная приборами для собирания газов. Он испытывал его физиологическое действие на себе и на мышах. Пристли установил, что после вдыхания газа некоторое время ощущается приятная легкость. Мыши в герметически закрытой банке с воздухом задыхаются быстрей, чем в банке с O2. Поскольку Пристли был приверженцем флогистонной теории он так и не узнал, что оказалось у него в руках. Он только описал этот газ, даже не догадываясь, что он описал. А вот лавры открытия кислорода принадлежат Антуан Лоран Лавуазье (Antoine Laurent de Lavoisier), который и дал ему имя.
Лавуазье, поставил свой знаменитый опыт, продолжавшийся 12 дней. Он нагревал ртуть в реторте. При кипении образовывалась ее красная окись. Когда реторту охладили, оказалось, что воздуха в ней убыло почти на 1/6 его объема, а остаток ртути весил меньше, чем перед нагревом. Но когда разложили окись ртути сильным прокаливанием, все вернулось: и недостача ртути, и «исчезнувший» кислород.
Впоследствии Лавуазье установил, что этот газ входит в состав азотной, серной, фосфорной кислот. Он ошибочно полагал, что O2 обязательно входит в состав кислот, и поэтому назвал его «оксигениум», что значит «рождающий кислоты». Теперь хорошо известны кислоты, лишенные «оксигениума» (например: соляная, сероводородная, синильная и др.).
Способы получения кислорода
В основном кислород получают тремя способами:
Из атмосферного воздуха его получают методом глубокого охлаждения, как побочный продукт при получении азота.
Также O2 добывают путем пропускания электрического тока через воду (электролиз воды) с попутным получением водорода.
Химические способ получения малопроизводителен, а, следовательно, и неэкономичен, он не нашел широкого применения и используются в лабораторной практике.
Наверно многие помнят химический опыт, когда в колбе нагревают марганцовку (перманганат калия KMnO4), а потом выделяющийся в процессе нагрева газ собирают в другую колбу?
Применение кислорода
Помимо того, что все живые существам в природе, за исключением немногих микроорганизмов, при дыхании потребляют кислород, он широко применяется во многих отраслях промышленности: металлургической, химической, машиностроении, авиации, ракетостроении и даже в медицине.
В химической промышленности его применяет:
В металлургии его используют:
В медицинских целях больным, у которых нарушена нормальная деятельность органов дыхания или кровообращения, искусственно увеличивают содержание O2 в воздухе или дают дышать непродолжительное время чистым O2. Медицинский кислород, выпускаемый ГОСТ 5583, особенно тщательно очищают от всех примесей.
Применение кислорода в сварке
Сам по себе O2 является негорючим газом, но из-за свойства активно поддерживать горение и увеличения интенсивности (интенсификации) горения газов и жидкого топлива его используют в ракетных энергетических установках и во всех процессах газопламенной обработки. В таких процессах газопламенной обработки, как газовая сварка, поверхностная закалка высокая температура пламени достигается путем сжигания горючих газов в O2, а при газовой резке благодаря ему происходит окисление и сгорание разрезаемого металла.
При полуавтоматической сварке (MIG/MAG) кислород O2 используют как компонент защитных газовых смесей с аргоном (Ar) или углекислым газом (CO2).
Кислород добавляют в аргон при полуавтоматической сварке легированных сталей для обеспечения устойчивости горения дуги и струйного переноса расплавленного металла в сварочную ванну. Дело в том, что как поверхностно активный элемент он уменьшает поверхностное натяжение жидкого металла, способствуя образованию на конце электрода более мелких капель.
При сварке низколегированных и низкоуглеродистых сталей полуавтоматом O2 добавляют в углекислый газ для обеспечения глубокого проплавления и хорошего формирования сварного шва, а также для уменьшения разбрызгивания.
Чаще всего кислород используют в газообразном виде, а в виде жидкости используют только при его хранении и транспортировке от завода-изготовителя до потребителей.
Вредность и опасность кислорода
За внешней безобидностью скрывается очень опасный газ, но об этом на нашем сайте опубликована статья про маслоопасность и взрывоопасность кислорода и мы не будем здесь дублировать информацию.
Хранение и транспортировка кислорода
Кислород газообразный технический и медицинский выпускают по ГОСТ 5583.
Хранят и транспортируют его в стальных баллонах ГОСТ 949 под давлением 15 МПа. Кислородные баллоны окрашены в синий цвет с надписью черными буквами «КИСЛОРОД».
Жидкий кислород выпускается по ГОСТ 6331. O2 находится в жидком состоянии только при получении, хранении и транспортировке. Для газовой сварки или газовой резки его необходимо снова превратить в газообразное состояние.
Характеристики кислорода
Характеристики O2 представлены в таблицах ниже:
Коэффициент перевода объема и массы O2 при Т=15°С и Р=0,1 МПа
| Масса, кг | Объем | |
|---|---|---|
| Газ, м 3 | Жидкость, л | |
| 1,337 | 1 | 1,172 |
| 1,141 | 0,853 | 1 |
| 1 | 0,748 | 0,876 |
Коэффициенты перевода объема и массы O2 при Т=0°С и Р=0,1 МПа
| Масса, кг | Объем | |
|---|---|---|
| Газ, м 3 | Жидкость, л | |
| 1,429 | 1 | 1,252 |
| 1,141 | 0,799 | 1 |
| 1 | 0,700 | 0,876 |
Кислород в баллоне
| Наименование | Объем баллона, л | Масса газа в баллоне, кг | Объем газа (м 3 ) при Т=15°С, Р=0,1 МПа |
|---|---|---|---|
| O2 | 40 | 8,42 | 6,3 |
Благодаря этой таблице теперь можно легко дать ответы на вопросы, которые очень часто задают сварщики:
Что тяжелее вода или кислород
Название «водород»относится и к химическому элементу, и к простому веществу. Элемент водород состоит из атомов водорода. Простое вещество водород состоит из молекул водорода.
а) Химический элемент водород
В естественном ряду элементов порядковый номер водорода – 1. В системе элементов водород находится в первом периоде в IA или VIIA группе.
Водород – один из самых распространенных элементов на Земле. Молярная доля атомов водорода в атмосфере, гидросфере и литосфере Земли (все вместе это называется земной корой) равна 0,17. Он входит в состав воды, многих минералов, нефти, природного газа, растений и животных. В теле человека в среднем содержится около 7 килограммов водорода.
Существуют три изотопа водорода:
а) легкий водород 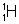
б) тяжелый водород 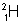
в) сверхтяжелый водород 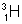
Тритий неустойчивый (радиоактивный) изотоп, поэтому в природе он практически не встречается. Дейтерий устойчив, но его очень мало: wD = 0,015% (от массы всего земного водорода). Поэтому атомная масса водорода очень мало отличается от 1 Дн (1,00794 Дн).
Из предыдущих разделов курса химии вам уже известны следующие характеристики атома водорода:
Атомный номер
Заряд ядра
Число протонов в ядре
Электронная формула атома
Форма граничной поверхности ЭО
Орбитальный радиус атома
Молярная энергия ионизации
Z = +1e
Z = 1
1s 1
Сфера
ro(H) = 0,53 A = 0,053 нм
E m и(H) = 1312 кДж/моль
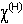 = 2,10
= 2,10Валентные возможности атома водорода определяются наличием одного электрона на единственной валентной орбитали. Большая энергия ионизации делает атом водорода не склонным к отдаче электрона, а не слишком высокая энергия сродства к электрону приводит к незначительной склонности его принимать. Следовательно, в химических системах образование катиона Н 

В простом веществе степень окисления атомов водорода равна нулю, в большинстве соединений водород проявляет степень окисления +I, и только в гидридах наименее электроотрицательных элементов у водорода степень окисления –I.
Сведения о валентных возможностях атома водорода приведены в таблице 28. Валентное состояние атома водорода, связанного одной ковалентной связью с каким-либо атомом, в таблице обозначено символом «H—».
Валентное состояние
Примеры химических веществ
HCl, H2O, H2S, NH3, CH4, C2H6, NH4Cl, H2SO4, NaHCO3, KOH
H2
B2H6, SiH4, GeH4
в) Молекула водорода
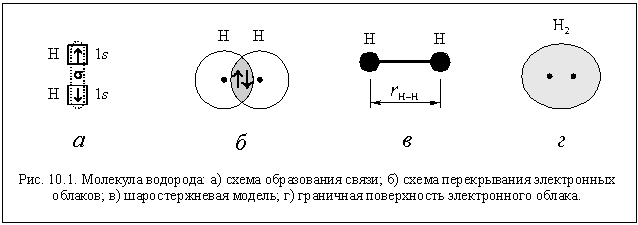
Двухатомная молекула водорода Н2 образуется при связывании атомов водорода единственной возможной для них ковалентной связью. Связь образуется по обменному механизму. По способу перекрывания электронных облаков это s-связь (рис. 10.1 а). Так как атомы одинаковы, связь неполярная.
Межатомное расстояние (точнее равновесное межатомное расстояние, ведь атомы-то колеблются) в молекуле водорода r(H–H) = 0,74 A (рис.10.1 в), что значительно меньше суммы орбитальных радиусов (1,06 A). Следовательно, электронные облака связываемых атомов перекрываются глубоко (рис. 10.1 б), и связь в молекуле водорода прочная. Об этом же говорит и довольно большое значение энергии связи (454 кДж/моль).
Если охарактеризовать форму молекулы граничной поверхностью (аналогичной граничной поверхности электронного облака), то можно сказать, что молекула водорода имеет форму слегка деформированного (вытянутого) шара (рис. 10.1 г).
г) Водород (вещество)
Zn + H2SO4 = ZnSO4 + H2.
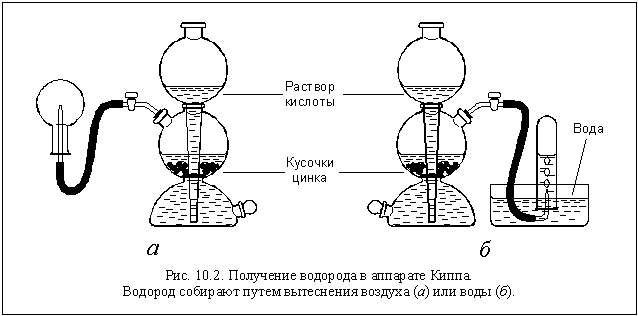
Вместо цинка можно использовать железо, алюминий и некоторые другие металлы, а вместо серной кислоты – некоторые другие разбавленные кислоты. Образующийся водород собирают в пробирку методом вытеснения воды (см. рис. 10.2 б) или просто в перевернутую колбу (рис. 10.2 а).
В промышленности в больших количествах водород получают из природного газа (в основном это метан) при взаимодействии его с парами воды при 800 °С в присутствии никелевого катализатора:
или обрабатывают при высокой температуре парами воды уголь:
Чистый водород получают из воды, разлагая ее электрическим током (подвергая электролизу):
2H2O = 2H2+ O2
(электролиз).
д) Соединения водорода
Гидриды (бинарные соединения, содержащие водород) делятся на два основных типа:
а) летучие (молекулярные) гидриды,
б) солеобразные (ионные) гидриды.
Элементы IVА – VIIA групп и бор образуют молекулярные гидриды. Из них устойчивы только гидриды элементов, образующих неметаллы:
И ионные, и почти все молекулярные гидриды (кроме Н2О и НF) являются восстановителями, но ионные гидриды проявляют восстановительные свойства значительно сильнее, чем молекулярные.
Кроме гидридов, водород входит в состав гидроксидов и некоторых солей. Со свойствами этих, более сложных, соединений водорода вы познакомитесь в следующих главах.
Главными потребителями получаемого в промышленности водорода являются заводы по производству аммиака и азотных удобрений, где аммиак получают непосредственно из азота и водорода:
N2 +3H2 
В больших количествах водород используют для получения метилового спирта (метанола) по реакции 2Н2 + СО = СН3ОН (t, ZnO – катализатор), а также в производстве хлороводорода, который получают непосредственно из хлора и водорода:
Иногда водород используют в металлургии в качестве восстановителя при получении чистых металлов, например: Fe2O3 + 3H2= 2Fe + 3H2O.
а) MH + O2 MOH (t); б) MH + Cl2
MCl + HCl (t);
в) MH + H2O MOH + H2; г) MH + HCl(p)
MCl + H2
Здесь М – это литий, натрий, калий, рубидий или цезий. Составьте уравнения соответствующих реакций в случае, если М – натрий. Проиллюстрируйте уравнениями реакций химические свойства гидрида кальция.
14.Используя метод электронного баланса, составьте уравнения следующих реакций, иллюстрирующих восстановительные свойства некоторых молекулярных гидридов:
а) HI + Cl2 HCl + I2 (t); б) NH3 + O2
H2O + N2 (t); в) CH4 + O2
H2O + CO2 (t).
Как и в случае водорода, слово «кислород» является названием и химического элемента, и простого вещества. Кроме простого вещества «кислород» (дикислород) химический элемент кислородобразует еще одно простое вещество, называемое » озон»(трикислород). Это аллотропные модификации кислорода. Вещество кислород состоит из молекул кислорода O2, а вещество озон состоит из молекул озона O3.
а) Химический элемент кислород
В естественном ряду элементов порядковый номер кислорода – 8. В системе элементов кислород находится во втором периоде в VIA группе.
Кислород – самый распространенный элемент на Земле. В земной коре каждый второй атом – атом кислорода, то есть молярная доля кислорода в атмосфере, гидросфере и литосфереЗемли – около 50 %. Кислород (вещество) – составная часть воздуха. Объемная доля кислорода в воздухе –21 %. Кислород (элемент) входит в состав воды, многих минералов, а также растений и животных. В теле человека содержится в среднем 43 кг кислорода.
Природный кислород состоит из трех изотопов ( 16 О, 17 О и 18 О), из которых наиболее распространен самый легкий изотоп 16 О. Поэтому атомная масса кислорода близка к 16 Дн (15,9994 Дн).
Вам известны следующие характеристики атома кислорода.
Атомный номер
Заряд ядра
Число протонов в ядре
Электронная формула атома
Орбитальный радиус атома
Молярная энергия ионизации
Молярная энергия сродства к электрону
Z = 8
Z = +8 e
Z = 8
1s 2 2s 2 2p 4
ro(O) = 0,45 A = 0,045 нм
E m и(O) = 1314 кДж/моль
Ес m (O) = 141 кДж/моль
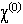 = 3,50
= 3,50Таблица 29. Валентные возможности атома кислорода
Валентное состояние
Примеры химических веществ
H2O, SO2, SO3, CO2, SiO2, H2SO4, HNO2, HClO4, COCl2, H2O2
O2**
O2F2
OF2
NaOH, KOH, Ca(OH)2, Ba(OH)2
Na2O2, K2O2, CaO2, BaO2
Li2O, Na2O, MgO, CaO, BaO, FeO, La2O3
в) Молекула кислорода
Экспериментально установлено, что двухатомная молекула кислорода О2 содержит два неспаренных электрона. Используя метод валентных связей, такое электронное строение этой молекулы объяснить невозможно. Тем не менее, связь в молекуле кислорода близка по свойствам к ковалентной. Молекула кислорода неполярна. Межатомное расстояние (ro–o = 1,21 A = 121 нм) меньше, чем расстояние между атомами, связанными простой связью. Молярная энергия связи довольно велика и составляет 498 кДж/моль.
г) Кислород (вещество)
При обычных условиях кислород – газ без цвета и запаха. Твердый кислород плавится при 55 К (–218 °С), а жидкий кислород кипит при 90 К (–183 °С).
Межмолекулярные связи в твердом и жидком кислороде несколько более прочные, чем в водороде, о чем свидетельствует больший температурный интервал существования жидкого кислорода (36 °С) и большие, чем у водорода, молярные теплоты плавления (0,446 кДж/моль) и парообразования (6,83 кДж/моль).
Кислород незначительно растворим в воде: при 0 °С в 100 объемах воды (жидкой!) растворяется всего 5 объемов кислорода (газа!).
Высокая склонность атомов кислорода к присоединению электронов и высокая электроотрицательность приводят к тому, что кислород проявляет только окислительные свойства. Эти свойства особенно ярко проявляются при высокой температуре.
Кислород реагирует со многими металлами: 2Ca + O2 = 2CaO, 3Fe + 2O2 = Fe3O4 (t);
неметаллами: C + O2 = CO2, P4 + 5O2 = P4O10,
и сложными веществами: CH4 + 2O2 = CO2 + 2H2O, 2H2S + 3O2 = 2H2O + 2SO2.
Чаще всего в результате таких реакций получаются различные оксиды (см. гл. II § 5), но активные щелочные металлы, например натрий, сгорая, превращаются в пероксиды:
Структурная формула получившегося пероксида натрия (Na 


Тлеющая лучинка, помещенная в кислород, вспыхивает. Это удобный и простой способ обнаружения чистого кислорода.
В промышленности кислород получают из воздуха путем ректификации (сложной разгонки), а в лаборатории – подвергая термическому разложению некоторые кислородсодержащие соединения, например:
2KMnO4 = K2MnO4 + MnO2 + O2(200 °С);
2KClO3 = 2KCl + 3O2 (150 °С, MnO2 – катализатор);
2KNO3 = 2KNO2 + 3O2 (400 °С)
и, кроме того, путем каталитического разложения пероксида водорода при комнатной температуре: 2H2O2 = 2H2O + O2 (MnO2–катализатор).
Чистый кислород используют в промышленности для интенсификации тех процессов, в которых происходит окисление, и для создания высокотемпературного пламени. В ракетной технике в качестве окислителя используется жидкий кислород.
Огромное значение имеет кислород для поддержания жизнедеятельности растений, животных и человека. В обычных условиях человеку достаточно для дыхания кислорода воздуха. Но в условиях, когда воздуха не хватает, или он вообще отсутствует (в самолетах, при водолазных работах, в космических кораблях и т. п.), для дыхания готовят специальные газовые смеси, содержащие кислород. Применяют кислород и в медицине при заболеваниях, вызывающих затруднение дыхания.
д) Озон и его молекулы
Озон O3 – вторая аллотропная модификация кислорода.
Трехатомная молекула озона имеет уголковую структуру, среднюю между двумя структурами, отображаемыми следующими формулами:
Озон – темно-синий газ с резким запахом. Из-за своей сильной окислительной активности он ядовит. Озон в полтора раза «тяжелее» кислорода и несколько больше, чем кислород, растворим в воде.
Озон образуется в атмосфере из кислорода при грозовых электрических разрядах:
3О2 = 2О3 (
При обычной температуре озон медленно превращается в кислород, а при нагревании этот процесс протекает со взрывом.
Озон содержится в так называемом «озоновом слое» земной атмосферы, предохраняя все живое на Земле от вредного воздействия солнечного излучения.
В некоторых городах озон используется вместо хлора для дезинфекции (обеззараживания) питьевой воды.
Определите валентность и степень окисления каждого из атомов кислорода.
2.Составьте уравнения реакций сгорания в кислороде лития, магния, алюминия, кремния, красного фосфора и селена (атомы селена окисляются до степени окисления +IV, атомы остальных элементов – до высшей степени окисления). К каким классам оксидов относятся продукты этих реакций?
3.Сколько литров озона можно получить (при нормальных условиях) а) из 9 л кислорода, б) из 8 г кислорода?
Вода – самое распространенное в земной коре вещество. Масса земной воды оценивается в 10 18 тонн. Вода – основа гидросферы нашей планеты, кроме того, она содержится в атмосфере, в виде льда образует полярные шапки Земли и высокогорные ледники, а также входит в состав различных горных пород. Массовая доля воды в человеческом организме составляет около 70 %.
Вода – единственное вещество, у которого во всех трех агрегатных состояниях есть свои особые названия.
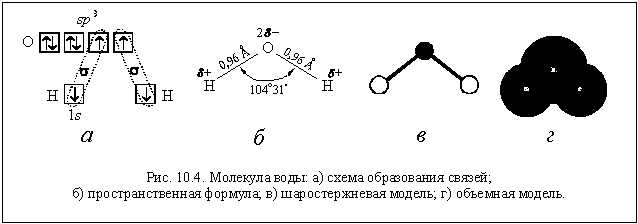
Электронное строение молекулы воды (рис. 10.4 а) нами было подробно изучено ранее (см. § 7.10).
Из-за полярности связей О–Н и уголковой формы молекула воды представляет собой электрический диполь.
| Электрический диполь – частица (или тело), несущая равные по модулю положительный и отрицательный заряды, не совпадающие в пространстве. |
Для характеристики полярности электрического диполя используется физическая величина, называемая «электрический момент электрического диполя» или просто «дипольный момент»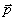
| Электрический момент электрического диполя (дипольный момент) – произведение положительного заряда диполя на вектор расстояния между заряженными концами диполя. |
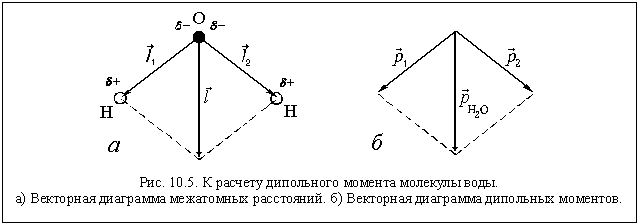
В молекуле воды – две полярные ковалентные связи, то есть два электрических диполя, каждый из которых обладает своим дипольным моментом (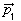
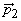
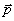
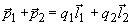
где q1 и q2 – частичные заряды ( +) на атомах водорода, а 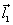
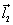
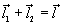
Экспериментально определенные дипольные моменты молекулы воды и некоторых других молекул приведены в таблице.
Зная дипольные моменты, можно рассчитать частичные заряды на атомах. Так частичный заряд на атоме водорода равен 0,33 е, а частичный заряд на атоме кислорода равен –0,66 е.
Учитывая дипольный характер молекулы воды, ее часто схематически изображают следующим образом: 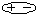
Чистая вода – бесцветная жидкость без вкуса и запаха. Некоторые основные физические характеристики воды приведены в таблице.
Физические величины
Молярный объем при 4 °С
18 мл
0 ° С
100 ° С
6,01 кДж/моль
40,7 кДж/моль
Большие значения молярных теплот плавления и парообразования (на порядок больше, чем у водорода и кислорода) свидетельствуют о том, что молекулы воды, как в твердом, так и в жидком веществе, довольно прочно связаны между собой. Эти связи называют «водородными связями».

2.При перекрывании каких орбиталей образуются связи между водородом и кислородом в молекуле воды?
3.Составьте схему образования связей в молекуле пероксида водорода H2O2. Что вы можете сказать о пространственном строении этой молекулы?
4.Межатомные расстояния в молекулах HF, HCl и HBr равны, соответственно, 0,92; 1,28 и 1,41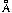
5.Межатомные расстояния S – H в молекуле сероводорода равны 1,34 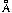
В последней структурной формуле тремя точками (пунктирный штрих, а не электроны!) показана водородная связь.
| Водородная связь – межмолекулярная связь, образованная за счет частичного акцептирования неподеленной пары электронов атома не связанным с ним химической связью атомом водорода. |
Водородная связь существует не только между молекулами воды. Она образуется, если соблюдаются два условия:
1) в молекуле есть сильно полярная связь Н–Э (Э – символ атома достаточно электроотрицательного элемента),
2) в молекуле есть атом Э с большим отрицательным частичным зарядом и неподеленной парой электронов.
В качестве элемента Э может быть фтор, кислород и азот. Существенно слабее водородные связи, если Э – хлор или сера.
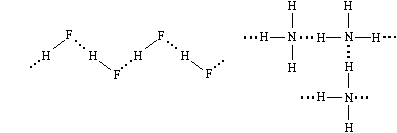
Примеры веществ с водородной связью между молекулами: фтороводород, твердый или жидкий аммиак, этиловый спирт и многие другие.
В жидком фтороводороде его молекулы связаны водородными связями в довольно длинные цепи, а в жидком и твердом аммиаке образуются трехмерные сетки.
По прочности водородная связь – промежуточная между химической связью и остальными видами межмолекулярных связей. Молярная энергия водородной связи обычно лежит в пределах от 5 до 50 кДж/моль.
В твердой воде (то есть в кристаллах льда) все атомы водорода связаны водородными связями с атомами кислорода, при этом каждый атом кислорода образует по две водородные связи (используя обе неподеленные пары электронов). Такая структура делает лед более » рыхлым»по сравнению с жидкой водой, где часть водородных связей оказывается разорванной, и молекулы получают возможность несколько плотнее » упаковаться». Эта особенность структуры льда объясняет, почему, в отличие от большинства других веществ, вода в твердом состоянии имеет меньшую плотность, чем в жидком. Максимальной плотности вода достигает при 4 °С –при этой температуре рвется достаточно много водородных связей, а тепловое расширение еще не очень сильно сказывается на плотности.
Водородные связи имеют очень большое значение в нашей жизни. Представим себе на минуту, что водородные связи перестали образовываться. Вот некоторые последствия:
Приведенных примеров достаточно, чтобы понять, что в этом случае природа на нашей планете стала бы совсем иной.

2.Водородные связи существуют не только в индивидуальных веществах, но и в растворах. Покажите с помощью структурных формул, как образуются водородные связи в водном растворе а) аммиака, б) фтороводорода, в) этанола (этилового спирта).
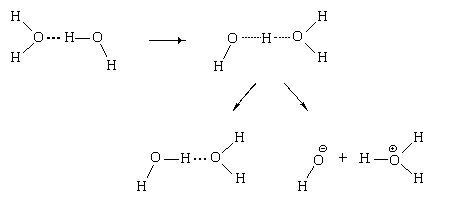
Наличие водородных связей в жидкой воде объясняет еще одно интересное и важное свойство этого вещества – ее автопротолиз.
Рассмотрим, что происходит с двумя молекулами воды, связанными водородной связью.
За счет тепловых колебаний атом водорода, образующий водородную связь, может на мгновение занять промежуточное положение между атомами кислорода. Из частицы с таким атомом водорода с равной вероятностью могут образоваться как исходные молекулы воды, связанные водородными связями, так и два иона: гидроксид-ион и ион оксония:
То есть, в воде протекает реакция 2Н2О = Н3О 

Также легко происходит и обратный процесс – образование двух молекул воды при столкновении иона оксония с гидроксид-ионом: Н3О 

Обе эти реакции протекают в воде постоянно и с равной скоростью, следовательно, в воде существует равновесие: 2Н2О AН3О 

Это равновесие называется равновесием автопротолиза воды.
| Автопротолиз –обратимый процесс образования равного числа катионов и анионов из незаряженных молекул жидкого индивидуального вещества за счет передачи протона от одной молекулы к другой. |
Прямая реакция этого обратимого процесса эндотермична, поэтому при нагревании автопротолиз усиливается, при комнатной же температуре равновесие сдвинуто влево, то есть концентрация ионов Н3О 

По закону действующих масс
Но из-за того, что число прореагировавших молекул воды по сравнению с общим числом молекул воды незначительно, можно считать, что концентрация воды при автопротолизе практически не изменяется, и [H2O] 2 = const. Тогда
Произведение KC· [H2O] 2 – величина постоянная. Она называется константой автопротолиза воды (устаревшее название – ионное произведение воды) и обозначается 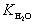
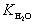


Как и константа равновесия, константа автопротолиза воды зависит от температуры. Экспериментально установлено, что при 25 °С константа автопротолиза воды
Отсюда следует, что при этих условиях в чистой воде
с(Н3О 

При увеличении температуры значение константы автопротолиза воды несколько возрастает.
Такая низкая концентрация разноименно заряженных ионов в чистой воде объясняет, почему эта жидкость, хоть и плохо, но все же проводит электрический ток.
2. Получение кислорода и горение веществ в нем (окислительные свойства).


Сервер создается при поддержке Российского фонда фундаментальных исследований
Не разрешается копирование материалов и размещение на других Web-сайтах
Вебдизайн: Copyright (C) И. Миняйлова и В. Миняйлов
Copyright (C) Химический факультет МГУ
Написать письмо редактору