Что усиливает реакцию в химии
Виды и особенности катализаторов химических реакций
Химическая реакция – это процесс превращения реагентов в продукты реакции. Многие превращения в химии имеют очень долгий срок протекания, что абсолютно недопустимо для промышленности или для организма человека. Колоссальное ускорение превращений как в промышленности, так и в живых организмах, обеспечивают катализаторы химических реакций. Рассмотрим этот вопрос подробнее.
Что такое катализатор реакции?
Речь идет о веществе, которое способно ускорять протекание превращения многократно. Процесс в химии, протекающий в присутствии ускорителей превращений, называется катализом. Катализ характеризуется тем, что вещество, ускоряющее химический процесс, не расходует в ходе протекания последнего, а также не входит в состав конечных продуктов.
Катализ по своему результату может быть двух видов: положительный и отрицательный. Положительный катализ приводит к увеличению скорости превращения. Отрицательный катализ приводит к замедлению или прекращению протекания химического превращения. Вещества, реализующие, отрицательный катализ называются ингибиторами.
Разновидности веществ, ускоряющих химические реакции
Существуют две общепризнанных классификации веществ, которые ускоряют протекания превращений в химии. Первая основывается на агрегатном состоянии катализатора, вторая – на происхождении.
Классификация по агрегатному состоянию
По агрегатному состоянию вещества каталитические соединения можно подразделить на гомогенные и гетерогенные. Гомогенные вещества, ускоряющие химическую реакцию, находятся в одной фазе с реагентами. Гетерогенные вещества, ускоряющие химическое превращение, находятся в разных фаза с реагентами (например, катализатор представлен жидкость, а реагенты – газами).
Свойства гомогенных ускорителей реакции
К данной группе соединений относятся кислоты и основания. Например, серная кислота ускоряет протекание превращение органических субстратов. Основными свойствами гомогенных соединений являются:
Свойства гетерогенных ускорителей реакции
К данной группе соединений относятся оксиды большинства металлов (Al2O3, CaO, BaO, MgO, TiO2), а также алюмосиликаты и цеолиты. Обозначим основные свойства гетерогенных каталитических веществ:
Классификация по происхождению
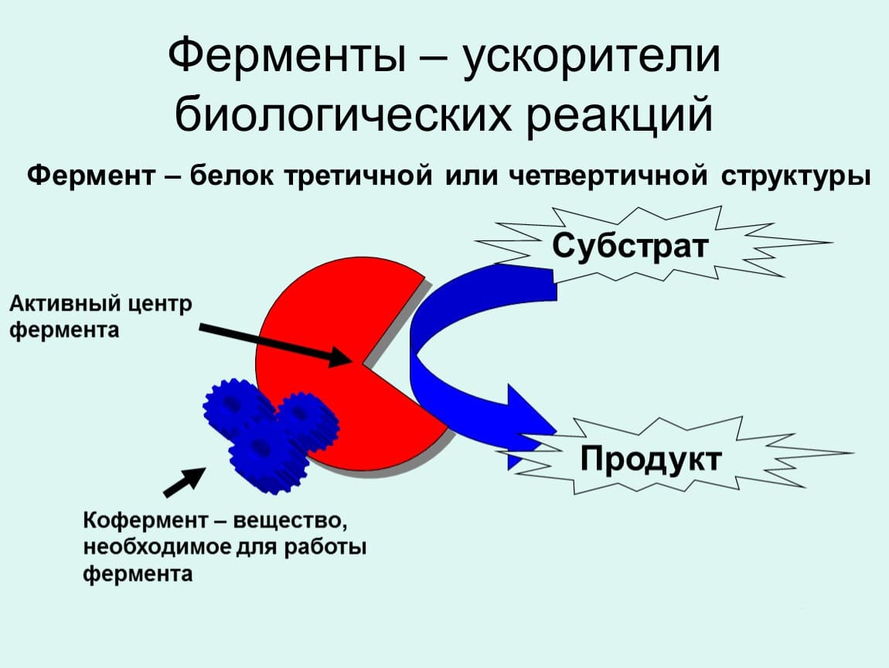
По происхождению вещества, ускоряющие процесс протекания превращений в химии, подразделяются на органические и неорганические. Неорганические соединения в основном представлены тяжелыми металлами (свинец, палладий), спектр органический соединений намного шире. Основными представителями органических ускорителей превращений являются энзимы (соединения биологического происхождения). Энзимы – это катализаторы, увеличивающие скорость химических реакций в живых организмах. Ферменты (энзимы) имеют следующие особенности:
Свойства катализаторов
Каталитические вещества, ускоряющие протекание реакций в химии, имеют определенные свойства. Обозначим их:
Другие свойства каталитические соединений связаны с их строением и физическими параметрами:
Каталитические системы на основе катализаторов
Современные промышленные каталитические смеси состоят из нескольких компонентов:
Промотор
Добавление промоторов к каталитическому соединению улучшает следующие свойства последних: активность, избирательность и стабильность в системе. Сам по себе промотор может являться соединением, которое не участвует в протекающем процессе. По своему назначению активаторы подразделяются на две большие группы:
Также промоторы подразделены на две большие группы структурообразующие (инертные соединения, предотвращающие слипание частиц) и активирующие (изменяют электронную конфигурацию каталитического соединения в активную фазу катализа).
Носитель
Носитель представляет собой материю, на которую различными методами укладывают катализатор. При использовании носителя увеличивается площадь поверхности действия каталитического соединения, повышается его термостойкость. Благодаря использованию носителей возможна экономия в промышленных условиях достаточно дорогих каталитических элементов (палладий, никель, платина, серебро). Однако стоит отметь, что носитель также может положительно влиять на активность каталитического соединения, поэтому нельзя провести четкую границу между этими двумя понятиями. Носителями могут быть оксид алюминия, силикагель, пемза, каолин, асбест, алюмосиликаты и другие вещества.
Классификация реакций
Существует несколько классификаций реакций, протекающих в неорганической и органической химии.
По характеру процесса
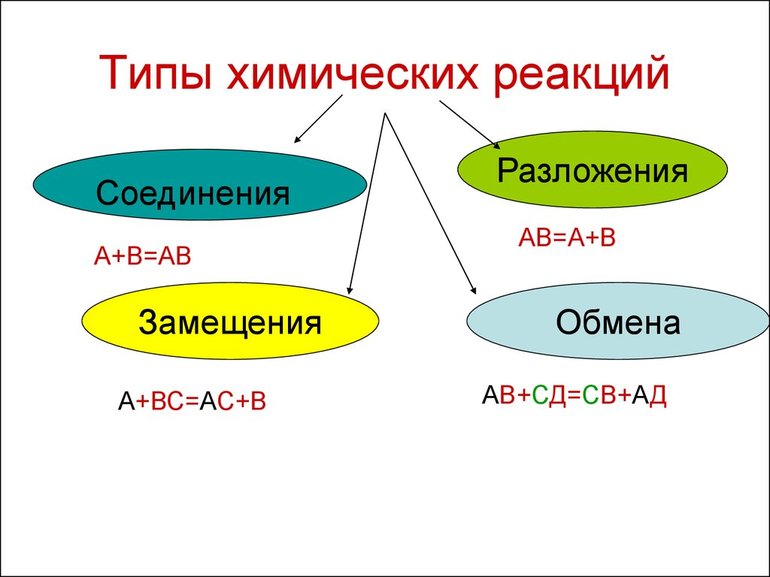
Так называют химические реакции, где из нескольких простых или сложных веществ получается одно сложное вещество. Примеры:
В результате реакции разложения сложное вещество распадается на несколько сложных или простых веществ. Примеры:
В ходе реакций замещения атом или группа атомов в молекуле замещаются на другой атом или группу атомов. Примеры:
К реакциям обмена относятся те, которые протекают без изменения степеней окисления и выражаются в обмене компонентов между веществами. Часто обмен происходит анионами/катионами:
AgF + NaCl = AgCl↓ + NaF
Окислительно-восстановительные реакции (ОВР)
Замечу, что окислителем и восстановителем могут являться только исходные вещества (а не продукты!) Окислитель всегда понижает свою СО, принимая электроны в процессе восстановления. Восстановитель всегда повышает свою СО, отдавая электроны в процессе окисления.
ОВР уравнивают методом электронного баланса, с которым мы подробно познакомимся в разделе «Решения задач».
Обратимые и необратимые реакции
Классическим примером обратимой реакции является синтез аммиака и реакция этерификации (из органической химии):
Необратимые реакции протекают только в одном направлении, до полного расходования одного из исходных веществ. Главное отличие их от обратимых реакций в том, что образовавшиеся продукты реакции не взаимодействуют между собой с образованием исходных веществ.
Примеры необратимых реакций:
NaOH + HCl = NaCl + H2O (образуется вода)
2Na + 2H2O = 2NaOH + H2 (сопровождается выделением большого количества тепла)
Реакции и агрегатное состояние фаз
Фазой в химии называют часть объема равновесной системы, однородную во всех своих точках по химическому составу и физическим свойствам и отделенную от других частей того же объема поверхностью раздела. Фаза бывает жидкой, твердой и газообразной.
К гетерогенным реакциям относятся следующие реакции (примеры): жидкость + газ, газ + твердое вещество, твердое вещество + жидкость. Примером такой реакции может послужить взаимодействие твердого цинка и раствора соляной кислоты:
К гомогенным реакциям относятся (примеры): жидкость + жидкость, газ + газ. Примером такой реакции может служить взаимодействие между растворами уксусной кислоты и едкого натра.
Реакции и их тепловой эффект
NaOH + HCl = NaCl + H2O + 56 кДж
К экзотермическим реакциям часто относятся реакции горения, соединения.
Исключением является взаимодействие азота и кислорода, при котором тепло поглощается:
Как уже было отмечено выше, если тепло выделяется во внешнюю среду, значит, система реагирующих веществ потеряло это тепло. Поэтому не должно казаться противоречием, что внутренняя энергия веществ в результате экзотермической реакции уменьшается.
Энтальпией называют (обозначение Н), количество термодинамической (тепловой) энергии, содержащееся в веществе. Иногда с целью «запутывания» в реакции вместо явного +Q при экзотермической реакции могут написать ΔH 0, так как внутренняя энергия веществ увеличивается. Например:
CaCO3 = CaO + CO2↑ ; ΔH > 0 (значит реакция эндотермическая, так как внутренняя энергия увеличивается)
Замечу, что не все реакции разложения являются эндотермическими. Широко известная реакция разложения дихромата аммония («вулканчик») является примером экзотермического разложения, при котором тепло выделяется.
© Беллевич Юрий Сергеевич 2018-2021
Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение (в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования, обратитесь, пожалуйста, к Беллевичу Юрию.
Химическое равновесие
Принцип Ле Шателье
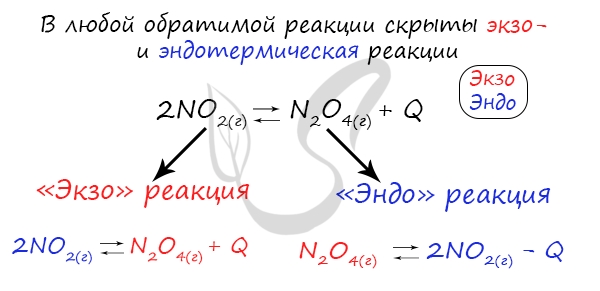
В 1884 году французским химиком Анри Ле Шателье был предложен принцип, согласно которому, если на систему, находящуюся в состоянии равновесия, оказать внешнее воздействие (изменить температуру, давление, концентрацию), то система будет стремиться компенсировать внешнее воздействие.
Это принцип обоснован термодинамически и доказан. Однако в такой абстрактной формулировке его сложно применить для решения конкретных задач по химическому равновесию. В этой статье я покажу конкретные примеры и обозначу алгоритм действия, чтобы вы могли успешно справляться с заданиями.
Влияние изменения концентрации на химическое равновесие
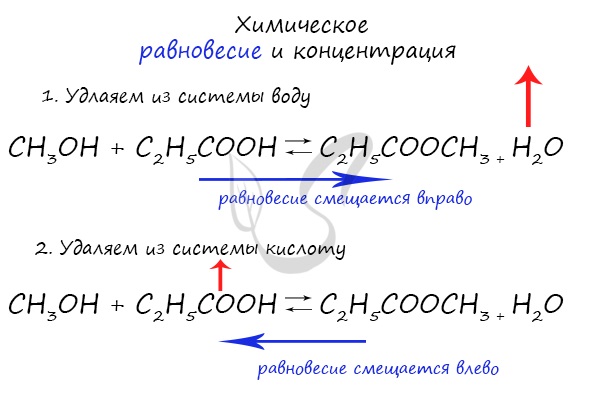
При увеличении концентрации какого-либо компонента химической реакции, система будет стремиться восстановить равновесие: равновесие будет смещаться в сторону расходования добавленного компонента.
Если мы попытаемся удалить какое-либо вещество из системы (уменьшить его концентрацию), то система будет стремиться заполнить «пустое» место, которые мы создали. Наглядно демонстрирую на примере:
Изменения давления и химическое равновесие
Если речь в задании идет об изменении давления, то первое, что нужно сделать, это посчитать количество газов в уравнении слева и справа. Твердые вещества и жидкости считать не нужно. Например:
В случае, если слева и справа количество молекул газа одинаково, например, в реакции:
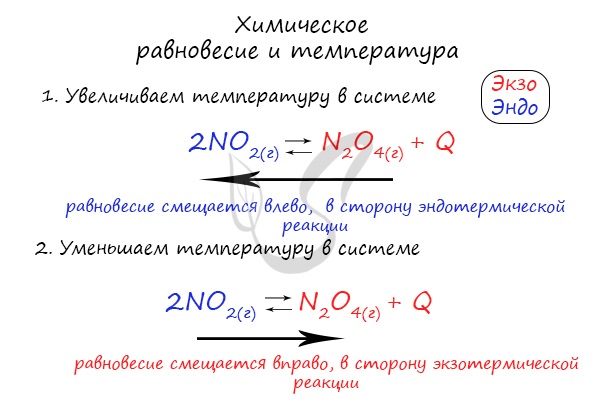
Изменение температуры и химическое равновесие
Если в задании увеличивают или уменьшают температуру, то первое, что вы должны оценить: экзотермическая это реакция или эндотермическая.
Поэтому данное правило универсально и применимо для всех реакций. Для примера разберем следующие задачи:
Чтобы не осталось белых пятен, возьмем экзотермическую реакцию и повторим с ней подобный эксперимент.
Катализатор и ингибитор
Действие катализатора и ингибитора соответственно касается только ускорения и замедления химической реакции. Они никоим образом не влияют на равновесие.
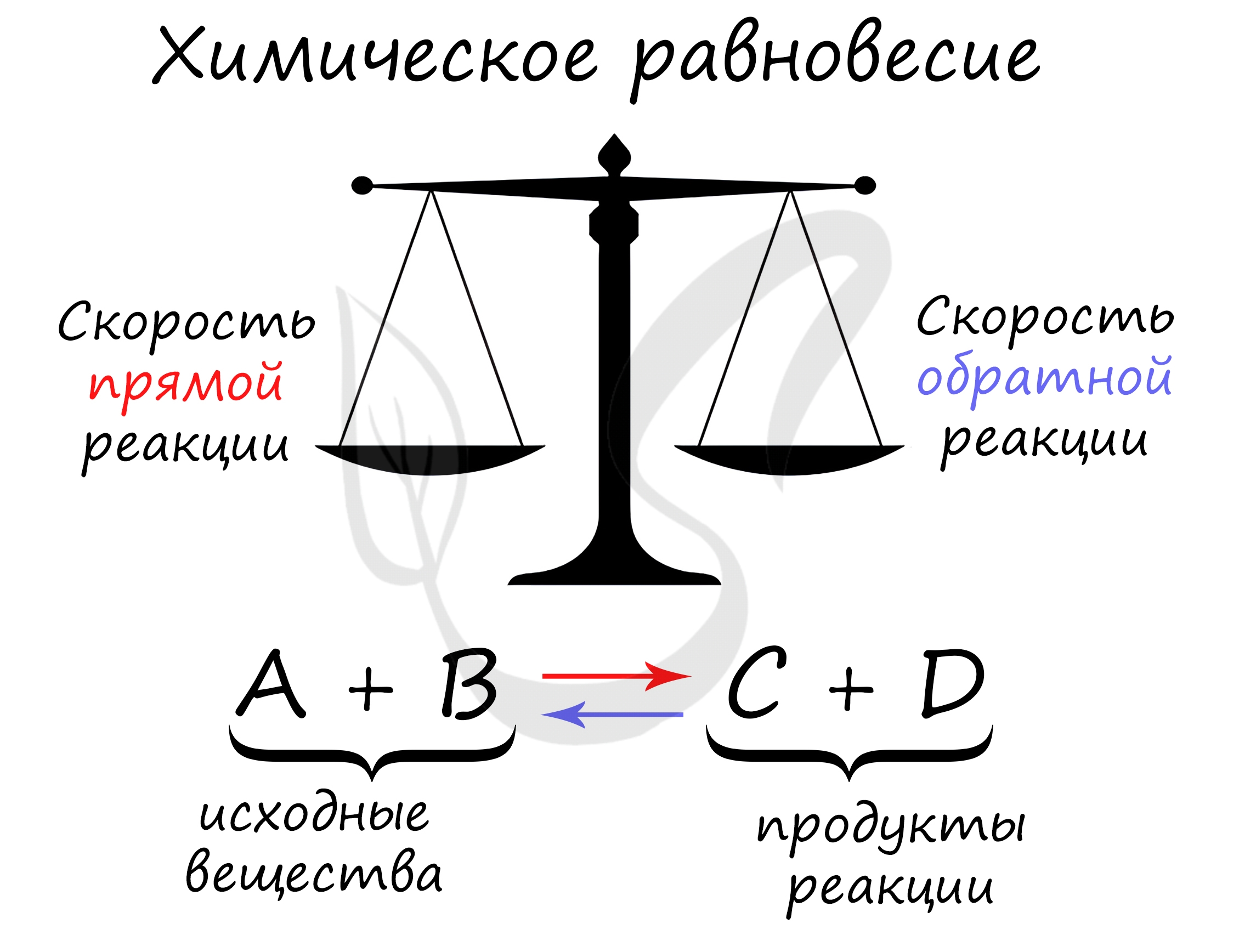
Константа равновесия
Константой равновесия называют отношения скоростей прямой и обратной реакции. Для реакции типа aA + bB = cC + dD константа равновесия будет записана следующим образом:
© Беллевич Юрий Сергеевич 2018-2021
Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение (в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования, обратитесь, пожалуйста, к Беллевичу Юрию.
Основные термины и понятия
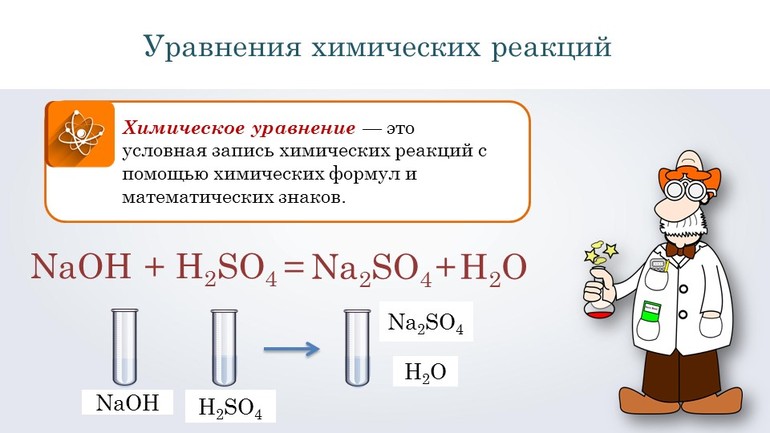
Любой химический элемент описывается с помощью символов, условно обозначающих структуру веществ. Формулы являются неотъемлемой частью языка науки. Именно на их основе составляют уравнения и схемы. По своей сути они отражают количественный и качественный состав элементов. Например, запись HNO3 сообщает, что в соединении содержится одна молекула азотной кислоты, а оно само состоит из водорода, азота и кислорода. При этом в состав одного моля азотной кислоты входит по одному атому водорода и азота и 3 кислорода.
Символика элементов, условное обозначение, представляет собой химический язык. В значке содержится информация о названии, массовом числе и порядковом номере. Международное обозначение принято, согласно периодической таблице Менделеева, разработанной в начале 1870 года.
Взаимодействующие между собой вещества называются реагентами, а образующиеся в процессе реакции — продуктами. Составление и решение химических уравнений фактически сводится к определению результатов реакций, поэтому просто знать формулы веществ мало, нужно ещё уметь подбирать коэффициенты. Располагаются они перед формулой и указывают на количество молекул или атомов, принимающих участие в процессе. С правой стороны от химического вещества ставится индекс, указывающий место элемента в системе.
Записывают уравнения в виде цепочки, в которой указываются все стадии превращения вещества начиная с левой части. Вначале пишут формулы элементов в исходном состоянии, а затем последовательно их преобразование.
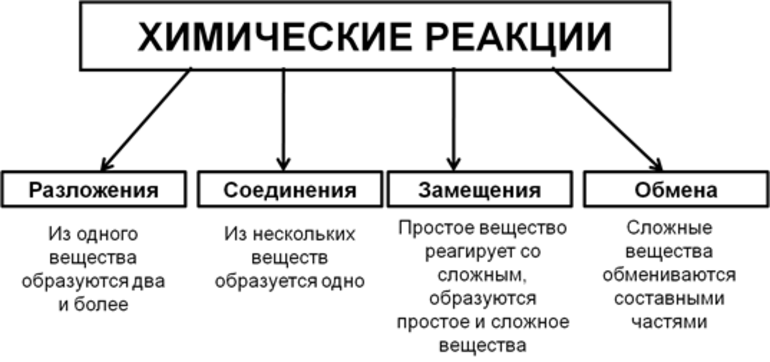
Виды химических реакций
Химические явления характеризуются тем, что из двух и более элементов образуются новые вещества. Уравнения описывают эти процессы. Впервые с объяснениями протекания реакций знакомят в восьмом классе средней образовательной школы на уроках неорганической химии. Ученикам демонстрируют опыты, в которых явно наблюдаются различия в протекании реакций.
Всего существует 4 типа химического взаимодействия веществ:
Основными признаками химических реакций является изменение цвета, выделение газа или образование осадка. Различают их по числу веществ, вступивших в реакцию и образовавшихся продуктов. Правильное определение типа реакции особо важно при составлении химических уравнений, а также определения свойств и возможностей веществ.
Окислительно-восстановительный процесс
Составление большинства реакций сводится к подбору коэффициентов. Но при этом могут возникнуть трудности с установлением равновесия, согласно закону сохранения массы веществ. Чаще всего такая ситуация возникает при решении заданий, связанных с расстановкой количества атомов в уравнениях окислительно-восстановительных процессов.
Под ними принято понимать превращения, протекающие с изменением степени окисления элементов. При окислении происходит процесс передачи атомом электронов, сопровождающийся приобретением им положительного заряда или ионом, после чего он становится нейтральным. При этом также происходит процесс восстановления, связанный с присоединением элементарных частиц атомом.
Для составления уравнений необходимо определить восстановитель, окислитель и число участвующих в реакции электронов. Коэффициенты же подбирают с помощью метода электронно-ионного баланса (полуреакций). Его суть состоит в установлении равенства путём уравнивания количества электронов, отдаваемых одним элементом и принимаемым другим.
Классический алгоритм
В основе решения задач этим методом — закон сохранения массы. Согласно ему, совокупная масса элементов до реакции и после остаётся неизменной. Другими словами, происходит перегруппировка частиц. Если рассматривать решение химического уравнения поэтапно, оно будет состоять из трёх шагов:
Перед тем как переходить к сложным соединениям, лучше всего потренироваться на простых. Например, нужно составить уравнение, описывающее взаимодействие двух сложных веществ: гидроксида натрия и серной кислоты. При таком соединении образуется сульфат натрия и вода.
Согласно алгоритму, в левой части уравнения необходимо записать реагенты, а в правой продукты реакции: NaOH + H2SO 4 → Na 2SO4 + H2O. Теперь следует уравнять коэффициенты. Начинают с первого элемента. В примере это натрий. В правой части содержится 2 его атома, а в левой один, поэтому необходимо возле реагента поставить цифру 2. Затем нужно уровнять водород. В результате получится выражение: 2 NaOH + H2SO 4 → Na2 SO4 +2H2O.
Ещё одним наглядным примером является процесс реакции тринитротолуола с кислородом. При их взаимодействии образуется: C7H5N3O6 + O2 → CO2 + H2O + N2. Исходя из того, что слева находится нечётное число атомов H и N, а справа чётное, нужно их уравнять: 2C7H5N3O6 + O2 → CO2 + H2O + N2.
Теперь становится понятным, что 14 и 10 атомов углерода и водорода должны образовать 14 долей диоксида и 5 молекул воды. При этом 6 атомов азота превратятся в 3. Итоговое уравнение будет выглядеть как 2C7H5N3O6 + 10,5O2 → 14CO2 + 5H2O + 3N2.
Перед тем как начинать тренировку по составлению уравнений, следует научиться расставлять валентность. Это параметр, равный числу соединившихся атомов каждого элемента. Фактически это способность к соединению. Например, в формуле NH3 валентность атома азота равна 3, а водорода 1.
Решение методом полуреакций
Алгоритм для решения примеров химических уравнений проще рассмотреть на конкретном задании. Пускай необходимо описать процесс окисления пирита азотной кислоты с малой концентрацией: FeS2 + HNO3. Решать этот пример необходимо в следующей последовательности:
Такой алгоритм считается классическим, но для упрощения понимания лучше использовать способ электронного баланса. Процесс восстановления переписывают как N5+ + 3e → N2+. Степень же окисления составить сложнее. Сере нужно приписать степень 2+ и учесть, что на 1 атом железа приходится 2 атома серы: FeS2 → Fe3++ 2S6+. Запись общего баланса будет выглядеть: FeS2 + 5N5+ = Fe3+ + 2S6+ + 5N2+.
Пять молекул потратятся на окисление серного железа, а ещё 3 на образование Fe (NO3)3. После уравнения двух сторон запись реакции примет вид, аналогичный полученному с использованием предыдущего метода.
Использование онлайн-расчёта
Простые уравнения решать самостоятельно довольно просто. Но состоящие из сложных веществ могут вызвать трудности даже у опытных химиков. Чтобы получить точную формулу и не подбирать вручную коэффициенты, можно воспользоваться онлайн-калькуляторами. При этом их использовать сможет даже пользователь, не особо разбирающийся в науке.
Чтобы расстановка коэффициентов в химических уравнениях онлайн происходила автоматически, нужно лишь подключение к интернету и исходные данные. Система самостоятельно вычислит продукты реакции и уравняет обе стороны формулы. Интересной особенностью таких сайтов является не только быстрый и правильный расчёт, но и описание правил с алгоритмами, по которому выполняются действия.
После загрузки калькулятора в веб-обозревателе единственное, что требуется от пользователя — правильно ввести реагенты в специальные формы латинскими буквами и нажать кнопку «Уравнять». Иногда возникает ситуация, когда запись сделана верно, но коэффициенты не расставляются. Это происходит, если суммы в уравнении могут быть подсчитаны разными способами. Характерно это для реакций окисления. В таком случае нужно заменить фрагменты молекул на любой произвольный символ. Таким способом можно не только рассчитать непонятное уравнение, но и выполнить проверку своих вычислений.
Урок 19 Бесплатно Скорость химической реакции
Понятие о скорости химической реакции
Химические реакции протекают с различными скоростями.
Конечно же, человек захотел иметь власть над этими процессами: ускорять и замедлять реакции, исходя из необходимости.
Ржавление железа протекает медленно, но с тех самых пор, когда человек открыл для себя железо, этот процесс хочется ещё более замедлить или вообще остановить.
В промышленности при производстве каких-либо полезных веществ человек стремится ускорить реакции, ведь чем быстрее они проходят, тем больше продукции вырабатывает производство.
Для контроля всех этих процессов нужно знать, от чего зависит скорость химических реакций и понимать, можно ли на эти процессы воздействовать и каким образом.
Количественной характеристикой быстроты течения химической реакции является её скорость.
О скорости химической реакции судят по изменению концентрации исходного вещества или продукта реакции в единицу времени.
Концентрацию вещества выражают числом молей в единице массы или объма: моль/л, моль/г, моль/кг.
По мере протекания реакции концентрации исходных веществ уменьшается, а концентрация продуктов реакции увеличивается.
Скорость реакции выражается в моль/л х сек.
Вместо литра может стоять грамм или килограмм, а вместо секунды – другая единица времени.
Пройти тест и получить оценку можно после входа или регистрации
Гомогенные и гетерогенные реакции
Характер взаимодействия веществ зависит от их агрегатного состояния.
По этому признаку различают гомогенные и гетерогенные химические реакции.
Гомогенными называют реакции, в которых отсутствует поверхность раздела между реагирующими веществами, то есть все вещества образуют однородную среду.
Такие реакции протекают во всём объёме.
Это реакции между газами, между жидкостями или протекающие в растворах.
Например, если химик сливает растворы йодида калия и нитрата серебра, происходит реакция обмена с образованием йодида серебра, который выпадает в осадок; причем осадок выпадает не на стенках сосуда и не на дне, а во всём объеме раствора.
Или, например, когда хозяйка печёт пироги, она добавляет в тесто дрожжи и соду, и тесто поднимается во всём объёме, а не только у краёв посуды.
Сгорание топливно-воздушной смеси в двигателе, горение природного газа, образование осадка при приготовлении бордосской смеси, образование озона во время грозы – всё это гомогенные химические реакции.
Гетерогенными называют реакции, в которых реагирующие вещества отделены друг от друга поверхностью раздела фаз: они протекают на поверхности соприкосновения твёрдого вещества и газа, твёрдого вещества и жидкости, двух твёрдых веществ или двух несмешивающихся жидкостей.
Примером таких реакций может служить горение твёрдого топлива, взаимодействие металлов с кислотами.
Так, взаимодействие цинка с соляной кислотой происходит только на поверхности металла:
Горение дров в костре, растворение накипи в чайнике под воздействием уксуса, образование ржавчины, осаждение металла при гальванопластике – всё это гетерогенные химические реакции.
Пройти тест и получить оценку можно после входа или регистрации
Условия, влияющие на скорость химической реакции
Чтобы управлять химической реакцией, надо знать условия, влияющие на скорость её протекания.
Это позволит замедлить скорость нежелательной реакции (например, ржавления железа, порчи пищевых продуктов) и увеличить скорость полезных для человека реакций (например, получение водорода, выплавка металла из руды).
Факторы, влияющие на скорость химической реакции:
Давайте поподробнее рассмотрим влияние этих факторов на скорость реакции.
1) Природа реагирующих веществ.
Например, скорость взаимодействия металлов с водой различна и зависит от активности металла.
Натрий бурно реагирует с водой, однако калий при контакте с водой ещё и воспламеняется, а рубидий взрывается.
В свою очередь, скорость взаимодействия одного и того же металла с разными веществами также зависит от природы этих веществ.
Натрий, который бурно реагирует с водой, с этиловым спиртом реагирует более спокойно.
2) Концентрация реагирующих веществ
Чтобы произошло взаимодействие, частицы (атомы, молекулы, ионы) реагирующих веществ должны столкнуться.
И чем больше столкновений происходит в единицу времени, тем быстрее протекает химическая реакция.
Гомогенные реакции протекают во всём объёме, и чем больше частиц в единице объёма, тем чаше они сталкиваются.
Следовательно, с повышением концентрации реагирующих веществ происходит увеличение скорости реакции.
Если реакция гетерогенная, то взаимодействие частиц происходит лишь на поверхности твёрдого вещества, поэтому в данном случае говорят не о концентрации, а о площади соприкосновения веществ.
По сути, это понятие аналогично концентрации, ведь чем больше площадь поверхности, тем больше частиц вещества способны вступить в реакцию.
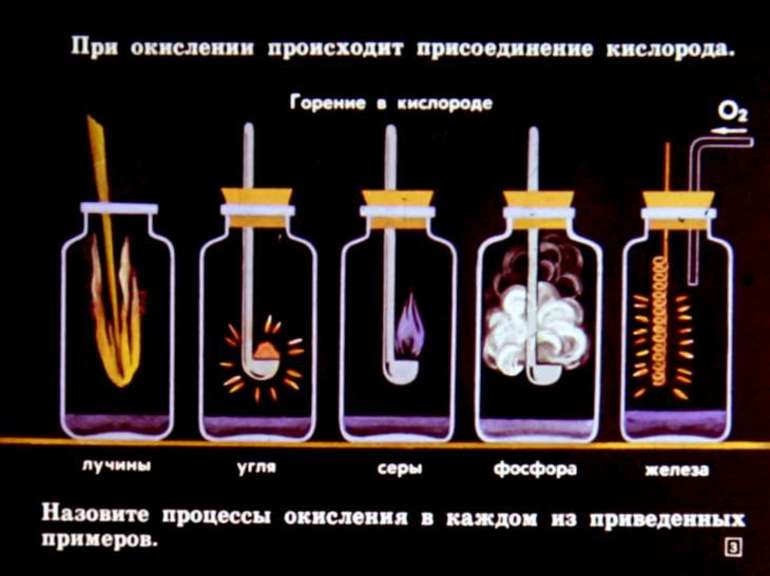
Мелкие щепки горят в костре гораздо быстрее крупных поленьев.
Можно даже поставить «чистый» эксперимент: взять одинаковое количество (по массе) дерева, только в одном случае в виде мелких веток и щепок, а в другом в виде более крупных поленцев.
Мелкие щепки всё равно сгорят быстрее.
Происходит это именно из-за того, что в данном случае площадь поверхности дерева больше.
То же происходит и в лаборатории или в школьном кабинете химии: цинк или магний выпускают в виде маленьких гранул специально для того, чтобы скорость их взаимодействия с кислотами была больше.
3) Температура
С повышением температуры скорость химических реакций, как правило, возрастает, так как при нагревании реагирующие частицы становятся более активными и способными к взаимодействию.
Если нам нужно почистить чайник от накипи, то мы заливаем в него уксусную или лимонную кислоту и кипятим.
Можно, конечно, оставить чайник и так, но при нагревании накипь растворяется быстрее.
Экспериментально установлено, что при повышении температуры на каждые десять градусов скорость большинства реакций увеличивается в 2-4 раза.
Эту закономерность называют правилом Вант-Гоффа по имени голландского учёного, который впервые её сформулировал.
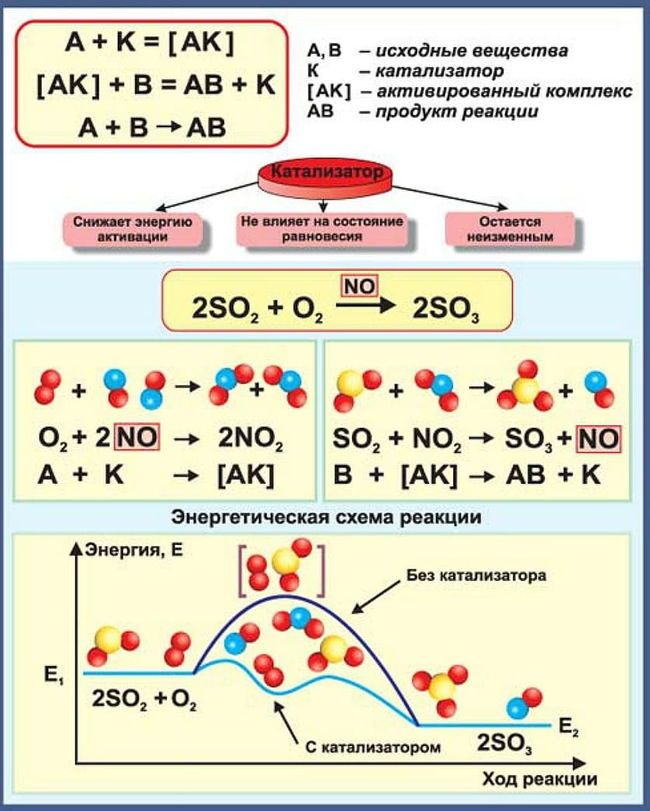
4) Действие катализаторов
Ещё алхимики заметили, что существуют такие вещества, при воздействии которых реакции идут намного быстрее.
Такие вещества называются катализаторами, а увеличение скорости реакции – катализ.
Важно то, что сам катализатор в реакции не участвует.
Природа катализа различна. Иногда катализатор служит концентратором, то есть «собирает» на себе реагенты, увеличивая концентрацию, как например, при разложении перекиси водорода: в обычном состоянии она разлагается очень медленно, а при добавлении к ней оксида марганца очень быстро с образованием большого количества пены.
Или при синтезе аммиака – скорость реакции увеличивается при введении в область реакции губчатой платины: она имеет очень неровную поверхность, которая, как активированный уголь, собирает на себе молекулы водорода и азота, увеличивая их концентрацию в несколько раз.
Иногда катализатор вступает в реакцию с одним из веществ, но в конце всей цепочки высвобождается в исходном виде.
Например, сухой хлор можно хранить в стальных баллонах длительное время.
Но если в хлоре есть примесь влаги, баллон может очень быстро разрушиться. Вода является катализатором взаимодействия хлора с железом. Сначала происходит реакция хлора и воды с образованием хлороводорода, который легко реагирует с железом:
Эти реакции происходят почти моментально, и поэтому образующийся атомарный кислород не успевает образовать двухатомные молекулы.
В итоге всю цепочку можно записать одной реакцией:
Большую часть продукции, вырабатываемой химической промышленностью, получают с использованием катализаторов.
Каталитическими являются процессы производства кислот, удобрений, резины, пластмасс, лекарств, процессы переработки нефти.
Особую роль играют биологические катализаторы – ферменты.
Они участвуют в сложных химических процессах, протекающих в живых организмах.
Слюна содержит фермент птиалин, который катализирует превращение крахмала в сахар, – переваривание пищи начинается уже во рту! Желудочный сок содержит пепсин, который катализирует расщепление белков.
В случае, когда у человека имеются серьезные нарушения пищеварения, ему прописывают медицинские препараты, содержащие пищеварительные ферменты.
В организме человека около 30 000 различных ферментов, каждый из них — катализатор какой-либо одной реакции.
5) Давление
Как правило, с повышением давления скорость химической реакции возрастает.
Пройти тест и получить оценку можно после входа или регистрации