Что является анодным процессом при электрохимической коррозии
Анодный и катодный процессы при электрохимической коррозии



При электрохимической коррозии выделяют два взаимосвязанных процесса: анодный и катодный.
— Анодный процесс – окисление металла, проходит на участках изделий с меньшим потенциалом в данной среде. Анодные участки разрушаются.
— Катодный процесс – восстановление окислителя, находящегося в растворе или расплаве электролита, происходит на участках изделий с бóльшим потенциалом в данной среде. Катодные участки химически не изменяются. Они служат проводниками электронов от анодных участков к окислителю, чем усиливают коррозию анодных участков. Более подробно это будет рассмотрено далее на конкретных примерах.
Окислители при коррозии принято называть деполяризаторами. Коррозию с участием наиболее распространенных окислителей – растворенного кислорода и ионов водорода (кислоты или воды) соответственно называют коррозией с кислородной и водородной деполяризацией. Уравнения катодных процессов приведены в таблице.
| Уравнения катодного процесса при коррозии | |
| с водородной деполяризацией (в отсутствие растворенного О2) | с кислородной деполяризацией в присутствии растворенного О2) |
| кислая среда | |
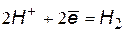 (1) (1) | 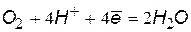 (3) (3) |
| нейтральная и щелочная среда | |
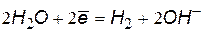 (2) (2) | 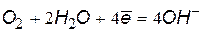 (4) (4) |
Окислительно-восстановительные потенциалы кислорода и водорода в различных средах (точнее, соответствующих окислительно-восстановительных пар) указаны в таблице.
Коррозия, как и любой окислительно-восстановительный процесс, может осуществляться только при условии, что потенциал окислителя больше потенциала восстановителя (металла анодных участков).
ЭЛЕКТРОХИМИЧЕСКАЯ КОРРОЗИЯ
Примером электрохимической коррозии является разрушение деталей машин, приборов и различных металлических конструкций в почвенных, грунтовых, речных и морских водах, в атмосфере, под пленками влаги, в технических растворах, под действием смазочно-охлаждающих жидкостей и т.д. При электрохимической коррозии всегда требуется наличие электролита (конденсат, дождевая вода и т. д.), с которым соприкасаются электроды — либо различные элементы структуры материала, либо два различных соприкасающихся материала с различающимися окислительно-восстановительными потенциалами.
Коррозионный элемент
Гальванический элемент — химический источник электрического тока, основанный на взаимодействии двух металлов и/или их оксидов в электролите, приводящем к возникновению в замкнутой цепи электрического тока. Назван в честь Луиджи Гальвани
В гальванических элементах происходит переход химической энергии в электрическую энергию
Гальванический элемент содержит два металлических электрода, которые отличаются значениями своих электродных потенциалов. Электроды соединены между собою проводником и погружены в раствор электролита. Более активный металл является анодом, на котором протекает окисление, а менее активный – катодом, на котором протекает восстановление. Электроны, которые освобождаются при окислении анода, перемещаются на катод. Благодаря пространственному разделению полуреакций окисления и восстановления возникает электрический ток.
Причины возникновения местных гальванических элементов:
1) неоднородность сплава
• неоднородность металлической фазы, обусловлена неоднородностью сплава и наличием микро- и макровключений;
• неравномерность окисных пленок на поверхности за счет наличия макро-и микропор, а также неравномерного образования вторичных продуктов коррозии;
• наличие на поверхности границ зерен кристаллов, выхода дислокации на поверхность, анизотропность кристаллов.
2) неоднородность среды
• область с ограниченным доступом окислителя будет анодом по отношению к области со свободным доступом, что ускоряет электрохимическую коррозию.
3) неоднородность физических условий
• температура (по отношению к холодным участкам, нагретые являются анодами) и т. д.
Анодные и катодные процессы при электрохимической коррозии металлов
Любой металл содержит примеси других металлов, поэтому в среде электролита система из основного металла (Мe1) и металла-примеси (Мe2) образуют большое число микрогальванических элементов:
где более активный металл, например Мe1, является анодом (А) и на аноде идут процессы окисления (окисляется сам металл):
Менее активный металл (Мe2) является катодом (К), на катоде идет процесс восстановления окислителя среды. При электрохимической коррозии в кислой среде на поверхности катода (менее активного металла) происходит восстановление катионов водорода:
процесс электрохимической коррозии Cu–Zn в кислой среде:
А(Zn): Zn – 2ē = Zn 2+ 1
Образование гальванической пары Cu–Zn ускоряет процесс разрушения цинка.
Катионы водорода, восстанавливаясь на катоде, принимают электроны на медной поверхности, а на аноде происходит окисление цинка. Таким образом, при электрохимической коррозии происходит возникновение электрического тока, обусловленное перемещением электронов по поверхности металлов.
Морская вода имеет слабощелочную реакцию среды, рН варьирует в пределах от 7,5 до 8,4. При электрохимической коррозии в щелочной среде на аноде происходит окисление (разрушение) металла, а на катоде – восстановление молекулярного кислорода, растворенного в морской воде. А: Me(0) – ne → Me(n+) К: 2H2O + О2 + 4e → 4OH(-) (рН ≥ 7 – среда слабощелочная) При электрохимической коррозии анодом становится металл, обладающий меньшим значением электродного потенциала, а катодом – металл с большим значением электродного потенциала.
Влажная атмосферная коррозия наблюдается при наличии на поверхности тончайшей пленки влаги. Толщина такой пленки составляет от 100 до 1 мкм. Относительная влажность воздуха, при которой начинается образование влажной пленки, составляет около 60 – 70%. Значение, при котором начинается конденсация на поверхности влаги, называется критической влажностью. Критическая влажность зависит от загрязнения воздуха и состояния металла.
Уравнение атмосферной коррозии:
Анод: ионы металла переходят в раствор:
Катод: проходит реакция восстановления:
O2 + 4H + + 4e → 2H2O (подкисленная среда)
Во многом стойкость металлов и сплавов, в условиях атмосферной коррозии, зависит от природы металла и состояния его поверхности.
Термодинамические основы процессов коррозии
Термодинамическую возможность электрохимической коррозии, как любого химического процесса, можно определить по изменению энергии Гиббса. Поскольку коррозия является самопроизвольно протекающим процессом, то сопровождается ее убылью, т.е. ∆GT Me + mHO +ne.
Анодная пассивность металлов.
На склонность к пассивному состоянию влияет природа системы металл-раствор. Наибольшую склонность к переходу в пассивное состояние проявляют Ti,Ni,Al,Mg,Fe,Co и др.
Экспериментальное изучение процесса коррозии.
При выполнении практической части работы был проведен ряд экспериментов.
Опыт 1. Изучение влияния среды на коррозию железа
Посуда и реактивы: четыре химические пробирки, четыре железных гвоздя; дистиллированная вода, 0.5н раствор хлорида натрия, 0.5н раствор гидроксида натрия, 0.5 н раствор хлорида аммония.
Четыре одинаковых железных гвоздя помещают в четыре пробирки, приливают разные жидкости, закрывают пробирки и в течение месяца наблюдают за происходящими изменениями. В пробирке № 1 дистиллированная вода (вода была оставлена на воздухе для на насыщения O2 ); в пробирке № 2 раствор хлорида натрия, в пробирке № 3 раствор гидроксида натрия, в пробирке № 4 раствор хлорида аммония.
Коррозия железа наблюдается во всех пробирках, кроме третьей.
Рис.1. Первая неделя эксперимента.
Рис.2.Вторая неделя эксперимента.
Рис.3. Третья неделя эксперимента.
Рис.4. Четвертая неделя эксперимента.
В пробирке 1 мало ржавчины, в чистой воде коррозия идет медленно т. к. вода слабый электролит.
4 Fe 2+ + O2 → 4 Fe 3+ + 2 O 2−
В пробирке 2 ржавчины больше, следовательно, хлорид ионы увеличивают скорость коррозии. Эта система аналогична морской воде. Роль катода выполняют примеси в железе.
4 Fe 2+ + O2 → 4 Fe 3+ + 2 O 2−
В пробирке 3 ржавчины не наблюдается. В щелочных растворах (рН ≥ 10) на железе происходит образование нерастворимых гидроксидов, и скорость коррозии резко падает.
В пробирке 4 ржавчины много.
NH4 + + НОН ↔ NH4OH + Н + сокращенное уравнение
NH4Cl + Н2О ↔ NH4OH + НСl молекулярное уравнение
Из сокращенного уравнения видно, что ионы ОН− воды связываются в слабый электролит, ионы Н + накапливаются в растворе и cреда становится кислой pH катодное покрытие
Реакции в кислой среде:
При нарушении целостности катодного покрытия разрушается защищаемый металл (Fe).
Zn более активный металл, чем Fe => анодное покрытие
Реакции в кислой среде:
При нарушении целостности анодного покрытия разрушается покрытие, а металл (Fe) остается защищенным.
Что является анодным процессом при электрохимической коррозии
8.2 ЭЛЕКТРОХИМИЧЕСКАЯ КОРРОЗИЯ
Причиной электрохимической коррозии * является возникновение на поверхности металла короткозамкнутых гальванических элементов *.
В тонком слое влаги, обычно покрывающем металл, растворяются кислород, углекислый, сернистый и другие газы, присутствующие в атмосферном воздухе. Это создает условия соприкосновения металла с электролитом *. Различные участки поверхности любого металла обладают разными потенциалами. Причинами этого могут быть наличие примесей в металле, различная обработка отдельных его участков, неодинаковые условия (окружающая среда), в которых находятся различные участки поверхности металла. При этом участки поверхности металла с более электроотрицательным потенциалом становятся анодами и растворяются.
Представим схематично работу короткозамкнутого гальванического элемента, возникающего на поверхности металла, подверженного коррозии в электролите * (рисунок 8.1). Анодный участок имеет более электроотрицательный потенциал, поэтому на нем идет процесс окисления металла. Образовавшиеся в процессе окислен ия ио ны переходят в электролит, а часть освободившихся при этом электронов может перемещаться к катодному участку (на рисунке 8.1 показано стрелками). Процесс коррозии будет продолжаться в том случае, если электроны, перешедшие на катодный участок, будут с него удаляться. Иначе произойдет поляризация электродов *, и работа коррозионного гальванического элемента прекратится.
Рисунок 8.1 – Схема электрохимической коррозии. Д – деполяризатор
Процесс отвода электронов с катодных участков называется деполяризацией. Вещества, при участии которых осуществляется деполяризация, называются деполяризаторами. На практике чаще всего приходится встречаться с двумя типами деполяризации: водородной и кислородной. Тип деполяризации (катодный процесс) зависит от реакции среды раствора электролита.
А: Fe – 2e → Fe 2+ – окисление
К: 2 H + + 2e → H2 ↑ – восстановление
Схема возникающего короткозамкнутого гальванического элемента выглядит следующим образом:
В нейтральной среде коррозия протекает с кислородной деполяризацией, т.е. роль деполяризатора выполняет кислород, растворенный в воде. Этот вид коррозии наиболее широко распространен в природе: он наблюдается при коррозии металлов в воде, почве и в незагрязненной промышленными газами атмосфере. Если коррозии во влажном воздухе подвергается железо с примесями меди, то электродные процессы можно записать в виде:
(А) Fe – 2e → Fe 2+ – окисление
(К) 2 H2O + O2 + 4e → 4 OH – – восстановление
У поверхности металла в электролите протекают следующие реакции:
Fe 2+ + 2 OH – → Fe( OH)2
Основная масса черных металлов разрушается вследствие процесса ржавления, в основе которого лежат вышеуказанные реакции.
Рисунок 8.2 – Коррозия в результате неравномерного доступа кислорода. Б – техническое сооружение; А – анодный участок; К – катодный участок.
Часть конструкции, находящаяся в воде, омывается растворенным в ней кислородом и, в случае возникновения условий для электрохимической коррозии, будет выполнять роль катода. Другая же часть конструкции, находящаяся в почве, будет анодом и подвергнется разрушению.
Электрохимическая коррозия
Электрохимическая коррозия относится к наиболее часто встречающимся процессам постепенного разрушения металла.
Как мы знаем, наше окружение наполнено электричеством.
В зависимости от среды, меняются показатели проводимости. Не отличается то, что при контакте с такой средой сталь начинает постепенно портиться.
У процесса есть несколько важных отличий.
В первую очередь – неодновременное протекание восстановления окислительного процесса и ионизации атомов металла.
На интенсивность распространения при этом влияет такой параметр, как электродный потенциал металла.
Главная причина электрохимической коррозии в том, что большинство металлов проявляют термодинамическую неустойчивость.
Примеры распространения коррозии такого типа встречаются в воде, почве, на открытом воздухе.
Она часто становится причиной потери прочности и постепенного разрушения металла на днище судов, трубопроводов, опор ЛЭП и других объектов.
Если говорить о типах электрохимической коррозии, то называют 3 разновидности:
Повреждаться могут разные типы металлов в зависимости от их расположения. Ржавчина появляется при контакте со стоячей и текущей водой, в местах соединения разных металлов, а также на сварных швах.
Какие механизмы отвечают за протекание электрохимической коррозии
Такое повреждение металла проводится двумя механизмами – гомогенным и гетерогенным. Рассмотрим каждый из них подробно.
У такого вида процесса есть несколько особенностей.
В первую очередь – четкое деление на катодный и анодный процесс. Один из основных факторов, влияющих на их скорость протекания относительно друг друга – это время.
Схема электрохимической коррозии
В зависимости от типа металла, коррозия может быть локализована на отдельных участках. Также наблюдается растворение поверхностного слоя на анодах, что позволяет поражению затронуть обширные площади.
Здесь появляется еще одна особенность протекания процесса – формирование гальванических элементов. Это происходит из-за специфики структуры поверхности, на которой присутствуют микроэлектроды.
Из-за чего начинает развиваться коррозия
После того, как мы рассмотрели суть электрохимической коррозии, пришло время обратить внимание на причины распространения коррозии.
Среди них три распространенные:
Именно по причине различия в критических факторах, скорость электрохимической коррозии может сильно меняться.
Главные внутренние факторы протекания электрохимической коррозии
На интенсивность распространения коррозийного поражения влияют две группы факторов – внешние и внутренние.
Текущее состояние поверхности металла
Когда поверхность металла неровная, коррозийный процесс протекает намного интенсивнее. Если на поверхности присутствуют небольшие выступы, они начинают накапливать воду.
Это может негативно повлиять на интенсивность распространения.
Чтобы не допустить такого фактора, важно использовать отшлифованный или отполированный металл.
Когда сталь гладкая, вода не так сильно повреждает ее, потому что постепенно происходит формирование равномерной пленки по всей поверхности.
Также хорошим средством для уменьшения поражения становится применение пассивирования, а также ряд других способов.
Степень термодинамической стойкости металла
Разные виды материалов отличаются разными показателями термодинамической устойчивости.
Наиболее стойкие разновидности материала не разрушаются при помещении в агрессивную среду.
Чтобы понять, есть ли у металла склонность к коррозии под действием термодинамических факторов, измеряют потенциал анодного и катодного процесса, а также изобарно-изотермического.
Именно такой фактор оказывает большое влияние на потенциальное воздействие среды на постепенное развитие коррозии.
К сожалению, у большинства представленных в продаже марок металлов стойкость невысокая. Есть и неустойчивые разновидности, у которых этот риск нивелируется благодаря склонности к образованию пассивных пленок на поверхности.
Кристаллографическая структура
Оказывает прямое воздействие на металл.
Как известно, атомы в кристаллической решетке располагаются по-разному. Лучше защищены те разновидности, у которых атомы упакованы неплотно.
Особенности решетки также учитывают при планировании защиты материала методом создания на нем специальных пленок. И пленка и сам основной материал должны четко соответствовать по составу друг другу или быть максимально приближенными.
В этом случае исключается появление напряжения, которое негативно отражается на текущем состоянии заготовки. Если контакт с агрессивной средой все-таки происходит, материал начинает разрушаться слой за слоем.
Гетерогенность
Этот фактор рассматривается в непосредственной связи с величиной зерна металла.
Если в сплаве есть выраженные анодные включения, они сильно влияют на ускорение протекания коррозии.
Катодные включения не столь опасны, потому что на интенсивности процесса не отражаются. Величина зерна как фактор риска рассматривается не так часто и этим показателем можно пренебречь.
Не стоит сбрасывать со счетов и механические факторы
Важно понимать, что многие конструкции из металла используются под постоянным напряжением.
К этой категории относится повышенное внутреннее напряжение, когда сильно увеличивается риск деформации.
Негативно влияют на качество металла также воздействие истирания, периодические контакты с другими металлическими изделиями.
Такой фактор оказывает значительное влияние на интенсивность распространения повреждения.
Даже если само сырье первоначально обладало стойкостью к потенциальным повреждениям, в таком случае она уменьшится – формируемые пленки просто не будут закрепляться на поверхности.
Потому лучше сразу исключить это условие электрохимической коррозии – постараться не использовать металлоконструкции под пиковыми сильными нагрузками, не допускать возникновения трения и соприкосновения между собой стальных деталей.
Основные внешние факторы электрохимической коррозии
Кроме внутренних, на металл также влияют и внешние факторы.
Они могут не только ускорять, но и замедлять процесс, а также влиять на характер его протекания.
К ним относятся следующие:
Если деталь помещается в растворы неокисляющихся кислот, наблюдается коррозия с водородной деполяризацией.
Повышение температуры уменьшает скорость распространения повреждений, потому что сильно снижается перенапряжение водорода.
Отдельно стоит отметить ситуацию, когда металл уже покрывается специальной защитной пленкой. В этом случае сам тип пленки будет влиять на то, как именно она поведет себя при контакте с разными видами внешних угроз, в том числе, с повышением температуры.
Нагрев и охлаждение могут отразиться на состоянии катодов и анодов через их внутренние процессы.
В некоторых случаях полярность электродов значительно меняется.
Как мы уже отмечали выше, проблемы могу возникать из-за того, что разные участки детали нагреты до отличающихся друг от друга температур.
В этом случае стремительно увеличивается количество термогальванических пар, стимулирующих распространение коррозии на новые участки.
Если по каким-то причинам металлическая заготовка оказалась помещена в раствор, большое значение будет иметь скорость, с которой он движется, а также само наличие внутренних колебаний.
Заранее определить точное воздействие будет сложно по той причине, что всегда непросто предсказать, как поведут себя нейтральные электролиты.
Cчитается, что при смешении электролита, меняются показатели диффузии кислорода, что значительно отражается на процессе протекания коррозии.
Можно уделять меньше внимания скорости движения электролита в том случае, если вы имеете дело со средами повышенной кислотности.
На них подобное поражение оказывает минимум влияния.
Чем отличаются анодный и катодный процессы
Если вы внимательно проследите за тем, как работает гальванический элемент, то увидите, что в нем протекают сразу два связанных друг с другом процесса – анодный и катодный.
Рассмотрим их более подробно.
Анодный процесс
В химии показывается формулой Fe → Fe2+ + 2e. Она показывает, что постепенно запускается окисление, ионы металла начинают переход в раствор.
Катодный процесс
Может протекать по-разному.
В частности, переизбыток электронов решается ассимиляцией атомами электролита и его молекул. На фоне этого происходит восстановительная реакция непосредственно на самом катоде.
Формула будет зависеть от того, в каких условиях протекает реакция.
Так при наличии водородной деполяризации можно записать процесс как 2 H+ + 2e → H2.
Важно понимать, что оба процесса сильно связаны друг с другом под влиянием кинетического фактора.
С течением времени может происходить взаимное замедление или ускорение анодного или катодного процесса. При этом сам анод всегда будет оставаться тем местом, на котором формируется коррозия металла.
Во время анализа протекания процесса коррозии часто обращают внимание на электропроводящие фазы и момент после их соприкосновения.
Обычно одна фаза имеет положительный заряд, в то время как другая – отрицательный. Это приводит к появлению разности потенциалов.
Таким образом возникает ДЭС или как его часто называют ученые – двойной электрический слой с ассиметричным расположением частиц в местах, где фазы разделяются.
Опасным для металла становится скачок потенциалов. Он может стимулироваться двумя центральными причинами:
Что происходит в том случае, если поверхностный слой металла совсем не имеет определенного заряда?
В таком случае ДЭС наблюдаться не будет, возникнет явление нулевого заряда.
Его потенциал будет отличаться в зависимости от того, с каким металлом вам приходится работать.
Описанный процесс значительно отражается на том, как протекает коррозия и как быстро она захватывает все новые и новые участки металла.
В современной науке нет средств, которые могли бы точно измерить величину скачка потенциала, значит и процесс формирования электродвижущей силы оказывается на таким интенсивным.
Если рассматривать вопросы, связанные с процессом поляризации, можно написать отдельную статью на эту тему.
Потому далее мы рассмотрим другой важный показатель – поляризацию.
Поляризация и ее влияние на скорость протекания коррозии
Процесс поляризации связан с интенсивностью распространения электрохимической коррозии.
Этот показатель отражает, насколько сильное перенапряжение наблюдается на определенном участке.
Принято выделять три вида поляризации:
Особенности поляризации также стоит учитывать в том случае, если вы заинтересованы в дополнительной защите металлов от постепенного разрушения.
Обеспечиваем эффективную защиту от коррозии
Наша компания предлагает заказчикам защиту металлоконструкций разных типов от коррозии.
В пользу работы с нами говорит сразу несколько факторов:
Мы используем в процессе проверенное европейское оборудование. Даем гарантию соответствия качества товаров требованиям ГОСТ 9.307-89.
Чтобы получить дополнительные консультации и ответы на интересующие вас вопросы, звоните нам или оставляйте заявку на сайте.














