Что является деполяризатором при коррозии стали в растворе na2so4
Что является деполяризатором при коррозии стали в растворе na2so4
8.2 ЭЛЕКТРОХИМИЧЕСКАЯ КОРРОЗИЯ
Причиной электрохимической коррозии * является возникновение на поверхности металла короткозамкнутых гальванических элементов *.
В тонком слое влаги, обычно покрывающем металл, растворяются кислород, углекислый, сернистый и другие газы, присутствующие в атмосферном воздухе. Это создает условия соприкосновения металла с электролитом *. Различные участки поверхности любого металла обладают разными потенциалами. Причинами этого могут быть наличие примесей в металле, различная обработка отдельных его участков, неодинаковые условия (окружающая среда), в которых находятся различные участки поверхности металла. При этом участки поверхности металла с более электроотрицательным потенциалом становятся анодами и растворяются.
Представим схематично работу короткозамкнутого гальванического элемента, возникающего на поверхности металла, подверженного коррозии в электролите * (рисунок 8.1). Анодный участок имеет более электроотрицательный потенциал, поэтому на нем идет процесс окисления металла. Образовавшиеся в процессе окислен ия ио ны переходят в электролит, а часть освободившихся при этом электронов может перемещаться к катодному участку (на рисунке 8.1 показано стрелками). Процесс коррозии будет продолжаться в том случае, если электроны, перешедшие на катодный участок, будут с него удаляться. Иначе произойдет поляризация электродов *, и работа коррозионного гальванического элемента прекратится.
Рисунок 8.1 – Схема электрохимической коррозии. Д – деполяризатор
Процесс отвода электронов с катодных участков называется деполяризацией. Вещества, при участии которых осуществляется деполяризация, называются деполяризаторами. На практике чаще всего приходится встречаться с двумя типами деполяризации: водородной и кислородной. Тип деполяризации (катодный процесс) зависит от реакции среды раствора электролита.
А: Fe – 2e → Fe 2+ – окисление
К: 2 H + + 2e → H2 ↑ – восстановление
Схема возникающего короткозамкнутого гальванического элемента выглядит следующим образом:
В нейтральной среде коррозия протекает с кислородной деполяризацией, т.е. роль деполяризатора выполняет кислород, растворенный в воде. Этот вид коррозии наиболее широко распространен в природе: он наблюдается при коррозии металлов в воде, почве и в незагрязненной промышленными газами атмосфере. Если коррозии во влажном воздухе подвергается железо с примесями меди, то электродные процессы можно записать в виде:
(А) Fe – 2e → Fe 2+ – окисление
(К) 2 H2O + O2 + 4e → 4 OH – – восстановление
У поверхности металла в электролите протекают следующие реакции:
Fe 2+ + 2 OH – → Fe( OH)2
Основная масса черных металлов разрушается вследствие процесса ржавления, в основе которого лежат вышеуказанные реакции.
Рисунок 8.2 – Коррозия в результате неравномерного доступа кислорода. Б – техническое сооружение; А – анодный участок; К – катодный участок.
Часть конструкции, находящаяся в воде, омывается растворенным в ней кислородом и, в случае возникновения условий для электрохимической коррозии, будет выполнять роль катода. Другая же часть конструкции, находящаяся в почве, будет анодом и подвергнется разрушению.
ЗАЩИТА МЕТАЛЛОВ И СПЛАВОВ ОТ КОРРОЗИИ
Все методы защиты от коррозии можно условно разделить на следующие группы:
В состав сплава вводят компоненты, вызывающие пассивность металла. В качестве таких компонентов применяют хром, никель, вольфрам, медь, титан и т.д.
Введение добавок к сталям приводит к тому, что при коррозии образуются плотные продукты реакции, которые предохраняют сплав от дальнейшей коррозии. При этом используют сплавы жаростойкие (стойкие по отношению к газовой коррозии при высоких температурах) и жаропрочные (сплавы, сохраняющие свою высокую механическую прочность при значительных повышениях температуры).
2. ЗАЩИТНЫЕ ПОКРЫТИЯ
2.1.Металлические покрытия – цинк, кадмий, алюминий, олово, серебро и др., а также сплавы – бронза, латунь и т.д. В свою очередь металлические покрытия разделяются на:
б) катодные покрытия – покрытие, у которого потенциал больше потенциала защищаемой поверхности. При нарушении такого покрытия в первую очередь будет окисляться защищаемая поверхность.
2.2. Неметаллические покрытия. Их можно разделить на:
а) неорганические покрытия – неорганические эмали (различные силикаты), оксиды металлов, соединения хрома и фосфора и т.д.
б) органические покрытия – лакокрасочные покрытия, покрытия смолами, резиной, полимерными пленками и т.п.
3. ЭЛЕКТРОХИМИЧЕСКАЯ ЗАЩИТА
Данный метод основан на торможении катодных или анодных процессов.
а) протекторная защита – к защищаемой поверхности конструкции присоединяется деталь из более активного металла (протектор), чем защищаемая поверхность. При этом образуется коррозионная пара, в которой защищаемая поверхность будет катодом, а разрушаться в первую очередь будет протектор. Протекторная защита эффективно используется при защите кораблей от коррозии.
б) катодная защита – защищаемое изделие подключается к отрицательному полюсу внешнего источника постоянного тока и становится катодом, а анодом служит вспомогательный, обычно стальной, электрод, который растворяется, а на защищаемом сооружении выделяется водород. Катодная защита используется для защиты от коррозии подземных трубопроводов, кабелей, водных резервуаров.
4. ИЗМЕНЕНИЕ СВОЙСТВ КОРРОЗИОННОЙ СРЕДЫ
а) Для снижения агрессивности среды уменьшают концентрацию компонентов, которые опасны в коррозионном отношении. Например, в нейтральных средах деполяризатором является кислород, поэтому его удаляют кипячением или восстанавливают.
б) Для замедления процессов коррозии широко используют ингибиторы. Ингибиторы— вещества, которые при добавлении в агрессивную среду, уменьшают скорость коррозии. Они используются в тех случаях, когда в системе редко или мало обновляется раствор электролита ( в парогенераторах, системах охлаждения и т.д.)
Механизм действия большинства ингибиторов заключается в адсорбции ингибитора на корродирующей поверхности, и затем тормозятся катодные или анодные процессы. В качестве ингибиторов используют органические вещества, содержащие серу, азот и кислород (уротропин), неорганические вещества (H2O2, Na2Cr2O7, NaNO2 и. т.д.)
5. РАЦИОНАЛЬНОЕ КОНСТРУИРОВАНИЕ
При конструировании исключить (по возможности) или сократить число и размеры особо опасных, с точки зрения коррозии, участков (например, сварных швов, узких щелей); предусмотреть специальную защиту металлической конструкции от коррозии.
ПРИМЕР 6: К какому типу покрытия относится лужение железа (железо покрывают оловом)? Рассмотрите схему коррозионного процесса, происходящего при нарушении целостности покрытия в растворе сульфида натрия.
Ответ: Коррозия луженого железа осуществляется за счет работы коррозионного элемента, состоящего из железа и олова.
В водном растворе сульфид натрия подвергается гидролизу по аниону слабой кислоты:
Процесс коррозии протекает по схеме:
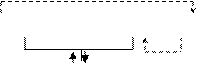 |
Анодные участки: Fe – 2e = Fe 2+
ПРИМЕР 7: Какой из металлов – цинк или медь – можно использовать в качестве протектора для защиты от электрохимической коррозии железной конструкции? Рассмотрите схему коррозионного разрушения железной конструкции в почвенном растворе с рН = 4.
Т.к. рН = 4, почвенный раствор кислый (pH 2+ 1
Катодный процесс: рН + + 2ē →Н2↑ 1
Zn + 2HCl → ZnCl2 + H2 или Zn + 2H + → Zn 2+ + H2
При использовании метода внешнего потенциала защищаемое изделие подключается к отрицательному полюсу источника тока, а положительный полюс замыкают на землю.
ЛАБОРАТОРНАЯ РАБОТА
«Коррозия металлов. Методы защиты металлов от коррозии»
Опыт 1. Электрохимическая неоднородность поверхности стали
Через 2-3 минуты опишите изменение цвета фильтровальной бумаги, форму и распределение пятен. Опишите наблюдения, запишите уравнения электродных реакций и схему коррозионного процесса.
Опыт 2. Коррозия железа в контакте с углеродом
Заполните U-образную трубку на ½ объёма 0,5 М раствором хлорида натрия. Зачистите наждачной бумагой и промойте проточной водой стальные и графитовые стержни. В одно колено трубки поместите стальной стержень и добавьте 3-4 капли раствора K3[Fe(CN)6], во второе колено погрузите графитовый стержень и добавьте 3-4 капли фенолфталеина.
Замкните внешнюю цепь через милливольтметр и запишите напряжение. Отключите вольтметр, замкните внешнюю цепь и наблюдайте за работой элемента. Как изменяется окраска раствора в катодном и анодном пространствах.
Запишите уравнения катодного и анодного процессов, составьте суммарное уравнение коррозионного процесса и схему коррозионного элемента.
Опыт 3. Легирование металла
В качестве легирующих добавок к железу применяют никель и хром. В две пробирки налейте на ½ объёма воды и добавьте 2-4 мл раствора серной кислоты и 2-3 капли раствора K3[Fe(CN)6]. В одну пробирку поместите зачищенную наждачной бумагой и промытую проточной водой стальную пластинку, во вторую пробирку – пластинку из нержавеющей стали (незачищенную).
Отметьте изменение цвета раствора через 5 минут и количество выделяющихся пузырьков газа в единицу времени.
Объясните ваши наблюдения, запишите уравнения анодных и катодных процессов. Приведите схему коррозионного процесса и уравнение суммарной реакции. Объясните причину различного поведения пластинок в растворе кислоты.
Опыт 4. Анодные и катодные защитные покрытия
В две пробирки налейте на ½ объёма воды и добавьте 1-2 мл раствора серной кислоты и 2-4 капли раствора K3[Fe(CN)6]. В одну пробирку поместите полоску оцинкованного, а в другую – лужёного железа. Отметьте изменение цвета раствора через 5 минут.
Объясните ваши наблюдения, запишите уравнения анодных и катодных процессов, приведите схемы работы коррозионных элементов и суммарные уравнения процессов коррозии. Укажите, какое из изученных покрытий было анодным, какое – катодным.
Вылейте растворы из пробирок; полоски железа хорошо промойте водой и проделайте опыт с раствором щёлочи. Наблюдения запишите и объясните так же, как в случае с кислым раствором.
Опыт 5. Протекторная защита металла
А. Протекторная защита свинца
В две пробирки налейте на ½ объёма 0,4 М раствора уксусной кислоты СН3СООН и добавьте в каждую несколько капель раствора иодида калия. В одну пробирку поместите полоску свинца, в другую – такую же полоску свинца, но в контакте с цинком. Наблюдайте, в какой из пробирок быстрее появится жёлтое окрашивание.
Объясните наблюдаемые явления. Запишите уравнения анодных и катодных процессов, приведите схемы работы коррозионных элементов и суммарные уравнения процессов коррозии.
Б. Протекторная защита стали
В две пробирки налейте на ½ объёма 0,1 М раствора серной кислоты и 2-4 капли раствора K3[Fe(CN)6]. В одну пробирку поместите стальную полоску, в другую – такую же полоску стали, но в контакте с цинком.
Запишите ваши наблюдения и объясните их, написав уравнения анодного и катодного процессов, приведите схемы работы коррозионных элементов и суммарные уравнения процессов коррозии.
Опыт 6. Влияние ингибитора на скорость коррозии
В две пробирки налейте на ½ объёма 0,1 М раствора серной кислоты и поместите в каждую пробирку полоску железа или железные стружки. В одну пробирку добавьте уротропин или другой ингибитор.
Наблюдения запишите и объясните. Запишите уравнения анодных и катодных процессов, приведите схемы работы коррозионных элементов и суммарные уравнения процессов коррозии.
ИНДИВИДУАЛЬНЫЕ ЗАДАНИЯ
Задание 1
Определите тип коррозии. Составьте уравнения процессов, протекающих в каждом из случаев, и схему коррозионного элемента для случая электрохимической коррозии. Укажите тип коррозионного разрушения.
(А) а/ Шероховатая железная пластинка в среде газообразного хлора при Т=573 К;
б/ Изогнутая цинковая пластинка в растворе K2S при Т=298К.
(Б)а/ Полированная пластина из углеродистой стали в сухом хлороводороде при Т=300 К;
б/ Полированная алюминиевая пластина в растворе Са(ОН)2 при Т=298 К.
(В) а/ Полированная алюминиевая пластина в сухом воздухе при Т=400К;
б/ Шероховатая железная пластинка в растворе (NH4)2S при Т=298К.
(Г) а/ Шероховатая железная пластинка в сухом воздухе при Т=373К;
б/ Изогнутая железная пластина в растворе NiSO4 при Т=298К.
(Д) а/ Шероховатая цинковая пластинка в сухом сероводороде при Т=300К;
б/ Полированная алюминиевая пластина в растворе FeCl2 при Т=298К.
(Е) а/ Изогнутая пластина из углеродистой стали в сухом хлороводороде при Т=300К;
б/ Изогнутая цинковая пластина в растворе Na2CO3 при Т=298К.
(Ж) а/ Шероховатая алюминиевая пластина в водяном паре при Т=423К;
б/ Изогнутая железная пластина в растворе HCl при Т=298К.
(З) а/ Полированная цинковая пластина в сухом сероводороде при Т=360К;
б/ Полированная цинковая пластина в растворе CuSO4 при Т=298 К.
(И) а/ Изогнутая пластина из углеродистой стали в насыщенном кислородом бензине при Т=298К;
б/ Изогнутая алюминиевая пластина в растворе Na2SO3 при Т=298 К.
(К) а/ Полированная алюминиевая пластина в сухом воздухе при Т=398К;
б/ Пластина из углеродистой стали в растворе K2SO4 при Т=298 К.
(Л) а/ Полированная пластина из углеродистой стали в сухом хлороводороде при Т=350К;
б/ Шероховатая цинковая пластинка во влажном воздухе при Т=298К.
(М) а/ Шероховатая железная пластинка в насыщенном кислородом керосине при Т=298К;
б/ Пластина из углеродистой стали в растворе CrCl2 при Т=298 К.
(Н) а/ Полированная пластина из углеродистой стали в насыщенном хлором керосине при Т=298К;
б/ Полированная алюминиевая пластина в растворе Ca(NO3)2 при Т=298 К.
(О) а/ Полированная цинковая пластина во влажном воздухе при Т=300К;
б/ Пластина из углеродистой стали в растворе NaOH при Т=298К.
(П) а/ Полированная железная пластина в водяном паре при Т=473К;
б/ Изогнутая цинковая пластина в растворе KCl при Т=298 К.
(Р) а/Шероховатая алюминиевая пластинка в сухом хлороводороде при Т=380К;
б/ Изогнутая железная пластина в растворе (NH4)2SO4 при Т=298 К.
(С) а/ Шероховатая железная пластинка в сухом сероводороде при Т=330К;
б/ Шероховатая алюминиевая пластинка в растворе Na2S при Т=298К.
(Т) а/ Полированная пластина из углеродистой стали в газообразном хлоре при Т=398К;
б/Полированная цинковая пластина в растворе K2SiO3 при Т=298К.
(У) а/ Полированная пластина из углеродистой стали в сухих парах брома при Т=320К;
б/ Изогнутая цинковая пластина в растворе Cr(NO3)2 при Т=298 К.
(Ф) а/ Полированная алюминиевая пластина в насыщенном кислородом керосине при Т=298К;
б/ Полированная алюминиевая пластина в растворе H2SO4 при Т=298 К.
Задание 2
(А) Какой из двух металлов, контактирующих в конструкции, будет подвергаться разрушению. Металлическое изделие находится в растворе электролита. Составьте соответствующие уравнения и схему коррозионного элемента: Fe/Ti в растворе CuCl2;
(Б)См. условие в варианте А: Cu/Au в растворе CrCl2;
(В) См. условие в варианте А: Fe/Cd в растворе KOH;
(Г) См. условие в варианте А: Sn/Cu в растворе Na2SiO3;
(Д) См. условие в варианте А: Fe/Zn в растворе HCl;
(Е) См. условие в варианте А: Cd/Ni в растворе Cr(NO3)2;
(Ж) См. условие в варианте А: Co/Pb в растворе NaOH;
(З) См. условие в варианте А: Mn/Fe в растворе NaCl;
(Т) В качестве протектора для защиты от коррозии стальных изделий используют алюминий. Составьте схему процессов, лежащих в основе защитного действия протектора, протекающих в почвенном растворе с рН = 7.
(У) В качестве протектора для защиты от коррозии стальных изделий используют марганец. Составьте схему процессов, лежащих в основе защитного действия протектора, протекающих в растворе NaНCO3.
(Ф) В качестве протектора для защиты от коррозии стальных изделий используют марганец. Составьте схему процессов, лежащих в основе защитного действия протектора, протекающих в растворе НNO3.
Что является деполяризатором при коррозии стали в растворе na2so4
Задача 20 (ОВР-129)
Коррозия в нейтральной среде и схема коррозионного процесса при контакте двух металлов: Fe, Zn.
Ответ:
При контакте двух металлов различной электрохимической активности возникает гальванический элемент. Так как цинк электрохимически более активен (см. ряд напряжений металлов), он будет служить анодом и корродировать (окисляться). На железе (катод) в нейтральной среде будет протекать восстановительный процесс:
В присутствии растворенного кислорода – кислородная деполяризация:
Анод: Zn – 2e- → Zn2+
Катод: 2H2O + O2 + 4e- → 4OH–
В отсутствие растворенного кислорода – водородная деполяризация:
Анод: Zn – 2e- → Zn2+
Катод: 2H2O + 2e- → H2↑ + 2OH-
Задача 21 (ОВР-141)
Какой процесс корозии может возникнуть при соединении медной трубы с гальванизированной (оцинкованной) стальной трубой, если обе трубы находятся в земле? От чего будет зависить скорость коррозии?
Задача 21 (ОВР-142)
Возможна ли коррозия сплава Cu-Ni в растворе при следующих условиях a(OH-)=2,5•10-5 моль/л, a(Ni2+)=2•10-6 моль/л. Изобразите схему электродных процессов и условную схему коррозионного элемента.
Поэтому в слабощелочной среде коррозия замедляется, или не происходит вообще, нужно посчитать φ.
Схема:
A (-) Ni | H2O, OH-, O2 | Cu (+) K
Электрохимические процессы при коррзии углеродистой стали и алитированного железа
Коррозия углеродистой стали и полированного алюминия
Задача 143.
Составьте уравнения процессов, протекающих в каждом из случаев, и схему коррозионного элемента для случая электрохимической коррозии. Укажите тип коррозионного разрушения.
а) Полированная алюминиевая пластина в сухом воздухе при Т=398 К;
б) Пластина из углеродистой стали в растворе K2SО4 при Т=298 К.
Решение:
а) На воздухе алюминий не реагирует с кислородом, потому что оксидная пленка пассивирует реакцию. При обычных условиях реакции с алюминием возможны только после удаления оксидной плёнки. Полированная алюминиевая пластина в сухом воздухе при нагревании подвергается действию кислорода по реакции:
б) При погружении в раствор K2SO4 пластины из углеродистой стали происходит электрохимическая коррозия. Так как K2SO4, соль, образованная сильной кислотой й сильным основанием, не подвергается гидролизу, то реакция среды будет нейтральной. Сульфат калия в растворе диссоциирует:
Анод: 2|Fe 0 – 2e = Fe 2+
Катод: 1|O2 + 2H2O + 4e = 4OH –
2Fe 0 + O2 + 2H2O = 2Fe 2+ + 4OH –
Коррозия алитированного железа
Коррозия пары металлов Al/Fe в атмосфере влажного газа
Анод 2 |Al 0 – 3электрона = Al 3+
Катод 3 |1/2O2 + H2O + 2электрона = 2ОН –
Так как ионы Al 3+ с гидроксид-ионами ОН – образуют нерастворимый гидроксид, то продуктом коррозии будет Al(OH)3:
1 Алитированное железо — это низкоуглеродистая сталь, покрытая тонким слоем алюминия для повышения ее коррозионной стойкости. При насыщении поверхности стали алюминием на глубину 0,02—1,2 мм создается плотная н прочная антикоррозийная пленка. Насыщенная алюминием поверхность стали имеет высокую жароупорность. Алитированная сталь обладает коррозионной стойкостью алюминия и прочностью стального листа.
ЭЛЕКТРОХИМИЧЕСКАЯ КОРРОЗИЯ



ХИМИЧЕСКАЯ КОРРОЗИЯ
Химическая коррозия – самопроизвольное разрушение металла или сплава в окислительных средах, которые не проводят электрический ток.
а) высокотемпературная коррозия в атмосфере сухих газов, т.е. при отсутствии конденсации влаги на поверхности металла или сплава (сухой воздух, хлор, сероводород и т.д.);
б) коррозия в жидких неэлектропроводных средах. К ним относятся жидкости органического происхождения (бензин, керосин, сернистая нефть и т.д.), а также ряд жидкостей неорганического происхождения ( расплавленная сера, жидкий бром и др.).
Сущность химической коррозии сводится к окислительно-восстановительной реакции, которая протекает между металлом или сплавом и окислителем.
При окислении металла или сплава образуется пленка продукта коррозии, которая может проявлять различные свойства, т.е. защищать поверхность от дальнейшего окисления или не защищать. Чтобы пленка продукта коррозии обладала защитными свойствами, она должна удовлетворять следующим требованиям:
1. быть сплошной, непористой;
2. иметь хорошее сцепление с металлом;
3. быть химически инертной по отношению к данной агрессивной среде;
4. обладать твердостью и износостойкостью.
ПРИМЕР 1: Рассмотрите процесс коррозии цинковой пластины в атмосфере сухого сероводорода при температуре 400К.
Ответ: В атмосфере любого сухого газа при высоких температурах протекает химическая коррозия, сущность которой, в данном случае, сводится к окислительно-восстановительной реакции между металлом (Zn) и окислителем (H2S):
Продуктом коррозии является сульфид цинка.
ПРИМЕР 2: Опишите процесс коррозии железного гвоздя, помещенного в бензин, который насыщен кислородом.
Ответ: В чистом виде органические растворители не реагируют с металлами, но в присутствии примесей химическое взаимодействие протекает интенсивно. В данном случае будет протекать химическое взаимодействие между железом и кислородом:
ЭЛЕКТРОХИМИЧЕСКАЯ КОРРОЗИЯ
Электрохимическая коррозия –самопроизвольное разрушение металла или сплава в среде электролита:
— в растворах электролитов (растворы щелочей, кислот и солей; морская вода);
— в атмосфере любого влажного газа;
Металлы и сплавы неоднородны. При соприкосновении их с электролитами, участки с более низким значением потенциала играют роль анода, а другие, с более высоким значением потенциала – роль катода. Таким образом, на поверхности металла или сплава возникает множество микрогальванических пар, и, чем их больше, тем больше скорость разрушения поверхности металла или сплава в электролите.
При электрохимической коррозии протекают раздельно два процесса: окисление на анодных участках и восстановление на катодных участках, при этом образуется коррозионный элемент:
 |
где Д – деполяризатор.
Схематично процесс электрохимической коррозии можно описать следующими электродными процессами:
Анодные участки: Ме – nе = Ме n +
Катодный процесс зависит от кислотности среды (рН):
б) если рН ≥ 7 (в нейтральных и щелочных средах), то деполяризатором являются молекулы кислорода, растворенные в электролите, и на катодных участках осуществляется кислородная деполяризация, протекающая по схеме:
Возможны различные случаи возникновения коррозионных гальванических пар:
1. Контакт с электролитом двух разных металлов
ПРИМЕР 3: Рассмотрите химические процессы, протекающие при контакте цинковой и свинцовой пластин, погруженных в раствор хлорида аммония.
В водном растворе хлорид аммония подвергается процессу гидролиза по катиону слабого основания :
Строение и работа коррозионного элемента описывается следующей схемой:
 |


Анодные участки : Zn – 2e = Zn 2+
Катодные участки: 2H + + 2e = H2 (pH + = Zn 2+ + H2
Продуктом коррозии является хлорид цинка.
2. Контакт металла с его химическим соединением или с неметаллическими включениями (например, углеродистая сталь Fe3C, где железо контактирует с углеродом);
ПРИМЕР 4: Какие химические процессы протекают при разрушении углеродистой стали во влажном воздухе?
Строение и работа коррозионного элемента описывается схемой:
 |
 |

Суммарное уравнение реакции: 2Fe + O2 + 2H2O = 2Fe(OH)2
Fe(OH)2 – белая ржавчина, промежуточный продукт коррозии железа при рН=7.
Дальнейшее окисление железа протекает по следующим схемам:
FeOOH – бурая ржавчина, конечный продукт коррозии железа при рН=7.
3. Структурная неоднородность металла (например, дефекты кристаллических решеток, деформации и неровности поверхности металла).
Коррозионному разрушению, обусловленному дефектами кристаллической решётки, как правило, подвергаются металлические изделия, не имеющие других структурных нарушений. При этом коррозионные элементы представляют собой микрогальванические пары. Причина их образования кроется в неоднородности кристаллической структуры поверхностного слоя металла. Как правило, дефекты кристаллической решётки в каждом кристалле перемещаются к его границам и там локализуются. При контакте с электролитом полированной поверхности металлического изделия на границах кристалла возникает более отрицательный потенциал, чем в его центре. Поэтому каждый кристалл будет представлять собой коррозионный элемент.
Cu 2+ + H2O ↔ CuOH + + H +
В результате гидролиза раствор хлорида меди становится кислым, и, следовательно, в нём будет протекать водородная деполяризация.
Схемы коррозии шероховатой и полированной цинковых пластинок в растворе хлорида меди:







