Что является источником энергии для мышечного сокращения является
Что является источником энергии для мышечного сокращения является
Верхняя кривая на рисунке выше подобна кривой на рисунке ниже, но показывает напряжение целой интактной мышцы, а не одиночного мышечного волокна. Целая мышца содержит большое количество соединительной ткани; кроме того, саркомеры в разных частях мышцы не всегда сокращаются с одинаковой силой. В результате данная кривая по сравнению с кривой для отдельного мышечного волокна имеет в определенной степени иные размерности, но демонстрирует ту же основную форму наклона в области нормального диапазона сокращения.
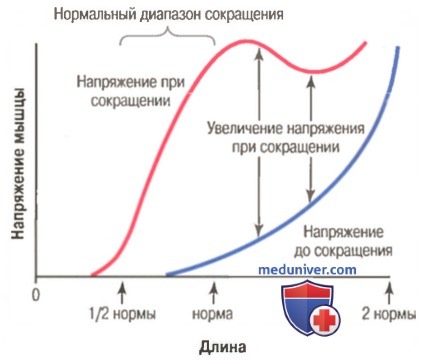
На рисунке выше видно, что при длине мышцы, соответствующей ее состоянию покоя (т.е. когда длина саркомера около 2 мкм), активация мышцы приводит к ее сокращению, сила которого близка к максимальной. Однако увеличение напряжения, происходящее во время сокращения и называемое активным напряжением, снижается по мере растяжения мышцы за пределы ее нормальной длины (т.е. за пределы длины саркомера примерно в 2,2 мкм). Это демонстрируется на рисунке уменьшением длины стрелки при длине мышцы больше нормы.
Без нагрузки скелетная мышца сокращается чрезвычайно быстро, достигая максимума примерно за 0,1 сек для усредненной мышцы. При наличии нагрузки по мере ее возрастания скорость сокращения постепенно снижается. Когда нагрузка возрастает до величины, равной максимальной силе, которую способна развить мышца, скорость сокращения становится нулевой, и в результате укорочения мышцы нет, несмотря на ее активацию.
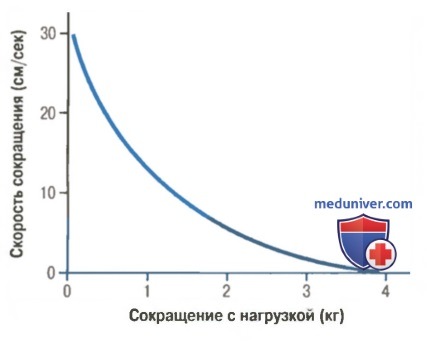
Снижение скорости сокращения при увеличении нагрузки связано с тем фактом, что нагрузка на сокращающуюся мышцу противостоит силе, развиваемой мышцей при сокращении. Следовательно, общая сила, доступная для развития скорости укорочения, соответственно уменьшается.
При сокращении против нагрузки мышца выполняет работу. Это значит, что энергия перемещается от мышцы к внешней нагрузке, чтобы поднять объект до большей высоты или преодолеть сопротивление движению.
В математическом выражении работа определяется следующим уравнением:
где W — производимая работа, L — нагрузка и D — расстояние движения против нагрузки.
Источником энергии, необходимой для выполнения работы, являются химические реакции в мышечных клетках во время сокращения, которые приведены в следующих разделах.
Источники энергии для мышечного сокращения
Мы уже знаем, что мышечное сокращение зависит от энергии, поставляемой АТФ. Большая часть этой энергии тратится на приведение в действие храпового механизма, с помощью которого поперечные мостики тянут актиновые нити. Однако небольшое количество энергии необходимо: (1) для откачивания ионов кальция из саркоплазмы в саркоплазматический ретикулум после завершения сокращения; (2) на активное перемещение ионов натрия и калия через мембрану мышечного волокна с целью поддержания соответствующей ионной среды для распространения потенциалов действия по волокну.
Концентрация АТФ в мышечном волокне (примерно 4 ммоль/л) достаточна для поддержания максимального сокращения в течение не более 1-2 сек. АТФ расщепляется с формированием АДФ и выделением энергии, которая передается механизму сокращения мышечного волокна. В течение следующей доли секунды АДФ рефосфорилируется, формируя новую молекулу АТФ, что позволяет мышце продолжать свое сокращение. Существуют несколько источников энергии для восстановления АТФ.
Первым источником энергии, используемым для восстановления АТФ, является креатинфосфат — вещество с высокоэнергетической фосфатной связью, подобной связям АТФ. Высокоэнергетическая фосфатная связь креатинфосфата имеет несколько большее количество свободной энергии, чем каждая связь АТФ. Креатинфосфат немедленно расщепляется, и освобожденная энергия вызывает связывание нового фосфата с АДФ, восстанавливая АТФ. Однако общее количество креатинфосфата в мышечном волокне также очень незначительно — примерно в 5 раз больше, чем АТФ. Следовательно, общий запас энергии в виде АТФ и креатинфосфата в мышце способен обеспечить максимальное сокращение в течение лишь 5-8 сек.
Вторым важным источником энергии, используемым для восстановления как АТФ, так и креатинфосфата, является гликолиз гликогена, предварительно накопленного в мышечных клетках. Быстрое ферментативное разрушение гликогена до пировиноградной кислоты, а затем до молочной кислоты освобождает энергию, которая используется для превращения АДФ в АТФ. Затем АТФ может участвовать непосредственно в обеспечении энергией дополнительного мышечного сокращения, а также в восстановлении запасов креатинфосфата.
Механизм гликолиза имеет двойное значение. Во-первых, гликолитические реакции могут происходить даже при отсутствии кислорода, и мышечное сокращение может поддерживаться в течение нескольких секунд, а иногда более 1 мин, даже если доставка кислорода из крови не доступна. Во-вторых, скорость образования АТФ с помощью гликолиза примерно в 2,5 раза выше, чем при образовании АТФ в реакциях питательных веществ клетки с кислородом. Однако конечных продуктов гликолиза в мышечных клетках накапливается так много, что примерно через 1 мин гликолиз также теряет способность поддерживать максимальное мышечное сокращение.
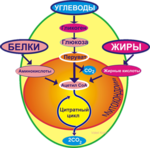
Третьим и решающим источником энергии является окислительный метаболизм, т.е. комбинирование кислорода с конечными продуктами гликолиза и различными другими клеточными питательными веществами с освобождением энергии. Более 95% всей энергии, используемой мышцей для непрерывного длительного сокращения, извлекается из этого источника. Потребляемыми питательными веществами являются углеводы, жиры и белки. Для чрезвычайно длительной максимальной мышечной активности, продолжающейся в течение многих часов, основная часть энергии получается из жиров, но при мышечной активности длительностью 2-4 ч до половины энергии может получаться из накопленных углеводов.
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
Что является источником энергии для мышечного сокращения является
АТФ как источник энергии для сокращения. Химические явления при движении головок миозина. При сокращении мышцы выполняется работа и расходуется энергия. Во время процесса сокращения много молекул АТФ расщепляются с формированием АДФ. Чем больше работа, производимая мышцей, тем больше расщепляется АТФ. Это называют эффектом Фена. При этом, как полагают, происходят следующие явления.
1. До начала сокращения головки поперечных мостиков связываются с АТФ. АТФ-азная активность головки миозина немедленно расщепляет АТФ, но продукты расщепления (АДФ и фосфатный ион) остаются связанными с головкой. В этом состоянии конформация головки такова, что она располагается перпендикулярно нити актина, но еще не прикрепляется к ней.
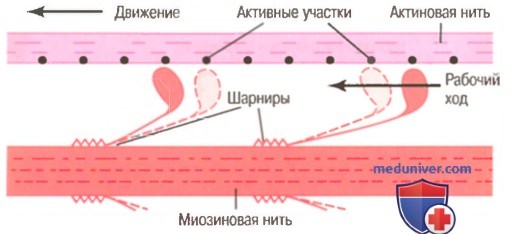
2. Когда тропонин-тропомиозиновый комплекс связывается с ионами кальция, активные участки нити актина открываются, и миозиновые головки соединяются с ними.
3. Связь между головкой поперечного мостика и активным участком на нити актина вызывает конформационное изменение в головке, заставляющее ее наклониться к плечу поперечного мостика. Это обеспечивает рабочий ход для протягивания актиновой нити. Рабочий ход активируется энергией, сохраненной в головке, как во «взведенной» пружине, в виде ее конформационного изменения, происходящего ранее во время расщепления молекулы АТФ.
4. Наклон головки поперечного мостика позволяет освободить АДФ и фосфатный ион, предварительно соединенные с головкой. К месту, от которого выделилась АДФ, прикрепляется новая молекула АТФ, что ведет к отсоединению головки от актина.
5. После отсоединения головки от актина новая молекула АТФ расщепляется, начиная следующий цикл, ведущий к новому рабочему ходу. Это значит, что энергия снова «взводит» головку в перпендикулярное положение, из которого она готова начать новый цикл рабочего хода.
6. Когда «взведенная» головка (с запасом энергии, извлеченной из расщепленной АТФ) связывается с новым активным участком на нити актина, она «разряжается», обеспечивая новый рабочий ход. Таким образом, процесс повторяется снова и снова до тех пор, пока нити актина не притянут Z-диску вплотную к концам миозиновых нитей или пока нагрузка на мышцу не станет слишком большой для осуществления дальнейшей тяги.
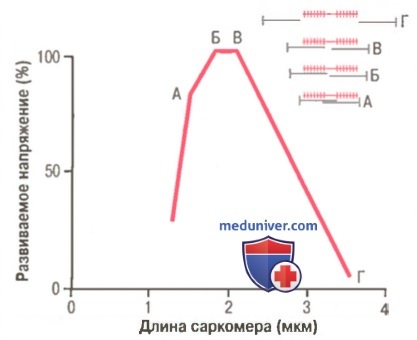
Видно, что максимальная сила сокращения развивается при длине саркомера 2,0-2,2 мкм.
Вверху справа показано относительное расположение актиновых и миозиновых нитей при разной длине саркомера, соответственно точкам от А до Г.
На рисунке демонстрируется влияние длины саркомера и степени перекрытия миозиновых и актиновых нитей на активное напряжение, развиваемое сокращающимся мышечным волокном. Справа черными линиями показаны разные степени перекрытия миозиновых и актиновых нитей при разной длине саркомера. В точке Г на кривой актиновая нить по всей длине оттянута от конца миозиновой нити, и перекрытие между актином и миозином отсутствует. В этом случае напряжение, развиваемое активированной мышцей, равно нулю. Затем по мере укорочения саркомера нить актина начинает перекрывать миозиновую нить, и напряжение постепенно увеличивается до тех пор, пока длина саркомера не уменьшится примерно до 2,2 мкм.
В этом случае актиновая нить перекрывает все поперечные мостики миозиновой нити, но еще не достигает ее центра. При дальнейшем укорочении саркомер сохраняет максимальное на пряжение до тех пор, пока длина саркомера не уменьшится до 2 мкм, что соответствует точке Б на кривой. В этом случае концы двух актиновых нитей начинают перекрывать друг друга в дополнение к перекрытию миозиновых нитей. По мере уменьшения длины саркомера от 2 мкм вплоть до 1,65 мкм, как в точке А, сила сокращения быстро уменьшается. В этой точке два Z-диска саркомера примыкают к концам миозиновых нитей. Если осуществляется сокращение с целью еще большего укорочения саркомера, концы миозиновых нитей изгибаются, и, как видно на рисунке, сила сокращения приближается к нулю, однако вся мышца теперь сжата до своей минимальной длины.
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
Что является источником энергии для мышечного сокращения является
Выделяют несколько последовательных этапов запуска и осуществления мышечного сокращения.
1. Потенциал действия распространяется вдоль двигательного нервного волокна до его окончаний на мышечных волокнах.
2. Каждое нервное окончание секретирует небольшое количество нейромедиатора ацетилхолина.
3. Ацетилхолин действует на ограниченную область мембраны мышечного волокна, открывая многочисленные управляемые ацетилхолином каналы, проходящие сквозь белковые молекулы, встроенные в мембрану.
4. Открытие управляемых ацетилхолином каналов позволяет большому количеству ионов натрия диффундировать внутрь мышечного волокна, что ведет к возникновению на мембране потенциала действия.
5. Потенциал действия проводится вдоль мембраны мышечного волокна так же, как и по мембране нервного волокна.
6. Потенциал действия деполяризует мышечную мембрану, и большая часть возникающего при этом электричества течет через центр мышечного волокна. Это ведет к выделению из саркоплазматического ретикулума большого количества ионов кальция, которые в нем хранятся.
7. Ионы кальция инициируют силы сцепления между актиновыми и миозиновыми нитями, вызывающие скольжение их относительно друг друга, что и составляет основу процесса сокращения мыщц.
8. Спустя долю секунды с помощью кальциевого насоса в мембране саркоплазматического ретикулума ионы кальция закачиваются обратно и сохраняются в ретикулуме до прихода нового потенциала действия. Удаление ионов кальция от миофибрилл ведет к прекращению мышечного сокращения.
Далее мы обсудим молекулярные механизмы этого процесса.
Молекулярные механизмы мышечного сокращения
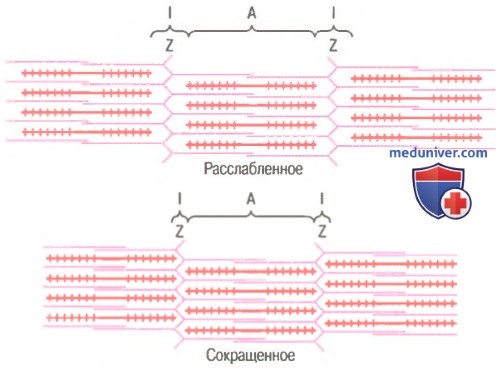
Механизм скольжения нитей для мышечного сокращения. На рисунке показан основной механизм мышечного сокращения. Показано расслабленное состояние саркомера (вверху) и сокращенное состояние (внизу). В расслабленном состоянии концы актиновых нитей, отходящие от двух последовательных Z-дисков, лишь незначительно перекрываются. Наоборот, в сокращенном состоянии актиновые нити втягиваются внутрь между миозиновыми так сильно, что их концы максимально перекрывают друг друга. При этом Z-диски притягиваются актиновыми нитями к концам миозиновых. Таким образом, мышечное сокращение осуществляется путем механизма скольжения нитей.
Что заставляет нити актина скользить внутрь среди нитей миозина? Это связано с действием сил, генерируемых при взаимодействии поперечных мостиков, исходящих от нитей миозина, с нитями актина. В условиях покоя эти силы не проявляются, однако распространение потенциала действия вдоль мышечного волокна приводит к выделению из саркоплазматическо-го ретикулума большого количества ионов кальция, которые быстро окружают миофи-бриллы. В свою очередь, ионы кальция активируют силы взаимодействия между нитями актина и миозина, в результате начинается сокращение. Для осуществления процесса сокращения необходима энергия. Ее источником являются высокоэнергетические связи молекулы АТФ, которая разрушается до АДФ с высвобождением энергии. В следующих разделах мы приведем известные детали молекулярных процессов сокращения.
Молекулярные особенности сократительных нитей
Миозиновая нить. Она состоит из множества молекул миозина, молекулярная масса каждой составляет около 480000. На рисунке показана отдельная молекула; и также — объединение многих молекул миозина в миозиновую нить, а также взаимодействие одной стороны этой нити с концами двух актиновых нитей.
В состав молекулы миозина входят 6 полипептидных цепей: 2 тяжелые цепи с молекулярной массой около 200000 каждая и 4 легкие цепи с молекулярной массой около 20000 каждая. Две тяжелые цепи спирально закручиваются вокруг друг друга, формируя двойную спираль, которую называют миозиновым хвостом. С одного конца обе цепи изгибаются в противоположных направлениях, формируя глобулярную полипептидную структуру, называемую миозиновой головкой. Таким образом, на одном конце двойной спирали молекулы миозина образуются 2 свободные головки; 4 легкие цепи также включены в состав миозиновой головки (по 2 в каждой). Они помогают регулировать функцию головки во время мышечного сокращения.
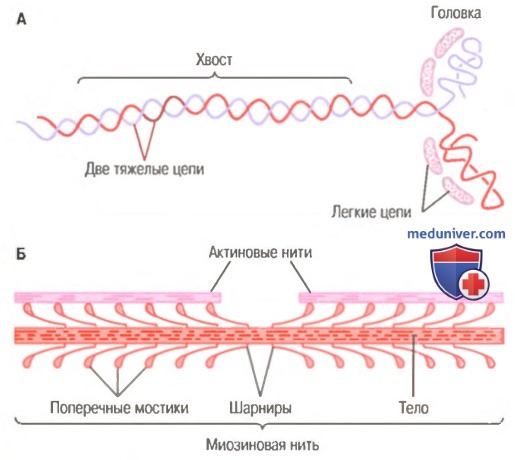
Б. Объединение многих молекул миозина в одну миозиновую нить.
Показаны также тысячи миозиновых поперечных мостиков и взаимодействие их головок с прилежащими актиновыми нитями.
Миозиновая нить состоит из 200 или более отдельных молекул миозина. Видно, что хвосты молекул миозина объединяются, формируя тело нити, а многочисленные головки молекул выдаются наружу по сторонам тела. Кроме того, наряду с головкой в сторону выступает часть хвоста каждой миозиновой молекулы, образуя плечОу которое выдвигает головку наружу от тела, как показано на рисунке. Выступающие плечи и головки вместе называют поперечными мостиками. Каждый поперечный мостик может сгибаться в двух точках, называемых шарнирами. Один из них расположен в месте, где плечо отходит от тела миозиновой нити, а другой — где головка крепится к плечу. Движение плеча позволяет головке или выдвигаться далеко наружу от тела миозиновой нити, или приближаться к телу. В свою очередь, повороты головки участвуют в процессе сокращения, что обсуждается в следующих разделах.
Общая длина каждой миозиновой нити остается постоянной и равна почти 1,6 мкм. В самом центре миозиновой нити на протяжении 0,2 мкм поперечных мостиков нет, поскольку снабженные шарнирами плечи отходят в стороны от центра.
Сама миозиновая нить сплетена таким образом, что каждая последующая пара поперечных мостиков смещена в продольном направлении относительно предыдущей на 120°, что обеспечивает распределение поперечных мостиков во всех направлениях вокруг нити.
АТФ-азная активность миозиновой головки. Есть и другая особенность миозиновой головки, необходимая для мышечного сокращения: миозиновая головка функционирует как фермент АТФ-аза. Как объясняется далее, это свойство позволяет головке расщеплять АТФ и использовать энергию расщепления высокоэнергетической связи для процесса сокращения.
Актиновая нить. Актиновая нить состоит из трех белковых компонентов: актина, тропомиозина и тропонина.
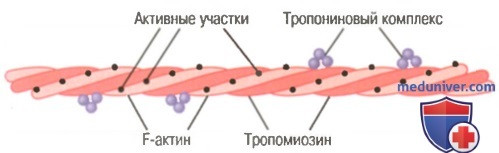
К одному концу каждой молекулы тропомиозина прикреплен тропониновый комплекс, который запускает сокращение.
Основой актиновой нити являются две цепи белковой молекулы F-актина. Обе цепи закручиваются в спираль так же, как и молекула миозина.
Каждая цепь двойной спирали F-актина состоит из полимеризованных молекул G-актина с молекулярной массой около 42000. К каждой молекуле G-актина прикреплена 1 молекула АДФ. Полагают, что эти молекулы АДФ являются активными участками на актиновых нитях, с которыми взаимодействуют поперечные мостики миозиновых нитей, обеспечивая мышечное сокращение. Активные участки на обеих цепях F-актина двойной спирали расположены со смещением таким образом, что вдоль всей поверхности актиновой нити встречается один активный участок примерно через каждые 2,7 нм.
Длина каждой актиновой нити — около 1 мкм. Основания актиновых нитей прочно встроены в Z-диски; концы этих нитей выступают в обоих направлениях, располагаясь в пространствах между миозиновыми молекулами.
Молекулы тропомиозина. Актиновая нить также содержит другой белок — тропомиозин. Каждая молекула тропомиозина имеет молекулярную массу 70000 и длину 40 нм. Эти молекулы спирально оплетают спираль из F-актина. В состоянии покоя молекулы тропомиозина располагаются поверх активных участков актиновых нитей, препятствуя их взаимодействию с миозиновыми нитями, лежащему в основе сокращения.
Тропонин и его роль в мышечном сокращении. По ходу молекул тропомиозина к ним периодически прикреплены другие белковые молекулы, называемые тропонином. Они представляют собой комплексы трех слабосвязанных белковых субъединиц, каждая из которых играет специфическую роль в регуляции мышечного сокращения. Одна из субъединиц (тропонин I) имеет высокое сродство к актину, другая (тропонин Т) — к тропомиозину, третья (тропонин С) — к ионам кальция. Считают, что этот комплекс прикрепляет тропомиозин к актину. Высокое сродство тропонина к ионам кальция, как полагают, инициирует процесс сокращения, о чем говорится в следующей статье.
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
— Вернуться в оглавление раздела «Физиология человека.»
Энергетические процессы в мышце
Содержание
Энергетические процессы в мышце [ править | править код ]
Естественно, что для совершения мышечного движения требуется энергия. В организме человека существуют разные источники энергии, которые последовательно включаются один за другим. Рассмотрим каждый из них.
АТФ [ править | править код ]
Универсальным источником энергии в живом организме является молекула АТФ, которая образуется в цитратном цикле Кребса. Под действием фермента АТФазы молекула АТФ гидролизуется, отсоединяя фосфатную группу в виде ортофосфорной кислоты (Н3РО4), и превращается в АДФ, при этом высвобождается энергия.
Головка миозинового мостика при контакте с актином обладает АТФазной активностью и соответственно возможностью расщеплять АТФ и получать энергию, необходимую для движения.

Креатинфосфат [ править | править код ]
Запас молекул АТФ в мышце ограничен, поэтому расход энергии при работе мышцы требует постоянного его восполнения, это происходит за счет креатинфосфата. Креатинфосфат обладает способностью отсоединять фосфатную группу и превращаться в креатин, присоединяя фосфатную группу к АДФ, которая превращается в АТФ.
АДФ + креатинфосфат = АТФ + креатин.
Эта реакция получила название – реакции Ломана. Именно поэтому креатин имеет большое значение в бодибилдинге.
Надо заметить, что креатин эффективен только при выполнении анаэробных (силовых) упражнений, так как креатинфосфата достаточно примерно на 2 минуты интенсивной работы, затем подключаются другие источники энергии. Соответственно, в лёгкой атлетике приём креатина как добавки для увеличения атлетических показателей малоэффективен.
Запасы креатинфосфата в волокне не велики, поэтому он используется в качестве источника энергии только на начальном этапе работы мышцы, до момента активизации других более мощных источников – анаэробного и затем аэробного гликолиза. По окончании работы мышцы реакция Ломана идет в обратном направлении, и запасы креатинфосфата в течение нескольких минут восстанавливаются.
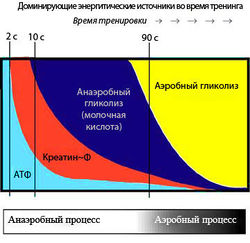
Энергетический метаболизм скелетных мышц [ править | править код ]
Алактатные механизмы [ править | править код ]
КФ обеспечивает запас энергии фосфата для ресинтеза АТФ из АДФ при наступлении сократительной деятельности (рис. 3):
КФ + АДФ Креатинкиназа К + АТФ (1)
В состоянии покоя мышечные волокна наращивают концентрацию КФ до пяти раз больше, чем АТФ. В начале сокращения, когда концентрация АТФ начинает падать, а АДФ повышаться вследствие ускорения разложения АТФ, массовая активность способствует образованию АТФ из КФ.
Хотя образование АТФ из КФ происходит быстро, требуя одной единственной ферментативной реакции (1), количество АТФ, которое может быть получено в результате этого процесса, ограничено начальной концентрацией КФ. Мышечные волокна также содержат миокиназу, которая катализирует образование одной молекулы АТФ и одной молекулы АМФ из двух молекул АДФ. АТФ и КФ, вместе взятые, могут обеспечить максимальную силу в течение 8—10 с. Таким образом, энергия, полученная от фосфагенной системы, используется для коротких всплесков максимальной мышечной активности, необходимых в легкой и тяжелой атлетике (забег на 100 м, толкание ядра или поднятие тяжестей).
Гликолиз [ править | править код ]
Хотя метаболизм по гликолитическому пути производит лишь небольшое количество АТФ из каждой усвоенной единицы глюкозы, он может обеспечить быстрый синтез большого количества АТФ при наличии достаточного количества ферментов и субстрата. Этот процесс может также происходить в отсутствие кислорода:
Глюкоза анаэробный быстрый гликолиз 2 АТФ + 2 лактата (2)
Глюкоза для гликолиза поступает либо из крови, либо из запасов гликогена. Когда исходным материалом выступает гликоген, из одной единицы потребленной глюкозы в результате фосфоролитического гликогенолиза образуется три молекулы АТФ. По мере того, как мышечная активность становится интенсивнее, для анаэробного расщепления гликогена мышц требуется все больше и больше АТФ, и, соответственно, увеличивается производство молочной кислоты. Анаэробный гликолиз может обеспечить энергию на 1,3-1,6 мин максимальной мышечной активности.
Образование молочной кислоты понижает уровень pH в мышечных волокнах. Это препятствует действию ферментов и вызывает боль, если удаление молочной кислоты происходит слишком медленно по сравнению с ее образованием.
Окислительное фосфорилирование [ править | править код ]
При умеренном уровне физической нагрузки, например, при беге на 5000 м или марафоне, большая часть АТФ, используемого для сокращения мышц, образуется путем окислительного фосфорилирования. Окислительное фосфорилирование позволяет высвободить из глюкозы гораздо больше энергии по сравнению с отдельно взятым анаэробным гликолизом:
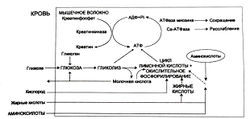
Жиры катаболизируются только с помощью окислительных механизмов, при этом выделяется много энергии. Аминокислоты тоже могут быть метаболизированы подобным образом. Три метаболических пути образования АТФ для сокращения и расслабления мышц показаны на рис. 3.
В течение первых 5
10 мин умеренной физической нагрузки главным потребляемым «топливом» является собственный гликоген мышц. В течение следующих 30 мин доминирующими становятся переносимые кровью вещества; глюкоза крови и жирные кислоты вносят примерно одинаковый вклад в потребление мышцами кислорода. По истечении этого периода все более важную роль приобретают жирные кислоты. Важно подчеркнуть взаимодействие между анаэробными и аэробными механизмами в образовании АТФ во время физической нагрузки. Вклад анаэробного образования АТФ больше при краткосрочной нагрузке высокой интенсивности, в то время как при более продолжительных нагрузках низкой интенсивности преобладает аэробный метаболизм.
Восстановление и кислородная задолженность [ править | править код ]
После того как физическая нагрузка закончилась, поглощение кислорода все еще остается выше нормы (табл.). С недавнего времени для обозначения кислородной задолженности используется также термин «избыточное потребление кислорода после физической нагрузки». Сначала его уровень очень высок, пока тело восстанавливает запасы КФ и АТФ, возвращая тканям запасенный кислород, а затем в течение еще одного часа потребление идет на более низком уровне, пока удаляется молочная кислота. Поэтому ранние и последние фазы кислородной задолженности называют соответственно алактатной и лактатной кислородной задолженностью. Повышение температуры тела также говорит о более высокой скорости метаболизма и росте потребления кислорода.
Чем продолжительнее и интенсивнее физическая нагрузка, тем больше времени занимает восстановление. Например, на восстановление после полного истощения гликогена мышц зачастую требуется несколько дней, а не секунд, минут или часов, необходимых для восстановления запасов КФ и АТФ и удаления молочной кислоты. Физическая нагрузка большой интенсивности, вероятно, приводит к микротравмам мышечных волокон, и их восстановление занимает некоторое время.
Компоненты кислородной задолженности. После длительной, тяжелой физической нагрузки дыхание остается выше нормы для удовлетворения повышенной потребности в кислороде
Восстановление запасов кислорода в тканях(около 1 л)
Восстановление уровней креатинфосфата и других богатых энергией фосфатов (около 1-1,5 л)
Удаление молочной кислоты путем глюконеогенеза и другими путями (до 12 л)
Стимуляция метаболизма вследствие повышения уровня адреналина (около 1 л)
Дополнительное потребление кислорода в дыхательных мышцах и сердце (около 0,5 л)
Общее усиление метаболизма вследствие более высокой температуры тела*