Что является мономером белка
Белок: мономер, строение и функции
Строение
Классификация
Сами же белки классифицируются по аминокислотному составу. Они могут быть полноценными, если содержат полной набор аминокислот, и неполноценным, если одна или несколько аминокислот отсутствуют. Если белок состоит исключительно из аминокислот, его называют простым. В случае, когда присутствует простетическая группа, которая также называется неаминокислотным компонентом, их называют сложными. Неаминокислотная группа может быть представлена в виде металлопротеинов, углеводов (гликопротеинов), липидов (липопротеинов) и нуклеиновых кислот (нуклеопротеинов).
Элементарная часть
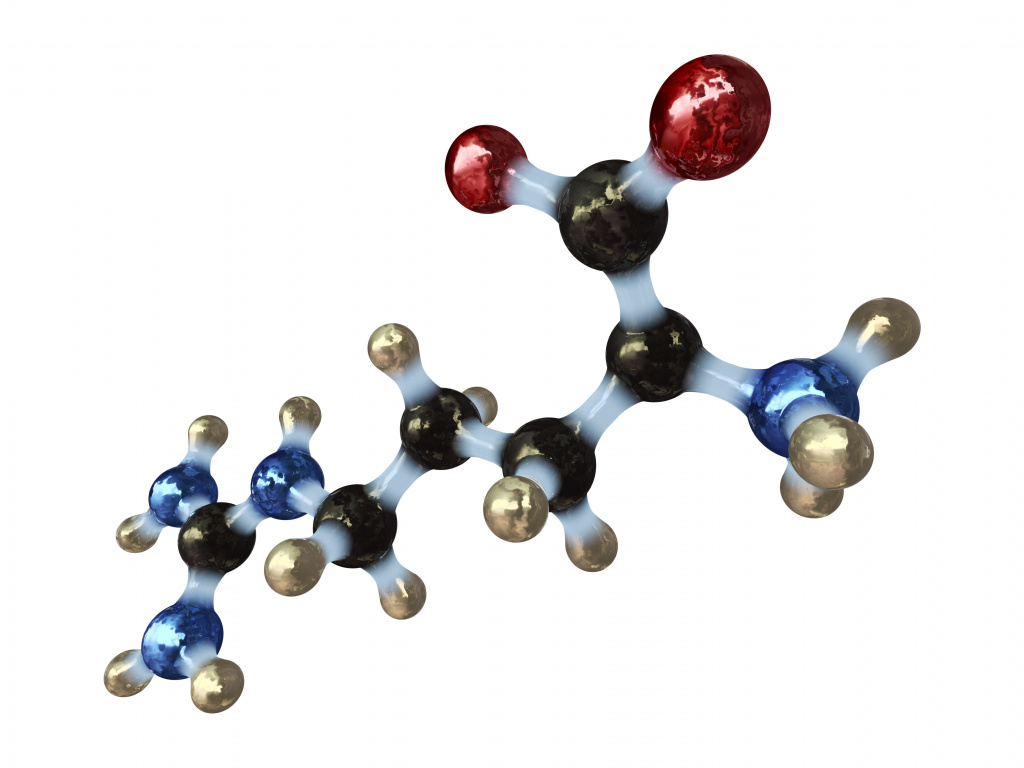
Сами аминокислоты состоят из трех обязательных частей. Таким образом, можно сказать, что мономером белка является радикал, различающий между собой виды аминокислот, а также неизменяемые карбоксильная и амино- группы. По количеству входящих в состав карбоксильных и аминогрупп аминокислоты подразделяют на нейтральные, основные и кислые. Нейтральные имеют по одной карбоксильной и аминогруппе. В формуле основных содержится более одной аминогруппы, а в кислых аминокислотах, наоборот, имеется более чем одна карбоксильная группа.
Пептидная связь
Еще одна классификация
Как уже упоминалось выше, мономеры белков состоят из амино- и карбоксильной групп и радикала, которые образуют между собой прочные связи. Также могут присутствовать и другие вещества, однако именно от R-группы в основном зависят свойства всей молекулы, и существует еще один тип классификации. Какой? Мономеру белка свойственно иметь различные радикалы, по их типу и можно разделить все аминокислоты на гетероциклические, ароматические и алифатические. Алифатический радикал может содержать функциональные группы, которые придают особые свойства. Это амино-, карбоксильная, тиольная (-SH), гидроксильная (-OH), амидная (-C0-NH2) и гуанидиновая группы.
Разные радикалы
Организация молекул белка в пространстве
Пространственная организация белковых молекул имеет четыре уровня.
Так как мономерами молекул белков являются аминокислоты, то первичная структура представлена в виде полипептидной цепи, состоящей из аминокислотных остатков, которые объединены пептидной связью. Несмотря на кажущуюся простоту, именно первичная структура определяет, какую функцию сможет выполнять белок. Мономер в составе цепи должен быть на своем месте, замена даже одного из них изменит назначение всей молекулы. Например, если шестую глутаминовую кислоту в гемоглобине заменить на валин, вся молекула в целом перестанет функционировать, и транспорт кислорода будет нарушен. Такая замена приводит к развитию у человека серповидноклеточной анемии.
Вторичная структура характерна упорядоченным свертыванием цепи в спираль, по внешнему виду напоминающую растянутую пружину. Связи, возникающие между мономерами белков, являются водородными и укрепляют структуру. Эти связи появляются между амино- и карбоксильными группами. Водородные связи слабее пептидных, но делают всю конфигурацию более жесткой и устойчивой за счет многократного повторения. Для некоторых белков, например фиброина (паутина, шелк), кератина (ногти и волосы) и коллагена, дальнейшей компактизации не происходит.
Третий уровень
При попадании в водный раствор радикалы-гидрофобы стараются скрыться от воды путем группировки внутри глобул, а гидрофильные R-группы взаимодействуют с диполями воды (гидратация), напротив, оказываются на поверхности. Некоторые белки имеют дополнительную стабилизацию третичной структуры за счет дисульфидных ковалентных связей, которые возникают между двумя остатками цистеина за счет наличия атомов серы. На третичной структуре заканчивается компактизация белков-ферментов, антител и некоторых гормонов.
Четвертичная структура
Последняя степень компактизации присутствует в сложных белках, в составе которых имеется две и более глобул. Удерживание субъединиц происходит за счет ионных, гидрофобных и электростатических взаимодействий. Также возможно образование дисульфидных связей. Четвертичную структуру имеет белок гемоглобин, образованный двумя альфа-субъединицами, содержащими 141 аминокислотный остаток, и бета-субъединицами, в составе которых насчитывается 146 остатков. Каждая субъединица связана также с молекулой гема, в которой содержится железо.
Свойства белков
Так как мономером молекулы белка является аминокислота, то именно от них, наряду со структурной организацией, зависят и свойства. Белки проявляют как кислотные, так и основные свойства, которые определяется R-группами аминокислот: если в составе больше основных аминокислот, то и основные свойства выражены ярче. Буферные свойства белков определяется способностью присоединять и отдавать протон (H+). Гемоглобин, содержащийся в эритроцитах, является одним из мощнейших буферов, помимо связывания кислорода он исполняет функции регуляции уровня pH крови.
Денатурация
Защита и обмен веществ
Без участия белков в организме не происходит ни одного процесса. Их строительная функция заключается в участии в формировании внеклеточных и клеточных структур, они присутствуют в составе мембран клеток, волос, ногтей и сухожилий. Также выполняют и транспортную функцию: гемоглобин осуществляет перенос кислорода и углекислого газа, а белки мембран клеток активно и избирательно проводят перенос нужных веществ в клетку и из нее во внешнюю среду.
Некоторые гормоны имеют белковую природу и участвуют в регуляции обмена веществ. К примеру, инсулин производит регулировку в крови уровня глюкозы, а наряду с этим способствует образованию гликогена и оптимизирует синтез жиров из углеводов.
Защитная функция белков состоит в образовании антител в случае, если организм атакован чужеродными белками и микроорганизмами. Антитела способны находить и обезвреживать их. При ранах и порезах из фибриногена образуется фибрин, который помогает остановить кровотечение.
Другие функции
На белках лежит также и сигнальная функция. В клеточных мембранах содержатся белки, которые могут менять свою третичную структуру в зависимости от воздействия внешней среды. Это является основой приема и передачи в клетку сигналов из внешней среды.
Ни человек, ни животные не могут запасать белки (исключением является казеин молока и альбумин яиц), но белки способствуют накоплению в организме некоторых веществ. К примеру, во время распада гемоглобина железо не покидает организм, а образует комплекс с ферритином. Распад одного грамма белка дает организму и 17,6 кДж энергии, в этом заключается их энергетическая функция. Однако, как правило, организм «старается» не расходовать для этого такой важный материал, и сначала распадаются жиры и углеводы.
Аминокислоты – чьи мономеры?
Отказ от ответсвенности
Обращаем ваше внимание, что вся информация, размещённая на сайте Prowellness предоставлена исключительно в ознакомительных целях и не является персональной программой, прямой рекомендацией к действию или врачебными советами. Не используйте данные материалы для диагностики, лечения или проведения любых медицинских манипуляций. Перед применением любой методики или употреблением любого продукта проконсультируйтесь с врачом. Данный сайт не является специализированным медицинским порталом и не заменяет профессиональной консультации специалиста. Владелец Сайта не несет никакой ответственности ни перед какой стороной, понесший косвенный или прямой ущерб в результате неправильного использования материалов, размещенных на данном ресурсе.
Мономеры – это повторяющиеся звенья макромолекул органических соединений под названием биополимеры. К биополимерам относят полисахариды, нуклеиновые кислоты и белки. Аминокислоты являются мономерами белков, моносахариды – полисахаридов, нуклеотиды – нуклеиновых кислот.
Полимеры могут разрушиться до мономеров, из которых сложена их молекула. Такой процесс происходит в пищеварительной системе живых существ. Крупные вещества расщепляются до мелких, которые способны всосаться в кровь. В дальнейшем они используются для формирования новых макромолекул, необходимых организму.
Состав аминокислот
В состав аминокислот входят по одной или по две аминогруппы и карбоксильной группы. Первые обладают щелочными, а вторые кислотными свойствами. Этим обусловлены амфотерные свойства аминокислот, за счет которых они выполняют функции буферных соединений.
Внимание! У большинства аминокислот есть 1 карбоксильная и 1 аминогруппа. Они являются нейтральными.
Как аминокислоты образуют белки?
При дальнейшем объединении аминокислот посредством пептидных связей образуется полипептидная цепь. Ее называют первичной структурой белка.
Сколько аминокислот образуют все многообразие белков?
Существует 26 аминокислот. В образовании всех белков участвуют лишь 20 из них. Протеиногенные, или мажорные аминокислоты бывают заменимыми и незаменимыми.
Аминокислоты заменимые
Заменимые аминокислоты поступают в организм с пищей и образуются в нем из других аминокислот. Всего их 12:
Аминокислоты незаменимые
Незаменимые аминокислоты организмом не вырабатываются, но необходимы ему для полноценной жизнедеятельности, поэтому должны поступать с пищей. Всего их 8:
Внимание! Без аминокислот невозможна жизнедеятельность организма. Без них он не сможет производить белки, которые составляют основу всех его тканей. Кроме того, белки участвуют почти во всех физиологических процессах.
Отказ от ответсвенности
Обращаем ваше внимание, что вся информация, размещённая на сайте Prowellness предоставлена исключительно в ознакомительных целях и не является персональной программой, прямой рекомендацией к действию или врачебными советами. Не используйте данные материалы для диагностики, лечения или проведения любых медицинских манипуляций. Перед применением любой методики или употреблением любого продукта проконсультируйтесь с врачом. Данный сайт не является специализированным медицинским порталом и не заменяет профессиональной консультации специалиста. Владелец Сайта не несет никакой ответственности ни перед какой стороной, понесший косвенный или прямой ущерб в результате неправильного использования материалов, размещенных на данном ресурсе.
Лекция № 3. Строение и функции белков. Ферменты
Строение белков
Белки — высокомолекулярные органические соединения, состоящие из остатков α-аминокислот.
В состав белков входят углерод, водород, азот, кислород, сера. Часть белков образует комплексы с другими молекулами, содержащими фосфор, железо, цинк и медь.
Белки обладают большой молекулярной массой: яичный альбумин — 36 000, гемоглобин — 152 000, миозин — 500 000. Для сравнения: молекулярная масса спирта — 46, уксусной кислоты — 60, бензола — 78.
Аминокислотный состав белков
Белки — непериодические полимеры, мономерами которых являются α-аминокислоты. Обычно в качестве мономеров белков называют 20 видов α-аминокислот, хотя в клетках и тканях их обнаружено свыше 170.
В зависимости от того, могут ли аминокислоты синтезироваться в организме человека и других животных, различают: заменимые аминокислоты — могут синтезироваться; незаменимые аминокислоты — не могут синтезироваться. Незаменимые аминокислоты должны поступать в организм вместе с пищей. Растения синтезируют все виды аминокислот.
В зависимости от аминокислотного состава, белки бывают: полноценными — содержат весь набор аминокислот; неполноценными — какие-то аминокислоты в их составе отсутствуют. Если белки состоят только из аминокислот, их называют простыми. Если белки содержат помимо аминокислот еще и неаминокислотный компонент (простетическую группу), их называют сложными. Простетическая группа может быть представлена металлами (металлопротеины), углеводами (гликопротеины), липидами (липопротеины), нуклеиновыми кислотами (нуклеопротеины).
Все аминокислоты содержат: 1) карбоксильную группу (–СООН), 2) аминогруппу (–NH2), 3) радикал или R-группу (остальная часть молекулы). Строение радикала у разных видов аминокислот — различное. В зависимости от количества аминогрупп и карбоксильных групп, входящих в состав аминокислот, различают: нейтральные аминокислоты, имеющие одну карбоксильную группу и одну аминогруппу; основные аминокислоты, имеющие более одной аминогруппы; кислые аминокислоты, имеющие более одной карбоксильной группы.
Аминокислоты являются амфотерными соединениями, так как в растворе они могут выступать как в роли кислот, так и оснований. В водных растворах аминокислоты существуют в разных ионных формах.
Пептидная связь
Пептиды — органические вещества, состоящие из остатков аминокислот, соединенных пептидной связью.
Образование пептидов происходит в результате реакции конденсации аминокислот. При взаимодействии аминогруппы одной аминокислоты с карбоксильной группой другой между ними возникает ковалентная азот-углеродная связь, которую и называют пептидной. В зависимости от количества аминокислотных остатков, входящих в состав пептида, различают дипептиды, трипептиды, тетрапептиды и т.д. Образование пептидной связи может повторяться многократно. Это приводит к образованию полипептидов. На одном конце пептида находится свободная аминогруппа (его называют N-концом), а на другом — свободная карбоксильная группа (его называют С-концом).
Пространственная организация белковых молекул
Выполнение белками определенных специфических функций зависит от пространственной конфигурации их молекул, кроме того, клетке энергетически невыгодно держать белки в развернутой форме, в виде цепочки, поэтому полипептидные цепи подвергаются укладке, приобретая определенную трехмерную структуру, или конформацию. Выделяют 4 уровня пространственной организации белков.
Первичная структура белка — последовательность расположения аминокислотных остатков в полипептидной цепи, составляющей молекулу белка. Связь между аминокислотами — пептидная.
Именно первичная структура белковой молекулы определяет свойства молекул белка и ее пространственную конфигурацию. Замена всего лишь одной аминокислоты на другую в полипептидной цепочке приводит к изменению свойств и функций белка. Например, замена в β-субъединице гемоглобина шестой глутаминовой аминокислоты на валин приводит к тому, что молекула гемоглобина в целом не может выполнять свою основную функцию — транспорт кислорода; в таких случаях у человека развивается заболевание — серповидноклеточная анемия.
Вторичная структура — упорядоченное свертывание полипептидной цепи в спираль (имеет вид растянутой пружины). Витки спирали укрепляются водородными связями, возникающими между карбоксильными группами и аминогруппами. Практически все СО- и NН-группы принимают участие в образовании водородных связей. Они слабее пептидных, но, повторяясь многократно, придают данной конфигурации устойчивость и жесткость. На уровне вторичной структуры существуют белки: фиброин (шелк, паутина), кератин (волосы, ногти), коллаген (сухожилия).

Третичная структура — укладка полипептидных цепей в глобулы, возникающая в результате возникновения химических связей (водородных, ионных, дисульфидных) и установления гидрофобных взаимодействий между радикалами аминокислотных остатков. Основную роль в образовании третичной структуры играют гидрофильно-гидрофобные взаимодействия. В водных растворах гидрофобные радикалы стремятся спрятаться от воды, группируясь внутри глобулы, в то время как гидрофильные радикалы в результате гидратации (взаимодействия с диполями воды) стремятся оказаться на поверхности молекулы. У некоторых белков третичная структура стабилизируется дисульфидными ковалентными связями, возникающими между атомами серы двух остатков цистеина. На уровне третичной структуры существуют ферменты, антитела, некоторые гормоны.
Четвертичная структура характерна для сложных белков, молекулы которых образованы двумя и более глобулами. Субъединицы удерживаются в молекуле благодаря ионным, гидрофобным и электростатическим взаимодействиям. Иногда при образовании четвертичной структуры между субъединицами возникают дисульфидные связи. Наиболее изученным белком, имеющим четвертичную структуру, является гемоглобин. Он образован двумя α-субъединицами (141 аминокислотный остаток) и двумя β-субъединицами (146 аминокислотных остатков). С каждой субъединицей связана молекула гема, содержащая железо.
Если по каким-либо причинам пространственная конформация белков отклоняется от нормальной, белок не может выполнять свои функции. Например, причиной «коровьего бешенства» (губкообразной энцефалопатии) является аномальная конформация прионов — поверхностных белков нервных клеток.
Свойства белков
Купить проверочные работы
по биологии


Аминокислотный состав, структура белковой молекулы определяют его свойства. Белки сочетают в себе основные и кислотные свойства, определяемые радикалами аминокислот: чем больше кислых аминокислот в белке, тем ярче выражены его кислотные свойства. Способность отдавать и присоединять Н + определяют буферные свойства белков; один из самых мощных буферов — гемоглобин в эритроцитах, поддерживающий рН крови на постоянном уровне. Есть белки растворимые (фибриноген), есть нерастворимые, выполняющие механические функции (фиброин, кератин, коллаген). Есть белки активные в химическом отношении (ферменты), есть химически неактивные, устойчивые к воздействию различных условий внешней среды и крайне неустойчивые.
Внешние факторы (нагревание, ультрафиолетовое излучение, тяжелые металлы и их соли, изменения рН, радиация, обезвоживание)
могут вызывать нарушение структурной организации молекулы белка. Процесс утраты трехмерной конформации, присущей данной молекуле белка, называют денатурацией. Причиной денатурации является разрыв связей, стабилизирующих определенную структуру белка. Первоначально рвутся наиболее слабые связи, а при ужесточении условий и более сильные. Поэтому сначала утрачивается четвертичная, затем третичная и вторичная структуры. Изменение пространственной конфигурации приводит к изменению свойств белка и, как следствие, делает невозможным выполнение белком свойственных ему биологических функций. Если денатурация не сопровождается разрушением первичной структуры, то она может быть обратимой, в этом случае происходит самовосстановление свойственной белку конформации. Такой денатурации подвергаются, например, рецепторные белки мембраны. Процесс восстановления структуры белка после денатурации называется ренатурацией. Если восстановление пространственной конфигурации белка невозможно, то денатурация называется необратимой.
Функции белков
| Функция | Примеры и пояснения |
|---|---|
| Строительная | Белки участвуют в образовании клеточных и внеклеточных структур: входят в состав клеточных мембран (липопротеины, гликопротеины), волос (кератин), сухожилий (коллаген) и т.д. |
| Транспортная | Белок крови гемоглобин присоединяет кислород и транспортирует его от легких ко всем тканям и органам, а от них в легкие переносит углекислый газ; в состав клеточных мембран входят особые белки, которые обеспечивают активный и строго избирательный перенос некоторых веществ и ионов из клетки во внешнюю среду и обратно. |
| Регуляторная | Гормоны белковой природы принимают участие в регуляции процессов обмена веществ. Например, гормон инсулин регулирует уровень глюкозы в крови, способствует синтезу гликогена, увеличивает образование жиров из углеводов. |
| Защитная | В ответ на проникновение в организм чужеродных белков или микроорганизмов (антигенов) образуются особые белки — антитела, способные связывать и обезвреживать их. Фибрин, образующийся из фибриногена, способствует остановке кровотечений. |
| Двигательная | Сократительные белки актин и миозин обеспечивают сокращение мышц у многоклеточных животных. |
| Сигнальная | В поверхностную мембрану клетки встроены молекулы белков, способных изменять свою третичную структуру в ответ на действие факторов внешней среды, таким образом осуществляя прием сигналов из внешней среды и передачу команд в клетку. |
| Запасающая | В организме животных белки, как правило, не запасаются, исключение: альбумин яиц, казеин молока. Но благодаря белкам в организме могут откладываться про запас некоторые вещества, например, при распаде гемоглобина железо не выводится из организма, а сохраняется, образуя комплекс с белком ферритином. |
| Энергетическая | При распаде 1 г белка до конечных продуктов выделяется 17,6 кДж. Сначала белки распадаются до аминокислот, а затем до конечных продуктов — воды, углекислого газа и аммиака. Однако в качестве источника энергии белки используются только тогда, когда другие источники (углеводы и жиры) израсходованы. |
| Каталитическая | Одна из важнейших функций белков. Обеспечивается белками — ферментами, которые ускоряют биохимические реакции, происходящие в клетках. Например, рибулезобифосфаткарбоксилаза катализирует фиксацию СО2 при фотосинтезе. |
Ферменты
Ферменты, или энзимы, — особый класс белков, являющихся биологическими катализаторами. Благодаря ферментам биохимические реакции протекают с огромной скоростью. Скорость ферментативных реакций в десятки тысяч раз (а иногда и в миллионы) выше скорости реакций, идущих с участием неорганических катализаторов. Вещество, на которое оказывает свое действие фермент, называют субстратом.
Ферменты — глобулярные белки, по особенностям строения ферменты можно разделить на две группы: простые и сложные. Простые ферменты являются простыми белками, т.е. состоят только из аминокислот. Сложные ферменты являются сложными белками, т.е. в их состав помимо белковой части входит группа небелковой природы — кофактор. У некоторых ферментов в качестве кофакторов выступают витамины. В молекуле фермента выделяют особую часть, называемую активным центром. Активный центр — небольшой участок фермента (от трех до двенадцати аминокислотных остатков), где и происходит связывание субстрата или субстратов с образованием фермент-субстратного комплекса. По завершении реакции фермент-субстратный комплекс распадается на фермент и продукт (продукты) реакции. Некоторые ферменты имеют (кроме активного) аллостерические центры — участки, к которым присоединяются регуляторы скорости работы фермента (аллостерические ферменты).
Для реакций ферментативного катализа характерны: 1) высокая эффективность, 2) строгая избирательность и направленность действия, 3) субстратная специфичность, 4) тонкая и точная регуляция. Субстратную и реакционную специфичность реакций ферментативного катализа объясняют гипотезы Э. Фишера (1890 г.) и Д. Кошланда (1959 г.).
Э. Фишер (гипотеза «ключ-замок») предположил, что пространственные конфигурации активного центра фермента и субстрата должны точно соответствовать друг другу. Субстрат сравнивается с «ключом», фермент — с «замком».
Д. Кошланд (гипотеза «рука-перчатка») предположил, что пространственное соответствие структуры субстрата и активного центра фермента создается лишь в момент их взаимодействия друг с другом. Эту гипотезу еще называют гипотезой индуцированного соответствия.
Скорость ферментативных реакций зависит от: 1) температуры, 2) концентрации фермента, 3) концентрации субстрата, 4) рН. Следует подчеркнуть, что поскольку ферменты являются белками, то их активность наиболее высока при физиологически нормальных условиях.
Большинство ферментов может работать только при температуре от 0 до 40 °С. В этих пределах скорость реакции повышается примерно в 2 раза при повышении температуры на каждые 10 °С. При температуре выше 40 °С белок подвергается денатурации и активность фермента падает. При температуре, близкой к точке замерзания, ферменты инактивируются.
При увеличении количества субстрата скорость ферментативной реакции растет до тех пор, пока количество молекул субстрата не станет равным количеству молекул фермента. При дальнейшем увеличении количества субстрата скорость увеличиваться не будет, так как происходит насыщение активных центров фермента. Увеличение концентрации фермента приводит к усилению каталитической активности, так как в единицу времени преобразованиям подвергается большее количество молекул субстрата.
Для каждого фермента существует оптимальное значение рН, при котором он проявляет максимальную активность (пепсин — 2,0, амилаза слюны — 6,8, липаза поджелудочной железы — 9,0). При более высоких или низких значениях рН активность фермента снижается. При резких сдвигах рН фермент денатурирует.
Скорость работы аллостерических ферментов регулируется веществами, присоединяющимися к аллостерическим центрам. Если эти вещества ускоряют реакцию, они называются активаторами, если тормозят — ингибиторами.
Классификация ферментов
По типу катализируемых химических превращений ферменты разделены на 6 классов:
Классы в свою очередь подразделены на подклассы и подподклассы. В действующей международной классификации каждый фермент имеет определенный шифр, состоящий из четырех чисел, разделенных точками. Первое число — класс, второе — подкласс, третье — подподкласс, четвертое — порядковый номер фермента в данном подподклассе, например, шифр аргиназы — 3.5.3.1.
Перейти к лекции №2 «Строение и функции углеводов и липидов»
Перейти к лекции №4 «Строение и функции нуклеиновых кислот АТФ»
Смотреть оглавление (лекции №1-25)