Что является основанием к продолжению антибактериальной терапии тест
Определение чувствительности возбудителя к антибактериальным препаратам (ддм) в Москве
Исследование чувствительности возбудителя инфекции к антибактериальным препаратам с целью назначения оптимальной схемы лечения бактериальной инфекции.
Приём и исследование биоматериала
Когда нужно сдавать анализ Определение чувствительности возбудителя к антибактериальным препаратам (ддм)?
Подробное описание исследования
Бактерии представляют собой одноклеточные микроорганизмы, составляющие основную массу микробиома человека. Выделяют так называемые полезные бактерии, необходимые для поддержания иммунитета, образования витаминов, расщепления пищи и других процессов в организме; кроме того, существуют условно-патогенные и патогенные микроорганизмы.
Условно-патогенные бактерии могут присутствовать в организме человека, не вызывая проблем со здоровьем. Однако в случае нарушения состава микробиома, снижения иммунитета человека или развития других благоприятных условий их численность увеличивается, что приводит к развитию заболеваний.
В ряде случаев организм способен самостоятельно справиться с инфекцией, однако чаще может потребоваться назначение антибактериальных препаратов для борьбы с возбудителем.
С момента появления первого антибиотика пенициллина в XX веке было разработано множество лекарств, уничтожающих бактерии. Тем не менее микроорганизмы постоянно изменяются, вырабатывая устойчивость (резистентность) к различным антибактериальным средствам. Распространение антибиотикорезистентности бактерий вызвано частым, бесконтрольным и неадекватным назначением этих препаратов.
Особенную проблему представляют внутрибольничные инфекции. Их возбудители часто устойчивы ко многим антибиотикам, то есть демонстрируют полирезистентность. Поэтому при подозрении на развитие внутрибольничной инфекцией обязательно требуется проведение бактериального посева с оценкой чувствительности выделенных микроорганизмов к антибактериальным препаратам.
Среди полирезистентных бактерий особое место занимает возбудитель туберкулеза — Mycobacterium tuberculosis. Данный микроорганизм развивает резистентность к лекарственным препаратам путем спонтанных мутаций в своем геноме, что привело к появлению такой актуальной проблемы, как увеличение случаев возникновения туберкулеза с множественной лекарственной устойчивостью. Важно также отметить, что согласно клиническим рекомендациям, людям, страдающим туберкулезом, в обязательном порядке необходимо проводить на фоне лечения оценку чувствительности микроорганизма к антибиотикам с определенной периодичностью.
Перечень антибактериальных средств, воздействующих на возбудителя, определяется конкретно для каждого вида интересующего специалиста микроорганизма. Обнаружение чувствительности к тому или иному антибактериальному средству помогает врачу назначить эффективную терапию.
Некоторые заболевания приводят к попаданию бактерий в биологические жидкости и среды организма, которые изначально стерильны, например, спинномозговую жидкость или кровь. В подобной ситуации исследование полученной культуры бактерий на устойчивость к антибактериальным средствам особенно важно, поскольку позволит раньше назначить этиотропную терапию, направленную непосредственно на возбудителя инфекции, улучшая тем самым течение и прогноз заболевания.
Чувствительность бактерий к антибиотикам постоянно меняется и может быть различной даже у микроорганизмов одного вида, что подчеркивает важность и обязательный характер проведения данного исследования.
Ошибки в антибактериальной терапии инфекций дыхательных путей в амбулаторной практике
Проблема рациональной антибактериальной терапии инфекций дыхательных путей не теряет актуальности и в настоящее время. Наличие большого арсенала антибактериальных препаратов, с одной стороны, расширяет возможности лечения различных инфекций, а с другой
Проблема рациональной антибактериальной терапии инфекций дыхательных путей не теряет актуальности и в настоящее время. Наличие большого арсенала антибактериальных препаратов, с одной стороны, расширяет возможности лечения различных инфекций, а с другой — требует от врача-клинициста осведомленности о многочисленных антибиотиках и их свойствах (спектр действия, фармакокинетика, побочные эффекты и т. д.), умения ориентироваться в вопросах микробиологии, клинической фармакологии и других смежных дисциплинах.
Согласно И. В. Давыдовскому, «врачебные ошибки — род добросовестных заблуждений врача в его суждениях и действиях при исполнении им тех или иных специальных врачебных обязанностей». Ошибки в антибактериальной терапии инфекций дыхательных путей имеют наибольший удельный вес в структуре всех лечебно-тактических ошибок, совершаемых в пульмонологической практике, и оказывают существенное влияние на исход заболевания. Кроме того, неправильное назначение антибактериальной терапии может иметь не только медицинские, но и различные социальные, деонтологические, экономические и другие последствия.
При выборе способа антибактериальной терапии в амбулаторной практике необходимо учитывать и решать как тактические, так и стратегические задачи. К тактическим задачам антибиотикотерапии относится рациональный выбор антибактериального препарата, обладающего наибольшим терапевтическим и наименьшим токсическим воздействием.
Стратегическая задача антибиотикотерапии в амбулаторной практике может быть сформулирована как уменьшение селекции и распространения резистентных штаммов микроорганизмов в популяции.
В соответствии с этими положениями следует выделять тактические и стратегические ошибки при проведении антибактериальной терапии инфекций дыхательных путей в амбулаторной практике (см. таблицу 1).
Тактические ошибки антибактериальной терапии
I. Необоснованное назначение антибактериальных средств
Особую категорию ошибок представляет неоправданное применение антибактериальных препаратов (АП) в тех ситуациях, когда их назначение не показано.
Показанием для назначения антибактериального препарата является диагностированная или предполагаемая бактериальная инфекция.
Наиболее распространенная ошибка в амбулаторной практике — назначение антибактериальных препаратов при острых респираторных вирусных инфекциях (ОРВИ), имеющее место как в терапевтической, так и в педиатрической практике. При этом ошибки могут быть обусловлены как неправильной трактовкой симптоматики (врач принимает ОРВИ за бактериальную бронхолегочную инфекцию в виде пневмонии или бронхита), так и стремлением предотвратить бактериальные осложнения ОРВИ.
При всех трудностях принятия решения в подобных ситуациях необходимо отдавать себе отчет в том, что антибактериальные препараты не оказывают влияния на течение вирусной инфекции и, следовательно, их назначение при ОРВИ не оправдано (см. таблицу 2). В то же время предполагаемая возможность предотвращения бактериальных осложнений вирусных инфекций с помощью назначения антибактериальных препаратов не находит себе подтверждения в клинической практике. Кроме того, очевидно, что широкое неоправданное применение антибактериальных препаратов при ОРВИ чревато формированием лекарственной устойчивости и повышением риска возникновения нежелательных реакций у пациента.
Одной из распространенных ошибок при проведении антибактериальной терапии является назначение одновременно с антибиотиком противогрибковых средств с целью профилактики грибковых осложнений и дисбактериоза. Следует подчеркнуть, что при применении современных антибактериальных средств у иммунокомпетентных пациентов риск развития грибковой суперинфекции минимален, поэтому одновременное назначение антимикотиков в этом случае не оправдано. Комбинация антибиотика с противогрибковым средством целесообразна только у больных, получающих цитостатическую или противоопухолевую терапию или у ВИЧ-инфицированных пациентов. В этих случаях оправдано профилактическое назначение антимикотиков системного действия (кетоконазол, миконазол, флуконазол), но не нистатина. Последний практически не всасывается в желудочно-кишечном тракте и не способен предотвратить грибковую суперинфекцию иной локализации — полости рта, дыхательных или мочевыводящих путей, половых органов. Часто практикующееся назначение нистатина с целью профилактики дисбактериоза кишечника вообще не находит логического объяснения.
Часто врач назначает нистатин или другой антимикотик в случае обнаружения в полости рта или в моче грибов рода Сandida. При этом он ориентируется лишь на данные микробиологического исследования и не учитывает наличие или отсутствие симптомов кандидоза, а также факторов риска развития грибковой инфекции (тяжелый иммунодефицит и др.).
Выделение грибов рода Сandida из полости рта или мочевых путей пациентов в большинстве случаев служит свидетельством бессимптомной колонизации, не требующей коррегирующей противогрибковой терапии.
II. Ошибки в выборе антибактериального препарата
Пожалуй, наибольшее число ошибок, возникающих в амбулаторной практике, связано с выбором антибактериального средства. Выбор антибиотика должен производиться с учетом следующих основных критериев:
Определяющим фактором выбора препарата должен быть спектр природной активности антибиотика: необходимо, чтобы он охватывал основных возбудителей внебольничных инфекций дыхательных путей (см. таблицу 3).
Кроме того, при выборе препарата следует учитывать уровень приобретенной резистентности возбудителей в популяции. Основные тенденции, касающиеся резистентности возбудителей, отмеченной в последние годы, отражены в таблице 4. Наиболее значимые проблемы, связанные с применением основных антибактериальных средств при инфекциях дыхательных путей, могут быть сформулированы следующим образом.
С учетом вышесказанного, оптимальными средствами для лечения внебольничных инфекций дыхательных путей в настоящее время могут быть признаны β-лактамные антибиотики и новые фторхинолоны (см. таблицу 5). Использование макролидов должно быть ограничено — препараты можно назначать при нетяжелой пневмонии у детей или пациентов молодого возраста, особенно при наличии признаков атипичного течения (микоплазменная, хламидийная).
 |
| Таблица 5. Значение антибактериальных средств при инфекциях нижних дыхательных путей в амбулаторной практике. |
Следует подчеркнуть, что назначение некоторых антибактериальных препаратов, применяемое в амбулаторной практике при респираторных инфекциях, нельзя признать рациональным. К таким препаратам прежде всего относятся:
В таблице 6 приведены современные рекомендации по антибактериальной терапии внебольничных респираторных инфекций, с учетом всех требуемых критериев и доказанной эффективности в контролируемых клинических исследованиях.
Представленные рекомендации имеют наиболее общий характер. В то же время с практических позиций выбор оптимального антибактериального препарата также должен осуществляться с учетом особенностей пациента и заболевания. Так, например, у больных пневмонией молодого и среднего возраста без отягощающих факторов терапевтический эффект оказывают амоксициллин, макролиды, защищенные пенициллины и новые фторхинолоны. Однако у больных пожилого возраста в этиологии заболевания большее значение приобретают S. aureus и грамотрицательные бактерии, что объясняет снижение эффективности амоксициллина и макролидов у этой категории больных.
Также распространенной во врачебной практике ошибкой является отказ от назначения антибактериальной терапии при пневмонии беременным женщинам из-за опасения негативного влияния препаратов на плод. Следует отметить, что перечень антибактериальных препаратов, прием которых нежелателен во время беременности из-за риска эмбриотоксического действия, ограничен — тетрациклины, хлорамфеникол, сульфаниламиды, ко-тримоксазол, фторхинолоны, аминогликозиды. Другие антибиотики, в частности β-лактамы, макролиды, могут применяться у беременных женщин.
Другие возможные факторы, влияющие на выбор антибактериального препарата, представлены в таблице 7.
 |
| Таблица 7. Особые клинические ситуации при внебольничных инфекциях нижних дыхательных путей. |
Нередки ошибки при выборе антибактериального препарата в случае неэффективности первоначального. Здесь необходимо также остановиться на ошибках антибактериальной терапии, которые касаются несвоевременной оценки неэффективности первоначального антибиотика. Общепринятым критическим сроком оценки эффективности (или неэффективности) антибактериальной терапии считаются 48—72 ч с момента его назначения. К сожалению, приходится нередко сталкиваться с такими случаями, когда больной продолжает получать назначенный антибиотик в течение недели и более, несмотря на отсутствие очевидного клинического эффекта. Обычно критерием эффективности антибактериальной терапии является снижение или нормализация температуры тела больного, уменьшение признаков интоксикации. В тех случаях (не столь частых), когда лихорадка с самого начала заболевания отсутствует, приходится ориентироваться на другие признаки интоксикации (головная боль, анорексия, общемозговая симптоматика и т. д.), а также на отсутствие прогрессирования заболевания за период проводимого лечения.
Продолжение антибактериальной терапии, невзирая на ее неэффективность, имеет немало негативных последствий. При этом затягивается назначение другого, более адекватного антибиотика, что ведет к прогрессированию воспаления (особенно важно при тяжелых пневмониях, у больных с сопутствующей патологией) и развитию осложнений, а также удлиняет сроки лечения. Кроме того, повышается риск возникновения побочных (токсических) эффектов препаратов, а также развития и усиления антибиотикорезистентности. Продолжение лечения, несмотря на неэффективность проводимой терапии, подрывает доверие больного и его родственников к лечащему врачу. Очевидна и неэкономичность такой ошибочной тактики антибактериальной терапии (напрасный расход неэффективного АП, дополнительные затраты на лечение токсических эффектов и др.).
Кроме того, ошибки встречаются при замене неэффективного антибиотика на другой, т. е. при смене препарата. При этом врач забывает, что принцип выбора антибактериального препарата остается прежним, т. е. ориентироваться следует на клиническую ситуацию с учетом, однако, неэффективности первоначального препарата и ряда других дополнительных признаков. Отсутствие эффекта от первоначально назначенного антибиотика в известной степени должно служить дополнительным ориентиром, позволяющим обосновать выбор второго препарата. Так, например, отсутствие эффекта от применения β-лактамных антибиотиков (пенициллины, цефалоспорины) у больного с внебольничной пневмонией позволяет предполагать атипичную этиологию пневмонии (микоплазменной, хламидийной или легионеллезной) с учетом, разумеется, других клинических признаков.
Клинические признаки атипичной пневмонии, вызванной Mycoplasma pneumoniae или Chlamydia pneumoniae:
Наличие клинических признаков атипичной пневмонии делает обоснованным назначение антибактериальных препаратов из группы макролидов, доксициклина или фторхинолонов (левофлоксацин, моксифлоксацин, офлоксацин).
III. Ошибки в выборе режима дозирования антибактериального препарата
Ошибки в выборе оптимальной дозы антибактериального средства могут заключаться в назначении как недостаточной, так и избыточной дозы препарата. И те и другие ошибки чреваты негативными последствиями.
Если доза антибиотика недостаточна и не создает в крови и тканях дыхательных путей концентрацию, превышающую минимальную дозу для подавления основных возбудителей инфекции, что является условием эрадикации соответствующего возбудителя, то это не только может служить одной из причин неэффективности терапии, но и создает реальные предпосылки для формирования резистентности микроорганизмов. Ошибки в выборе оптимальной дозы могут быть связаны как с назначением недостаточной разовой дозы, так и с неправильным режимом дозирования (недостаточная кратность введения).
В качестве примера неадекватного режима дозирования антибиотиков при внебольничной пневмонии можно привести амоксициллин, который ранее рекомендовался в суточной дозе до 1 г. Однако современные рекомендации предполагают назначение амоксициллина в суточной дозе 1,5 и даже 3 г для преодоления возможной резистентности S. pneumoniae. Примеры неадекватных режимов дозирования антибиотиков в амбулаторной практике при респираторных инфекциях приводятся в таблице 8.
 |
| Таблица 8. Неадекватные режимы дозирования пероральных антибактериальных препаратов в амбулаторной практике при респираторных инфекциях у взрослых. |
Неправильный выбор интервалов между введениями антибактериальных препаратов обычно обусловлен не столько сложностями парентерального введения препаратов в амбулаторных условиях или негативным настроем больных, сколько неосведомленностью практикующих врачей о некоторых фармакодинамических и фармакокинетических особенностях препаратов, которые должны определять режим их дозирования. Типичной ошибкой является назначение в амбулаторной педиатрической практике при пневмонии бензилпенициллина с кратностью введения два раза в сутки, так как более частое его введение неудобно для пациента. Следует отметить, что при нетяжелом течении пневмонии вряд ли оправдано стремление некоторых врачей к обязательному назначению парентеральных антибиотиков. Современные антибактериальные препараты характеризуются хорошей биодоступностью при приеме внутрь, а также одинаковой клинической эффективностью с парентеральными препаратами, поэтому в подавляющем большинстве случаев оправдано лечение пероральными препаратами. Если назначение парентеральных антибиотиков действительно необходимо, следует выбрать препарат с длительным периодом полувыведения (например, цефтриаксон), что позволяет назначать его один раз в сутки.
IV. Ошибки при комбинированном назначении антибиотиков
Одной из ошибок антибактериальной терапии внебольничных респираторных инфекций является необоснованное назначение комбинации антибиотиков. Врачи старших поколений помнят то время (50—70-е гг. прошлого столетия), когда при лечении пневмонии обязательным считалось назначение пенициллина и стрептомицина, о чем свидетельствовали многие учебные пособия и руководства. Это был своеобразный стандарт лечения пневмоний для того времени. Несколько позднее одновременно с антибиотиками рекомендовалось назначение сульфаниламидов, с учетом полученных в свое время З. В. Ермольевой данных о химиотерапевтическом синергизме сульфаниламидов и пенициллина.
В современной ситуации, при наличии большого арсенала высокоэффективных антибактериальных препаратов широкого спектра, показания к комбинированной антибактериальной терапии значительно сужены, и приоритет в лечении респираторных инфекций остается за монотерапией. В многочисленных контролируемых исследованиях показана высокая клиническая и бактериологическая эффективность адекватных антибактериальных средств при лечении респираторных инфекций в режиме монотерапии (амоксициллин, амоксициллин/клавуланат, цефалоспорины II-III поколений, новые фторхинолоны). Комбинированная антибактериальная терапия не имеет реальных преимуществ ни в выраженности эффекта, ни в предотвращении развития резистентных штаммов.
Основными показаниями к комбинированной антибактериальной терапии являются тяжелое течение пневмонии — в этом случае общепринятым стандартом лечения становится комбинированное назначение парентерального цефалоспорина III поколения (цефотаксим или цефтриаксон) и парентерального макролидного антибиотика (эритромицин, или кларитромицин, или спирамицин); последние включаются в комбинацию для воздействия на вероятных атипичных микроорганизмов (легионелла или микоплазма). Следует отметить, что в настоящее время в клинической практике появились новые антибактериальные препараты (левофлоксацин, моксифлоксацин) с высокой активностью в отношении как типичных, так и атипичных возбудителей, что позволяет назначать их в режиме монотерапии даже при тяжелой пневмонии.
Другой клинической ситуацией, оправдывающей комбинированное назначение антибиотиков, является пневмония у иммунокомпрометированных пациентов (лечение цитостатиками, СПИД), при которой имеется высокая вероятность ассоциации возбудителей (см. таблицу 7).
К сожалению, часто в амбулаторной практике приходится сталкиваться с ситуациями, при которых больным с нетяжелым течением пневмонии, при отсутствии осложнений, тяжелой фоновой патологии назначается два антибиотика. Логичного обоснования этой тактики лечения нет, при этом следует учитывать возможный антагонизм препаратов, более высокий риск нежелательных реакций и увеличение стоимости лечения.
Следует отметить, что нерациональные комбинации антибактериальных препаратов имеют и официальные лекарственные формы, которые выпускаются отечественной фармацевтической промышленностью, например ампиокс, олететрин. Разумеется, применение таких препаратов недопустимо.
V. Ошибки, связанные с длительностью антибактериальной терапии и критериями клинической эффективности
В некоторых случаях проводится необоснованно длительная антибактериальная терапия. Такая ошибочная тактика обусловлена, прежде всего, недостаточным пониманием цели самой антибактериальной терапии, которая сводится прежде всего к эрадикации возбудителя или подавлению его дальнейшего роста, т. е. направлена на подавление микробной агрессии.
Собственно воспалительная реакция легочной ткани, которая проявляется различными клинико-рентгенологическими признаками (аускультативная картина, сохраняющаяся рентгенологическая инфильтрация, ускорение СОЭ) регрессирует медленнее и не требует продолжения антибактериальной терапии (см. таблицу 9). В связи с этим следует считать ошибочной тактику, согласно которой у больногос сохраняющимися рентгенологическими признаками легочной инфильтрации, крепитирующими хрипами (crepitacio redux), увеличением СОЭ при нормализации температуры тела и исчезновении (или уменьшении) признаков интоксикации продолжают проводить антибактериальную терапию.
 |
| Таблица 9. Сроки исчезновения симптомов при эффективной антибактериальной терапии внебольничной пневмонии. |
Еще более ошибочна тактика замены одного антибиотика на другой в подобных ситуациях, расцениваемых врачом как неэффективность назначенной антибактериальной терапии. У некоторых больных после исчезновения признаков интоксикации и даже регрессии воспалительных изменений в легких в течение длительного времени может сохраняться слабость, потливость, субфебрильная температура. Последняя расценивается врачом как проявление не полностью купированной бронхолегочной инфекции, что «подтверждается» рентгенологическими данными в виде изменения легочного рисунка или «остаточными явлениями пневмонии» и обычно влечет за собой назначение антибактериального препарата, несмотря на отсутствие изменений со стороны крови. Между тем подобная клиническая ситуация часто обусловлена вегетативной дисфункцией после легочной инфекции (постинфекционная астения) и не требует антибактериальной терапии, хотя, разумеется, в каждом конкретном случае необходимы тщательное обследование больного и расшифровка всей имеющейся симптоматики.
Рекомендованная длительность применения антибактериальных препаратов при бронхолегочных инфекциях приведена в таблице 10.
 |
| Таблица 10. Длительность антибактериальной терапии бактериальных респираторных инфекций в амбулаторной практике. |
Л. И. Дворецкий, доктор медицинских наук, профессор
С. В. Яковлев, доктор медицинских наук, профессор
ММА им. И. М. Сеченова, Москва
Что является основанием к продолжению антибактериальной терапии тест
М.С.Савенкова, С.Г.Врублевский, И.Е.Колтунов, Е.С.Персиянинова, Л.П.Семенова, А.Н.Анин, С.Я.Пуркина, Н.В.Бузина, В.О.Трунов, И.В.Куренков
ФДПО ГБОУ ВПО РНИМУ им. Н.И.Пирогова Минздрава России, Москва Морозовская детская городская клиническая больница, Москва
Вдревности на заре изучения хирургии Гиппократ указывал на то, что, если воспаление легких не разрешается в течение 14–18 дней, оно заканчивается формированием абсцесса. В 1930-е гг. абсцедирующие формы пневмонии были связаны с туберкулезом и стафилококком. История изучения тяжелых форм пневмоний принадлежит основоположнику детской хирургии С.Д. Терновскому, который в 1938 г. описал клинику гнойных плевритов у детей. В последующие годы (1970–1990) данная проблема разрабатывалась академиком Ю.Ф. Исаковым, профессорами В.И. Гераськиным, Э.А. Степановым (1978), С.Я. Долецким, Г.А. Баировым, Л.М. Рошалем [1–3].
Основные направления хирургии в этой области на протяжении последних десятилетий были сосредоточены на разработке методов видеоторакоскопии. Торакоскопические операции в 1970-е гг. были основаны на применении жестких эндоскопов без использования волоконного освещения и видеотехники. В последующие годы видеотехника торакосопических операций была усовершенствована [4–8]. Подробно была описана техника торакоскопии с использованием троакара диаметром 5 мм, которая позволяет определять дальнейшую тактику хирургического лечения больного. Точка для введения первого торакопорта – в области угла лопатки при отведенной вверх руке на уровне 4–5-го межреберья по заднеподмышечной линии. Инструментальный торакопорт диаметром 3 мм необходимо вводить под визуальным контролем. Детям раннего возраста санация плевральных полостей производится из двух доступов, что позволяет уменьшать операционную рану. При санации плевральных полостей проводится разъединение спаек, абсцесс дренируется. При гангренозной деструкции проводится удаление некротических масс с помощью мягких эндохирургических зажимов. В конце операции – промывание антисептическими растворами от 300 до 1000 мл. Операция заканчивается раздуванием легкого до его полного расправления [9].
При лечении деструктивной пневмонии всегда возникает вопрос о необходимости проведения повторных санаций плевры. В работе А.С. Кашина и соавт. (2009) были разработаны показания к повторным вмешательствам с оценкой состояния плевры, легочной ткани, внутриплеврального содержимого [9]. При оценке состояния париетальной (костальной) плевры принимается во внимание диффузное ее утолщение от 2 мм и более; при инструментальной пальпации имеет место деревянистая плотность. Визуально сосудистый рисунок не прослеживается, плевра серо-белесого цвета, при удалении фибрина возникает диффузная кровоточивость. Висцеральная плевра плотная, имеет плотные сращения с фибрином в виде шварт. При оценке состояния легочной ткани наблюдаются диффузные или локальные уплотнения, внутрилегочные абсцессы (исключение составляют субплевральные абсцессы без глубокого повреждения легочной ткани, участки гангренозно-некротизированной ткани). При оценке внутриплеврального содержимого возможно выявление плотного фибринозного слоя с множественными отграниченными полостями, содержащими гнойный выпот и фибрин на разных стадиях разной плотности; плотных фибринозных шварт в междолевых бороздах. Средняя продолжительность видеоторакоскопической санации плевральной полости при эмпиеме плевры у детей равна 64,4±15,3 минуты. Срок пребывания в реанимации – 1–2 дня, в постреанимационных отделениях – 32,2±2,46 дня [9]. Таким образом, на сегодняшний день хирургами предложены органосохраняющие методы эндоскопической хирургии.
Деструктивная пневмония на сегодняшний день относится к междисциплинарной проблеме, т.к. в ее лечении помимо хирургов принимают участие специалисты других медицинских профессий: педиатры, инфекционисты, пульмонологи. От тесного взаимодействия хирургов и педиатров во многом зависит исход заболевания. Не случайно на протяжении более 60 лет педиатрами также активно разрабатывается настоящая тема [10, 11]. Основные усилия педиатров были сосредоточены на изучении характера микрофлоры и выборе антибактериальной терапии, исследовании микроциркуляторного гемостаза, иммунной системы – для проведения иммунокоррекции, а также других методов лечения, например энзимотерапии.
Благодаря развитию антибиотикотерапии многие тяжелые формы внебольничной пневмонии в отсутствие показаний к оперативному вмешательству лечатся уже не в хирургических, а в педиатрических отделениях. Однако летальность от деструктивной пневмонии, по литературным данным, колеблется от 3 до 15%. По данным Морозовской детской городской клинической больницы, за последние годы количество деструктивных форм значительно увеличилось – с 2,6 (2010) до 14% (2014).
Для внебольничных пневмоний (ВП) существует следующая классификация.
В соответствии с МКБ-10 (1992) и Классификацией клинических форм бронхолегочных заболеваний у детей выделяют следующие формы пневмоний [12]:
Как видно из данной классификации, деструктивной пневмонии в МКБ-10 нет. Однако она представлена в МКБ-10 в качестве различных осложнений.
Существует классификация деструктивной пневмонии, используемая в хирургической практике.
А. Абсцессы (дренирующиеся, недренирующиеся, гигантские («провисающие»).
II. Прогрессирующая эмфизема средостения, которая может сочетаться с пневмотораксом и пиопневмотораксом.
Абсцессы возникают на месте сливных или очагово-сливных инфильтратов в 1,5% случаев при деструктивной пневмонии. Эвакуация экссудата происходит через бронх (частично). При широком просвете последнего абсцесс практически полностью дренируется. При узком – эвакуация затруднена. Тяжело протекают «провисающие» абсцессы, особенно у детей первых месяцев жизни.
Буллы (полостные образования) возникают в период разрешения пневмонии и через 1–4 недели спонтанно исчезают. Реже может происходить нарастание пневмоторакса.
Пиопневмоторакс развивается на 7–15-й день заболевания в результате прорыва абсцесса или буллы в полость плевры. Известно, что летальные исходы при развитии деструктивной пневмонии связаны с развитием сепсиса, синдрома диссеминированного внутрисосудистого свертывания, легочной и сердечно-сосудистой недостаточности.
Сложность лечения детей с тяжелыми формами пневмоний объясняется многими проблемами и трудностями, возникающими на разных этапах маршрутизации больного, начиная с амбулаторного периода: недооценки тяжести состояния, позднего назначения антибактериальной и противовирусной терапии, несвоевременно проведенного рентгенологического обследования. На госпитальном этапе необходимо комплексное обследование, которое бы включало экспресс-методы диагностики (пневмококк, легионелла, вирусы респираторной и герпес-группы), серологию крови на внутриклеточные инфекции (хламидии и микоплазмы) и герпесвирусы, а также посевы на бактериальные возбудители (кровь, если выделяется мокрота – трахеальный аспират, плевральная жидкость). Зачастую в стационаре врачи традиционно ориентированы на результаты бактериологических посевов, недооценивая возможную другую этиологию – вирусную или совместное их течение. Отсутствие своевременной этиологической диагностики, неадекватно выбранное стартовое лечение, неправильная смена препаратов без учета основных возбудителей – все эти факторы определяют меру ответственности врача, в т.ч. и правовую, за неэффективное лечение ребенка. Уровень диагностических ошибок при тяжелых формах ВП достигает 40% [14].
С нашей точки зрения, этиология ВП и деструктивной пневмонии должна анализироваться и пересматриваться регулярно, т.к. наряду с хорошо известными возбудителями, колонизирующими верхние отделы дыхательных путей, немаловажную роль на сегодняшний день будут играть внутриклеточные возбудители, а также вирусы респираторной группы, герпесвирусы, формирующие смешанные формы.
В аналитическом обзоре Федеральной службы по надзору в сфере защиты прав потребителей и благополучия человека в 2013 г. были даны эпидемиологические диагностические критерии ВП [15]. К сожалению, к пневмониям часто относятся не как к инфекционным заболеваниям, вызываемым широким спектром возбудителей, а как к синдромному заболеванию без этиологической расшифровки.
До 2013 г. в РФ не существовало нормативных документов по эпидемиологическому надзору и контролю за ВП. В 2013 г. впервые были разработаны, утверждены и введены в действие главным санитарным врачом РФ Г.Г. Онищенко методические указания 3.1.2. 30047-12 «Эпидемиологический надзор за внебольничными пневмониями».
Современные классификации пневмонии предусматривают обязательное установление этиологии, пневмонии, которое производится на основании следующего перечня обследований [15]:
а) выделение гемокультуры микроорганизма;
б) выделение патогенного микроорганизма из пробы транстрахеального аспирата, бронхиального смыва или биоптата;
в) выделение вируса или обнаружение вирусного антигена в респираторном секрете;
г) диагностический однократный титр антител (IgM) или четырехкратное увеличение титра антител (IgG) к патогенному микроорганизму в парных пробах сывороток;
д) патогистологические признаки пневмонии.
Буквально в последние годы важным достижением в развитии и совершенствовании полимеразной цепной реакции (ПЦР) стала разработка технологии в реальном времени (Real-time PCR). Технология «ПЦР в реальном времени» имеет следующие преимущества: возможна количественная оценка возбудителя в анализируемом материале; сводится к нулю возможность контаминации продуктами ПЦР; возможно проведение мультиплексного анализа (в одной пробирке можно исследовать 5–6 специфических нуклеотидных последовательностей возбудителей пневмонии). Ответ может быть получен в течение 4 часов.
До настоящего времени сохраняется мнение о доминирующей роли S. pneumoniae, однако удельный вес его значительно колеблется. Деструктивные пневмонии, как правило, служат результатом взаимодействия нескольких возбудителей. Ассоциации возбудителей, описанные в литературе разными исследователями, могут быть самыми различными. В данных ассоциациях возбудители находятся в сложных взаимоотношениях (аддитивное, синергизм, антагонизм). Приводятся данные о цитопатогенетическом действии Mycoplasma pneumoniae на мерцательный эпителий слизистой бронхов и способность Chlamydia spp. блокировать двигательную активность ресничек респираторного тракта. Для микоплазмы мишенью служат клетки реснитчатого эпителия, что позволяет возбудителю атаковать респираторный тракт на всем протяжении – от носовых ходов до бронхиол. В опытах на добровольцах установлено, что для развития инфекционного процесса достаточно всего 10–100 бактерий (КОЕ) наиболее вирулентных штаммов микоплазм [20].
Респираторные вирусы (гриппов А, В, парагриппа, аденовирусы, респираторно-синтициальный вирус) являются своеобразными «проводниками» бактериальной инфекции.
К новым возбудителям ВП относятся корона-, метапневмовирус.
Герпетические пневмонии возникают вследствие распространения герпетического трахеобронхита на легочную паренхиму либо гематогенным путем. Летальность от герпетической пневмонии у пациентов с иммуносупрессивным состоянием высокая – более 80% [20]. Цитомегаловирусная пневмония может развиваться во внутриутробном периоде и далее – в первые 3 месяца жизни ребенка. Цитомегаловирусная пневмония возникает и в более старшем возрасте у иммуноослабленного контингента больных.
По данным А.С. Левиной и соавт. (2014), вирусные возбудители у детей с ВП определялись в 2/3 случаев у детей от 1 месяца до 4 лет, тогда как бактериальные агенты – у 36–41% детей. В данной работе из вирусов респираторной группы чаще выявлялся респираторно-синтициальный вирус, а из группы герпесвирусов – цитомегаловирус. У детей старше 4 лет наблюдалось уменьшение роли вирусов и возрастание роли бактериальных возбудителей. У 48% детей пневмония была вызвана атипичными возбудителями – хламидиями и микоплазмами [21]. В работе С.С. Ким и соавт. (2012) проведена диагностика смешанных инфекций методом ПЦР при ВП. За 2008–2011 гг. были исследованы фаринго-трахеальные аспираты у 56 детей в возрасте от 1 до 18 лет. Было установлено, что вирусные пневмонии характерны для детей раннего возраста.
Наиболее часто обнаруживались респираторно-синтициальные вирусы. В ассоциации выявлены вирусы в сочетании с пневмококком [22].
Относительно деструктивной пневмонии, по данным Европейского респираторного общества (ERS), у детей наиболее частой этиологической причиной эмпиемы плевры считается S. pneumoniae, чуть реже – M. pneumonia и S. aureus, в т.ч. метициллин-резистентный. Другие возбудители встречались реже: S. pyogenes, S. viridans, Pseudomonas aeruginosa и анаэробы. Только 50% случаев деструктивной пневмонии идентифицируются микробиологическими методами [23].
Таким образом, на сегодняшний день эффективность лечения детей с тяжелыми, в т.ч. деструктивными, формами пневмонии будет зависеть от слаженной работы специалистов – хирургов и педиатров, своевременной этиологической диагностики и правильно выбранного лечения. Существует ряд документов по лечению ВП, созданных как у нас в стране, так и за рубежом на основании доказательной медицины.
Принципы лечения ВП представлены в научно-практической программе «Внебольничная пневмония у детей: распространенность, диагностика, лечение, профилактика», напечатанной в 2010 г., затем практически ежегодно пересматривается и дополняется [24], а также в Стандарте специализированной медицинской помощи при пневмонии тяжелой степени тяжести с осложнениями (приказ МЗ РФ № 741 от 09.11.2012), в Протоколе лечения внебольничной пневмонии у детей (протокол МЗ РФ от 25.12.2012). Лечение ВП включает выбор антибиотика, противовирусного препарата, муколитиков, откашливающих, обезболивающих, симптоматических средств и т.д. Однако в отношении деструктивной пневмонии необходим принцип индивидуальной этиопатогенетической терапии.
Антибактериальная терапия занимает ведущую роль в лечении тяжелых форм пневмоний. В связи с этим в отношении детей применяются «защищенные» аминопенициллины, цефалоспорины III–IV поколений, карбапенемы, макролиды, линезолиды, противогрибковые препараты. Рекомендуется комбинация антибиотиков, особенно если лечение было начато амбулаторно (например, в качестве стартовой терапии цефалоспорин III поколения+кларитромицин). Из всей группы макролидов для лечения пневмоний было рекомендовано всего два: азитромицин и кларитромицин, и этому обстоятельству есть свое объяснение. Макролиды в основном оказывают бактериостатическое действие и преимущественно активны в отношении грамположительных, ряда грамотрицательных и внутриклеточных возбудителей. Высокую чувствительность к макролидам проявляют стрептококки, пневмококки, стафилококки, гонококки, хламидии, микоплазмы, легионеллы. Умеренной чувствительностью обладают макролиды в отношении Helicobacter pylori, боррелий, микобактерии (не всех видов), токсоплазм, анаэробов, гемофильной палочки. Устойчивы к ним метициллин-резистентные штаммы стафилококков, Enterococcus faecium, грамотрицательные микроорганизмы семейства Enterobacteriaceae, Pseudomonas aeruginosa, Acinetobacter, Mycobacterium tиberculosis. Кларитромицин выгодно отличается от других макролидов.
Нами было проведено исследование по лечению пневмоний микоплазменной этиологии в период эпидемического подъема данной инфекции в 2012–2013 гг. Результат лечения зависел от схемы назначения антибиотиков и был лучше у детей при назначении цефалоспорина III поколения одновременно с макролидом [25].
Известно, что кларитромицин представляет собой метилированное производное эритромицина. Данная химическая структура позволила кларитромицину быть наиболее устойчивым макролидом к гидролизу в кислой среде, снизить нежелательные осложнения со стороны желудочно-кишечного тракта и сделало его не зависимым от приема пищи [26]. Кларитромицин рекомендован специалистами в качестве препарата первого выбора при лечении острого среднего отита, синусита, бронхитов, ВП, поскольку хорошо проникает в очаги воспаления [27]. Кларитромицин в форме суспензии не менее безопасен и эффективен, чем амоксициллин при лечении заболеваний нижних дыхательных путей [28].
В отделениях реанимации цефалоспориновые антибиотики III–IV поколений или карбапенемы назначают одновременно с макродидами (перорально или также внутривенно). Возможен «ступенчатый» подход к назначению антибиотиков: 2–3 дня парентерально, затем переход аналогичного препарата на пероральный прием [29].
Оценка эффективности лечения проводится через 48 часов, и в случае отсутствия положительного эффекта рекомендуется замена антибиотика или присоединение другого. Продолжительность лечения ВП составляет 7–10 дней, тяжелые формы пневмонии требуют более продолжительного курса лечения (более 14 дней) [29]. Критерием отмены антибиотика служит регресс клинических симптомов, при этом сохранение отдельных лабораторных и рентгенологических изменений не является основанием к продолжению антибактериальной терапии [30].
В качестве примера своевременной диагностики, выбора тактики индивидуализированной этиопатогенетической терапии приводим историю болезни ребенка 6 лет, поступившего в Морозовскую детскую городскую клиническую больницу (МДКБ) 30.12.2013 (выписан 14.01.2014) с основным клиническим диагнозом: левосторонняя деструктивная пневмония. Осложнения: пиофибриноторакс слева. Пневмоторакс. Состояние после плеврального дренирования. Сопутствующий диагноз: ожирение, мочекаменная болезнь, дисметаболическая нефропатия.
Ребенок был доставлен в отделение реанимации и интенсивной терапии (ОРИТ) МДГКБ бригадой «скорой» помощи на спонтанном дыхании с инфузией 10%-ной глюкозы через периферическую вену. Из анамнеза жизни известно, что ребенок от 3-й беременности, протекавшей физиологически, роды срочные, оперативные, оценка по Апгар – 9/9, масса – 4110 г, длина – 54 см. Привит по графику. Ребенок относится к группе часто болеющих детей, 6 раз переносил пневмонию. Мочекаменная болезнь – наследственная форма.
Из анамнеза заболевания: болен с 9.12.2013, поставлен диагноз «острая респираторная вирусная инфекция» (получал симптоматическую терапию, Гексорал). Через 5 дней (13.12.2013) отмечена отрицательная динамика, высокая лихорадка, появились жалобы на боли в левом боку, на рентгенограмме – картина левосторонней пневмонии. Был госпитализирован в Нарофоминскую районную больницу № 1, где назначена антибактериальная терапия, на фоне которой через 3 суток отмечена положительная динамика (стал более активным, появился аппетит), но продолжал лихорадить. К терапии добавлен амикацин, метронидазол, проведена компьютерная томография (КТ), произведена плевральная пункция (получено 20 мл мутной жидкости, состоящей на 84% из нейтрофилов). Улучшения состояния не наблюдалось, лихорадка достигла до 39°С. Дренаж в левую плевральную полость был установлен 20.12.2013. В связи с отсутствием положительного результата лечения ребенок переведен в отделение реанимации МБГКБ.
При поступлении 20.12.2013: состояние тяжелое, вялый, капризен, кожа бледная, одышка до 36 в минуту. Аускультативно в легких дыхание проводится во все отделы, слева ослаблено, там же притупление перкуторного звука. Тоны сердца приглушены, ритмичны. Перистальтика сохранена, явлений дизурии, диспепсии нет. В общем анализе крови лейкоцитоз 13,5×109/л тыс. со сдвигом лейкоцитарной формулы «влево», анемия легкой степени тяжести.
В биохимическом анализе крови выраженных изменений показателей выявлено не было, антистрептолизин-О (взят трижды в течение заболевания) не превышал нормальных значений. Прокальцитониновый тест отрицательный. Умеренно выражена гиперфибриногенемия (5,55 г/л).
В срочном порядке проведено ультразвуковое исследование плевральных полостей, при котором слева определено жидкостное неоднородное содержимое, местами ячеистой структуры. На КТ-легких отмечается смещение трахеи и органов средостения вправо, левое легкое поджато (пневмоторакс?), дренажная трубка визуализируется в проекции воздушной полости. Выполнено подтягивание дренажа, получено до 400 мл воздуха без конца и около 30 мл гнойно-геморрагического отделяемого. Дренаж функционирует удовлетворительно, подключена активная аспирация, по дренажу сброс воздуха. Начата инфузионная терапия с назначением Меронема, метронидазола, в связи с гипоальбуминемией начато введение альбумина.
При поступлении в тот же день показана санация плевральной полости с учетом течения процесса, в связи с чем была выполнена срочная видеоторакоскопия. При торакоскопии установлен троакар 5 мм в V межреберье по среднеподмышечной линии. В плевральной полости отмечен выраженный воспалительный процесс с массивным наложением фибрина. Из левой плевральной полости взят посев. Выполнен адгезиолизис левого легкого. При разделении спаек у верхушки левого легкого в области стояния дренажа выявлено краевое ранение легкого с поддуванием воздуха и незначительным кровотечением. Старый дренаж удален. Ранение легкого не требовало ушивания. Фибрин удален частично отсосом и диссекторами. Общий объем промывной жидкости составил 300 мл теплого физраствора с диоксидином, объем выпота из плевральной полости и фибрина составил около 200 мл.
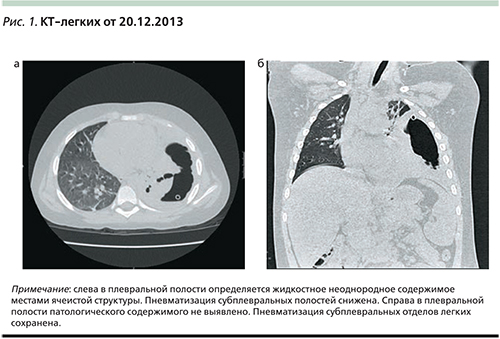
По совокупности клинических, а также данных КТ-легких (рис. 1а, б), торакоскопии 21.12.2013 был установлен диагноз тяжелой левосторонней деструктивной пневмонии с плевральными осложнениями. На совместном консилиуме были приняты во внимание результаты серологических анализов крови – микоплазменная инфекция (IgM 0,8 EД/мл отрицательно, IgG – 37,6 ЕД/мл положительно [0–22]) и обострение герпетической (ВПГ 1 – IgM – 1,7 EД/мл положительно (0,0–1,1), IgG – 138,2 EД/мл положительно (0–22), к терапии добавлен Клацид в/в из расчета 15 мг/кг/сут в два приема, ацикловир 0,4 г×3 раза в сутки, Вобэнзим. Через 7 дней ребенок был переведен на пероральный прием Клацида (всего 14 дней). Поскольку пневмония развилась у ребенка в шестой раз, было высказано предположение о вторичном иммунодефиците и проведении иммунокоррекции, назначенной в виде Имунорикса на 2 последующих месяца. На фоне скорригированной терапии (Меронем, Клацид, метронидазол, флуконазол в/в) на 9-е сутки пребывания в ОРИТ была отмечена положительная динамика в виде снижения интенсивности затемнения в левом легочном поле, ребенка перевели из ОРИТ в боксированно-хирургическое отделение 05.01.2014, была проведена замена карбопенема на Инванз. Дренаж был перекрыт через 9 дней, отменены внутривенные инфузии. В левом легком сохранялись массивные плевральные наложения в нижних отделах слева за счет воспалительной инфильтрации. Ребенок был выписан 14.01.2014 под наблюдение педиатра и пульмонолога по месту жительства с рекомендацией контроля серологических анализов и КТ-легких.
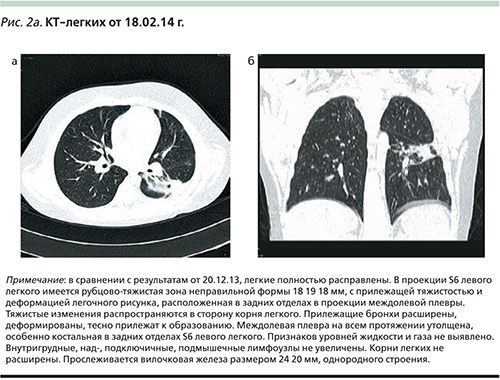
Полученные результаты КТ-легких от 18.02.2014 (рис. 2а, б) можно оценить как состояние после перенесенной деструктивной пневмонии.
В течение года ребенок находился под нашим наблюдением, проводился контроль серологических анализов крови на герпес и микоплазму (до полного излечения и получения отрицательных результатов). По функции внешнего дыхания после выписки из стационара от 24.11.2014 и в дальнейшем в динамике были выявлены явления обструкции, снижение жизненной емкости легких. В результате на медкомиссии была установлена бронхиальная астма и инвалидность.
Деструктивные пневмонии у детей относятся к междисциплинарной проблеме, успех лечения которых зависит от слаженной работы команды хирургов, педиатров и врачей других специальностей. Для диагностики деструктивной пневмонии наряду с хорошо известными традиционными лабораторными и рентгенологическими методами исследования должны быть включены ультразвуковое исследование плевральных полостей, КТ-легких, микробиологическое и серологическое исследование крови, посевы и ПЦР-диагностика – пневмопанель (плевральной жидкости, мочи, слюны), включение экспесс-методов, латекс-тестов. Огромную роль для положительного исхода заболевания будет иметь индивидуальная этиопатогенетическая терапия, проведенная с учетом выделенных основных патогенов, назначенная в ранние сроки заболевания, что позволит избежать тяжелых осложнений. После выписки из стационара в зависимости от особенностей течения деструктивной пневмонии следует период амбулаторного наблюдения, а также профилактики возможных осложнений.