Что является причиной давления газа
Давление газа
Давление газа — что это за параметр
Давление в физике представляет собой один из трех ключевых термодинамических макроскопических характеристик для измерения любой газовой системы.
Газ — это одно из четырех, включая плазму, агрегатных состояний материи, характеризующееся очень слабыми связями между составляющими его частицами, а также их большой подвижностью.
В газообразной среде частицы в определенной концентрации расположены не упорядоченно и перемещаются в хаотичном порядке в разных направлениях с одинаковой вероятностью. Подобное строение не позволяет газам сохранять стабильность объема и формы даже при малом внешнем силовом воздействии. Для любого газа, включая одноатомный, значение средней кинетической энергии его частиц в виде атомов и молекул будет превышать энергию межмолекулярного взаимодействия между ними.
Осторожно! Если преподаватель обнаружит плагиат в работе, не избежать крупных проблем (вплоть до отчисления). Если нет возможности написать самому, закажите тут.
Кроме того, расстояние, на которое удалены частицы, значительно превышает их собственные размеры. В том случае, когда молекулярными взаимодействиями и габаритами частиц допускается пренебрегать, газ считают идеальным. Для такой формы материи характерен только один тип внутреннего взаимодействия в виде упругих столкновений. Так как размер частиц пренебрежимо мал по сравнению с расстоянием, на которое они удалены, вероятность столкновений частиц между собой будет низкой.
По этой причине в идеальной газовой среде можно наблюдать лишь столкновения частиц со стенками сосуда. Какой-либо реальный газ с хорошей точностью можно отнести к идеальному, когда их температура выше, чем комнатная, а давление несущественно больше, чем атмосферное.
Причина возникновения давления в газах
Давление газа нельзя объяснить теми же причинами, что и давление твердого тела на опору. Расстояние, на которое удалены молекулы газообразной среды, существенно больше. В результате хаотичного движения они сталкиваются между собой и со стенками сосуда, который они занимают. Давление газа на стенки сосуда и вызвано ударами его молекул.
Данный параметр увеличивается по мере того, как нарастает сила ударов молекул о стенки. Газ характеризуется одинаковым давлением во всех направлениях, которое является следствием хаотичного движения огромного числа молекул.
Важно отметить, что газ оказывает давление на дно и стенки сосуда, объем которого он занимает, во всех направления равномерно. В связи с этим, воздушный шарик сохраняет форму, несмотря на то, что его оболочка достаточно эластична.
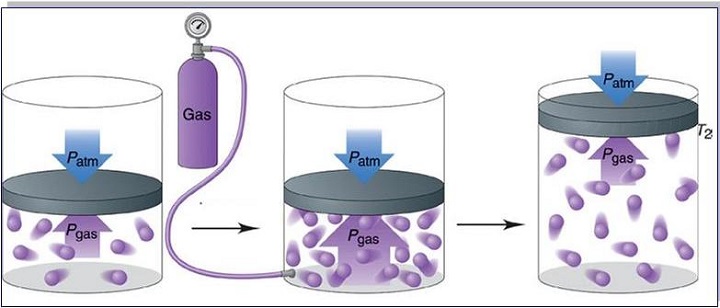
Перед тем как транспортировать или отправить на хранение газообразные вещества, их сильно сжимают. В этом случае давление газа увеличивается. Его помещают в специальные баллоны из стали высокой прочности. Такие емкости необходимы для хранения сжатого воздуха на подводных лодках и кислорода, предназначенного для сварки металлов.
Свойства давления газа:
Запись формул для определения давления газа начинают с выяснения причин, по которым оно возникает в рассматриваемой системе. Исходя из физического смысла, давление представляет собой величину, равную отношению силы, перпендикулярно воздействующей на некоторое основание, к площади этого основания:
Как было отмечено ранее, для идеальной газовой системы характерен лишь один тип взаимодействия — это абсолютно упругие столкновения. В процессе частицы передают количество движения Δp стенкам сосуда в течение времени соударения Δt. В данном случае применим второй закон Ньютона:
Таким образом, конкретно сила F является причиной формирования давления на стенки сосуда. Данная величина F, производимая одной частицей, незначительна. Однако, когда количество частиц огромно, они в совокупности создают ощутимый эффект, проявляемый в виде наличия давления в сосуде.
Формула давления идеального газа из молекулярно-кинетической теории
Объяснение концепции идеального газа построено на основных положениях молекулярно-кинетической теории, которая вытекает из принципов статистической механики. Наука получила активное развитие во второй половине XIX, благодаря таким ученым, как Джеймс Максвелл и Людвиг Больцман. Основы дисциплины были заложены еще Бернулли в первой половине XVIII века.
Исходя из статистики Максвелла-Больцмана, все частицы в системе обладают разными скоростями движения. При этом можно наблюдать небольшой процент частиц со скоростями, приближенными к нулю, и малую долю частиц, обладающих огромной скоростью. Средняя квадратичная скорость в этом случае будет соответствовать некоторой величине, не изменяющейся с течением времени.
Средняя квадратичная скорость частиц однозначно характеризует температуру газа. Используя приближения молекулярно-кинетической теории в виде невзаимодействующих безразмерных и хаотично движущихся частиц, получают формулу для расчета давления газа в сосуде:
где N является количеством частиц в системе; V обозначает объем; v представляет собой среднюю квадратичную скорость; m является массой одной частицы.
При наличии указанных в формуле параметров, выраженных в единицах СИ, можно вычислить давление газа в сосуде.
Второй способ записи основного уравнения МКТ
В середине 30-х годов XIX столетия французскому инженеру Эмилю Клапейрону удалось обобщить накопленный до этого времени экспериментальный опыт изучения поведения газов во время разнообразных изопроцессов и получить формулу, которую в будущем назвали универсальным уравнением состояния идеального газа:
n является количеством вещества в молях; T представляет собой температуру по абсолютной шкале и обозначается в кельвинах.
Величина R является универсальной газовой постоянной. Этот термин был введен в уравнение русским химиком Д.И. Менделеевым. Исходя из этого, запись уравнения называют законом Клапейрона-Менделеева.
С помощью данного выражения можно определить формулу для расчета давления газа:
Полученное уравнение объясняет линейный рост давления при увеличении температуры в условиях стабильности объема. Если объем уменьшается с сохранением температуры, то давление увеличивается по гиперболе. Данные закономерности явления отражены в законах Гей-Люссака и Бойля-Мариотта.
Сравнивая представленное выражение с записью формулы, которая вытекает из положений молекулярно-кинетической теории, можно установить связь кинетической энергии одной частицы, либо системы в общем, и абсолютной температуры.
Важно отметить, что при расчетах с использованием формулы для Р, вытекающей из уравнения Клапейрона, связь с химическим составом газа отсутствует. Если давление определяют с помощью выражения, согласно понятию молекулярно-кинетической теории, то данную связь следует учитывать в виде параметра m. В том случае, когда определяют давление смеси идеальных газов, применяют один из следующих методов:
Пример
Предположим, что молекулы кислорода движутся со средней скоростью в 500 м/с. Требуется рассчитать, каково давление в сосуде, объем которого равен 10 литров, содержащий 2 моль молекул.
Для того чтобы найти ответ, следует применить формулу для Р из молекулярно-кинетической теории:
Из-за неизвестных параметров m и N требуется выполнить некоторые преобразования формулы:
Таким образом, удельный объем сосуда в кубических метрах равен 0,01. Молярная масса молекулы кислорода М составляет 0,032 кг/моль. Данные параметры можно подставить в уравнение вместе со скоростью и количеством вещества. Тогда Р = 533333 Па, что представляет собой давление в 5,3 атмосферы.
Давление газа на стенки сосуда
Статья находится на проверке у методистов Skysmart.
Если вы заметили ошибку, сообщите об этом в онлайн-чат (в правом нижнем углу экрана).
Газ: агрегатное состояние
В мире есть три агрегатных состояния — твердое, жидкое и газообразное. Их характеристики — в таблице
Агрегатные состояния
Свойства
Расположение молекул
Расстояние между молекулами
Движение молекулы
сохраняет форму и объем
в кристаллической решетке
соотносится с размером молекул
колеблется около своего положения в кристаллической решетке
близко друг к другу
малоподвижны, при нагревании скорость движения молекул увеличивается
занимают предоставленный объем
больше размеров молекул
хаотичное и непрерывное
В жизни мы встречаем газообразное состояние вещества, когда чувствуем запахи. Запах очень легко распространяется, потому что газ не имеет ни формы, ни объема (он занимает весь предоставленный ему объем), состоит из хаотично движущихся молекул, расстояние между которыми больше, чем размеры молекул.
Давление газа
Мы только что выяснили, что молекулы газа беспорядочно движутся. Во время движения они сталкиваются друг с другом, а также со стенками сосуда, в котором этот газ находится. Поскольку молекул много, ударов тоже много.
Например, в комнате, в которой вы сейчас находитесь, на каждый квадратный сантиметр за 1 с молекулами воздуха наносится столько ударов, что их количество выражается двадцати трехзначным числом.
Хотя сила удара отдельной молекулы мала, действие всех молекул о стенки сосуда приводит к значительному давлению. Это как если бы один комар толкал машину, то она бы и не сдвинулась с места, а вот пару сотен миллионов комаров вполне себе способны эту машину сдвинуть.
Курсы подготовки к ОГЭ по физике помогут снять стресс перед экзаменом и получить высокий балл.
Зависимость давления от других величин
Зависимость давления от объема
В механике есть формула давления, которая показывает: давление прямо пропорционально силе и обратно пропорционально площади, на которую эта сила оказывается.
Давление
p = F/S
p — давление [Па]
F — сила [Н]
S — площадь [м^2]
То есть, если наши двести миллионов комаров будут толкать легковую машину, они распределятся по меньшей площади, чем если бы они толкали грузовой автомобиль (просто потому что легковая меньше грузовика).
Из формулы давления следует, что давление на легковой автомобиль будет больше из-за меньшей площади.
Давайте рассмотрим аналогичный пример с двумя сосудами разной площади.
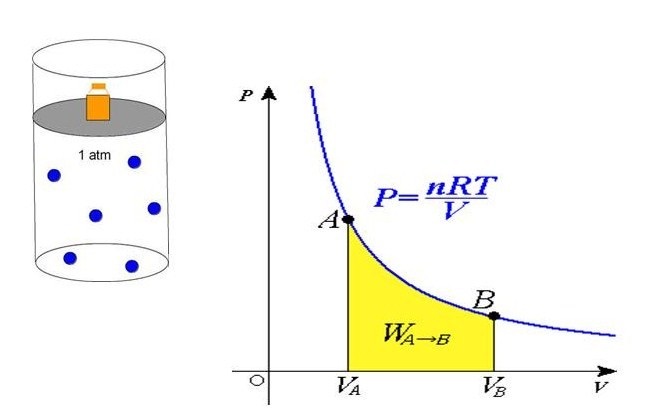
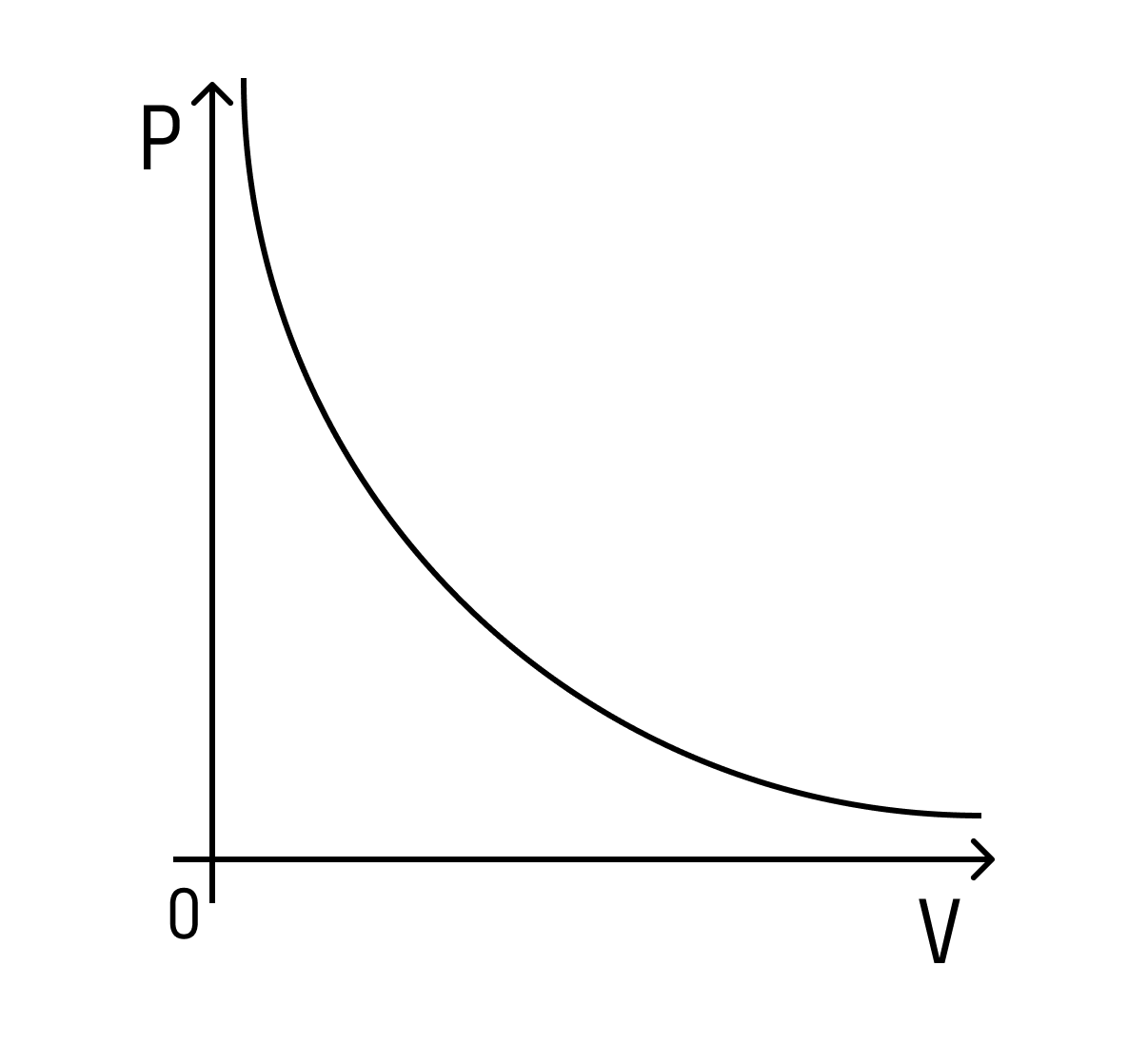
Давление в левом сосуде будет больше, чем во втором, по аналогичной схеме — потому что площадь меньше. Но если площадь основания меньше, то и объем меньше. Это значит, что давление будет зависеть от объема следующим образом: чем больше объем, тем меньше давление — и наоборот.
При этом зависимость будет не линейная, а примет вот такой вид (при условии, что температура постоянна):
Такая зависимость называется законом Бойля-Мариотта.
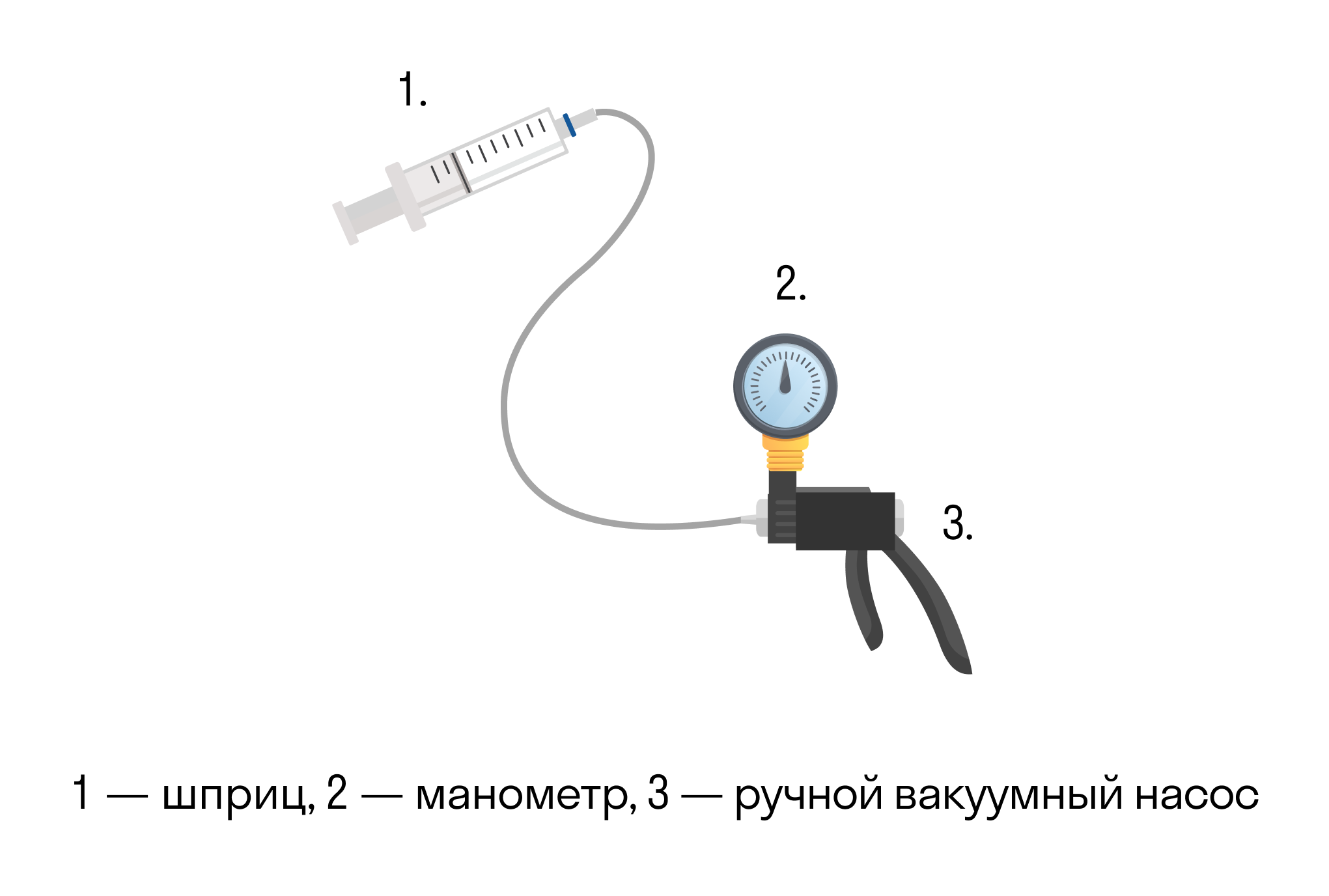
Она экспериментально проверяется с помощью такой установки.
Объем шприца увеличивают с помощью насоса, а манометр измеряет давление. Эксперимент показывает, что при увеличении объема давление действительно уменьшается.
Зависимость давления от температуры
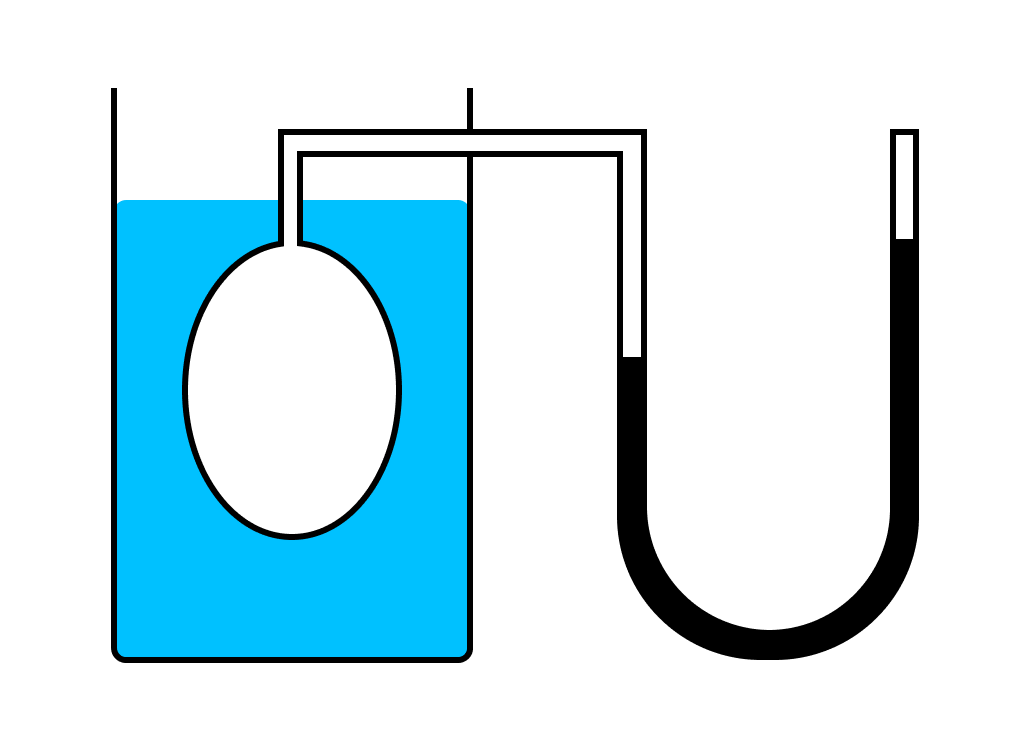
Рассмотрим зависимость давления газа от температуры при условии неизменного объема определенной массы газа. Эти исследования были впервые произведены в Жаком Шарлем.
Газ нагревался в большой колбе, соединенной с ртутным манометром в виде узкой изогнутой трубки. Пренебрегая ничтожным увеличением объема колбы при нагревании и незначительным изменением объема при смещении ртути в узкой манометрической трубке.
Таким образом, можно считать объем газа неизменным. Подогревая воду в сосуде, окружающем колбу, измеряли температуру газа по термометру, а соответствующее давление — по манометру.
Этот эксперимент показал, что давление газа увеличивается с увеличением температуры. Это связано с тем, что при нагревании молекулы газа движутся быстрее, из-за чего чаще ударяются о стенки сосуда.
С температурой все проще. Зависимость давления от температуры при постоянных объеме и массе будет линейно:
Эта зависимость называется законом Шарля.
Хранение и транспортировка газов
Если нужно перевезти значительное количество газа из одного места в другое, или когда газы необходимо длительно хранить — их помещают в специальные прочные металлические сосуды. Из-за того, что при уменьшении объема увеличивается давление, газ можно закачать в небольшой баллон, но он должен быть очень прочным.
Сосуды, предназначенные для транспортировки газов, выдерживают высокие давления. Поэтому с помощью специальных насосов (компрессоров) туда можно закачать значительные массы газа, которые в обычных условиях занимали бы в сотни раз больший объем.
Поскольку давление газов в баллонах даже при комнатной температуре очень велико, их ни в коем случае нельзя нагревать. Например, держать под прямыми лучами солнца или любым способом пытаться сделать в них отверстие, даже после использования.
Давление газа
Урок 22. Физика 7 класс ФГОС
В данный момент вы не можете посмотреть или раздать видеоурок ученикам
Чтобы получить доступ к этому и другим видеоурокам комплекта, вам нужно добавить его в личный кабинет, приобрев в каталоге.
Получите невероятные возможности
Конспект урока «Давление газа»
это самое давление»
В этой теме речь пойдёт о том, каким образом могут оказывать давление газы.
В газах молекулы расположены друг от друга на большом расстоянии, поэтому, силы взаимного притяжения между молекулами практически отсутствуют. Известно также, что газы легко сжимаются. Молекулы газа двигаются беспорядочно, занимая весь предоставленный им объём. Молекулы сталкиваются не только друг с другом, но и ударяются о стенки сосуда. Именно эти удары и создают давление. Сила удара одной молекулы ничтожно мала, но ведь количество молекул даже в маленьком сосуде очень велико.
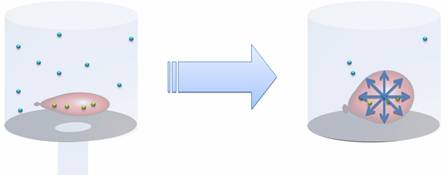
Рассмотрим классический опыт: возьмем завязанный шарик с небольшим количеством воздуха и накроем его стеклянным сосудом. Если выкачать из сосуда воздух, то объём воздушного шарика увеличится. Почему же это произошло? Дело в том, что изначально по шарику ударяли молекулы воздуха внутри сосуда, противодействуя ударам молекул внутри шарика. Таким образом, оболочка шарика сохраняла свой объём. Но когда воздух был откачен из сосуда, во много раз уменьшилось количество молекул воздуха внутри него. Ударов по шарику снаружи стало гораздо меньше, но вот количество молекул внутри шарика не изменилось. Это позволило газу внутри шарика расширяться до тех пор, пока давление газа внутри не стало равно давлению газа снаружи. Из этого можно сделать вывод, что при увеличении объёма, давление газа уменьшается. Но если мы вновь наполним сосуд воздухом, то шарик снова сдуется. Значит, при уменьшении объёма, давление увеличивается.
Следует понимать, что эти утверждения верны только в том случае, если речь идет о неизменной массе газа, находящейся при неизменной температуре. Также следует отметить: когда воздух был откачен из сосуда, форма шарика действительно стала шарообразной (а не вытянутой, как это было изначально). Это значит, что газ давит на оболочку шарика (или стенки сосуда) одинаково по всем направлениям. Это объясняется беспорядочным движением молекул. Они двигаются в случайных направлениях, но их число настолько велико, что можно с уверенностью сказать, что во всех направлениях летит одинаковое число молекул. В результате этого на каждый маленький кусочек площади поверхности шарика приходится одинаковое число ударов, то есть, создается одинаковое давление.
Проведем еще один опыт: возьмем цилиндр с подвижным поршнем и поместим туда некоторое количество газа.
Если поршень будет двигаться, то можно изменять объём газа, при этом сохраняя его массу. Таким образом, плотность газа увеличиться, то есть на единицу объёма будет приходиться большее число молекул газа. В этом случае, они значительно чаще будут ударяться о стенки сосуда. То есть, таким способом можно увеличить давление. Это еще раз доказывает, что при уменьшении объёма газа постоянной массы и температуры, давление увеличивается, а при увеличении объёма – давление уменьшается.
Если плотно закрыть пластиковую бутылку и сжать её, то можно почувствовать значительное сопротивление – молекулы газа будут давить на стенки бутылки изнутри, не давая вам сжать её.
Поставим опыт: Не будем изменять ни массу газа, ни его объём, а просто нагреем газ в плотно закрытом сосуде. В этом случае давление газа увеличится. Это объясняется тем, что при увеличении температуры, молекулы газа начинают двигаться быстрее, а, следовательно, будут чаще ударяться о стенки сосуда. То есть, при увеличении температуры газа постоянной массы и объёма, давление газа увеличивается, и, наоборот, при уменьшении температуры, давление газа уменьшается. Если слегка заткнуть стеклянную бутылку пробкой и нагреть бутылку, то пробка выскочит из горлышка под давлением газа.
Зависимость давления газа от температуры нередко используется людьми. Например, чтобы поместить большое количество газа в сравнительно небольшой объём, газ охлаждают и закачивают в баллон. После того, как газ вновь нагревается, в баллоне создается очень высокое давление. Именно поэтому на таких баллонах, как правило, пишут предупреждения о том, чтобы баллон ни в коем случае не нагревали и не ударяли (это может привести к взрыву – настолько в баллоне высокое давление).
Примеров давления газа можно привести очень много: это и накачанный мяч, и накачанные шины автомобиля, и атмосферное давление.
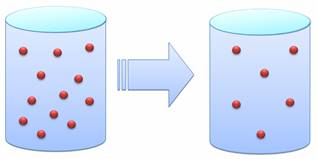
Упражнение 1. Из баллона медленно выпустили половину газа и снова закрыли его. Как изменится давление в баллоне?
Поскольку молекул газа внутри баллона стало вдвое меньше, они вдвое меньше стали ударяться о стенки баллона. Следовательно, давление уменьшилось вдвое.
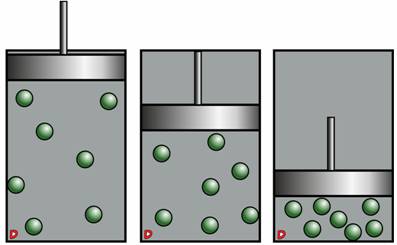
Упражнение 2. Одинаковые массы одного и того же газа находятся в двух баллонах: зеленом и синем. Известно, что температура и в том, и в другом баллоне одинакова. В каком баллоне давление будет больше?
По условию задачи, в обоих баллонах одинаковые условия. Из рисунка явно видно, что синий баллон больше зеленого. Поэтому давление в нем будет меньше, поскольку молекулы газа меньше будут ударяться о его стенки.
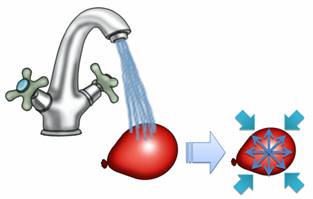
Упражнение 3. Воздушный шарик завязали и облили его ледяной водой. Из-за этого шарик немного сжался. Можете ли вы объяснить, почему это произошло?
Из-за понижения температуры, давление внутри шарика уменьшилось. В результате внешнее давление сжимало шарик до тех пор, пока внутреннее давление вновь ни стало равным внешнему.
– Давление газа – это давление, которое создается в результате ударов молекул о стенки сосуда (или о какое-то другое тело).
– Давление газа одинаково по всем направлениям.
– При неизменной массе и температуре, давление газа тем больше, чем меньше его объём. И, наоборот, давление газа тем меньше, чем больше объём.
– При постоянной массе и объёме, давление можно изменить, изменяя температуру. При нагревании газа, его давление будет увеличиваться, а при охлаждении – наоборот, уменьшаться.
Причина давления газа



· Молекулы находятся относительно далеко друг от друга,
· Молекулы постоянно двигаются и могут оказаться в любой части пространства,
· Газ не имеет своей формы и объема,
· Газ занимает весь предоставленный объем.
Давление газа на стенки сосуда (и помещенное в газ тело) вызывается ударами молекул газа.
Опыты:У вас в учебнике приведены опыты. На первом мы наблюдаем, как по мере откачивания воздуха из колокола воздушного насоса, полунадутый шарик начинает раздуваться (рис. 91 учебника). Такое поведение шарика можно объяснить лишь тем, что число ударов молекул воздуха о внешнюю поверхность шарика уменьшается, и объем шарика растет до той величины, при которой сила давления воздуха внутри шара не сравняется с силой упругости оболочки.
Так как форма шарика близка к сферической, можем заключить, что давление газа по всем направлениям одинаково.
Газ давит на сосуд, в котором находится по всем направлениям одинаково.
Зависимость давления газа от объема
Опыт, в котором в стеклянном сосуде находится воздух, с одной стороны сосуд закрыт резиновой пленкой – мембраной, а с другой поршнем. Если поршень вдавливать в сосуд, то мембрана раздувается, то есть на нее действует большее давление. И наоборот, если поршень выдвигать, то мембрана прогибается внутрь, значит давление газ на нее оказывает меньше.
Легко заметить, что уменьшение объема газа приводит к увеличению его давления. Это связано с тем, что плотность газа возрастает, число ударов молекул о мембрану также становится больше. Это приводит к росту давления.
При уменьшении объема газа его давление увеличивается, а при увеличении объема давление уменьшается при условии, что масса и температура газа остаются неизменными.
На этом же принципе работают пипетки, резиновая груша. (Учитель показывает работу пипетки, резиновой груши, шприца)
Зависимость давления газа от температуры
Это можно наблюдать, если воздушный шарик с морозного воздуха занести в теплую комнату: очень скоро объем шарика увеличится, т.к. возрастет давление газа внутри него.
Давление газа в закрытом сосуде тем больше, чем выше температура газа.
Из сказанного нами выше можно сделать общий вывод о том от чего же зависит давление газа.