Что является причиной электролитической диссоциации
Электролитическая диссоциация и причины её возникновения.



Электролитическая диссоциация — полный или частичный распад молекул растворенного в-ва на катионы и анионы. Э. д. называют также распад на катионы и анионы ионных кристаллов при растворении или расплавлении. Причиной диссоциации является взаимодействие между растворенным веществом и растворителем, в результате которого в растворе образуются гидратированные ионы.
Диссоциация кислот, солей и оснований.
-Кислоты диссоциируют на ионы водорода и кислотного остатка.
-Соли диссоциируют на ионы металла и кислотного остатка
-Основания диссоциируют на ионы металла и гидроксид-ионы
Сильные и слабые электролиты.
Электроли́ты— вещества, расплавы или растворы, которые проводят электрический ток вследствие диссоциации на ионы, однако сами вещества не проводят электрический ток. Примерами электролитов могут служить растворы кислот, солей и оснований. Электролиты — проводники второго рода, вещества, которые в растворе (или расплаве) состоят полностью или частично из ионов, и обладающие вследствие этого ионной проводимостью.
Исходя из степени диссоциации все электролиты делятся на две группы:
1.Сильные электролиты — электролиты, степень диссоциации которых в растворах равна единице (то есть диссоциируют полностью) и не зависит от концентрации раствора. Сюда относятся подавляющее большинство солей, щелочей, а также некоторые кислоты (сильные кислоты, такие как: HCl, HBr, HI, HNO3).
2.Слабые электролиты — степень диссоциации меньше единицы (то есть диссоциируют не полностью) и уменьшается с ростом концентрации. К ним относят воду, ряд кислот (слабые кислоты), основания p-, d-, и f- элементов.
Между этими двумя группами четкой границы нет, одно и то же вещество может в одном растворителе проявлять свойства сильного электролита, а в другом — слабого.
Теория электролитической диссоциации
Что такое электролитная диссоциация? В следствие чего она образуется и какие факторы влияют на ее степень? Как научиться составлять уравнения диссоциации?
Кто открыл способность некоторых растворов проводить электрический ток и почему великий русский химик Д.И.Менделеев не получил Нобелевской премии?
Ответы на все эти вопросы вы узнаете из этой статьи.
История вопроса
Изучение растворов с давних времен занимало умы исследователей. В начале XIX века М. Фарадей открыл способность некоторых растворов проводить электрический ток. Геймгольц, немецкий физик, предположил, что электролиты в растворе полностью распадаются на ионы, то есть существует электролитическая диссоциация. Однако увеличение электропроводности с уменьшением концентрации раствора объяснить не смог.
Ученые заметили, что растворы замерзают при более низкой температуре, чем чистые растворители. Именно этим свойством растворов и в наше время пользуются дворники, щедро посыпая солью обледеневшие тротуары. Однако, температура замерзания электролитов не соответствовала расчетным данным.
Научным несостыковкам требовалось найти объяснение. И молодой, 29-летний шведский ученый С. Аррениус, в 1887 г. исследуя проведение электрического тока в растворах различных веществ, выдвинул теорию, которая могла объяснить эти факты.
Основные положения теории электролитической диссоциации
Степень диссоциации
В ходе научных исследований ученые определили, что в растворе диссоциирует некоторая часть молекул растворителя. Для количественной характеристики силы электролита был введен показатель степени диссоциации, который обозначается α и рассчитывается по формуле
Где ν — количество вещества, распавшееся на ионы,
ν0 — общее количество вещества.
Степень диссоциации также можно выразить в процентах. Как это сделать, можно узнать в § 11 учебника «Химия. 9 класс» под редакцией В.В. Еремина.
В зависимости от степени диссоциации вещества делят на сильные и слабые электролиты.
Сильные электролиты представляют собой вещества, которые в разбавленных растворах практически полностью распадаются на ионы. Степень диссоциации более 0.5, или 50%.
Для слабых электролитов значение степени диссоциации α меньше 0.1, или 10%.
Вещества с промежуточными значениями от 10 до 50% иногда называют средними электролитами.
Уравнение диссоциации
Уравнение электролитической диссоциации используют для записи процессов, происходящих в растворе.
Диссоциация сильного электролита протекает практически необратимо, что показывает стрелка →.
Диссоциация слабого электролита — обратимый процесс, протекает не полностью и не до конца, что обозначает стрелка ⇄
Умение составлять уравнения диссоциации будет отличным подспорьем при разборе темы «§ 13. Реакции ионного обмена и условия их протекания» в учебнике «Химия. 9 класс» под редакцией В.В. Еремина и для решения ионных уравнений.
Противостояние титанов
Теория электролитической диссоциации Аррениуса вызвала жаркие споры среди ученых.
Химический мир разделился на два лагеря. Сторонники «физической» теории Аррениуса считали, что распад на ионы происходит без какого-либо воздействия сил внешней среды и раствор представляет собой механическую взвесь ионов и молекул воды.
Но эта теория не могла объяснить тепловые эффекты при растворении. Например, нагревание колбы при разведении в воде серной кислоты или покрытие сосуда инеем при растворении в воде аммиачной селитры или азотнокислого аммония.
Сторонники «химической», или гидратной, теории, автором которой был Д.И. Менделеев, считали, что в растворе происходит взаимодействие растворенного вещества и растворителя.
Много копий было сломано в этой борьбе. Проявились худшие человеческие качества. Так, Аррениус, пользуясь служебным положением (в 1905 году он был назначен директором физико-химического Нобелевского института в Стокгольме), приложил массу усилий, чтобы, несмотря на трехкратную номинацию на получение Нобелевской премии в 1905, 1906 и 1907 годах, Д.И. Менделеев так ее и не получил.
Но истина, как всегда, оказалась посередине: в ходе дальнейших экспериментов ученые выяснили, что растворитель и растворенное вещество, взаимодействуя между собой, дают необходимую энергию для разрушения кристаллической решетки электролитов. В споре великих умов родилась новая протолитическая, или протонная, теория кислот и оснований.
Что является причиной электролитической диссоциации
Известно, что существуют две основные причины прохождения электрического тока через проводники: либо за счёт движения электронов в электрическом поле, либо за счет движения ионов. Электрическая проводимость присуща, прежде всего, металлам. Ионная проводимость присуща многим химическим соединения, обладающим ионным строением, например, солям в твёрдом или расплавленном состояниях, а также многим водным и неводным растворам. В связи с этим все вещества принято условно делить на две категории:
а) вещества, растворы которых обладают ионной проводимостью, называются электролитами;
б) вещества, растворы которых не обладают ионной проводимостью, называются неэлектролитами.
К электролитам относится большинство неорганических кислот, оснований и солей. К неэлектролитам относятся многие органические соединения, например, спирты, углеводы.
Оказалось, что, кроме хорошей электропроводности, растворы электролитов обладают более низкими значениями давлениями пара растворителя и температуры плавления и более высокими температурами кипения по сравнению с соответствующими значениями для чистого растворителя или для раствора неэлектролита в этом же растворителе. Для объяснения этих свойств, шведский ученый С. Аррениус в 1887 г. предложил теорию электролитической диссоциации.
Сущность теории электролитической диссоциации С. Аррениуса
1. Электролиты при растворении в воде распадаются (диссоциируют) на ионы: положительные (катионы) и отрицательные (анионы).
Электролиты подразделяются в зависимости от степени диссоциации на сильные и слабые.
вещества, которые диссоциируют полностью и необратимо, т. е. в растворе присутствуют только гидратиро-ванные ионы. Относятся все соли, сильные кислоты `»HI»`, `»HCl»`, `»HBr»`, `»HNO»_3`, `»H»_2″SO»_4`, `»HMnO»_4`, `»HClO»_4`, `»HClO»_3`, щелочи `»NaOH»`, `»LiOH»`, `»KOH»`, `»RbOH»`, `»CsOH»`, `»Ca»(«OH»)_2`, `»Ba»(«OH»)_2`, `»Sr»(«OH»)_2`.
С точки зрения теории электролитической диссоциации, кислотой называется соединение, образующее при диссоциации в водном растворе только ионы `»H»^+`:
Если кислота является двухосновной, то диссоциация кислоты происходит ступенчато. Количество стадий определяется основностью кислоты:
Сила бескислородных кислот возрастает в ряду однотипных соединений при переходе вниз по подгруппе кислотообразующего элемента: `»HCl»-«HBr»-«HI»`. Бромоводородная кислота `»HBr»` и йодоводородная `»HI»` кислоты сильнее хлороводородной, что объясняется увеличением межъядерных расстояний в их молекулах.
Фтороводородная (плавиковая) кислота `»HF»` растворяет стекло, но это вовсе не говорит о её силе. В ряду бескислородных галогенсодержащих кислот она относится к кислотам средней силы ввиду низкой концентрации в растворе ионов водорода из-за способности молекул `»HF»` к объединению (ассоциации), благодаря сильным водородным связям, возникающим при взаимодействии ионов `»F»^-` с молекулами `»HF»` (водородные связи) с образованием ионов `»HF»_2^-`, `»H»_2″F»_3^-` и других боле сложных частиц. В результате концентрация ионов водорода в водном растворе фтороводородной кислоты оказывается сильно пониженной.
Сила однотипных кислородных кислот изменяется в противоположном направлении, например, йодная кислота `»HIO»_4` слабее хлорной кислоты `»HClO»_4`. Если элемент образует несколько кислородных кислот, то наибольшей силой обладает кислота, в которой кислотообразующий элемент имеет самую высокую валентность.
Так, в ряду кислот `»HClO»-«HClO»_2-«HClO»_3-«HClO»_4` хлорная кислота наиболее сильная.
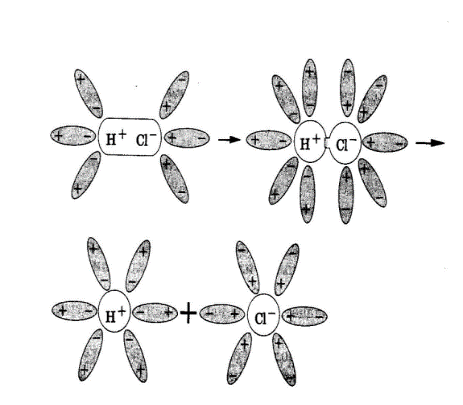
Схематически процесс распада (диссоциации) соляной кислоты на ионы можно представить следующим образом. Чтобы вещество в воде было электролитом, его молекула должна быть полярной.
Полярная молекула вещества окружена полярными молекулами воды, которые разрывают молекулу на две противоположно заряженные частицы – ионы.
с точки зрения теории электролитической диссоциации, представляет собой вещество, способное отдавать в растворе гидроксильную группу `»OH»^-`:
Диссоциация многокислотного гидроксида происходит ступенчато, например:
В свете теории электролитической диссоциации соли представляют собой соединения, образующие в водном растворе положительно заряженные ионы металла и отрицательно заряженные ионы кислотного остатка (для средних солей), а также кроме них ионы водорода (для кислых солей) и гидроксид-ионы (для основных солей):
вещества, которые диссоциируют частично и обратимо.
В растворе слабого электролита присутствуют гидратированные ионы и некоторая часть недиссоциированных молекул.
К слабым электролитам относятся:
3) оставшиеся кислоты, не относящиеся к сильным, например, `»HF»`, `»H»_2″S»`, `»HNO»_2`, `»H»_3″PO»_4` и другие, а также незамещённые органические кислоты. При растворении углекислого газа в воде образуется его гидрат `»CO»_2*»H»_2″O»` и в незначительном количестве угольная кислота `»H»_2″CO»_3`. Тем не менее, для диссоциации воспользуемся формулой угольной кислоты:
Практически диссоциация осуществляется лишь по первой ступени. Образующийся гидрокарбонат-ион `»HCO»_3^-` ведёт себя как слабый электролит.
Причиной диссоциации электролита в водных растворах является его гидратация, т. е. взаимодействие электролита с молекулами воды и разрыв химической связи в нем. В результате такого взаимодействия образуются гидратированные, т. е. связанные с молекулами воды, ионы.
Диссоциации проходит благодаря тому, что при гидратации ионов выделяется больше энергии, чем требуется на разрыв связи в молекуле. Примерно также происходит растворение ионного кристалла в воде и образование ионов. У кристаллов энергия гидратации ионов выше энергии кристаллической решётки.
Следует учитывать, что в растворах электролитов хаотически движущиеся гидратированные ионы могут столкнуться и вновь объединиться между собой. Этот обратный процесс называется ассоциацией. При некоторой постоянной температуре в данной системе устанавливается химическое равновесие, при котором скорость диссоциации станет равной скорости ассоциации.
Основные свойства гидроксидов одного и того же элемента усиливаются с уменьшением его валентности. Так, основные свойства у гидроксида железа (II) выражены сильнее, чем у гидроксида железа (III) и наоборот.
Слабым электролитом является гидроксид аммония `»NH»_4″OH»`. При растворении аммиака `»NH»_3` в воде образуется раствор, который слабо проводит электрический ток и имеет горько-мыльный вкус. Среда раствора основная. В растворе образуются гидрат аммиака `»NH»_3*»H»_2″O»` и в незначительном количестве гидроксид аммония `»NH»_4″OH»`, который диссоциирует как слабый электролит с образованием ионов аммония `»NH»_4^+` и гидроксид-иона `»OH»^-`.
К слабым электролитам относят некоторые соли, например хлорид цинка `»ZnCl»_2`, тиоцианат железа `»Fe»(«NCS»)_3`, цианид ртути `»Hg»(«CN»)_2`, которые также диссоциируют по ступеням.
Разделение электролитов на сильные, средние и слабые зависит от доли продиссоциированных молекул или степени диссоциации `alpha`, которая показывает отношение числа молекул, распавшихся на ионы `(N_»д»)`, к общему числу введённых в раствор молекул `(N_»р»)`:
Степень диссоциации не является строгим показателем силы электролита, т. к. она зависит от концентрации раствора, природы растворителя, присутствия в растворе другие электролитов.
При понижении концентрации степень диссоциации может повышаться, и в очень разбавленных растворах слабый электролит может находиться в состоянии почти полной диссоциации, в то же время в концентрированном растворе сильный электролит может вести себя как слабый и даже как неэлектролит.
Степень диссоциации как сильных, так и слабых электролитов зависит от концентрации раствора (степень диссоциации тем выше, чем более разбавлен раствор). Более точной характеристикой диссоциации электролита является константа диссоциации, которая от концентрации раствора не зависит.
Выражение для константы диссоциации можно получить, если записать уравнение реакции диссоциации электролита АК в общем виде:
Поскольку диссоциация слабого электролита является обратимым равновесным процессом, то к данной реакции применим закон действующих масс, и можно определить константу равновесия как
`[AK]` – концентрация недиссоцированных молекул;
Рассчитайте количество ионов водорода в `1` л раствора серной кислоты с концентрацией `0,1` моль/л.
Количество ионов водорода равно `0,1` моль.
Запишем уравнение диссоциации по второй ступени и по справочным данным определим степень диссоциации (`0,3`):
Используем формулу для нахождения степени диссоциации (при решении задачи степень диссоциации удобно выразить в долях от единицы):
`n(«диссоцH»_2″SO»_4)=0,1` моль/л `*0,3=0,03` моль.
Таким образом, в растворе появилось ионов `»H»^+` :
`0,1` моль `+ 0,03` моль `= 0,13` моль.
Следовательно, концентрация ионов водорода в растворе серной кислоты равна `0,13` моль/л.
Степень диссоциации гидроксида бария по первой ступени `- 92%`, по второй ступени `- 56%`. Рассчитайте число катионов бария и число гидроксид-ионов в `0,5` л `1,5 M` растворе.
1) Запишем уравнение электролитической диссоциации гидроксида бария:
1 ступень: `»Ba(OH»)_2-> «BaOH»^+ + «OH»^-`,
2) Найдём количество вещества гидроксида бария, содержащегося в данном образце раствора:
3) Зная степень диссоциации вычислим число молекул `»Ba(OH»)_2` распавшихся на ионы по первой ступени диссоциации:
Согласно диссоциации по `»I»` ступени, это количество вещества равно количеству вещества гидроксид-ионов, образовавшихся по первой ступени диссоциации, и количество ионов `»Ba(OH»)^+`:
4) Исходя из количества вещества гидроксокатионов бария, образовавшихся на первой стадии диссоциации, и степени диссоциации по второй ступени, вычислим количество ионов `»Ba»(«OH»)^+`, диссоциирующих по второй ступени:
В соответствии с диссоциацией по `»II»` ступени, это количество вещества равно количеству вещества катионов `»Ba»^(2+)` и количеству ионов `»OH»^-`, образовавшихся по `»II»` ступени диссоциации:
5) Найдём число катионов `»Ba»^(2+)`, образующихся при диссоциации:
6) Вычислим количество вещества гидроксид-ионов, образовавшихся на обеих стадиях диссоциации, и их число:
Главная причина диссоциации.
В процессе электролитической диссоциации (распаде электролитов на ионы) большую роль играют молекулы воды. Между атомами водорода и кислорода имеются расположенные под углом около 105 ковалентные сильнополярные связи. Поэтому молекулы воды полярны и представляют собой диполи:
При растворении в воде веществ с ионной связью, например, хлорида натрия, молекулы воды притягиваются своими отрицательными полюсами к положительно заряженным ионам натрия, а положительными полюсами – к отрицательно заряженным хлорид-ионам. В результате связь между ионами ослабляется, и кристаллическая решетка разрушается (рис.1). Таким образом, все ионы в растворе связаны с молекулами воды. Такие ионы называются гидратированными, а процесс их образования гидратацией. Положительно заряженные ионы называются катионами, а отрицательно заряженные – анионами.
Рис.1. Диссоциация NaCl Рис.2. Диссоциация HCl.
Теория электролитической диссоциации:
1. При растворении в воде (или расплавлении) электролиты распадаются на положительно и отрицательно заряженные ионы (подвергаются электролитической диссоциации).
2. Под действием электрического тока катионы (+) двигаются к катоду (-), а анионы (-) – к аноду (+).
4. Степень электролитической диссоциации (a) зависит от природы электролита и растворителя, температуры и концентрации. Она показывает отношение числа молекул, распавшихся на ионы (n) к общему числу молекул, введенных в раствор (N).
6.Электролиты и неэлектролиты:
Электролитическая диссоциация веществ, идущая с образованием свободных ионов, объясняет электрическую проводимость растворов.
Процесс электролитической диссоциации принято записывать в виде схемы, не раскрывая его механизма и опуская растворитель (H2O), хотя он является основным участником.
Из электронейтральности молекул вытекает, что суммарный заряд катионов и анионов должен быть равен нулю.
Электролиты— это вещества, растворы которых проводят электрический ток.
Электролиты при растворении в воде распадаются на ионы. (положительные- катионы, отрицательные- анионы), которые могут взаимодействовать друг с другом, но вновь образовывать молекулы, поэтому этот процесс обратимый.
Сильные электролиты:Это вещества, которые при растворении в воде практически полностью распадаются на ионы. Как правило, к сильным электролитам относятся вещества с ионными или сильно полярными связями: все хорошо растворимые соли, сильные кислоты (HCl, HBr, HI, HClO4, H2SO4,HNO3) и сильные основания (LiOH, NaOH, KOH, RbOH, CsOH,Ba(OH)2,Sr(OH)2,Ca(OH)2).
В растворе сильного электролита растворённое вещество находится в основном в виде ионов (катионов и анионов); недиссоциированные молекулы практически отсутствуют.
Слабые электролиты:Вещества, частично диссоциирующие на ионы. Растворы слабых электролитов наряду с ионами содержат недиссоциированные молекулы. Слабые электролиты не могут дать большой концентрации ионов в растворе.
К слабым электролитам относятся:
1) почти все органические кислоты (CH3COOH, C2H5COOH и др.);
2) некоторые неорганические кислоты (H2CO3, H2S и др.);
3) почти все малорастворимые в воде соли, основания и гидроксид аммония (Ca3(PO4)2; Cu(OH)2; Al(OH)3; NH4OH);
Неэлектролиты: Вещества, водные растворы и расплавы которых не проводят электрический ток. Они содержат ковалентные неполярные или малополярные связи, которые не распадаются на ионы. Электрический ток не проводят газы, твердые вещества (неметаллы), органические соединения (сахароза, бензин, спирт).
Степень диссоциации.
7.Химические свойства воды:
Под действием электрического тока вода разлагается на водород и кислород:
Вода реагирует с щелочными металлами с выделением водорода:
2Na + 2H2O = H2 + 2NaOH (бурно)
2K + 2H2O = H2 + 2KOH (бурно)
Реакция гидратации:
Контроль знаний:
1. Виды растворов. Истинные растворы. Классификация веществ по их растворимости в воде.
3.Факторы, от которых зависит растворимость веществ в воде.
4.Значение водных растворов для организма человека.
5.Дать характеристику механизма электролитической диссоциации.
6.Дать определение: электролиты и неэлектролиты. Степень электролитической диссоциации.
Литература:
1.Габриелян О.С. Химия. 11 класс. Базовый уровень: учеб. для общеобразоват. учреждений. – М., 2010,
2. Габриелян О.С. Химия: учеб. для студ. сред. проф. учеб. заведений.- 2-е издание / О.С. Габриелян, И.Г. Остроумов. – М., 2013.
3. http://ru.wikipedia.org— энциклопедия

Тема: Гидролиз органических и неорганических соединений. Необратимый гидролиз. Обратимый гидролиз солей. Практическое значение гидролиза для получения гидролизного спирта и мыла. Биологическая роль гидролиза в пластическом и энергетическом обмене веществ и энергии в клетке.
Окислительно-восстановительные реакции.Степень окисления. Понятие об окислительно-восстановительных реакциях. Окисление и восстановление, окислитель и восстановитель.
Электролиз. Электролиз как окислительно-восстановительный процесс. Электролиз расплавов и растворов на примере хлорида натрия. Практическое применение электролиза. Электролитическое получение алюминия.
Основные понятия и термины по теме:гидролиз и его виды, электролиз, окислительно-восстановительные реакции, степень окисления, окислитель, восстановитель.
План изучения темы:
(перечень вопросов, обязательных к изучению):
1.Понятие гидролиза и его виды.
2.Практического значение гидролиза.
3.Окислительно-восстановительные реакции. Степень окисления.
4.Электролиз как окислительно-восстановительный процесс. Практическое применение электролиза.
Содержание:
Гидролизом называют разложение вещества с водой, что приводит к образованию слабого электролита. Эта реакция является обратной к реакции нейтрализации.
Гидролизу подвергаются как неорганические, так и органические вещества в результате обменной реакции между молекулами воды и вещества. Реакции гидролиза могут протекать как обратимо, так и необратимо. Гидролиз имеет большое практическое значение и основан на теории, а именно теории протекания химических явлений, теории растворов.
Электролиты– вещества, проводящие электрический ток в растворенном или расплавленном состоянии. К электролитам относятся вещества, имеющие ионную связь: соли, основания, полярные молекулы кислот.
Процесс гидролиза протекает до тех пор, пока не установится равновесие между ионами соли, водой и продуктами гидролиза.
Чтобы точно определить продукты гидролиза, мы должны знать силу кислот и оснований.
В зависимости от своего состава соли по-разному реагируют с водой, поэтому можно выделить 4 типа гидролиза солей.
Процесс гидролиза количественно характеризуется степенью гидролиза (h) и константой гидролиза (Кг). Степенью гидролиза называется отношение числа молекул, подвергшихся гидролизу (Сгидр.), к общему числу растворенных молекул (Собщ.):

3. температуры раствора.
Гидролизу подвергаются только те соли, которые образуют при диссоциации ион от слабого электролита. Соли, образованные сильными основаниями и сильными кислотами гидролизу, не подвергаются.
Разбавление раствора равноценно увеличению концентрации одного из реагирующих веществ (воды) и приводит к усилению гидролиза. Усилению гидролиза способствует: увеличение концентрации исходных веществ, продуктов, добавление спирта, кислоты.
Гидролиз концентрированных растворов происходит слабее. Процесс гидролиза эндотермичен, поэтому с повышением температуры протекает полнее. Следовательно, при гидролизе соблюдается принцип Ле-Шателье.
Роль гидролиза в природе и жизни человека:
в процессах формирования и преобразования земной коры; в создании среды для развития жизни в мировом океане; в народном хозяйстве для производства продуктов из непищевого сырья; в повседневной жизни человека, гидролиз спирта и мыла (стирка, борьба с жесткостью воды, процессы пищеварения), в организме человека: биологическая роль гидролиза в пластическом и энергетическом обмене веществ и энергии в клетке.