дефект т супрессоров что это
Причины повышения и понижения Т-лимфоцитов-хелперов (CD4)
Весь контент iLive проверяется медицинскими экспертами, чтобы обеспечить максимально возможную точность и соответствие фактам.
У нас есть строгие правила по выбору источников информации и мы ссылаемся только на авторитетные сайты, академические исследовательские институты и, по возможности, доказанные медицинские исследования. Обратите внимание, что цифры в скобках ([1], [2] и т. д.) являются интерактивными ссылками на такие исследования.
Если вы считаете, что какой-либо из наших материалов является неточным, устаревшим или иным образом сомнительным, выберите его и нажмите Ctrl + Enter.
Повышение соотношения CD4/CD8 (до 3) нередко отмечают в острой фазе различных воспалительных заболеваний, за счёт повышения количества Т-хелперов и снижения Т-супрессоров. В середине воспалительного заболевания отмечают медленное снижение содержания Т-хелперов и повышение Т-супрессоров. При стихании воспалительного процесса эти показатели и их соотношения нормализуются. Повышение соотношения CD4/CD8 характерно практически для всех аутоиммунных заболеваний: гемолитической анемии, иммунной тромбоцитопении, тиреоидита Хашимото, пернициозной анемии, синдрома Гудпасчера, системной красной волчинки, ревматоидного артрита. Увеличение соотношения CD4/CD8 за счёт снижения количества CD8-лимфоцитов при перечисленных заболеваниях выявляют обычно при обострении и высокой активности процесса. Снижение соотношения CD4/CD8 из-за увеличения количества CD8-лимфоцитов характерно для ряда опухолей, в частности саркомы Капоши.
Заболевания и состояния, приводящие к изменению количества CD4 в крови
Дефект т супрессоров что это
Исследование включает в себя определение абсолютных и относительных значений субпопуляционного состава Т-лимфоцитов (CD3, CD4, CD8, CD45), количества Т-регуляторных лимфоцитов ( T-reg. Cells) соотношения Т – хелперы/Т – цитотоксические клетки и Т-клеток, несущих на своей поверхности маркеры активации CD38, HLA-DR. Рекомендуется к назначению для контроля показателей клеточного звена иммунной системы в динамике после комплексного иммунологического обследования.
Иммунофенотипирование, клеточный иммунитет, многоцветный клеточный анализ методом проточной цитометрии, Т-клетки, Т-хелперы, Т-цитотоксические клетки, Т-регуляторных лимфоциты.
Human Immune System, Immunophenotyping, Multicolor Flow Cytometry Cell Analysis, Human Leukocyte Differentiation Antigens, Human T cells, T helper cells, Cytotoxic T cells, T-reg Cells, Activation markers.
Метод исследования
Какой биоматериал можно использовать для исследования?
Общая информация об исследовании
В основе проточной цитофлуориметрии лежит проведение фотометрических и флюоресцентных измерений отдельных клеток, пересекающих одна за другой вместе с потоком жидкости луч монохроматического света, обычно света лазера.
СD3
Этот маркер позволяет идентифицировать зрелые покоящиеся (интактные) Т-клетки и подсчитать общее количество Т-лимфоцитов. Количественная оценка субпопуляции CD3+ лимфоцитов имеет диагностическую значимость в следующих случаях:
— первичные и вторичные иммунодефициты;
— острые вирусные инфекции, включая ВИЧ;
— внутриклеточные бактериальные и паразитарные инфекционные заболевания (например, туберкулез, лепра, лейшманиоз);
— реакции отторжения трансплантатов и болезни «трансплантат против хозяина»;
— лимфопролиферативные расстройства (острый Т-лимфобластный лейкоз).
При сахарном диабете довольно часто наблюдается снижение у больных процентного содержания и абсолютного числа СD3+ лимфоцитов.
СD4
Определение количества CD4+ клеток имеет значение в диагностике состояний, связанных с дефектами антителопродукции и реакций клеточноопосредованного иммунитета. Показателю числа CD4+ клеток отводится решающая роль для прогноза течения ВИЧ-инфекции.
Функциональное состояние CD4+ лимфоцитов тестируют по цитокиновому профилю: функциональная полноценность Th1-клеток подтверждается по секреции g-IFN, а Th2-клеток – по секреции IL-4.
СD8
Дифференцировочная молекула CD8 представляет собой гликопротеин, обнаруживаемый на поверхности тимоцитов и Т-лимфоцитов и участвующий в распознавании антигенных пептидов в контексте с молекулами главного комплекса гистосовместимости (MHC) класса I.
Клиническая значимость определения количества СD8+ лимфоцитов:
До недавнего времени приписываемая субпопуляции CD8+ клеток супрессорная активность сейчас практически полностью отвергается. По данным большинства экспериментальных и клинических исследований считается, что существование какой-либо отдельной популяции Т-супрессорных клеток, даже без привязки к CD8-маркеру, маловероятно.
При аутоиммунных тиреоидитах, в частности при диффузном токсическом зобе (ДТЗ), в реакциях клеточного иммунитета отмечается снижение субпопуляции CD8+ лимфоцитов и снижение функциональной активности цитотоксических лимфоцитов.
При сахарном диабете также отмечается уменьшение функциональной активности и количества CD8+ лимфоцитов.
Снижение фракции СD8+ лимфоцитов наблюдается также у больных с первичной хронической недостаточностью коры надпочечников (болезнь Аддисона).
Анти-HLA—DR
Молекула HLA-DR также является маркером активации и принадлежит к МНС II класса. Она представляет собой трансмембранный гликопротеин, состоящий из a- и b-субъединиц, имеющих молекулярный вес 36 и 27 кД. Анти-HLA-DR реагирует только с эпитопом HLA-DR и не имеет перекрестных реакций с молекулами HLA-DQ и HLA-DP. Он экспрессируется на В-лимфоцитах, моноцитах, макрофагах, активированных Т-лимфоцитах.
Имеются данные о том, что молекула HLA-DR экспрессируется примерно на 10 % Т-лимфоцитах ПК, однако при активации клеток митогеном количество и плотность ее экспрессии резко возрастает. Существует предположение, что молекула HLA-DR на Т-клетках может выступать в качестве рецептора, участвующего в трансдукции сигнала активированными Т-лимфоцитами. Это наводит на мысль о ее возможной роли в качестве «профессиональной» АПК, участвующей в поддержании иммунной памяти.
HLA-DR также может присутствовать на клетках эпителия тимуса, на клетках В-лимфоцит-зависимых полей селезенки и лимфатических узлов, В-клеточной лимфомы. Этот антиген имеет коэкспрессию с CD1а антигеном на клетках Лангерганса.
CD25
Антиген CD25 известен как низкоаффинный рецептор ИЛ2, имеющий молекулярную массу 55 кД.
Молекула CD25, ассоциированная с b-цепью (CD122) и общей g-цепью (CD132), формирует высокоаффинный комплекс рецептора ИЛ-2. В процессе воспаления может вырабатываться растворимая форма ИЛ-2R. Маркер CD25 присутствует на субпопуляцях Т- и В-лимфоцитов периферической крови, в том числе на активированных макрофагах, НK. Его экспрессия резко возрастает при активации ФГА и КонА на поверхности CD3-активированных Т-лимфоцитов, на Т-клетках из смешанной культуры лимфоцитов, на инфицированных HTLV Т-лимфоцитах лейкемической линии при Т-лимфоцитарной лейкемии.
Метод позволяет определить количественное соотношение основных популяций Т-лимфоцитов:
малые клеточные популяции, а также изучить их функциональную активность:
Когда назначается исследование?
Являясь реальными супрессорами, Т-регуляторные клетки играют ведущую роль во многих иммунологических процессах: регулируют Т-клеточный гомеостаз, предотвращают аутоиммунные заболевания, аллергии, гиперчувствительность, реакцию «трансплантат против хозяина». Вместе с тем регуляторные Т-клетки снижают противоопухолевый иммунитет и иммунитет к инфекциям.
Особый интерес представляют исследования, связанные с изучением соотношения аутоактивных клонов В-клеток и регуляторных Т-клеток при различной патологии воспалительного генеза. Так, при осложненном течении ряда патологических воспалительных процессов сохранение высокого уровня Т-reg и В1- клеток к 30-м суткам характеризует сохранение напряженности воспалительного процесса и, возможно, начало формирования дефекта функционирования Т-reg клеток, которое впоследствии может привести к хронизации воспаления и к развитию аутоиммунного процесса.
Таким образом, наличие и количественные характеристики этой популяции служат важным диагностическим признаком.
Рекомендовано для комплексного обследования пациентов, входящих в группу риска по четырем основным иммунопатологическим синдромам.
С инфекционным синдромом:
С аллергическим (атопическим) синдромом:
С аутоиммунным синдромом:
С иммунопролиферативным синдромом:
Что означают результаты?
Изменения различных клеточных популяций лимфоцитов в сторону повышения или понижения развиваются при различных патологических процессах в организме, таких как инфекции, аутоиммунные и онкологические заболевания, иммунодефициты, в постоперационном периоде, при трансплантации органов.
Ниже представлена таблица с клиническими ситуациями, которые могут приводить к изменениям в субпопуляционном составе лимфоцитов.
Субпопуляция лимфоцитов
Повышение показателя
Снижение показателя
• Острые и хронические инфекции;
• длительный прием лекарственных препаратов (особенно монотерапия);
• прием биологически активных добавок;
• интенсивные занятия спортом;
• Некоторые виды инфекций;
• алкогольный цирроз печени;
• прием иммуносупрессивных препаратов.
Т-хелперы (CD3 + CD4 + CD45 + )
• Ряд аутоиммунных заболеваний;
• отдельные Т-клеточные лейкозы;
• отравление солями бериллия.
• Иммунодефицитные состояния (основной лабораторный признак вторичного иммунодефицита);
• алкогольная болезнь печени;
• прием иммуносупрессивных препаратов или стероидов.
Т-цитотоксические лимфоциты (CD3 + CD8 + CD45 + )
• Некоторые вирусные инфекции;
• ряд Т-клеточных лейкозов;
• острая фаза аллергии;
• ряд аутоиммунных патологий.
• Некоторые виды аутоиммунных, аллергических заболеваний;
T-reg. (регуляторные Т-клетки (CD4+CD25brightCD45+)
(сахарный диабет 1-го типа, рассеянный склероз, ревматоидный артрит, аутоиммунный тиреоидит, неспецифический язвенный колит, болезнь Крона, миастения);
• аллергические заболевания (бронхиальная астма, атопический дерматит, пищевая аллергия).
Активированные Т-лимфоциты (CD3+HLA-DR+CD45+)
• алкогольный цирроз печени;
Не имеют диагностического значения.
В совокупности с клиническими данными, симптоматикой, другими методами лабораторных исследований вышеуказанные изменения являются диагностическим признаком возникновения этих патологических процессов в организме человека.
Дефект т супрессоров что это
Какие же характерные особенности свойственны супрессорным клеткам и что отличает их от других субпопуляций Т-лимфоцитов? Известно, что Т-супрессоры несут на своей поверхности Ly2, 3-антиген в отличие от клеток-помощников, несущих Lyl-антиген. Предполагается наличие на поверхности Т-клеток Fc-рецепторов (Playfair, 1974), а также рецепторов к гистамину (Shearer е. а., 1974).
Отмечается устойчивость супрессорных клеток к кортикостероидам (Gershon е. а., 1972; Rotter, Trainin, 1974; Wu, Lance, 1974), хотя имеются данные об ингибирующей активности и кортизончувствительных тимоцитов (Lawrence, Weigle, 1976). Супрессорные Т-лимфоциты чувствительны к ионизирующей радиации. Состояние толерантности, выработанное введением массивных доз эритроцитов барана у крыс, снимается трансплантацией лимфоцитов нормальных доноров при условии, что толерантные реципиенты были предварительно облучены (McGregor е. а., 1967).
Супрессорные Т-клетки локализуются преимущественно в селезенке. Об этом свидетельствуют опыты с введением облученным реципиентам тимоцитов, меченных мСr, и последующей спленэктомией (Wu, Lance, 1974). Введенные тимоциты выявляются в основном в селезенке. Удаление такой селезенки увеличивает иммунный ответ, а добавление приготовленной из нее клеточной суспензии к нормальным селезеночным клеткам приводит к подавлению ответа.
Предполагается, что супрессорными свойствами обладают тимоциты, мигрирующие в селезенку, где создается микроокружение, необходимое для проявления их ингибирующей активности. Однако известны данные о выявлении Т-супрессоров в лимфатических узлах (Feldbuch, 1976) и среди лимфоцитов периферической крови (Shou е. а., 1976), что.возможно, связано с перемещением этих клеток в процессе миграции.
В настоящее время установлено, что среди периферических тимусзависимых лимфоцитов имеется по крайней мере две субпопуляции, различающиеся по локализации в лимфоидных органах и по другим изученным свойствам (Dyminski, Smith, 1974; Арцимович, Настоящая, 1976; Брондз, 1977). Одна из них, T1-популяция, образована сравнительно короткоживущими нерециркулирующими Т-лимфоцитами, локализованными главным образом в селезенке.
К Т2-популяции относятся долгоживущие рециркулирующие лимфоциты, которые обнаруживаются преимущественно в лимфатических узлах и в периферической крови. По-видимому, это зрелые Т-клетки, наиболее чувствительные к обработке антилимфоцитарной сывороткой in vivo и имеющие на своей поверхности относительно низкую плотность антигена.
Учитывая, что популяция Т-клеток-супрессоров крайне чувствительна к обработке антилимфоцитарной сывороткой (Baker е. а., 1970; Barthold е. a., 1974b; Naor е. а., 1975), является, по-видимому, кортизонрезистент-ной (Gershon е. а., 1972; Rotter, Trainin, 1974) и имеет на клеточной поверхности низкую плотность 6-антигена (Gorczynski, 1974; Thomas e. a., 1975), ее следует отнести к популяции Т2-лимфоцитов.
Однако данные о преимущественной локализации супрессорных Т-клеток в селезенке (Wu, Lance, 1974; Kontiainen, Feldmann, 1976), а также факт частичной потери способности Т-клеток развивать супрессорную активность при тимэктомии взрослых животных (Burns е. а., 1975) говорят о возможном участии Т1-лимфоцитов в индукции Т-супрессии.
Дефект т супрессоров что это
Т супрессоры.
Чужеродные Аг в неиммуногенной форме (гаптены) или иммуногенные Аг в очень высокой концентрации также способны индуцировать специфическую супрессорную активность клеток. После распознавания Аг зрелые лимфоциты препятствуют развитию иммунного ответа, действуя непосредственно на клетки или секретируя супрессорные факторы.
Цитотоксические Т-лимфоциты ( ЦТЛ ). Т-киллеры. Цитотоксический эффект Т-киллеров.
Цитотоксические Т-лимфоциты (ЦТЛ), или Т-киллеры [от англ. to kill, убивать] лизируют клетки-мишени, несущие чужеродные или видоизменённые аутоантигены (например, клетки опухолей, трансплантатов, инфицированные вирусами, клетки, несущие поверхностные вирусные Аг). В большинстве случаев функция ЦТЛ также МНС-рестригирована — цитотоксические Т-лимфоциты распознаёт чужеродный вирусный, опухолевый или трансплантационный Аг в комплексе с молекулой МНС I на мембране клетки-мишени. Индукция цитотоксических свойств клетки-предшественницы Т-киллера происходит под действием двух сигналов.
Первый сигнал включает взаимодействие между двумя комплексами: поверхностной молекулой CD8 лимфоцита и комплексом эпитоп-молекула МНС I на клетке-мишени. Второй сигнал — ИЛ, секретируемые близлежащими макрофагами и Т-клетками. Т-хелпер играет ключевую роль в стимуляции цитотоксических Т-лимфоцитов в качестве источника необходимых цитокинов, усиливающих их пролиферацию и созревание до функционально активных ЦТЛ.
Цитотоксический эффект Т-киллеров реализуется через образование в клетках-мишенях пор под действием особых белков — перфоринов. Нарушение осмотического баланса с внеклеточной средой приводит к гибели клетки.
Т-клетки памяти
Т-клетки памяти образуются при первичном иммунном ответе. Специфически распознают Аг и участвуют в иммунном ответе при вторичном попадании Аг. Большинство клеток памяти обладает функциями Т-клеток, экспрессируют CD4 и рестригированы по молекулам МНС II, то есть узнают Аг только на Аг-представляющих клетках в связи с молекулой МНС II.
Долгое время одной из труднодостижимых целей иммунотерапии было достижение истощения функциональных возможностей Т-супрессоров при сохранении должной активности органоспецифичных эффекторных Т-клеток. Новое исследование, в котором описана разработка антител к цитокиновому рецептору CD25, модифицированных для того, чтобы истощить пул Т-супрессоров без блокады связывания цитокина ИЛ-2, оживляет интерес к этому терапевтическому направлению.
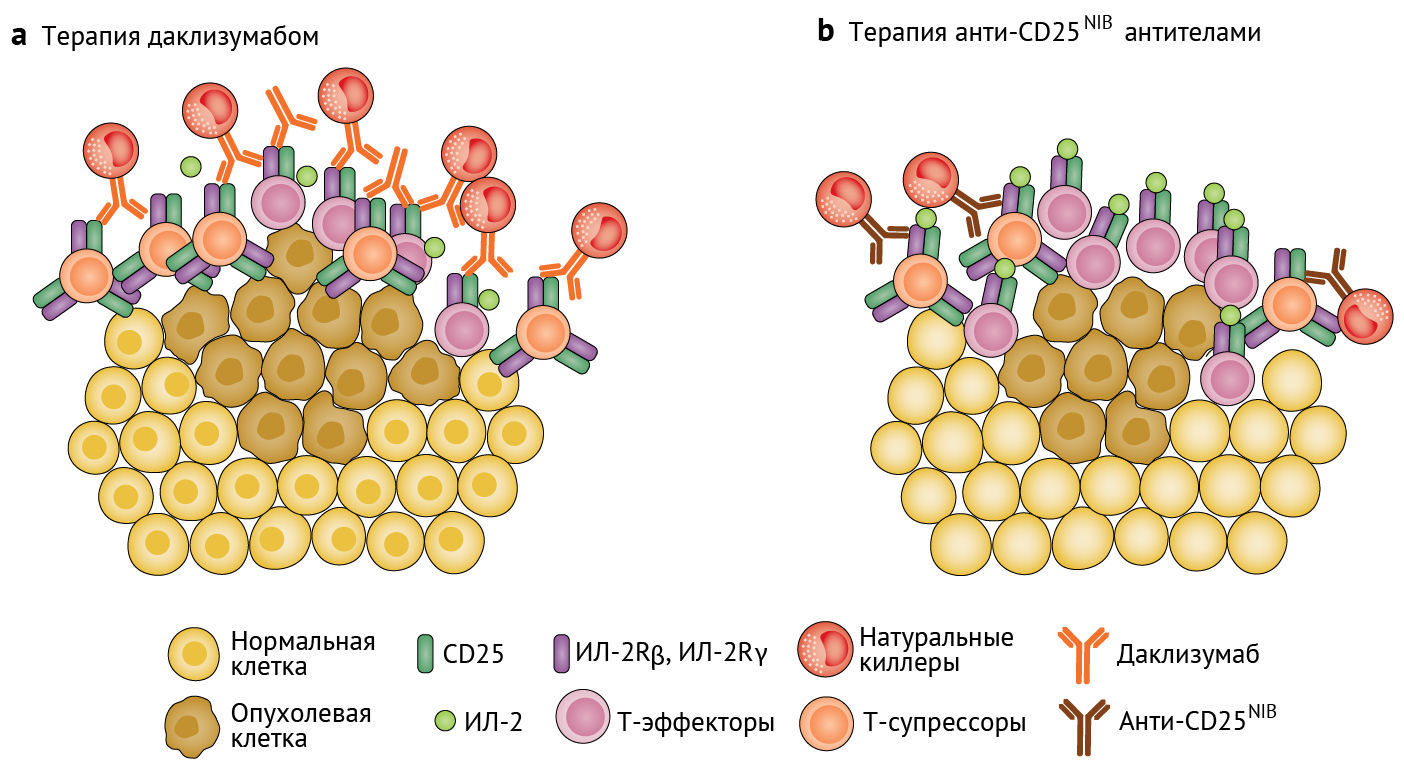
Регуляторные Т-клетки (Т-супрессоры), представляющие собой CD4+ Т-клетки с высокой экспрессией α-цепи цитокинового рецептора ИЛ-2 CD25 [1], сдерживают распространение воспаления для предотвращения аутоиммунного ответа, а также могут подавлять жизненно важные провоспалительные реакции. Однократная инъекция PC61 [моноклональное микроантитело к мышиному CD25, полученное из мышиных IgG1 — прим. перев.] мышам с опухолями приводит к истощению периферических CD25+ клеток и усиливает киллинг опухолевых клеток. Это подтверждает роль проонкогенного воздействия Т-супрессоров при раке [2, 3]. После этого открытия высокое соотношение T-супрессоров и эффекторных T-клеток (T-эффекторов) в опухолевом микроокружении (ОМО) стало расцениваться как признак плохого онкологического прогноза [4]. Следовательно, предполагается, что истощение пула T-супрессоров в ОМО человека сдвигает иммунологический баланс в провоспалительную сторону и состояние антиопухолевой защиты. К сожалению, не существует уникального поверхностного мембранного маркера, который помогал бы отличать Т-супрессоры от Т-эффекторов и, как следствие, позволял бы избирательно истощать пул клеток T-супрессоров. Однако CD25 постоянно экспрессируется в высокой степени в Т-супрессорах, но только время от времени и в более низких значениях — в T-эффекторах, что может предоставить терапевтическое окно для таргетного воздействия антител на эти молекулы, что позволит устранять Т-супрессоры, а не Т-эффекторы, внутри опухолевой ткани. В этом выпуске «Nature Cancer» Quezada с соавт. описывают антитела, которые связывают CD25, но не блокируют провоспалительную сигнализацию посредством IL-2, что улучшает функцию Т-эффекторов в контексте истощения Т-супрессоров [5].
В первых клинических испытаниях, посвященных таргетному воздействию на CD25 для достижения избирательного истощения T-супрессоров, использовались гуманизированные моноклональные антитела к CD25 (препарат даклизумаб, ранее одобренный Управлением по санитарному надзору за качеством пищевых продуктов и медикаментов США; первоначально был разработан для ослабления иммунного ответа, вызванного реакцией отторжения аллотрансплантата) [6, 7]. Хотя кажется удивительным, что лекарство, изначально разработанное для блокирования Т-эффекторов, могло быть модифицировано для прицельного воздействия преимущественно на T-супрессоры и сохранения функционала Т-эффекторов, но благодаря механизму, лежащему в основе функционирования даклизумаба, эта концепция правдоподобна. В то время как функция Т-эффекторов усиливается за счет сигнализации с помощью IL-2, Т-супрессорам этот сигнал жизненно необходим для поддержания своего супрессивного фенотипа [8]. Поскольку механизм действия даклизумаба связан с блокадой связывания IL-2 с его рецептором, было высказано предположение, что T-супрессоры, которых больше в ОМО и которые характеризуются более высокой экспрессией CD25, испытают заметно более выраженное воздействие, чем Т-эффекторы при приеме этого лекарства. Действительно, в ходе клинических испытаний было выявлено значимое, но не полное истощение пула Т-супрессоров и усиление реакции на противораковую вакцину при своевременном введении даклизумаба, но, увы, эффекта на размеры или прогрессирование опухоли это не возымело, вследствие чего дальнейшее развитие этой концепции было приостановлено [7].
Quezada с соавт. использовали «целостный» подход для переосмысления возможностей терапии антителами к CD25 (анти-CD25-антитела), возвращая надежду на то, что эта стратегия все еще может быть использована в иммунотерапии [5]. В своей предыдущей работе эта группа исследователей обнаружила, что вариант PC61 с замененным Fc-фрагментом способствовал антителозависимой клеточной цитотоксичности T-супрессоров в ОМО и синергично действовал вместе с иммунотерапией, направленной против рецептора PD-1 (мембранный рецептор, ингибирующий иммунный ответ), для отторжения сформировавшихся опухолей мыши [9]. Основное внимание здесь уделено вариабельному домену антитела; авторами впервые было продемонстрировано, что PC61 одинаково блокирует интерлейкиновую [ИЛ-2] сигнализацию в инфильтрирующих опухоль T-эффекторах и T-супрессорах, что приводит к безудержному росту опухоли на моделях мышей. Напротив, введение этим мышам анти-CD25-антител, не блокирующих ИЛ-2-путь сигнализации (в качестве монотерапии) с замененным Fc-фрагментом (анти-CD25NIB-антитела) значительно предотвращало опухолевый рост, обеспечивая истощение T-супрессоров при сохранении экспрессии цитолитического гранзима B Т-эффекторами. Эти результаты предполагают, что блокада ИЛ-2-сигнализации Т-эффекторам, расположенным внутри опухоли, может объяснять отсутствие эффекта, наблюдаемого при применении даклизумаба (см. рис. 1).
Хотя усиление иммунологически «горячих» опухолей, обладающих устойчивой инфильтрацией иммунокомпетентными клетками, с помощью иммунотерапии было результативным, лечение «холодных» опухолей, лишенных резидентного иммунного ответа, оставалось особой проблемой и иногда требовало применения нескольких лекарственных средств. Комбинированная терапия блокады иммунологической контрольной точки антителами к иммуномодулирующему рецептору CTLA-4 вместе с вакциной из облученных опухолевых клеток, секретирующих цитокин GM-CSF (GVAX), предотвращала опухолевый рост в модели «холодной» меланомы B16, тогда как монотерапия эффекта не давала [10]. Сходным образом Quezada с соавт. показывают, что анти-CD25NIB-антитела вместе GVAX вызывают регрессию опухолей B16 и повышают выживаемость [5]. Метод мультипараметрической проточной цитометрии лимфоцитов, инфильтрирующих опухоль (ЛИО), после комбинированной терапии показывает истощение T-супрессоров и активацию CD25hi CD4+ T-клеток, в то время как CD25lo CD8+ T-эффекторы, которые важны для киллинга опухолевых клеток, сохраняются. Хотя это важное открытие, необходимо выяснить, оказывает ли в этой модели эффект комбинация PC61 с GVAX. Это важно для уточнения того, в блокаде ли ИЛ-2-сигнализации заключается разница в терапевтическом воздействии PC61 и анти-CD25NIB-антител. Кроме того, было показано, что блокирование CD25 даклизумабом ведет к функциональной перестройке нестабильных CD45RA-Т-супрессоров (но не CD45RA+ T-супрессоров) в клетки с более выраженным провоспалительным фенотипом [7]. Однако пока не ясно, оказывают ли анти-CD25NIB-антитела аналогичный механистический эффект, так как CD4RA не проверялись в эксперименте (не включались в проточную панель цитометрии). Исследования, посвященные транскриптомике ЛИО в отдельно взятой клетке, могли бы решить эту проблему, а также теоретически идентифицировать гены, которые придают большую устойчивость и сохранение функционала ЛИО при воздействии анти-CD25NIB-антител. Это может служить вектором развития будущих разработок препаратов и биомаркеров для диагностики.
Чтобы адаптировать свои выводы к потенциальному клиническому исследованию, Quezada с соавт. провели скрининг среди антител по признаку их способности связывать человеческий CD25 и индуцировать антителозависимую клеточную цитотоксичность без нарушения ИЛ-2-сигнализации. В ходе этого «отбора кандидатов» было выявлено соединение, которое имело сродство к CD25, сходное с даклизумабом, и сохранявшее ИЛ-2-сигнализацию, взаимодействуя с ИЛ-2 в ином участке связывания. Человеческие анти-CD25NIB-антитела истощают пул T-супрессоров (но не CD8+ Т-клеток) в опухолях легких и колоректальной зоне человека. Аналогичные эффекты наблюдались у мышей, которым были привиты гетеротопные трансплантаты опухолей поджелудочной железы человека.
К сожалению, природа терапевтических эффектов моноклональных антител подразумевает не локальное, а глобальное воздействие. Поскольку врожденная нехватка T-супрессоров приводит к безудержной лимфопролиферации и иммунопатологиям, истощение их пула у взрослого может увеличить риск аутоиммунных реакций. Фактически, даклизумаб уменьшает системное содержание T-супрессоров у пациентов, а токсические эффекты, связанные с воздействием этого препарата и другими способами провоспалительной иммунотерапии, включают воспалительные процессы дерматологической локализации, желудочно-кишечного тракта, легочной ткани, артрит и в редких случаях диабет первого типа. Мышиные модели не могут служить полноценным отражением размера организма, степени патогенной нагрузки или характеристик биологии T-супрессоров у человека. Кроме того, каждое антитело, применяемое с терапевтической целью, обладает собственной аффинностью, иммуногенностью и способностью связываться не только со своей мишенью. Все это не всегда можно смоделировать в аналогичной молекуле лекарственного средства. Таким образом, масштабные исследования иммунотерапии на животных представляют собой важный пункт на пути к клиническим испытаниям на людях. Наряду с выявлением потенциально серьезных побочных эффектов, вызванных иммунотерапией, с помощью исследований на животных в перспективе можно сформировать критерии противопоказаний для испытаний на людях и обеспечить высокую осведомленность среди возможных участников испытаний о потенциально переносимых побочных эффектах. Таким образом, Quezada и его коллеги лечат здоровых яванских макак с помощью анти-CD25NIB-антител, истощающих периферический пул T-супрессоров обезьян без большой токсичности для животных [5]. Хотя авторами и отмечено некоторое воспаление на поверхности слизистой оболочки, соответствующее нарушенному балансу между иммунной системой и комменсальной микробиотой, этот эффект проявлялся только при дозах, превышающих физиологические, и оказывался обратимым. Данные свидетельства открывают путь к испытаниям на людях. Однако оптимизм в отношении этого метода иммунотерапии должен быть осторожным: введение человеку в ходе клинических испытаний незначительного количества суперагонистических антител к корецептору CD28, также хорошо переносимых у негоминидных приматов, приводило к серьезным токсическим эффектам [11].
Чтобы улучшить доставку препарата к месту воздействия, будущие разработки могут включать анти-CD25NIB, посылаемые Т-клетками, генетически запрограммированными на экспрессию антиген-специфических Т-клеточных рецепторов и химерных антигенных рецепторов (ХАР). T-супрессоры внутри опухолевой ткани представляют препятствие для воздействия на солидную опухоль [12]. Так как «вооруженные» ХАР Т-клетки изначально разрабатывались для обнаружения или выделения связывающих частей PD-1, чтобы ограничить иммуностимулирующее воздействие [13], эта же технология может быть адаптирована и для анти-CD25NIB. Генная инженерия молекулярных циклов может дополнительно ограничить секрецию антител на клетки, нацеленные на T-супрессоры, что будет способствовать локальному воздействию препарата.
Впечатляющие эффекты анти-CD25NIB на противоопухолевый иммунитет, о которых сообщается в данной работе, вызовут новый интерес к методу элиминации T-супрессоров в ОМО. Клинические испытания даклизумаба, проведенные ранее, могут быть пересмотрены. Теперь можно применить сочетание вакцины, разработанной на основе дендритных клеток, и антител, не блокирующих ИЛ-2-сигнализацию (описанные выше). Эта комбинация может стимулировать развитие опухолевых антиген-специфичных ЛИО, не способствующих патологическому воздействию Т-супрессоров на аутоиммунитет. Обнаружение терапевтического окна станет способом уравновесить местное истощение T-супрессоров для обеспечения противоопухолевого ответа, а также поддержания системной толерантности к препарату и гомеостазу иммунной системы. Более того, необходимо соблюдать осторожность при определении правильной дозировки, так как если будут достигнуты уровни насыщения антителами, воздействие T-эффекторов также может быть устранено, что нивелирует преимущество описываемого метода перед даклизумабом. Как и в случаях со всеми лекарственными препаратами, только тщательные, хорошо контролируемые и спланированные клинические испытания на людях окончательно определят, могут ли анти-CD25NIB-антитела претендовать на место эффективного метода иммунотерапии. Тем не менее, открытия Quezada с соавт. поднимут интерес к возможностям этой иммуномодуляционной стратегии для ряда опухолей.