депонирует молекулярный кислород что
Миоглобин скелетных мышц
Дано определение миоглобина и описаны его структура и функции. Приведены данные о концентрации миоглобина в скелетных мышцах человека и животных, а также в плазме крови человека. Приведен сравнительный анализ гемоглобина и миоглобина.
Миоглобин скелетных мышц
Определение
Структура миоглобина
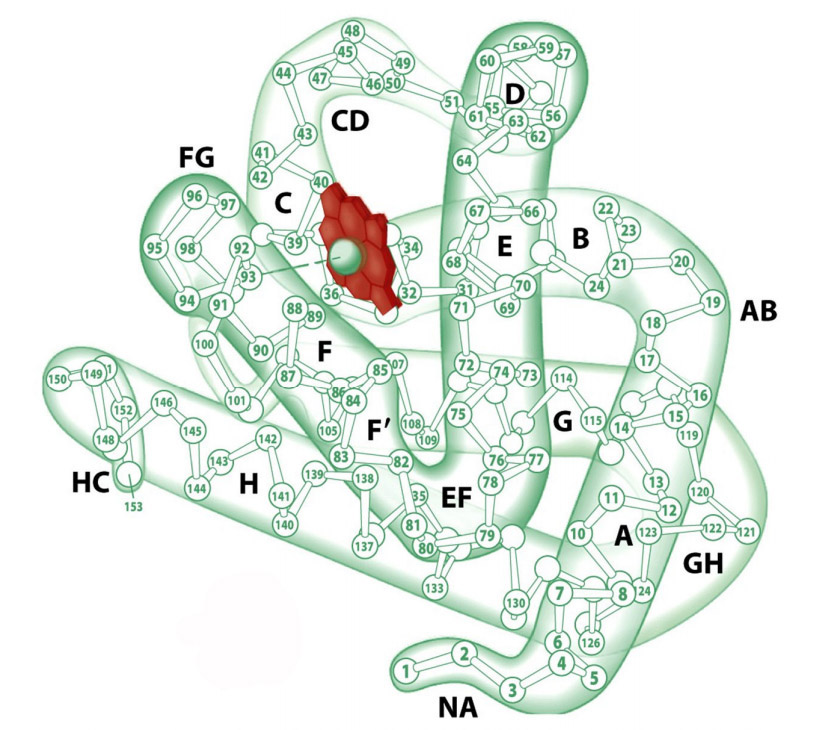
Первичная структура миоглобина представлена одной полипептидной цепью, состоящей из 146-154 аминокислотных остатков. Вторичная структура — α-спираль. Третичная структура миоглобина представлена свернутой в шар α-спиралью (глобулой) и небелковой частью – гемом (рис.1). Присутствие гема придает миоглобину красный цвет. В геме имеется железо, которое связывает кислород. В 1957 году Джон Кендрю посредством рентгеновской кристаллографии впервые определил пространственное расположение полипептидной цепи в молекуле белка миоглобина, а в 1959 году установил его детальное строение, подтвердив наличие в нём α-спиралей, которое еще в 1951 году предсказал Лайнус Полинг.
Рис.1. Структура миоглобина. Красным цветом выделен гем (illustration I. Geis)
Функции миоглобина
В мышечных волокнах миоглобин выполняет следующие функции:
Концентрация миоглобина в мышечных волокнах
В мышечных волокнах скелетных мышц человека концентрация миоглобина составляет 0,4-0,5 мM (0,25 мг на 1 г ткани). Миоглобин присутствует во всех типах мышечных волокон, однако в разных концентрациях. В мышечных волокнах типа I его концентрация в 1,5 раза выше, чем в мышечных волокнах типа IIB. Именно поэтому мышечные волокна типа I имеют более красную окраску по сравнению с мышечными волокнами типа II. У морских млекопитающих концентрация миоглобина в мышечных волокнах может достигать 3,8 мM. Установлена значительная корреляция между концентрацией миоглобина в мышцах морских животных и глубиной ныряния. Установлено также, что концентрация миоглобина в мышечных волокнах коррелирует с объемной плотностью митохондрий и плотностью кровеносных капилляров.
Концентрация миоглобина в крови
В обычных условиях концентрация миоглобина в крови настолько низка (100 нг/мл), что он не определяется лабораторными методами. Однако при сильных повреждениях мышечных волокон скелетных мышц (краш-синдроме, синдроме позиционной ишемии) миоглобин может попасть в кровь. Так как молекулы миоглобина достаточно крупные, они могут закупоривать канальцы почек и приводить к их некрозу. В результате возникает острая почечная недостаточность и тканевая гипоксия. Это может привести к смерти человека.
При тяжелых силовых и аэробных тренировках (например при марафонском беге), также происходит частичное повреждение мышечных волокон скелетных мышц и миоглобин поступает в кровь.
При остром инфаркте миокарда концентрация миоглобина в крови повышается через 2-4 часа. Поэтому его относят к неспецифическим маркерам этого заболевания (Тереньев А.А., 2016).
Гемоглобин и миоглобин
Миоглобин похож на гемоглобин (Hb) – кислородсвязывающий белок в эритроцитах крови. Гемоглобин осуществляет транспорт кислорода от легких к тканям (в том числе и мышцам), а миоглобин – депонирование и транспорт кислорода внутри мышечных волокон. Структура гемоглобина более сложная, чем миоглобина. Молекула гемоглобина состоит из четырех полипептидных цепочек и гема, а молекула миоглобина – из одной полипепдиной цепочки и гема. Молекулярная масса гемоглобина человека 66,8 кДа. Миоглобин человека обладает большим сродством к кислороду, чем гемоглобин, и способен связывать до 14% от общего количества кислорода в организме.
Молекулярный кислород: строение, свойства, применение
Содержание:
В молекулярный кислород или дикислород, также называемый двухатомным или газообразным кислородом, является наиболее распространенной формой элемента, в которой этот элемент встречается на планете Земля. Его формула O2, следовательно, являясь двухатомной и гомоядерной молекулой, полностью неполярной.
Воздух, которым мы дышим, на 21% состоит из кислорода в виде молекул O.2. По мере подъема концентрация газообразного кислорода уменьшается, а присутствие озона увеличивается, O3. Наше тело пользуется преимуществом O2 насыщать кислородом ваши ткани и осуществлять клеточное дыхание.
Молекулярный кислород необходим для бесчисленных аэробных процессов, применяемых в металлургии, медицине и очистке сточных вод. Этот газ практически является синонимом тепла, дыхания, окисления и, с другой стороны, температуры замерзания, когда он находится в жидком состоянии.
Структура молекулярного кислорода
На верхнем изображении представлена молекулярная структура газообразного кислорода, представленная несколькими моделями. Последние два показывают характеристики ковалентной связи, которая удерживает атомы кислорода вместе: двойная связь O = O, в которой каждый атом кислорода завершает свой октет валентности.
Молекула O2 он линейный, гомоядерный и симметричный. Его двойная связь имеет длину 121 пм. Это короткое расстояние означает, что для разрыва связи O = O требуется значительная энергия (498 кДж / моль), и, следовательно, это относительно стабильная молекула.
Если бы это было не так, кислород в атмосфере со временем полностью разложился бы, или воздух загорелся бы из ниоткуда.
Свойства
Внешность
Молярная масса
32 г / моль (округленное значение)
Температура плавления
Точка кипения
Растворимость
Молекулярный кислород плохо растворяется в воде, но его достаточно для поддержания морской фауны. Если бы ваша растворимость была выше, у вас было бы меньше шансов умереть от утопления. С другой стороны, его растворимость намного выше в неполярных маслах и жидкостях, поскольку он способен медленно их окислять и, таким образом, влиять на их первоначальные свойства.
Энергетические состояния
Электронная конфигурация кислорода следующая:
У него одна пара неспаренных электронов (O :). Когда два атома кислорода встречаются, они соединяются, образуя двойную связь O = O, и оба завершают октет валентности.
Следовательно, молекула O2 он должен быть диамагнитным, со всеми его электронами спаренными. Однако это парамагнитная молекула, и это объясняется диаграммой ее молекулярных орбиталей:
Трансформации
Молекулярный кислород в значительной степени стабилен до тех пор, пока он не контактирует с каким-либо веществом, подверженным окислению, и тем более, если поблизости нет источника сильного тепла, такого как искра. Это потому, что O2 он имеет высокую тенденцию к сжатию, получению электронов от других атомов или молекул.
При уменьшении он может создавать широкий спектр связей и форм. Если он образует ковалентные связи, он будет делать это с атомами, менее электроотрицательными, чем он сам, включая водород, с образованием воды, H-O-H. Он также может вселить углерод, чтобы создавать связи C-O и различные типы кислородсодержащих органических молекул (простые эфиры, кетоны, альдегиды и т. Д.).
О2 также может получать электроны для превращения в анионы пероксида и супероксида, ИЛИ2 2- я2 – соответственно. Когда он превращается в перекись в организме, перекись водорода, H2ИЛИ2, H-O-O-H, вредное соединение, которое перерабатывается под действием определенных ферментов (пероксидазы и каталазы).
Приложения
Сварка и горение
Кислород используется для проведения реакции горения, при которой вещество экзотермически окисляется с образованием огня. Этот огонь и его температура различаются в зависимости от горящего вещества. Таким образом, может быть получено очень горячее пламя, такое как ацетилен (см. Выше), которым свариваются металлы и сплавы.
Если бы не кислород, топливо не могло бы гореть и обеспечивать всю свою калорийную энергию, используемую для запуска ракет или запуска автомобилей.
Окислитель в зеленой химии
Благодаря этому газу синтезируются или производятся в промышленных масштабах множество органических и неорганических оксидов. Эти реакции основаны на окислительной способности молекулярного кислорода, который также является одним из наиболее жизнеспособных реагентов в зеленой химии для получения фармацевтических продуктов.
Вспомогательное дыхание и очистка сточных вод
Кислород жизненно необходим для удовлетворения респираторной потребности пациентов с серьезными заболеваниями, дайверов при спуске на небольшие глубины и альпинистов, на высоте которых концентрация кислорода резко снижается.
Кроме того, кислород «питает» аэробные бактерии, которые помогают расщеплять загрязнения из сточных вод или помогают рыбам дышать в водных культурах для защиты или торговли.
Ссылки
Тоталитарные доктрины: идеология и характеристики
Коммерческие обязательства: источники, условия, примеры
Тканевое дыхание, окислительное фосфорилирование
» data-shape=»round» data-use-links data-color-scheme=»normal» data-direction=»horizontal» data-services=»messenger,vkontakte,facebook,odnoklassniki,telegram,twitter,viber,whatsapp,moimir,lj,blogger»>
ТКАНЕВОЕ ДЫХАНИЕ, ОКИСЛИТЕЛЬНОЕ ФОСФОРИЛИРОВАНИЕ
Тканевое дыхание — процесс окисления водорода кислородом до воды ферментами дыхательной цепи. Как указывалось выше, процесс образования воды описывается уравнением:
Дыхательная цепь — последовательность переносчиков электронов на кислород, локализованная во внутренней мембране митохондрий (ВММ). Роль таких переносчиков выполняют:
Цель работы дыхательной цепи: провести реакцию окисления водорода кислородом с образованием эндогенной воды.
Принцип работы дыхательной цепи: разделение потоков протонов и электронов, поступающих из матрикса. Электроны передаются на конечный акцептор — кислород; протоны выбрасываются в межмембранное пространство (ММП).
Место того или иного переносчика в дыхательной цепи определяется величиной редокс-потенциала. Все реакции в дыхательной цепи направлены по термодинамической лестнице от компонента с самым отрицательным редокс-потенциалом (НАДH·Н + ) к кислороду, имеющему самый положительный редокс-потенциал.
Редокс-потенциал (Ео) численно равен э. д. с. в вольтах, возникающей между растворами окислителя и восстановителя (концентрации 1М, рН = 7,0, температура 25С). Чем отрицательнее редокс-потенциал системы, тем выше ее способность отдавать электроны (восстановители). Чем положительнее редокс-потенциал, тем выше способность вещества присоединять электроны (окислители).
Перенос электронов по дыхательной цепи осуществляется в следующей последовательности:
Во внутренней митохондриальной мембране переносчики электронов и протонов сгруппированы в 4 белково-липидных комплекса, пересекающих мембрану. Убихинол (КоQ) не входит в состав комплексов; цитохром с, являясь водорастворимым, находится в межмембранном пространстве:
Условные обозначения: ВММ — внутренняя мембрана митохондрий; ММП — межмембранное пространство; ПДГ — пиридинзависимые дегидрогеназы; ФДГ — флавинзависимые дегидрогеназы; ЭХП — электрохимический потенциал; РП — разность потенциалов между восстановителем и окислителем.
Комплексы дыхательной цепи
Ι. НАДН-убихинон-оксидоредуктаза. Принимает электроны и протоны от НАДН·Н + ; протоны выбрасываются в межмембранное пространство, электроны передаются на КоQ.
ΙΙ. Сукцинат-убихинон-оксидоредуктаза. Принимает электроны и протоны от субстратов в матриксе и передает их на убихинон.
Убихинон — липофильная молекула, хинон, легко перемещается по мембране, принимает электроны и протоны от Ι и ΙΙ комплексов дыхательной цепи и передает электроны на ΙΙΙ комплекс.
Цитохромы, входящие в состав дыхательной цепи, представляют собой железосодержащие белки, простетическая группа которых представлена гемом. Цитохромы могут переносить только электроны за счет атома железа с переменной валентностью, входящего в состав гемма:
Ш. Убихинол-цитохром с-оксидоредуктаза. Переносит электроны с убихинола на цитохром с. Одновременно за счет энергии, выделившейся при переносе, из матрикса переносятся протоны в межмембранное пространство.
IV. Цитохром с-оксидаза. Переносит электроны с цитохрома с непосредственно на кислород. Цитохромы а и а3, помимо атомов железа, содержат атомы меди, поэтому этот комплекс одновременно осуществляет полное (4-электронное) восстановление молекулы кислорода. Энергия переноса электронов используется на перекачивание в межмембранное пространство протонов.
Как указывалось выше, для синтеза АТФ необходимо затратить около 32 кДж/моль энергии. Для этого достаточной является разность потенциалов между окислителем и восстановителем не менее 0,26 вольта. Чанс, Скулачев установили, что таких участков в дыхательной цепи три. Они соответствуют I, III и IV комплексам и названы пунктами сопряжения или фосфорилирования.
Чтобы понять связь между транспортом электронов по дыхательной цепи и синтезом АТФ, познакомимся с V комплексом внутренней мембраны митохондрий — ферментом, осуществляющим реакцию синтеза АТФ и называемым протонной АТФ-синтазой (см. рис.). Этот ферментативный комплекс состоит из двух частей: Fо
(о – олигомицин), который встроен в мембрану и пронизывает ее насквозь, и F1, Последний по форме напоминает шляпку гриба или дверную ручку и обращен в матрикс митохондрии. В изолированном виде F1 не может синтезировать АТФ, но может проводить ее гидролиз до АДФ и фосфата.
Реакция синтеза АТФ, которую проводит V комплекс, носит название окислительного фосфорилирования и описывается уравнением:
Биохимики долго искали связь — промежуточные макроэргические соединения, которые могли бы служить посредником между процессом тканевого дыхания и окислительным фосфорилированием. Английский биохимик П. Митчелл предположил, что синтез АТФ V комплексом ВММ сопряжен с особым состоянием этой мембраны, и сформулировал хемиоосмотическую теорию окислительного фосфорилирования (Нобелевская премия 1978 г.).
Основные постулаты этой теории:
Дальнейшие исследования (Дж. Уокер, П. Бойер, Нобелевская премия 1997 г.) подтвердили предположения Митчелла. Ими показано, что энергия движения протонов используется на изменения конформации активного центра АТФ-синтазы, что сопровождается синтезом АТФ, а затем ее высвобождением. Образовавшаяся АТФ с помощью транслоказы перемещается в цитозоль; в ответ в матрикс митохондрии поступают АДФ и фосфат. Всего на процесс синтеза, высвобождения и выброса в цитозоль расходуется 4 протона.
При окислении НАД-зависимых субстратов в ММП выбрасывается 10 протонов (см. схему комплексов дыхательной цепи). Следовательно, в таком случае может быть синтезировано 2,5 моль АТФ (10:4), т. е. коэффициент фосфорилирования Р/О = 2,5. При окислении ФАД-зависимых субстратов в ММП выбрасывается 6 протонов в III и IV пунктах сопряжения. В таком случае может быть синтезировано 1,5 моль АТФ (6:4), т. е. коэффициент фосфорилирования Р/О = 1,5.
Регулируется скорость работы дыхательной цепи энергетическим зарядом клетки,
т. е. соотношением АТФ/АДФ. АДФ является стимулятором дыхательной цепи, АТФ – аллостерическим ингибитором.
Гипоэнергетические состояния возникают в организме вследствие дефицита АТФ в клетках. Причины их следующие:
Среди последних различают, во-первых, ингибиторы дыхательной цепи. Это яды, которые блокируют перенос электронов через I, II, III, IV комплексы. Ротенон и барбитураты блокируют I комплекс, малонат — II, антимицин А – III, цианиды, угарный газ блокируют перенос электронов на кислород, осуществляемый IV комплексом дыхательной цепи.
Во-вторых, ингибиторы окислительного фосфорилирования (олигомицин), закрывающие протонный канал V комплекса.
В-третьих, разобщители окислительного фосфорилирования. Это вещества, которые подавляют окислительное фосфорилирование, не влияя при этом на процесс переноса электронов дыхательной цепью. Механизм действия разобщителей сводится к тому, что, являясь липофильными веществами, они обладают способностью связывать протоны и переносить их в матрикс, минуя протонный канал Н + АТФ-синтазы. Выделяющаяся при переносе электронов энергия рассеивается в виде тепла. Различают:
Пути утилизации кислорода клеткой
Большая часть кислорода, потребляемого клеткой (около 80 %), используется, как указано, в митохондриях с участием цитохромоксидазы. Это так называемый оксидазный путь. При этом происходит полное восстановление кислорода, причем субстрат не реагирует с кислородом непосредственно. Данный путь дает клетке энергию в виде АТФ. Помимо цитохромоксидазы существуют другие оксидазы (ФМН и ФАД-зависимые), которые катализируют реакции окисления веществ с образованием перекиси водорода
Примерная схема монооксигеназной цепи выглядит следующим образом:
Смысл такого процесса заключается в том, что ксенобиотики, которые обычно гидрофобны, гидроксилируясь, становятся более гидрофильными, что способствует их обезвреживанию и выведению из организма с желчью или мочой. С участием микросомных систем осуществляется также биосинтез стероидов, желчных кислот, витамина Д3.
Свободные радикалы стимулируют разрывы в молекулах нуклеиновых кислот, нарушают функции белков, ведут к деполимеризации протеогликанов соединительной ткани, повреждают ненасыщенные жирные кислоты клеточных мембран, запуская, тем самым, механизм перекисного окисления липидов (ПОЛ). Вместе с тем свободные радикалы кислорода играют и положительную роль, так как участвуют в осуществлении фагоцитами и
Т-лимфоцитами их защитной функции.
Повышенное образование в организме свободных радикалов кислорода ведет к «окислительному стрессу», который может привести к повреждению мембран и гибели клетки. Поэтому в организме существует антиоксидантная защита от свободных радикалов.
Различают неферментативную и ферментативную защиту клеток. Важнейшим компонентом неферментативной защиты является витамин Е (токоферол), витамин размножения.
Являясь жирорастворимым витамином, он всасывается вместе с липидами, поступает в лимфатическую систему и кровяное русло, а оттуда — в ткани. Токоферол защищает ненасыщенные жирные кислоты клеточных мембран от перекисного окисления, предохраняет от окисления SH-группы мембранных белков, защищает от окисления двойные связи в молекулах каротинов и витамина А. Токоферол (совместно с витамином С) способствует включению селена в состав активного центра глутатионпероксидазы — важнейшего фермента антиоксидантной защиты клеток. Он контролирует синтез гема, цитохромов, стабилизирует биологические мембраны.
Ферментативная защита клеток от свободных радикалов (антиоксидантная защита) осуществляется с помощью следующих ферментов:
Депонирует молекулярный кислород что
4.1. Транспорт кислорода
В сложных механизмах транспорта газов кровью и газообмена в тканях важная роль отводится эритроцитам, ответственным за доставку О2 к различным органам и удаление образующегося в процессе метаболизма СО2.
Эритроцит – безъядерная клетка, лишенная митохондрий, основным источником энергии для эритроцита служит глюкоза, метаболизируемая в гексозомонофосфатном шунте или цикле Эмбдена-Мейергофа. Транспорт О2 обеспечивается в значительной мере гемоглобином, состоящим из белка глобина и гема. Последний представляет собой комплексное соединение железа и порфирина. Глобин представляет собой тетрамер полипептидной цепи. Hb A (HbA) – основной гемоглобин взрослых содержит 2 – альфа и 2 – бета – цепи, Hb A2 – содержит две альфа и две дельта цепи.
Гем состоит из иона железа, встроенного в порфириновое кольцо. Ион железа гема обратимо связывает одну молекулу О2. С одной молекулой Hb максимально связываются 4 молекулы О2 с образованием оксигемоглобина.
Гем может подвергаться не только оксигенации, но и истинному окислению, когда железо становится из двухвалентного трехвалентным. Окисленный гем носит название гематина, а молекула гемоглобина становится метгемоглобином. В крови человека метгемоглобин находится в незначительных количествах, его уровень резко возрастает при отравлениях. Метгемоглобин не способен отдавать кислород тканям.
В норме метгемоглобин составляет менее 3% общего Hb крови. Основная форма транспорта О2 – в виде оксигемоглобина. Кислород транспортируется артериальной кровью не только в связи с гемоглобином, но и в растворенном виде. Принимая во внимание тот факт, что 1 г Hb может связать 1,34 мл О2, кислородная емкость крови в среднем у взрослого человека составляет около 200 мл/л крови. Одним из показателей кислородного транспорта является насыщение артериальной крови О2(Sa O2), равного отношению О2, связанного с Hb, к кислородной емкости крови:
SaO2=O2, связанного с Hb/O2 емкость крови* 100%.
В соответствии с кривой диссоциации оксигемоглобина насыщение артериальной крови кислородом в среднем составляет 97%, в венозной крови – 75%.
PaO2 в артериальной крови около 100 мм. рт. ст., а в венозной – около 40 мм. рт. ст.
Количество растворенного кислорода в крови пропорционально парциальному давлению О2 и коэффициэнту его растворимости.
Последний для О2 составляет 0,0031/100 мл крови/ 1 мм. рт. ст.. Таким образом, 100 мл крови при PaO2, равном 100 мм. рт. ст., содержит менее 0,31 мл O2.
Диссоциация оксигемоглобина в тканях обусловлена главным образом химическими свойствами гемоглобина, а также рядом других факторов – температурой тела, рН среды, р СО2.
При понижении температуры тела наклон кривой диссоциации оксигемоглобина возрастает, а при ее повышении – снижается, и соответственно снижается сродство Hb к О2.
При снижении рН, т.е. при закислении среды, сродство гемоглобина к О2 уменьшается. Увеличение напряжения в крови СО2 также сопровождается снижением сродства Hb к О2 и уплощением кривой диссоциации оксигемоглобина.
Известно, что степень диссоциации оксигемоглобина определяется содержанием в эритроцитах некоторых фосфорорганических соединений, главным из которых является 2,3 – ДФГ (2,3 дифосфоглицерат), а также содержанием в эритроцитах катионов. В случаях развития алкалозов, поглощение О2 в легких увеличивается, но в то же время затрудняется отдача кислорода тканями. При ацидозах наблюдается обратная картина.
4.2.Утилизация кислорода тканями
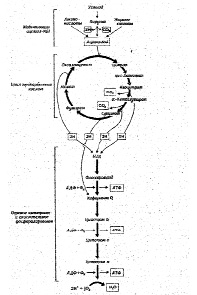
Тканевое или клеточное дыхание включает три стадии. На первой стадии пируват, аминокислоты и жирные кислоты окисляются до двухуглеродных фрагментов ацетильных групп, входящих в состав ацетилкофермента А. Последние на втором этапе окисления включаются в цикл лимонной кислоты, где происходит образование высокоэнергетических атомов водорода и высвобождение СО2 – конечного продукта окисления органических субстратов. На третьей стадии клеточного дыхания атомы водорода делятся на протоны (Н+) и «высокоэнергетические» электроны, передающиеся по дыхательной цепи на молекулярный О2 и восстанавливающие его до НО2. Перенос электронов сопряжен с запасом энергии в форме АТФ, т.е. с окислительным фосфорилированием (рис.6).
Касаясь патогенеза метаболических сдвигов, свойственных гипоксическим состояниям, следует отметить, что в организме человека более 90% всего потребляемого кислорода восстанавливается с участием цитохромоксидазы митохондрий, и лишь около 10% кислорода метаболизируется в тканях с участием оксигеназ: диоксигеназы и монооксигеназы.
Рис.6. Схема тканевого дыхания. Конечные продукты каждой стадии даны в рамке (Ленинджер А., 1999)
Наиболее многочисленны и сложны монооксигеназные реакции, протекающие в эндоплазматическом ретикулуме клеток при участии цитохрома Р-450 и обеспечивающие гидроксилирование субстрата (стероидных гормонов, лекарственных препаратов и различных др. соединений) и, как правило, его инактивацию.
Диоксигеназы катализируют реакции, в которых в молекулу органического субстрата включаются оба атома молекулы кислорода (например, реакция окисления катехола молекулярным кислородом с раскрытием кольца).
В реакциях, связанных с переносом электронов, т.е. в реакциях окисления-восстановления, где, как указывалось выше, используется более 90% потребляемого кислорода, атомы водорода, отщепленные дегидрогеназами от субстратов в цикле лимонной кислоты, передают свои электроны в цепь переноса электронов и превращаются также в Н +. Как известно, помимо 4 пар атомов водорода, поставляемых каждым оборотом цикла лимонной кислоты, образуются и другие атомы водорода, отщепленные дегидрогеназами от пирувата, жирных кислот и аминокислот в процессе их расщепления до Ацетил-СоА и других продуктов.
Таким образом, все атомы водорода, отщепляемые дегидрогеназами от субстратов, передают свои электроны в дыхательную цепь к конечному акцептору электронов – кислороду.
Скорость утилизации О2 в различных тканях различна. В среднем взрослый человек потребляет 250 мл О2 в 1 мин. Максимальное извлечение О2 из притекающей артериальной крови свойственно миокарду.
Кислород используется в клетках, в основном в метаболизме белков, жиров, углеводов, ксенобиотиков, в окислительно-восстановительных реакциях в различных субклеточных фракциях: в митохондриях, в эндоплазматическом ретикулуме, в реакциях липопероксидации, а также в межклеточном матриксе и в биологических жидкостях.
Коэффициент утилизации О2 в тканях равен отношению потребления О2 к интенсивности его доставки, широко варьирует в различных органах и тканях.
В условиях нормы минимальную потребность в О2 проявляют почки и селезенка, а максимальную потребность – кора головного мозга, миокард и скелетные мышцы, где коэффициент утилизации О2 колеблется от 0,4 до 0,6, а в миокарде до 0,7. При крайне интенсивной физической работе коэффициент утилизации О2 мышцами и миокардом может возрастать до 0,9.
Обмен дыхательных газов в тканях происходит в процессе свободной и облегченной диффузии. При этом О2 переносится по градиенту напряжения газа из эритроцитов и плазмы крови в окружающие ткани.
Одновременно происходит диффузия СО2 из тканей в кровь. На выход О2 из крови в ткани влияет диссоциация оксигемоглобина в эритроцитах, что обеспечивает так называемую облегченную диффузию О2. Интенсивность диффузионного потока О2 и СО2 определяется градиентом их напряжения между кровью и тканями, а также площадью газообмена, плотностью капилляров, распределением кровотока в микроциркуляторном русле. Интенсивность окислительных процессов в тканях определяется величиной критического напряжения О2 в митохондриях, которое в условиях нормы должно превосходить 0,1-1 мм рт. ст.
Соответствие доставки О2 к органам и тканям, возросшим потребностям в оксигенации обеспечивается на клеточном, органном уровнях за счет образования метаболитов изнашивания, а также при участии нервных, гормональных и гуморальных влияний.
Основная масса углекислого газа (СО2) образуется в организме как конечный продукт различных метаболических реакций и транспортируется к легким с кровью. Вдыхаемый воздух содержит лишь незначительное количество СО2.
Транспорт СО2 кровью осуществляется в 3-х состояниях: в виде аниона бикарбоната, в растворенной форме и в виде карбаминовых соединений.
СО2 хорошо растворяется в плазме крови и в артериальной крови, около 5% от общей двуокиси углерода содержится в крови в растворенной форме.
Третьей формой транспорта СО2 кровью являются карбаминовые соединения, образованные взаимодействием СО2 с концевыми группами белков крови преимущественно с гемоглобином:
Карбаминовые соединения составляют около 5% от общего количества СО2, транспортируемого кровью.
В оксигенированной артериальной крови напряжение СО2 составляет 40 мм. рт. ст., а в венозной крови Рv СО2 равно 46 мм. рт. ст.
4.4.Связывание гемоглобина с окисью углерода