децидуоподобная трансформация стромы что это
Рецидивирующее невынашивание беременности
Новые исследования и возможность лечения
От 15% до 25% беременностей заканчиваются невынашиванием, то есть прекращением беременности до момента достижения плодом жизнеспособности. Подавляющее большинство случаев невынашивания развиваются в срок до 12 недель гестации. В некоторых случаях потеря эмбриона случается на первых неделях, что проходит незаметно для женщины, так как менструальный цикл в этом случае не нарушается. Очень большое число эмбрионов, которые не могут прижиться в стенке матки имеют нарушенный хромосомный набор. В таких случаях реакция внутреннего слоя матки является механизмом естественного отбора имеет положительную функцию. При рецидивирующем невынашивании беременности происходит потеря плода с нормальным хромосомным набором. Это состояние безусловно является патологическим. К сожалению, до настоящего времени не найдено ни одного способа лечения этого состояния.
Для того, чтобы понимать, как лечить то или иное заболевание, необходимо знать законы развития этого заболевания. Эти законы и механизмы, ведущие к заболеванию, называются патогенезом. В физиологеских условиях оплодотворенная яйцеклетка дает начало эмбриону. Эмбрион внедряется во внутреннюю стенку матки – эндометрий. Причем эндометрий должен быть подоготовлен для этого внедрения. Процесс подготовки клеток эндометрия к имплантации эмбриона называется децидуализацией.
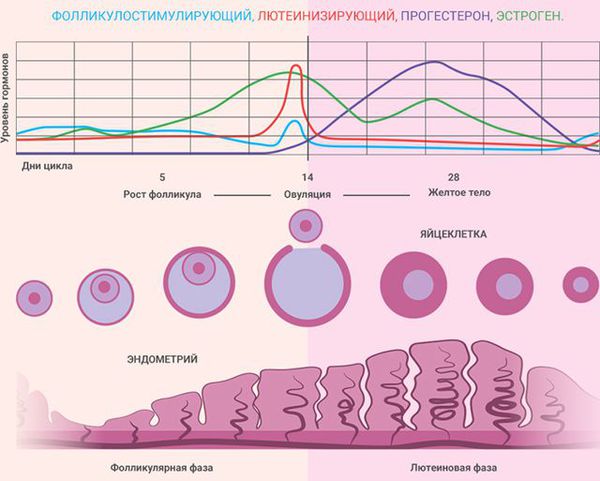
ДЕЦИДУАЛИЗАЦИЯ ЭНДОМЕТРИЯ – критически важный момент для успешной имплантации и развития эмбриона. В чем же она заключается и как все происходит? Известно, что эндометрий – внутренний слой матки, совершает циклические изменения каждый месяц. Эти изменения заключаются в ремоделировании сосудов, развитии секреторных желез, утолщении эндометрия, накапливании в клетках эндометрия биологически активных веществ. Все эти процессы запускаются в середине лютеиновой фазы цикла. То есть после того, как произошла овуляция и образовалось желтое тело. Причем децидуализация происходит независимо от того, наступила беременность в данном цикле или нет.
Что происходит при привычном невынашивании беременности? Децидуализация происходит, но с нарушениями. Эмбрион внедряется в толщу эндометрия, но дальше идет сбой. Окружающие клетки не способны поддерживать жизнедеятельность эмбриона и беременность прерывается. Почему так происходит. Недавние исследования, проведенные в Великобритании http://onlinelibrary.wiley.com/doi/10.1002/stem.2222/full, показали, что «виноваты» стромальные клетки эндометрия, которые «неправильно реагируют» на сигналы эмбриона. Таким образом стромальным клеткам принадлежить ключевая роль в обеспечении процессов перестройки эндометрия после родов, его восстановления после родов и менструаций. Известно, что стромальные клетки имеют определенную продолжительность жизни. Уменьшение этой продолжительности ведет к снижению количества стромальных клеток. В свою очередь «источником» стромальных клеток служат стволовые клетки соединительной ткани. Стволовые клетки – это особые структурные элементы. Они не имеют определенной функции и находятся в организме в дремлющем состоянии, активируясь только при воздейстии определенных сигналов. Дефицит стволовых клеток или их несостоятельность может привести к нарушению возобновления стромальных клеток, что в свою очередь, приводит к нарушению децидаулизации и потере беременности.
Значение данного исследования в том, что была подтверждена гипотеза о связи стволовых клеток эндометрия и привычном невынашивании беременности. Таким образом открываются две возможности:
В нашей клинике также проводится работа по изучению влияния стволовых клеток на процессы развития.
в акушерстве и гинекологи мы работаем по таким направлениям как:
Лечим такие проблемы:
Что такое гиперплазия эндометрия? Причины возникновения, диагностику и методы лечения разберем в статье доктора Анькина А. О., врача УЗИ со стажем в 9 лет.
Определение болезни. Причины заболевания
Диагноз « гиперплазия эндометрия » ставится только по заключению гистологического исследования. Без своевременной диагностики и целенаправленного лечения повышается риск развития рака эндометрия.
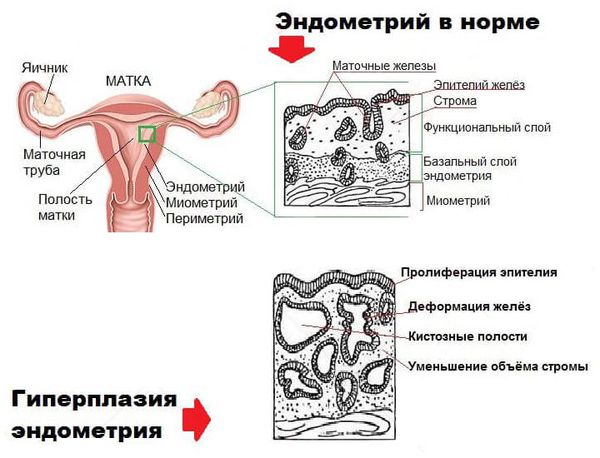
В составе маточного эндометрия есть специфические рецепторы, которые делают его органом-мишенью для половых гормонов. При гормональном сбое нарушается рост и дифференцировка эндометриальных клеток, что приводит к разрастанию эндометрия.
Факторы риска развития гиперплазии эндометрия [1] [8] [11] :
Симптомы гиперплазии эндометрия
В период перехода к менопаузе основным симптомом заболевания являются нерегулярные обильные менструации, сменяющиеся длительными мажущими кровянистыми выделениями.
Женщины менопаузального возраста жалуются на скудные кровянистые выделения из половых путей. Они могут проявляться эпизодически либо быть продолжительными.
Патогенез гиперплазии эндометрия
Состояние эндометрия зависит от фазы менструального цикла:
В патогенезе гиперплазии эндометрия выделяют два варианта развития событий:
В случае гиперплазии эндометрия с атипией избыток желёз эндометрия сочетается с клеточными мутациями (атипическим перерождением). Атипическая гиперплазия эндометрия является предраковым состоянием.
Классификация и стадии развития гиперплазии эндометрия
Международная классификация болезней 10-го пересмотра (МКБ-10):
Пересмотренная классификация ВОЗ 2014 года:
Осложнения гиперплазии эндометрия
Анемия. Для гиперплазии эндометрия характерны аномальные маточные кровотечения. В связи с этим женщины часто страдают от хронического малокровия разной степени выраженности.
Бесплодие. Гормональные изменения отражаются на качестве эндометрия, что создаёт риск неудачной имплантации эмбриона. Помимо этого, гиперплазия эндометрия часто выявляется на фоне хронической ановуляции, при которой зачатие невозможно.
Диагностика гиперплазии эндометрия
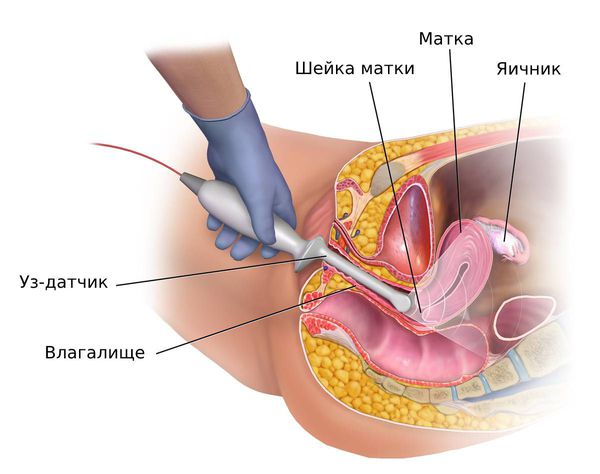
Диагностика основана на анализе данных анамнеза пациентки (истории болезни), клинической картины заболевания (жалоб и физикального осмотра), а также на результатах ультразвукового и гистероскопического исследования с обязательным патоморфологическим анализом соскоба из полости матки.
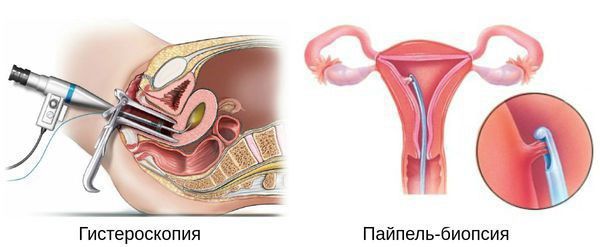
Диагноз «гиперплазия эндометрия» ставится только на основании гистологического исследования материала, полученного при диагностическом выскабливании слизистой оболочки матки или удалении матки.
Анамнез и клиническая картина
При сборе анамнеза врач-гинеколог задаёт пациентке вопросы:
Физикальный осмотр включает в себя местный осмотр наружных половых органов, исследование влагалища и шейки матки в зеркалах, а также бимануальное (двумя руками) исследование матки и придатков. Осмотр проводится на первичном приёме, чтобы исключить воспалительные заболевания и/или объёмные опухолевые образования.
Инструментальная диагностика
У женщин репродуктивного и пременопаузального возрастов при подозрении на гиперплазию эндометрия ТВУЗИ органов малого таза проводится на 5 – 7-й день менструального цикла. В норме в это время толщина эндометрия не превышает 6 мм. Патологию эндометрия подозревают, когда его толщина не соответствует определённой фазе менструального цикла:
Гистероскопия с раздельным диагностическим выскабливанием (РДВ) матки и цервикального канала — информативный метод в диагностике гиперпластических процессов эндометрия. При помощи гистероскопа (эндоскопического прибора для осмотра полости матки) врач оценивает состояние слизистой оболочки матки и цервикального канала. При необходимости удаляет локальные поражения и обязательно берёт материал для последующего гистологического исследования.
Если выскабливание проводят как лечебную процедуру при обильном маточном кровотечении, врач полностью удаляет слизистую оболочку матки под контролем гистероскопии.
Дифференциальная диагностика гиперплазии эндометрия проводится с полипом эндометрия, субмукозной (подслизистой) миомой матки, эндометритом, прервавшейся беременностью и раком эндометрия.
Лечение гиперплазии эндометрия
Лечение патологии эндометрия основывается на трёх принципах:
Тактика лечения будет зависеть от результата гистологического исследования эндометрия, полученного в ходе выскабливания, от возраста женщины, сопутствующих заболеваний и репродуктивных планов.
Гиперплазия эндометрия без атипии:
Гиперплазия эндометрия с атипией:
Медикаментозное лечение гормональными препаратами проводится пациенткам репродуктивного возраста с неатипической гиперплазией эндометрия при наличии симптомов, факторов риска, отсутствии регресса за 6 месяцев наблюдения и при атипической гиперплазии эндометрия у женщин, планирующих беременность.
Гормональную терапию назначают не менее чем на 6 месяцев:
В качестве негормональной терапии возможно применение препаратов:
Лечение нужно сочетать с низкокалорийной диетой и достаточной физической нагрузкой согласно общему физическому развитию женщины. При необходимости врач назначает препараты, которые нормализуют метаболизм углеводов в организме: подавляют образование глюкозы клетками печени, повышают чувствительность тканей к инсулину, расщепляют сложные сахара.
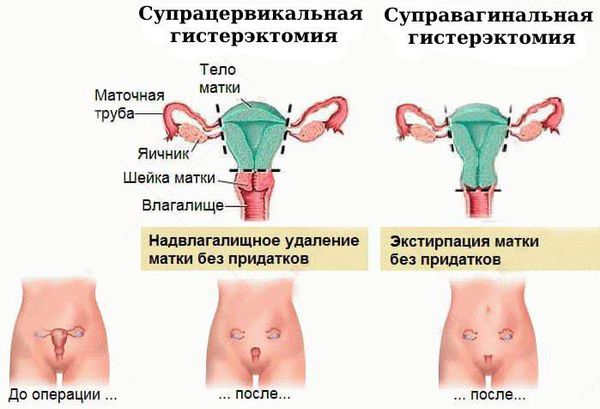
Хирургическое лечение. Атипическая гиперплазия эндометрия на начальном этапе требует обязательной консультации онкогинеколога, который должен установить, нужна ли операция и в каком объёме.
Чаще всего выполняется надвлагалищная ампутация матки — суправагинальная гистерэктомия (удаление тела и шейки матки). Вопрос о сохранении яичников решается строго индивидуально, зависит от возраста пациентки и факторов риска.
Показания к гистерэктомии:
Прогноз. Профилактика
Обследование для исключения гиперплазии или рака эндометрия показано в следующих случаях:
1. Если есть аномальные маточные кровотечения [29] [31] :
2. Если по результатам цитологического исследования соскоба шейки матки отмечается:
Профилактика:
Децидуоподобная трансформация стромы что это
И.В. Кузнецова
Кафедра акушерства и гинекологии РМАПО, Москва
Диффузные гиперпластические процессы эндометрия относятся к одной из основных форм пролиферативных заболеваний эндометрия и представляют собой гетерогенную группу патологических процессов, включающих изменения, распределяющиеся от доброкачественных эстрогензависимых пролифераций желез до моноклональных разрастаний генетически изменённой ткани [1].
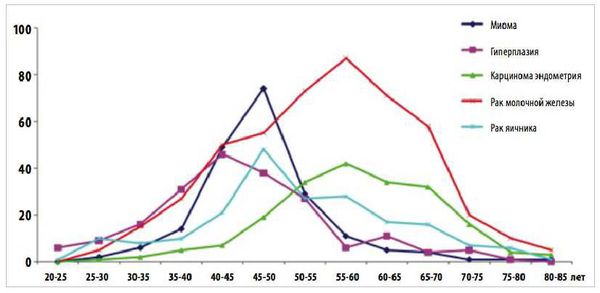
Истинную распространённость гиперпластических процессов эндометрия оценить очень сложно, в лучшем случае, исследования касаются тех женщин, которые обратились по различным поводам в гинекологический стационар и, следовательно, в большинстве своём имели нарушения репродуктивного здоровья. Например, по данным Г.Е. Чернухи [2], железистая гиперплазия эндометрия среди женщин в возрасте до 45 лет с различными нарушениями репродуктивной функции выявляется у 6,1 %, а аденоматозная гиперплазия – у 6,6 % пациенток. По нашим данным, распространённость сложной гиперплазии эндометрия в пременопаузе сохраняется на уровне репродуктивного возраста (6,5 %), а простой гиперплазии без атипии возрастает до 17 %.
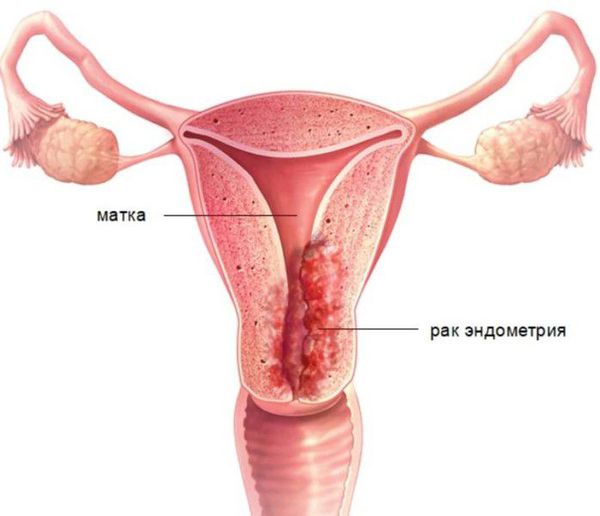
Актуальность проблемы гиперпластических процессов эндометрия определяет не столько их распространённость, сколько несомненная связь со злокачественным пролиферативным процессом тела матки – раком эндометрия.
Рак эндометрия – самое частое из онкологических заболеваний женской половой сферы, он диагностируется в 15-20 случаях на 100 тыс женщин каждый год [3] и преобладающим его типом (75 %) является аденокарцинома. Большинство случаев эндометриальной аденокарциномы возникает спорадически, только в 5 % наблюдений отмечается наследственная предрасположенность. Выделяются два типа канцерогенеза спорадической аденокарциномы. Около 80 % опухолей относится к I типу, возникает между 20-54 годами и зависит от избыточной эстрогенной стимуляции [4]. Предшественниками именно этого типа опухолей являются гиперпластические процессы эндометрия.
Классификация гиперплазий эндометрия основывается на морфологических критериях. В настоящее время в мире наиболее широко используется классификация, предложенная ВОЗ в 1994 г. [5]. Согласно этой классификации выделяют простую и сложную гиперплазии, в зависимости от степени структурного изменения слизистой оболочки тела матки, а также учитывают наличие или отсутствие клеточной атипии.
Простая типичная гиперплазия – это самый лёгкий и наиболее часто встречающийся вариант гиперплазии, когда при гистологическом исследовании обнаруживается повышение количества железистых и стромальных элементов без структурной перестройки эндометрия. В отечественной литературе эквивалентом простой типичной гиперплазии являются термины железистая и железисто-кистозная гиперплазия эндометрия [1]. Железистая и железисто-кистозная гиперплазия считаются качественно однозначным процессом, но степень их выраженности несколько различается: активная пролиферация желез и стромы эндометрия сопровождается или не сопровождается расширением желез и образованием кист.
Сложная гиперплазия без атипии предполагает изменение расположения желез, изменение их формы и размера, уменьшение выраженности стромального компонента, т. е. наличие структурных изменений ткани в отсутствии клеточной атипии, этот вариант соответствует нерезко выраженной аденоматозной гиперплазии. При сложной гиперплазии эндометрий, как и при простой, стимулируется эстрогенами, но «ускользает» из-под гормонального контроля.
Простая атипическая гиперплазия эндометрия встречается достаточно редко. Отличительным признаком является наличие атипии клеток желез; при этом структурные изменения желез отсутствуют. Сами железы имеют причудливую форму, на косых срезах напоминая картину «железа в железе», эпителий демонстрирует повышенную митотическую активность.
Сложная атипическая гиперплазия эндометрия характеризуется выраженной пролиферацией железистого компонента, сочетающейся с явлениями атипии как на тканевом, так и на клеточном уровне, но ещё без инвазии базальной мембраны железистых структур. Наблюдается скопление, наслоение и анормальный вид клеток, потеря полярности желез и расположение их «спина к спине». Цитоплазма эпителиальных клеток увеличена в размерах, эозинофильна; ядра клеток также увеличены, бледные. Отчётливо идентифицируются глыбки хроматина и крупные ядрышки. Увеличивается митотическая активность, возрастают количество и спектр патологических митозов [6]. Клеточная атипия сопровождается разрастанием и искажением формы желез, иногда с инфильтрацией в эндометриальную строму. Для определения формы и степени выраженности атипической гиперплазии учитывают выраженность атипии на тканевом, клеточном и ядерном уровнях. При наличии инвазии опухолевых клеток за пределы предсуществующих железистых структур изменения расцениваются как начало инвазии. Атипическая гиперплазия эндометрия занимает промежуточное положение между обычными формами железистой гиперплазии эндометрия и раком и является предраковым процессом эндометрия.
В отсутствии клеточной атипии риск малигнизации эндометриальной гиперплазии низок, не более 1-3 %, но онкологический потенциал атипической гиперплазии высок и составляет 30-50 % [7]. Атипическая гиперплазия рассматривается в настоящее время как процесс чаще локальный, чем диффузный, возникающий на фоне типичной гиперплазии de novo, а не являющий собой стадию развития простой или сложной гиперплазии [8]. Несмотря на то, что типичная и атипичная гиперплазия считаются принципиально разными процессами, отражающими два пути развития патологической пролиферации – путь гиперплазии и путь неоплазии, в их патогенезе лежит один общий фактор – гиперэстрогения.
Эндометрий, являясь «тканью-мишенью» для половых гормонов, чрезвычайно чувствителен к действию эстрогенов. Последние, вызывая пролиферативные изменения эндометрия, при отсутствии достаточного влияния прогестерона приводят к развитию гиперплазии [9].
Помимо длительных избыточных эстрогенных влияний в патогенезе гиперпластических процессов эндометрия большое значение имеют локальные ростовые факторы. Эстрогены стимулируют пролиферацию клеток нормального, гиперплазированного или злокачественно изменённого эндометрия различными способами, включая повышение экспрессии собственных рецепторов [10], восходящую регуляцию ростовых факторов и/или их рецепторов и индукцию прото-онкогена FOS [11]. Эстрадиол индуцирует продукцию и секрецию в эндометрии одного из самых значимых пролиферативных факторов – инсулиноподобного фактора роста 1 (ИФР-1) [12].
Известно также, что риск гиперплазии и рака эндометрия повышается при некоторых заболеваниях/состояниях, например, ожирении, диабете и артериальной гипертензии, среди которых, несомненно, как независимый фактор риска выделяется ожирение, повышающее вероятность возникновения и диабета, и артериальной гипертензии [13, 14]. В то же время появляются работы, свидетельствующие о независимом влиянии артериальной гипертензии и, возможно, гипотензивных препаратов на формирование гиперплазии [15]. В любом случае, надо принимать во внимание, что женщины с гиперплазией эндометрия часто отягощены по соматическим заболеваниям, требующим особо тщательного подбора терапии.
Клинические проявления гиперпластических процессов эндометрия представлены аномальными маточными кровотечениями (АМК) [9]. Основной целью обследования женщин с АМК является исключение гиперплазии и рака эндометрия, поэтому кровотечения обычно становятся показанием к проведению раздельного диагностического выскабливания. Гиперплазия эндометрия встречается чаще, чем рак, и особенно широко распространена среди женщин перименопаузального возраста [16].
Традиционным терапевтическим подходом к гиперплазиям эндометрия является назначение гормональной терапии, а в случае неэффективности лечения или наличии дополнительных факторов, в т. ч. принадлежности больной к перименопаузальной возрастной группе – гистерэктомия. Выбор тактики ведения и лекарственного средства, в первую очередь, зависит от морфологической характеристики гиперпластического процесса. Так, большинство случаев атипической гиперплазии становится поводом для хирургического лечения, 85 % гистерэктомий проводится именно по этому показанию [17]. Подобная тактика определяется, во-первых, высоким риском малигнизации атипической гиперплазии, и, во-вторых, возможностью неадекватной диагностики при проведении биопсии эндометрия [16]. При исследовании удалённых маток оказалось, что 11 % рака эндометрия предварительно, после выскабливания эндометрия, идентифицировались как гиперплазия эндометрия (в подавляющем большинстве случаев – атипическая гиперплазия) [17]. Тем не менее, значение консервативной терапии велико и в этой группе больных, особенно при желании сохранить фертильность либо наличии медицинских факторов, создающих возможность (или необходимость) избежать операции. Оценка исходов гормональной терапии атипической гиперплазии показывает, что к гистерэктомии приходится прибегать в 34 % наблюдений, но в 2/3 случаях удаётся сохранить матку [17].
Cложная гиперплазия эндометрия без атипии имеет небольшой, около 3 %, потенциал малигнизации. Несмотря на это, опасения о прогрессировании заболевания приводят к выбору гистерэктомии в половине всех случаев. Такой традиционный подход вряд ли можно считать обоснованным, поскольку консервативная терапия позволяет избежать гистерэктомии у 4-х из 5-ти женщин, имеющих морфологический диагноз «сложная гиперплазия эндометрия» [17].
В отношении простой гиперплазии эндометрия без атипии вопрос о гистерэктомии вообще не должен ставиться, так как это морфологическое заключение отражает не столько заболевание эндометрия, сколько нормальную реакцию эндометрия на ановуляторную дисфункцию яичников и гиперэстрогению. Гормональная терапия в данной группе больных в отсутствии противопоказаний к приёму гормональных лекарственных средств является наиболее разумным выбором. Фактически, первым этапом лечения гиперплазии эндометрия становится удаление патологически изменённой ткани во время выскабливания слизистой тела матки под контролем гистероскопии. У женщин в возрасте до наступления естественной менопаузы гормональная терапия преследует целью устранение гиперэстрогении, ановуляции, достижение циклических секреторных превращений эндометрия и формирование правильного менструального цикла. У женщин, желающих осуществить детородную функцию, лечение маточных кровотечений, связанных с простой гиперплазией эндометрия, совпадает с лечением эндокринного бесплодия.
Консервативные методы лечения гиперплазии эндометрия включают прогестины, комбинированные оральные контрацептивы, антигонадотропные препараты, агонисты гонадолиберина. Наиболее часто во всем мире используются прогестины и прогестинсодержащие препараты.
Уже с середины 70-х годов было известно, что изолированное повышение концентрации эстрогенов в крови или экзогенное введение только эстрогенов в значительной степени повышает риск развития рака эндометрия. В связи с этим с начала 80-х годов основной целью клинического использования прогестерона стала защита эндометрия. В частности, был хорошо известен тот факт, что рецепторы эстрогенов, расположенные в ядрах клеток, контролируют клеточный цикл эпителия желез эндометрия, т. е. эстрогены индуцируют начало клеточного цикла, а прогестерон блокирует этот процесс, при этом экзогенно введённые синтетические прогестины также обладают этой способностью, но только в другой дозе.
В процессе подбора оптимальной дозы прогестагенов основное значение придавалось их способности вызывать у женщины в постменопаузе такую же гамму морфологических и биохимических изменений в эндометрии, как во время лютеиновой фазы менструального цикла женщины пременопаузального возраста. Начало кровотечения после 10-12 дней введения прогестагенов являлось доказательством эффективной защиты эндометрия и наилучшим свидетельством клинической эффективности.
По своей сути прогестины являются препаратами, повышающими биодоступность прогестерона при пероральном приёме, сохраняя при этом его эффекты на эндометрий. Метаболизм прогестерона ферментами желудочно-кишечного тракта (ЖКТ) и печени начинается с редукции 5α (в ЖКТ) и 5β (в печени) кольца А, а на втором этапе – гидроксилирование С-20 и/или С-17. Любое изменение кольца В снижает аффинитет 5α или 5β-редуктаз и поэтому используется для повышения биодоступности пероральных прогестагенов и улучшения их связывания с рецепторами прогестерона. Эти изменения включают подавление С-19 (19-нортестостерона дериваты), добавление 4,6-диеновой структуры (дидрогестерон, ципротерона ацетат) или метильного радикала к С-6 (медроксипрогестерон). Все эти препараты способны вызывать прогестагенные эффекты на организм в дозе, в 10 раз меньшей по сравнению с пероральным прогестероном.
Влияние прогестагенов на эндометрий зависит от дозы и режима введения [18]. Увеличение дозы и продолжительности введения вплоть до непрерывного режима приводит к децидуализации стромы и атрофии железистого эпителия эндометрия. Но введение прогестинов в виде монотерапии в длительном режиме сопровождается сиюминутными и долговременными побочными эффектами, снижающими переносимость терапии. Улучшения переносимости прогестагенов можно добиться двумя способами: введение непосредственно в матку [19] или добавление низких доз эстрогенов в составе комбинированных эстроген-гестагенных препаратов [20].
Одним из вариантов выбора эстроген-гестагенных препаратов являются комбинированные оральные контрацептивы (КОК), которые могут назначаться сексуально активным пациенткам репродуктивного возраста при отсутствии клеточной атипии по результатам морфологического исследования эндометрия. Использование КОК позволяет реализовать также и другие благоприятные эффекты этого вида лечения, например, уменьшение выраженности гиперандрогении и её клинических проявлений, снижение менструальной кровопотери, симптомов дисменореи и т. д. Особенно важно для женщин, страдающих гиперпластическими процессами эндометрия и, следовательно, аномальными маточными кровотечениями, возможность контроля цикла и уменьшение менструальной кровопотери [21].
Эстрогенный компонент КОК представлен этинилэстрадиолом. По содержанию этинилэстрадиола КОК делятся на высокодозированные (50 мкг), низкодозированные (35 мкг) и микродозированные (менее 35 мкг). С целью лечения гиперплазии эндометрия могут применяться низко- и микродозированные монофазные препараты. Микродозированные КОК в большей степени приемлемы у женщин старше 35 лет, поскольку снижение дозы КОК благоприятно с точки зрения минимизации их влияния на метаболизм.
Гестагенный компонент КОК отличается значительным разнообразием. С позиций лечения гиперплазий эндометрия особое значение имеет трансформирующая способность прогестина, входящего в состав КОК. Наиболее «сильными» прогестинами следует признать норгестимат, левоноргестрел, дезогестрел и гестоден, представляющие гестагенный компонент КОК второго и третьего поколения. По сравнению с прогестинами, производными прогестерона, для секреторной трансформации эндометрия требуется меньшая доза прогестинов, производных нортестостерона (таблица).
Под влиянием КОК эндометрий подвергается быстрой регрессии в пролиферативной фазе, в нём появляется преждевременная секреторная трансформация желёз, в строме отмечается децидуоподобная трансформация. В первую очередь, процессы регрессии касаются железистого компонента, поэтому относительное количество стромы в соотношении стромального и железистого компонента преобладает. Подвергается значительным изменениям сосудистая сеть эндометрия: имеет место угнетение развития спиральных артериол, а вместо них в поверхностных слоях слизистой тела матки формируется разветвлённая сеть капилляров. Наблюдаемые изменения эндометрия обусловлены влиянием прогестинов, входящих в состав КОК.
Положительное влияние КОК на эндометрий реализуется в главной цели, преследуемой при лечении гиперпластических процессов – существенное, до 50 %, снижение риска рака эндометрия [22] и смертности от рака эндометрия [23]. Следовательно, применение КОК имеет долговременный эффект, улучшающий показатели продолжительности и качества жизни.
Помимо сильного прогестагенного эффекта, прогестины в составе КОК обладают и другими, остаточными (парциальными) эффектами, которые, тем не менее, могут влиять на переносимость КОК и возникновение тех или иных побочных реакций. Так, например, среди прогестинов III поколения (дезогестрел, гестоден, норгестимат), можно выделить гестоден, хорошая переносимость которого определяется слабым антиальдостероновым эффектом. Этот эффект не имеет клинического значения (как, например, у дроспиренона), но в составе КОК приводит к частичному уменьшению эстроген-зависимых побочных реакций, связанных с задержкой жидкости (болезненное нагрубание молочных желез, прибавка в массе тела и др.). Антиальдостероновый эффект особенно значим при выборе КОК для женщин с избыточной массой и артериальной гипертензий. Поэтому среди «сильных» прогестагенов, обеспечивающих хороший контроль эндометрия, гестоден имеет преимущества при назначении этой категории женщин, которая, кстати, чаще страдает гиперпластическими процессами слизистой тела матки. Гестоден входит в состав КОК «Линдинет®» и может назначаться для профилактики и лечения эндометриальной гиперплазии в репродуктивном возрасте («Линдинет-30®») и у женщин старше 35 лет («Линдинет-20®»).
Заслуживает внимания выбор режима приёма КОК. Стандартный режим приёма КОК предполагает 21-дневный приём препарата с 7-дневными перерывами. Для лечения простой или сложной гиперплазии без атипии достаточно 6 стандартных циклов приёма препарата.
Помимо стандартного режима приёма возможно использование пролонгированного режима. Варианты пролонгированных режимов предполагают непрерывный приём препарата от 42 и более дней. Использование пролонгированного режима с целью лечения гиперпластических процессов эндометрия представляется более обоснованным, чем применение стандартной схемы [24].
Исходя из основной задачи в процессе профилактики рецидивов гиперплазии эндометрия, гормональное лечение должно быть направлено на подавление эстрогенпродуцирующей функции яичников. Вне всяких сомнений, эта задача лучше осуществляется на фоне применения пролонгированного режима, поскольку при стандартном режиме приёма в дни перерыва приёма препарата уровень эстрадиола достоверно повышается. Согласно результатам собственного исследования, после окончания лечения уровень эстрадиола у женщин, получавших низкодозированный КОК в пролонгированном режиме, оказался достоверно ниже, чем у пациенток, получавших препарат в стандартном режиме. Учитывая роль гиперэстрогении в генезе гиперплазии эндометрия, следует признать целесообразным режим, позволяющий более эффективно исключить этот важный патогенетический фактор.
Влияние КОК на процесс фолликулогенеза реализуется через гипоталамо-гипофизарную систему: гестагенный компонент препаратов снижает секрецию гонадотропинов. Это особенно актуально у больных СПКЯ, представляющих группу высокого риска по гиперплазиям эндометрия в репродуктивном возрасте. Проведённые нами исследования показали, что уровень ЛГ при применении КОК снижается в достоверно большей степени в случаях использования пролонгированного режима. Следует отметить, что средний показатель объёма яичников также достоверно снижался после проведённого лечения, отражая положительный эффект терапии.
Клиническая эффективность проведённого противорецидивного курса гормонотерапии выразилась в восстановлении овуляции у 60 % женщин, использовавших пролонгированный режим приёма и у 32,1 % пациенток, получавших КОК в стандартном режиме. Несмотря на отсутствие достоверных различий, тенденция очевидна: эффективность пролонгированного режима выше, чем стандартной схемы приёма КОК.
Пролонгированный режим приёма КОК имеет ещё одно преимущество. Сокращение 7-дневных перерывов уменьшает общую длительность лечения простой гиперплазии на две недели, а сложной гиперплазии – на четыре недели, что положительно оценивается больными. К недостаткам пролонгированного режима следует отнести частые ациклические кровяные выделения. Несмотря на то, что эти выделения обычно бывают скудными, больные негативно реагируют на их появление. В действительности, ациклические кровяные выделения на фоне приёма КОК не представляют угрозы здоровью и не отражают вероятную неэффективность терапии. Пациенткам следует разъяснять механизмы появления ациклических выделений, что повышает переносимость терапии. Наш опыт свидетельствует, что подобные беседы с больными оказываются весьма полезными: назначая КОК в непрерывном режиме мы ни разу не получили отказа от терапии по причине ациклических кровяных выделений.
Контроль эффективности лечения поводится после его окончания. Метод контроля зависит от исходного морфологического диагноза. При сложной гиперплазии эндометрия без атипии рекомендуется диагностическое выскабливание под контролем гистероскопии через 3 недели от начала первого менструальноподобного кровотечения. Простая гиперплазия без атипии не требует морфологического контроля. Вполне достаточно клинического наблюдения, включающего оценку ритма менструаций и ультразвуковое исследование. Частота рецидивов гиперплазии эндометрия после приёма КОК составляет от 7 до 16 %.
Правильный выбор гормональной терапии у больных гиперпластическими процессами эндометрия позволяет избежать оперативного вмешательства и, вместе с тем, значительно снизить заболеваемость раком тела матки. Комбинированные оральные контрацептивы – один из методов лечения гиперплазии эндометрия, который при правильном подборе лекарственного средства, обеспечивает контроль состояния эндометрия, хорошую переносимость и долговременный протективный эффект.