диагноз алд что такое
Адренолейкодистрофия
Тип наследственного заболевания, при котором повреждается мембрана (миелиновая оболочка), изолирующая нервные клетки мозга. При АЛД организм не может расщеплять насыщенные жирные кислоты с очень длинной углеродной цепью (ОДЦЖК), накапливая их в мозге, органах нервной системы и надпочечниках.
Формы Х-сцепленной АЛД
Наиболее распространенным типом АЛД является Х-сцепленная АЛД, характеризующаяся генетическим дефектом Х-хромосомы. Чаще диагностируется у мужчин.
Причины
АДЛ наследственное заболевание, основной причиной которого является нарушение обмена жирных кислот, вследствие чего происходит генетическая мутация.
Факторы риска
Симптомы
Поскольку заболевание является наследственным, диагноз может быть предсказан задолго до начала проявления симптомов. При дебюте АМН различают следующие симптомы:
Осложнения
Зависят от формы заболевания. При церебральных формах прогноз обычно неблагоприятный; в случае развития АМН продолжительность жизни очень широко варьируется.
Диагностика
Проводится на основании клинической картины после осмотра врача и сбора анамнеза. Также при постановке диагноза бывают информативны следующие исследования:
Лечение
Возможные методы лечения:
Основные рекомендации
Недавние клинические исследования показали, что у мальчиков на ранней стадии церебральной формы АЛД положительный результат лечения дала генная терапия, как альтернатива трансплантации стволовых клеток. Ранние результаты генной терапии являются многообещающими.
Диагноз алд что такое
Х-сцепленная адренолейкодистрофия (X-ALD) является самой частой лейкодистрофией у мужчин, установленная частота составляет 1:20000. Изначально заболевание было описано в 1913 г. Schilder как «периаксиальный диффузный энцефалит» и в отчете о клиническом случае «диффузного склероза» в сочетании с атрофией надпочечников (Siemerling и Creutzfeldt, 1923).
Почти полвека спустя был обнаружен дефект пероксисомного бета-окисления, приводящий к характерному избытку очень длинноцепочечных жирных кислот в плазме, клетках крови и поврежденных фибробластах. Ген Х-ALD находится на хромосоме Xq28 и кодирует трансмембранный белок-переносчик семейства АТФ-связывающих транспортеров. Идентифицировано более 200 мутаций.
Транспортер необходим для переноса очень длинноцепочечных жирных кислот (VLCFA) или VLCFA-кофермент А в пероксисомы, где они метаболизируются. Данный процесс зависит от ряда генов биогенеза пероксисом или пероксинов. Корреляции между характером мутации и клиническим фенотипом выявлено не было (Powers и Moser, 1998; Dubois-Dalcq et al., 1999).
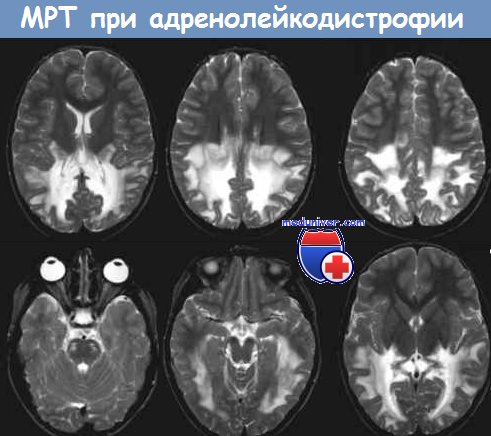
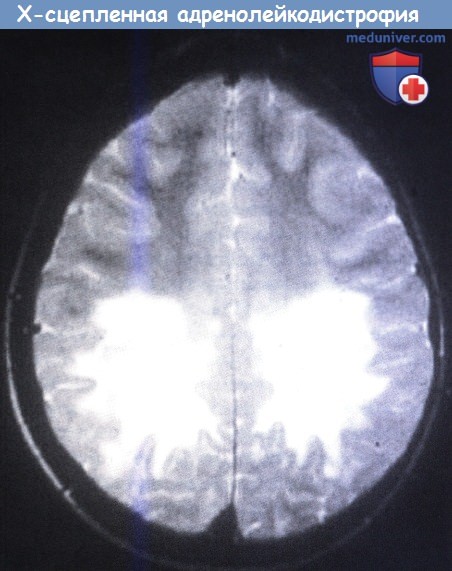
Селективное поражение надпочечников и нервной ткани с повреждением спинного и головного мозга является морфологическим признаком Х-ALD. В отличие от адреномиелонейропатиии взрослых (AMN), детская форма Х-ALD сочетается с воспалительной реакцией белого вещества головного мозга. Отмечается сливная демиелинизация, обычно симметричная и наиболее выраженная в теменно-затылочных областях. U-волокна относительно сохранны, отмечается поражение мозолистого тела, задней части внутренней капсулы, корково-спинномозгового пирамидного пути, моста и продолговатого мозга.
При гистологическом исследовании выявляется утрата миелинизированных аксонов и олигодендроцитов, реактивный астроцитоз, поздняя вакуолизация и астроглиоз. На границе демиелинизации отмечается интенсивное периваскулярное воспаление и накопление липофагов. Периваскулярные скопления клеток содержат макрофаги и некоторое количество лимфоцитов. Гипертрофические GFAP-положительные астроциты и макрофаги вырабатывают цитокиноподобный фактор некроза опухолей-альфа (ФНО-альфа) и интерлейкин 1 (ИЛ-1).
Три основных фенотипа X-ALD встречаются у мужчин, известно также еще три подтипа. AMN может встречаться у женщин-носительниц мутантного гена.
1. Церебральная детская форма (частота 30-40%): начало в возрасте 3-10 лет, стремительное прогрессирование
2. Подростковая форма ALD (4-7%): начало в возрасте 11-21 года, медленное прогрессирование
3. Взрослая форма AMN (40%): средний возраст начала— 28 лет (стандартное отклонение 9 лет), поражение спинного мозга
4. Взрослая форма ALD (2-5%): выраженные психиатрические симптомы и деменция
5. Изолированная болезнь Адиссона: начало в возрасте 7-8 лет; чаще всего у пациентов в итоге развивается AMN, частота которого варьирует в зависимости от возраста
6. Бессимптомные случаи: выявляется только биохимический и генетический дефект.
Из 84 случаев Х-ALD, зарегистрированных в отделении детской неврологии в Геттингене (Германия), 51 были расценены как симптомный ALD, а 10 как бессимптомный ALD, у 23 пациентов выявлялась только болезнь Адиссона (F. Hanefeld, неопубликованные личные наблюдения).
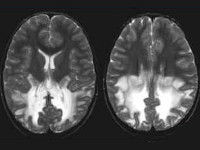
На МРТ в Т2-режиме виден высокий сигнал от задней части обоих полушарий.
Видна сохранность арочных волокон.
Церебральная детская форма ALD характеризуется медленным прогрессированием в начальной фазе, а затем резким ухудшением. Начальные симптомы включают трудности обучения в школе в сочетании с нарушениями поведения. Ранним симптомом может быть нарушение или утрата слуха. Нарушение зрения, деменция, припадки, трудности при ходьбе, нарушения речи и способности к письму развиваются вскоре после появления первых неврологических симптомов. После появления неврологических симптомов заболевание прогрессирует стремительно, и через несколько лет формируется вегетативное состояние.
Средний возраст смерти по результатам отчета Института Кеннеди Кригера в Балтиморе составил 9,4 года (стандартное отклонение 2,7 года, диапазон 5,1-19 лет) (Powers и Moser, 1998).
Гиперпигментация, типичная для болезни Адиссона, может появляться до развития неврологических симптомов.
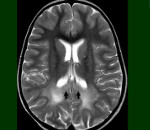
Следует исключить сцепленную с Х-хромосомой ALD во всех случаях недостаточности надпочечников у мальчиков. Диагностика основана на выявлении повышенной концентрации VLCFA (с22:0, с24:0, с26:0) в плазме. Возможна пренатальная диагностика путем измерения уровня VLCFA в культуре амниоцитов и с помощью анализа мутаций. Большое значение имеет выявление демиелинизации на МРТ, что в большинстве случаев является основой диагностики.
Демиелинизация головного мозга начинается в валике мозолистого тела и медленно прогрессирует, распространяясь симметрично на теменно-затылочное белое вещество. Дугообразные волокна остаются неповрежденными. При помощи контрастных веществ выявляется ободок усиления вокруг наиболее пораженных участков головного мозга. Также возможно поражение задней части внутренней капсулы, пирамидного тракта, моста и ствола мозга. Приблизительно в 10% случаев демиелинизация может начинаться в передних отделах с поражением передней части внутренней капсулы. Также возможно симметричное поражение белого вещества мозжечка.
Дифференциальная диагностика X-ALD проводится с опухолями головного мозга, другими лейкодистрофиями, энцефалитом, подострым склерозирующим панэнцефалитом, рассеянным склерозом и острым демиелинизирующим энцефалитом.
Недостаточность надпочечников корректируется гормонозаместительной терапией, но лечение не предотвращает и не уменьшает неврологические проявления. Диета с повышенным содержанием ненасыщенных жирных кислот (масло Лоренцо) снижает уровень VLCFA, но не уменьшает выраженность неврологических симптомов и не предотвращает прогрессирование заболевания. Исследование с участием 49 пациентов, у которых отсутствовали симптомы ALD и проводилось лечение маслом Лоренцо, выявило снижение риска развития аномалий на MPT (Moser et al., 2005).
В настоящее время наиболее эффективным методом лечения является трансплантация гемопоэтических клеток, проводимая на ранних стадиях заболевания (Shapiro et al., 2000).
Редактор: Искандер Милевски. Дата публикации: 16.12.2018
Диагноз алд что такое
Адренолейкодистрофия (АЛД) представляет собой группу дегенеративных заболеваний ЦНС, которые часто ассоциируются с надпочечниковой недостаточностью и передаются по Х-сцепленному рецессивному типу. Классическая адренолейкодистрофия (АЛД) дебютирует в возрасте 5-15 лет в виде снижения школьной успеваемости, поведенческих изменений и расстройства походки.
Адренолейкодистрофия (АЛД) вызвана мутацией в гене ABCD 1 на хромосоме Xq28, кодирующем синтез пероксисомного переносчика, который участвует в транспорте жирных кислот с очень длинной цепью внутрь пероксисомы. Заболеваемость адренолейкодистрофией (АЛД) составляет примерно 1:20 000 мальчиков. На ранних стадиях характерны генерализованные судороги.
Признаки поражения пирамидных путей включают спастический тетрапарез и контрактуры, появляется атаксия, выражены нарушения глотания вследствие псевдобульбарного паралича — эти симптомы преобладают в конечных стадиях заболевания.
Снижение функции надпочечников наблюдается примерно в 50 % случаях; надпочечниковая недостаточность с патологической пигментацией кожи (смуглый, коричневатый оттенок кожи без воздействия солнца) может предшествовать дебюту неврологической симптоматики. На КТ и МРТ перивентрикулярная демиелинизация, начинаясь с задних отделов, постепенно распространяется в белом веществе в передние отделы больших полушарий.
Адреномиелоневропатия начинается с медленно прогрессирующего спастического парапареза, недержания мочи и импотенции на 3-4-м десятилетии жизни, хотя признаки надпочечниковой недостаточности возможны с детского возраста. Описаны случаи типичной адренолейкодистрофии (АЛД) в семьях, в которых у пробанда была диагностирована адреномиелоневропатия.
Одна из сложностей диагностики Х-адренолейкодистрофии (АЛД) состоит в том, что у пациентов из одной семьи нередко наблюдается различное клиническое течение заболевания. Например, у мальчика диагностирована адренолейкодистрофия (АЛД) с тяжелым течением и летальным исходом в возрасте 10 лет, у брата этого пациента отмечалась адреномиелоневропатия с поздним дебютом, у третьего брата симптомы болезни отсутствовали. Генетическое консультирование в семьях, в которых выявлены мальчики на пресимптомной стадии заболевания, затруднено, так как отсутствуют надежные методы прогнозирования клинического течения заболевания.
Неонатальная адренолейкодистрофия (АЛД) характеризуется выраженной гипотонией, тяжелой задержкой психомоторного развития и ранним дебютом судорог. Тип наследования — аутосомно-рецессивный. Отсутствие зрительной фиксации обусловлено атрофией зрительных нервов. Тесты, определяющие функцию надпочечников, без нарушений, однако при посмертном патоморфологическом исследовании находят атрофию надпочечников. Коррекция надпочечниковой недостаточности для предотвращения прогрессирования неврологических нарушений неэффективна.
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
— Вернуться в оглавление раздела «неврология»
Адренолейкодистрофия – это наследственная патология из группы пероксисомных болезней, связанная с накоплением в организме жирных кислот с очень длинной углеродной цепью. Заболеванию свойственен клинический полиморфизм – различные формы характеризуются поражением мозговой ткани и надпочечников, проявляясь сочетанием неврологических расстройств (сенсомоторных, эмоционально-когнитивных, поведенческих) и гипокортицизма. Диагностируют патологию по клиническим данным, подтверждая биохимическими, молекулярно-генетическими тестами, МРТ и КТ мозга. Комплексное лечение предполагает диету, фармакотерапию, трансплантацию гемопоэтических клеток.
МКБ-10
Общие сведения
Адренолейкодистофия (болезнь Зиммерлинга-Крейтцфельдта, Аддисона-Шильдера) была впервые описана немецкими невропатологами Эрнстом Зиммерлингом и Гансом-Герхардом Крейтцфельдтом в 1923 году. Является не настолько редким заболеванием, как считалось ранее – встречается повсеместно, превосходя по распространенности другие пероксисомные болезни. По данным различных исследований, частота данного варианта лейкодистрофии варьируется от 1:100000 до 1:15000, патология затрагивает представителей всех возрастных групп (детей, подростков, взрослых). Обычно болеют лица мужского пола, женщины являются носителями мутантного гена, но при гетерозиготном генотипе в 20% случаев симптомы обнаруживаются и у них.
Причины адренолейкодистофии
Возникновение патологии связано с мутациями гена ABCD1, занимающего терминальный участок длинного плеча X-хромосомы (локус Xq28). Он кодирует синтез трансмембранного белка-переносчика, называемого адренолейкодистофическим протеином (ALDP). Последний находится на специфических клеточных органеллах, участвующих в реакциях окисления – пероксисомах, отвечая за транспортировку и дальнейшее расщепление очень длинноцепочечных жирных кислот (ОДЦЖК).
Структурный дефект пероксисомного транспортного белка делает его функционально неспособным, что ведет к накоплению в тканях токсических соединений. Уже идентифицировано более 2600 мутаций ABCD1, связанных с заменой нуклеотидов ДНК, потерей локусов, и многие из них вызывают структурные изменения ALDP. Адренолейкодистофии развиваются при наличии в генотипе лишь одного рецессивного гена (у мужчин-гемизигот) или двух его разновидностей (у женщин-гетерозигот).
Патогенез
Из-за структурной аномалии белка-переносчика страдает транспорт ОДЦЖК внутрь пероксисом, где они должны подвергаться β-окислению. В норме насыщенные жирные кислоты с длинной цепью присутствуют в липидах нервной ткани (цереброзидах, сульфатидах), эритроцитах, но при адренолейкодистрофии их содержание может возрастать в тысячу раз. Обычные эфиры холестерина заменяются аномальными с длиной цепи в 24–30 и более атомов углерода. Когда их концентрация в оболочке нервных волокон достигает 10%, миелин дестабилизируется и разрушается.
Накопление ацил-КоА-производных жирных кислот нарушает физико-химические свойства клеточных мембран: повышается проницаемость митохондрий, возрастает концентрация цитозольного кальция. В свою очередь, это приводит к атрофии нейроэндокринной ткани надпочечников. Важным механизмом демиелинизации считают активацию нейроглиальных структур, стимуляцию воспалительных процессов с участием цитокинов (фактора некроза опухолей).
Гистологические изменения при церебральных вариантах адренолейкодистофии характеризуются резким снижением содержания миелина, периваскулярной лимфоцитарно-макрофагальной инфильтрацией. В основном демиелинизирующий процесс начинается с мозолистого тела, постепенно переходя на белое вещество затылочно-теменных областей. Реже наблюдается вовлечение лобных долей, пирамидного тракта.
Классификация
Адренолейкодистофия характеризуется выраженным фенотипическим полиморфизмом, обусловленным различиями пенетрантности и экспрессивности аномального гена. Учитывая время дебюта, основные проявления, скорость нарастания симптоматики, в современной неврологии различают несколько форм заболевания:
Симптомы адренолейкодистрофии
Клиническая картина патологии очень вариабельна, что определяется конкретным фенотипическим вариантом. Клиницистам чаще всего приходится сталкиваться с признаками церебральной формы, адреномиелонейропатией, изолированной надпочечниковой недостаточностью.
Церебральная форма
Для всех разновидностей церебральной адренолейкодистрофии характерно быстрое прогрессирование. Пик манифестации детской формы приходится на период между 5 и 10 годами жизни. У большинства пациентов нервно-психические расстройства предшествуют признакам надпочечниковой недостаточности. Характерны расстройства поведения, мышления, двигательной сферы. Дети становятся гиперактивными или аутистичными, эпизодически проявляют агрессию. Возникает дефицит внимания, прогрессирующая деменция, нарушается походка.
Ювенильная адренолейкодистрофия манифестирует в возрасте 10–21 года. По симптоматике она напоминает детскую форму. У взрослых 30–50 лет патология начинается шизофреноподобным синдромом, нарастающей деменцией. Среди церебральных симптомов присутствуют дисфагия, зрительные нарушения (скотомы). Патология может быстро прогрессировать, но описывают и так называемые хронические варианты, когда процесс на многие годы приостанавливается, а после ремиссии наблюдается внезапное ухудшение с нарастанием неврологического дефицита.
Адреномиелонейропатия
Начинается заболевание в широком возрастном диапазоне – от 12 до 50 лет (чаще между вторым и четвертым десятилетиями жизни). Во многих случаях симптомы хронического гипокортицизма предшествуют или сопутствуют неврологическим расстройствам. Иногда самым первым признаком, возникающим задолго до развертывания всей клинической картины (еще в раннем детстве), становится изолированная гиперпигментация кожи.
Начальные неврологические признаки представлены миелопатией со снижением глубокой чувствительности, нижним парапарезом. Дальнейшее развитие такой адренолейкодистрофии проявляется тетрапарезом с нарушением функции тазовых органов (мочеиспускания, дефекации, эрекции). Со временем присоединяются психические расстройства (депрессия), гипогонадизм, алопеция. Патологическое состояние характеризуется медленным течением, но неуклонно прогрессирует.
Изолированная недостаточность надпочечников
Поражение коры надпочечных желез проявляется сначала глюкокортикоидной, а затем и минералокортикоидной недостаточностью, дебютирует в различные сроки, начиная с двухлетнего возраста. Наиболее частые симптомы представлены потерей аппетита, мышечной слабостью, рвотой. Пациенты теряют в весе, страдают от абдоминальных болей, гипотонии. Кожная гиперпигментация возникает не всегда. Неврологическое исследование указывает на снижение вибрационной чувствительности, гиперрефлексию, интеллектуальные расстройства, возникающие спустя несколько лет.
Симптоматическая адренолейкодистрофия
У некоторых женщин-носителей отмечается возникновение неврологических симптомов без сопутствующих эндокринных сдвигов. Заболевание дебютирует позже, чем у мужчин со спинальным поражением – к 50–60 годам. В тяжелых случаях симптоматика схожа с церебральной формой, умеренные нарушения напоминают адреномиелонейропатию. Наиболее часто выявляют сенсорную атаксию, умеренный спастический парапарез и боли в нижних конечностях, дисфункцию органов малого таза. Недостаточность коры надпочечников возникает редко.
Осложнения
Прогрессирование церебральных форм и адреномиелонейропатии сопровождается выраженным неврологическим дефицитом с инвалидностью. Опасным осложнением гипокортицизма является острая декомпенсация с развитием аддисонического криза, проявляющегося дегидратацией, сердечно-сосудистой, почечной недостаточностью. Быстропрогрессирующие варианты без активной коррекции заканчиваются коматозным состоянием и смертью.
Диагностика
Предположить заболевание удается при внимательной оценке анамнестической информации (наличия семейных случаев, времени манифестации, характера течения), клинических данных. Но этиопатогенетические особенности адренолейкодистрофии устанавливаются при комплексном лабораторно-инструментальном исследовании. Диагностическая программа включает следующие методы:
Дифференцировать заболевание врачу-неврологу приходится со многими состояниями. Церебральные нарушения требуют исключения других лейкодистрофий, рассеянного склероза, подострого склерозирующего энцефалита. Адреномиелонейропатию следует отличать от бокового амиотрофического склероза, фуникулярного миелоза, спинальных опухолей. Дифференцировать изолированный гипокортицизм необходимо с болезнью Аддисона, синдромом Оллгрова.
Лечение адренолейкодистрофии
Консервативная терапия
Выбор обоснованной патогенетической терапии – наиболее острая проблема, стоящая перед клиницистом при лечении конкретного пациента. Поскольку диагностировать заболевание можно еще до развития клинических признаков, особое значение приобретает пресимптоматическая коррекция. При проведении терапии адренолейкодистрофии задействуют консервативные методы:
Экспериментальное лечение
Несмотря на некоторые успехи, заболевание плохо поддается лечению. Но возрастающая активность исследователей в сфере молекулярной генетики и лучшее понимание патогенеза адренолейкодистрофии поддерживают попытки разработать новые эффективные методы коррекции. Среди них особого внимания заслуживают следующие:
Прогноз и профилактика
Долгосрочный прогноз при Х-сцепленной адренолейкодистрофии зависит от конкретного фенотипа. У детей церебральная форма принимает особо тяжелое, быстропрогрессирующее течение с пятилетней выживаемостью на уровне 59%, многие умирают в течение нескольких лет после дебюта болезни. Другие формы могут не влиять на продолжительность жизни, но снижать ее качество за счет потери трудоспособности. Учитывая высокую степень полиморфизма, даже у членов одной семьи прогноз может существенно варьироваться.
Мероприятия первичной профилактики при адренолейкодистрофии предполагают медико-генетическое консультирование вероятных носителей, пренатальную диагностику (биопсию ворсин хориона, анализ амниотической жидкости). Раннее выявление биохимических изменений в крови важно для подтверждения диагноза на доклинических стадиях. В сочетании с активной патогенетической терапией, это поможет избежать прогрессирования, снижая риск дальнейшей инвалидизации.
Современные аспекты этиологии и патогенеза первичной хронической надпочечниковой недостаточности
Полный текст:
Аннотация
Первичная хроническая надпочечниковая недостаточность является относительно редким заболеванием. На сегодняшний день, по данным разных авторов, распространенность Первичной хронической надпочечниковой недостаточности в мире значительно варьирует.
Ключевые слова
Для цитирования:
Мельниченко Г.А., Марьина Т.Л., Александрова Г.Ф. Современные аспекты этиологии и патогенеза первичной хронической надпочечниковой недостаточности. Проблемы Эндокринологии. 2006;52(6):45-50. https://doi.org/10.14341/probl200652645-50
For citation:
Melnichenko G.A., Maryina T.L., Aleksandrova G.F. The etiology and pathogenesis of primary chronic adrenal insufficiency: Current aspects. Problems of Endocrinology. 2006;52(6):45-50. (In Russ.) https://doi.org/10.14341/probl200652645-50
Эпидемиология
Первичная хроническая надпочечниковая недостаточность (ПХНН) является относительно редким заболеванием. На сегодняшний день, по данным разных авторов, распространенность ПХНН в мире значительно варьирует. Например, в Европе заболеваемость ПХНН на 100 000 населения составляет 12—13 случаев, в США — примерно 5 случаев, в Новой Зеландии лишь 0,45 случая [30, 35, 36, 53]. Между тем, клиническая значимость заболевания возросла за последние десятилетия. По сравнению с 1970 г. распространенность ПХНН в общей популяции увеличилась более чем в 3 раза. Пока остается неясным, является ли данный факт действительным отражением возросшей заболеваемости ПХНН или же результатом лучшей выявляемое™ [23].
Классификация
За 150 лет (со времени первого клинического описания болезни Аддисона) значительно расширилось понятие об этиологической структуре надпочечниковой недостаточности (НН). Причинами ПХНН являются: [9, 42]:
Выделены 3 группы причин, ведущих к ПХНН: 1) дисгенез/гипоплазия надпочечников, 2) нарушение стероидогенеза, 3) деструкция надпочечников. В первые 2 группы входят различные генетические синдромы, приводящие к манифестации НН преимущественно в детском возрасте (с момента рождения и до 14 лет). Третья группа объединяет различные причины деструкции надпочечников (аутоиммунный или инфекционный адреналит, неоплазии, воздействия лекарств, амилоидоз и др.) и наблюдается главным образом у взрослых [32, 49].
Особенности современной этиологической структуры
В начале XX века основной причиной болезни Аддисона был туберкулезный процесс. Так, по данным Р. Guttman (1930), при аутопсии пациентов с болезнью Аддисона в 70% случаев надпочечники были поражены туберкулезом и в 17% случаев отмечались признаки идиопатической атрофии [28]. Открытие эффективной химиотерапии туберкулеза значительно снизило роль данной инфекции в этиологии ПХНН. В настоящее время частота поражения надпочечников при активном туберкулезе составляет примерно 5% [4].
Этиологическая структура ПХНН значительно обогатилась за последние десятилетия благодаря обнаружению и описанию новых генетических синдромов [17], таких как синдром Кернса—Сейра и синдром Смита—Лемли—Опица. Синдром Кернса—Сейра обусловлен различными делениями митохондриальной ДНК. Клиническими проявлениями синдрома являются пигментная ретинопатия сетчатки, миопатия глазных мышц, аритмии сердца, атаксия, НН и другие эндокринопатии (сахарный диабет — СД, гипогонадизм, патология щитовидной железы, дефицит гормона роста) [15,50]. Синдром Смита—Лемли—Опица является результатом мутации гена, кодирующего стерол-5-7-ре- дуктазу, которая участвует в конечных этапах биосинтеза холестерина. У детей, страдающих этим синдромом, наблюдается сочетание недостаточности надпочечников с задержкой умственного развития, микроцефалией, врожденными пороками сердца, синдактилией, фоточувствительностью, недоразвитием гениталий у мальчиков [49]. Диагностика этих и других наследственных синдромов основана прежде всего на типичной клинической картине. Для верификации диагноза в связи с отсутствием в большинстве случаев, четких лабораторных критериев проводится генотипирование [51].
При рассмотрении вопроса о роли генетических нарушений в современной этиологии ПХНН необходимо отметить актуальность такого заболевания, как адренолейкодистрофия (АЛД). Синдром обусловлен мутациями гена, локализованного в терминальном сегменте Х-хромосомы, кодирующего структурный белок мембран пероксисом. В результате нарушения окисления длинноцепочечных жирных кислот (ДЖК) в пероксисомах они накапливаются в плазме, центральной и периферической нервной системе, яичках и надпочечниках, приводя к неврологическим нарушениям, гипогонадизму и НН. Определение ДЖК в крови позволяет поставить диагноз АЛД. Основными формами заболевания являются церебральная АЛД, адреномиело- нейропатия, изолированная хроническая НН. Церебральная форма отмечается у 50% больных АЛД, манифестирует в раннем детском возрасте и характеризуется быстрым прогрессированием заболевания. Адреномиелонейропатия выявляется в 35% больных, дебютирует в молодом возрасте и развивается постепенно. У 15 % больных НН предшествует появлению неврологической симптоматики и является единственным проявлением заболевания. Отмечена высокая распространенность АЛД (20— 35%) среди молодых мужчин с идиопатической болезнью Аддисона [38, 45].
Первичная хроническая надпочечниковая недостаточность как аутоиммунное заболевание
До появления понятия об аутоиммунной патологии случаи нетуберкулезной формы болезни Аддисона определялись как «идиопатические». Аутоиммунный адреналит был впервые описан Т. Аддисоном как случай идиопатического фиброза надпочечников: «Два надпочечника весили 49 гран (3 грамма), выглядели крайне маленькими и атрофированными. Их болезненное состояние не было результатом обычной гиперплазии или злокачественного процесса, а было вызвано истинным воспалением, разрушающим целостность органов и ведущим к их сморщиванию и атрофии» [3].
Впервые критерии аутоиммунитета были сформулированы Е. Whitebsky в 1957 г. В 1993 г. С. Bona и N. Rose пересмотрели и дополнили постулаты Е. Whitebsky, на основе которых предложили следующие критерии определения заболевания как аутоиммунного [8, 37]:
1) прямые (перенос заболевания патологическими антителами или Т-лимфоцитами); 2) непрямые (воспроизведение заболевания у экспериментальных животных, изоляция аутоантител или аутореактивных Т-лимфоцитов); 3) косвенные (ассоциация с другими аутоиммунными заболеваниями у того же индивида и в его семье; лимфоцитарная инфильтрация органа мишени, ассоциация с определенными HLA (Human Leukocyte Antigens) гаплотипами или аберрантная экспрессия антигенов HLA II класса на органе мишени).
Таким образом, аутоиммунную природу идиопатической НН подтвердили следующие открытия [9, 47]:
Понятие о патогенезе аутоиммунной надпочечниковой недостаточности (АНН). Патогенез аутоиммунных эндокринных заболеваний считается муль- тифакториальным. Антигенспецифичный ответ инициируется антигенпрезентирующими клетками (АПК). АПК захватывают молекулы антигена в нелимфоидных органах, фрагментируют антигены и мигрируют к вторичным лимфоидным органам, представляя фрагменты антигена в комплексе с белками HLA I или II класса. Затем комплекс антиген — HLA I/П класса активирует антигенспеци- фичные Т-хелперы (Th), взаимодействуя посредством Т-клеточного рецептора. Активированные Т- лимфоциты секретируют фактор пролиферации интерлейкин-2 (ИЛ-2) и другие цитокины, что стимулирует клеточный иммунный ответ через активацию цитотоксичных Т-лимфоцитов (Thl- и Th2- хелперов), и/или гуморальный иммунный ответ — через В-лимфоциты, синтезирующие ключевые аутоантитела. Активация В-клеток Th2 осуществляется посредством секреции ИЛ-4, 5, 6. При Thl происходит также активация мононуклеарных фагоцитов. Т-супрессоры регулируют иммунные ответы: при потере иммунной толерантности происходит аутоагрессия [21, 26].
При АНН в отличие от аутоиммунной тиреоидной патологии, предложенная последовательность патогенетических превращений остается только гипотетической и не изучена экспериментально. Повреждение в результате инфильтрации коры надпочечника Т-лимфоцитами, выброс ими цитокинов считают наиболее вероятными причинами деструкции. В одной из экспериментальных работ у больных ПХНН в дебюте заболевания был получен повышенный процент активированных Т-лимфо- цитов крови, чего не наблюдалось у лиц с длительным анамнезом болезни [44]. При дальнейшем изучении патогенеза АНН был выявлен пролиферативный Т-клеточный ответ к белковой фракции коры надпочечника с мол. массой 18—24 кДа [11]. Также были получены данные о преобладании IgGl-ответа к ферментам стероидогенеза Р450с21 (21-гидроксилаза) и P450scc (холестерин-десмола- за), что позволило сделать вывод об участии Th 1-го типа хелперов в деструкции коры надпочечников при АНН [14].
Этапы развития АНН
С высокой вероятностью провоцирующими факторами при запуске аутоиммунного процесса могут стать инфекция, медикаменты, пищевые продукты и стресс. Как и любое органоспецифичное аутоиммунное заболевание, болезнь Аддисона имеет хроническое течение с длительным «молчащим» доклиническим периодом. Выделяют следующие фазы развития заболевания: потенциальная, субклиническая, клиническая.
Потенциальная фаза характеризуется появлением аутоантител на фоне генетической предрасположенности и отсутствием нарушения функции коры надпочечников. В субклинической фазе происходит увеличение активности ренина плазмы при нормальных или низких показателях альдостерона (стадия I), затем, через месяцы или даже годы наблюдается снижение выброса кортизола на введение АКТГ (стадия II), а позже — дискретное увеличение уровня АКТГ и снижение кортизола (стадия III). Воздействие любого стрессового фактора на последней стадии (травмы, инфекции, беременность, хирургические вмешательства и др.), требующее увеличения продукции кортизола, ведет к проявлению недостаточной функции коры надпочечников. Такая последовательность развития заболевания, вероятно, обусловлена большей чувствительностью клубочковой зоны к лимфоцитарной атаке и/или защите пучковой зоны от лимфоцитарной инфильтрации на более длительный период за счет продукции высоких концентраций глюкокортикоидов и способности к регенерации. При дальнейшем прогрессировании заболевания и разрушении 90% функционирующей коры надпочечника появляются клинические признаки НН [9, 26].
Клинические формы АНН
На современном этапе АНН рассматривается как изолированная форма и в составе аутоиммунных полигландулярных синдромов (АПС) (см. таблицу). Классификация АПС была предложена Neufeld и Blizzard (1980), которые дали клиническую характеристику основных типов синдромов.
АПС 1-го типа (АПС1) — редкий аутосомно-рецессивный синдром, который манифестирует в детском возрасте с появления кожно-слизистого кандидоза (до 5-летнего возраста), затем через несколько лет присоединяется гипопаратиреоз (до 10-летнего возраста) и НН (до 15—20 лет) [43].
АПС 2-го типа (АПС2) представляет собой сочетание аутоиммунной патологии щитовидной железы (аутоиммунный тиреоидит, диффузный токсический зоб) с АНН (синдром Шмидта) и с СД 1-го типа (синдром Карпентера). Наиболее распространенной формой АПС2 является сочетание болезни Аддисона с аутоиммунным тиреоидитом [1]. В крупном исследовании (2004 г.), включавшем 129 пациентов с АПС2, синдром Шмидта наблюдался в 88,4% случаев, а синдром Карпентера — лишь в 11,6% всех случаев. При обоих типах АПС могут развиваться другие аутоиммунные заболевания. Так, например, ретроспективный анализ 146 случаев АПС2 показал, что наиболее часто среди сопутствующей патологии у пациентов с этим синдромом встречались витилиго, гипергонадотропный гипогонадизм и алопеция [7, 46].
Около 60% случаев АНН приходится на долю АПС, которые встречаются преимущественно среди женщин. Распространенность изолированной АНН в популяции составляет примерно 40%, при этом существует относительное доминирование данной формы заболевания у мужчин [8]. Результаты исследований показывают, что риск развития АНН высок среди родственников первой линии и пациентов с аутоиммунными заболеваниями, особенно с хроническим гипопаратиреозом и преждевременным истощением яичников [19].
Ряд авторов рассматривают изолированную АНН как предстадию полигландулярных синдромов. В связи с этим у больных с АНН необходимо проводить регулярное определение серологических маркеров других аутоиммунных заболеваний. Предлагаемый алгоритм диагностического поиска включает: а) исследование каждые 2—3 года от дебюта заболевания специфических аутоантител (прежде всего тиреоидных и антител к [3-клеткам поджелудочной железы, к стероидпродуцирующим клеткам, а также аутоантител к париетальным клеткам желудка, эндомизию, митохондриальных, ядерных и т. п.); б) проведение специальных тестов (пероральный глюкозотолерантный тест, исследование гормонов щитовидной железы и т. д.), направленных на выявление субклинических нарушений функции поражаемых органов. В одной из работ такая тактика длительного динамического наблюдения больных с изолированной АНН позволила выявить у 48 % пациентов один или несколько серологических маркеров другой аутоиммунной патологии. Впоследствии, через несколько лет наблюдения, у этих пациентов отмечено наличие АПС [10, 21].
Генетические аспекты. Возникновение и развитие АНН обусловлено определенными генетическими нарушениями. Большим шагом вперед в понимании патогенеза АПС1 было открытие и клонирование гена AIRE или гена аутоиммунного регулятора [29]. АПС1 — аутоиммунное заболевание, обусловленное мутациями в одном гене. Но только мутации в обоих аллелях этого гена ведут к клиническим проявлениям синдрома. К настоящему времени описано более 50 мутаций этого гена.
Установлена взаимосвязь гаплотипов HLA II класса как с изолированной АНН, так и с АПС2. В ходе исследований выявлено, что характерные гаплотипы DR3-DQ2 и DR4-DQ8 одинаково часто встречаются у больных с обеими формами заболевания. Более того, сочетание этих гаплотипов в гетерозиготной комбинации (DR3-DQ2/DR4-DQ8) обусловливает высокий риск развития АНН. Необходимо отметить, что DR3-DQ2/DR4-DQ8 известен как генотип высокого риска развития СД 1-го типа, но преобладающим подтипом DR4 при СД 1-го типа является DRB 1*0401, тогда как при болезни Аддисона — DRB 1*0404. В 2002 г. впервые был выявлен гаплотип «защиты» от болезни Аддисона: HLADRBl*01, DQA1*O1, DQBl*0501 [27, 39, 54].
Характеристика клинических форм АНН
Средний возраст манифестации, годы
Главные компоненты заболевания
Кандидоз, гипопаратиреоз, АНН
АСА и/или Р450С21-АТ (в дебюте болезни)
StCa и/или Р450С17-АТ и /или
Ассоциированы с клиническим гипогонадизмом или предшествуют ему
Другие аутоиммунные заболевания
Гипогонадизм, витилиго, алопеция, атрофический гастрит, пернициозная анемия, целиакия, хронический гепатит, гипофизит, мальабсорбция и др.
Серологические маркеры других аутоиммунных заболеваний
Нормальные или атрофированные надпочечники
Примечание. StCa — аутоантитела к стероидпродуцирующим клеткам, Р450С17-АТ — аутоантитела к 17а-гидроксилазе, P450scc-AT — аутоантитела к холестерин-десмолазе, АИЗЩЖ — аутоиммунные заболевания щитовидной железы, МРТ — магнитно-резонансная томография, КТ — компьютерная томография.
В настоящее время описан антиген четырех цитотоксичных лимфоцитов (CTLA-4), регулирующий активность Т-лимфоцитов. Ген расположен на 2дЗЗ-хромосоме и кодирует молекулу, являющуюся важным негативным регулятором активации Т- клеток. Данный локус имеет связь с СД 1-го типа и аутоиммунной патологией щитовидной железы. Недавно был выявлен полиморфизм гена CTLA-4, который кореллировал с изолированной АНН и АПС2 [13, 47, 50]. Одним из последних открытий в области молекулярно-генетических основ аутоиммунной болезни Аддисона является установление ассоциации АНН с геном CYP27B1 [31].
Серологические маркеры аутоиммунной деструкции. За последнее время различные ферменты, гормоны и рецепторы были идентифицированы как аутоантигены при органоспецифических заболеваниях. Специфическими аутоантигенами при АНН являются 3 главных фермента стероидогенеза — члены семейства энзимов цитохрома Р450 — 17а- ОН-гидроксилаза (Р450с17), 21-ОН-гидроксилаза (Р450с21), локализованные в микросомах эндоплазматического ретикулума, и холестерин-десмо- лаза (P450scc), расположенная на внутренней мембране митохондрий. Активность ферментов зависит от НАЦРН-цитохром-Р450-редуктазы. Органоспецифичным из 3 ферментов является только Р450с21. Р450с17 вырабатывается также в гонадах, a P450scc представлен, помимо надпочечников и гонад, в плаценте [5].
Аутоантитела к коре надпочечника были впервые выявлены Anderson в 1957 г. методом фиксации комплемента. АСА (adrenal cortex autoantibodies) — органоспецифические аутоантитела, реагирующие со всеми тремя слоями коры надпочечника и представляющие собой IgG 1, 2 и 4-го подклассов. В настоящее время наиболее чувствительным методом их определения является метод непрямой иммунофлюоресценции. Частота выявления АСА, по данным разных авторов, варьирует от 60 до 80% [7, 12]. В 1988 г. в микросомах клеток коры надпочечника человека был обнаружен специфический белок мол. массой 55 кД, связывающий АСА, который в 1992 г., в двух независимых исследованиях у пациентов с болезнью Аддисона был идентифицирован как главный надпочечниковый аутоантиген — фермент 21-ОН-гидроксилаза. Позднее было выяснено, что антитела к этому ферменту принадлежат преимущественно к классу IgGl [14]. В том же году Krohn путем молекулярного клонирования идентифицировал фермент Р450с17 как аутоантиген, ассоциированный с АНН в рамках АПС1 [25].
В 1994 г. Furmaniak и соавт. определили, что IgG сыворотки больных с АНН, относящиеся к антителам Р450с21, обусловливают значимое дозозависимое снижение активности фермента Р450с21 in vitro. В 2005 г. было предложено два возможных механизма угнетения активности фермента Р450с21 антителами in vitro: а) изменение в конформации молекулы Р450с21 при связывании с антителами; б) воздействие связывания с антителами на передачу электронов от НАЦРН-цитохром-Р450-редук- тазы (ЦР) к 21-гидроксилазе. В ходе экспериментов первое предположение не подтвердилось, но было выяснено, что антитела угнетали первую фазу передачи электронов от ЦР к 21-гидроксилазе. Это открытие позволило считать вероятным механизмом угнетения активности фермента Р450с21 снижение его взаимодействия с ЦР [40]. Еще в 1996 г. была предпринята попытка выяснить роль ингибирующего эффекта Р450с21-АТ на активность фермента Р450с21 у больных с клинической и субклинической АНН. После стимуляции АКТГ ожидаемого повышения уровней 17а-гидроксипрогесте- рона вследствие подавления активности 21- гидроксилазы не наблюдалось. Таким образом, патогенетическая роль аутоантител к коре надпочечников и к 21-гидроксилазе до сих пор не продемонстрирована in vivo [16].
Аутоантитела к 21-ОН-гидроксилазе. Р450с21- АТ могут определяться путем вестерн-блоттинга с применением нативных или рекомбинантных белков или методом иммунопреципитации, при котором используется экспрессируемый in vitro системой транскрипции/трансляции на ретикулоцитах кролика фермент 21-гидроксилаза, меченный S35. В 1997 г. группой ученых был разработан высокоспецифичный и простой в использовании метод определения Р450с21-АТ на основе человеческого рекомбинантного Р450с21, продуцируемого в дрожжах и меченного 125 1. Несмотря на наличие ряда методов определения надпочечниковых аутоантител, международной стандартизации и экспериментальных программ по их измерению, как, например, при СД 1-го типа (определение АТ к 13- клеткам), пока не существует [48].
По данным разных авторов, частота выявления аутоантител к Р450с21 при идиопатической болезни Аддисона составляет 70—90%. Несмотря на снижение частоты обнаружения Р450с21-АТ с возрастанием длительности болезни аутоантитела определяются в высоком титре. Так, по данным одного из исследований, у больных с длительностью заболевания менее 2 лет Р450с21-АТ определялись в 92% случаев, при большей продолжительности болезни — в 78% [23]. Эти данные согласуются с результатами других исследований с использованием всех известных методов определения аутоантител к Р450с21 [22]. A. Falorni и S. Lauretti (1997) продемонстрировали одинаково высокую специфичность АСА и Р450с21-АТ при обнаружении их у лиц с продолжительностью заболевания менее 15 лет. Более того, при большей продолжительности болезни высокая частота обнаружения аутоантител к Р450с21 сохранялась [24]. В ряде исследований были получены данные о том, что Р450с21-АТ встречаются чаще при изолированной АНН, чем при полигландулярных синдромах, а аутоантитела к 17а-ОН и к P450scc при изолированной АНН выявляются спорадически. При аутоиммунном поражении надпочечников могут быть выявлены аутоантитела и к другим компонентам коры надпочечника: к поверхности клеток, рецептору АКТГ, к кортикостероидам, но они обладают меньшей клинической значимостью [33].
Лу/иоэли/ионы. Группой авторов проведены исследования по изучению локализации антигенных эпитопов фермента Р450с21, опознаваемых аутоантителами в сыворотке крови пациентов с АНН. С этой целью использовался метод вестерн-блот- тинга и/или реакция иммунопреципитации. В этих экспериментах сравнивалась различная реактивность Р450с21-АТ с интактным ферментом и ферментами, содержащими N-терминальные, центральные, С-терминальные делении. Было определено, что центральный и С-терминальный регионы аминокислотной последовательности Р450с21 (АМК с 241-й по 494-ю) вовлечены в формирование мест связывания аутоантител [41]. Аутоантитела разных сывороток показали различную реактивность с ферментом, содержащим мутации в аминокислотной последовательности, или с фрагментами фермента, что позволило думать о гетерогенности Р450с21-АТ. Значительной разницы между эпитопами, опознаваемыми аутоантителами сывороток пациентов с различными формами АНН (изолированной и в составе АПС), обнаружено не было [18, 52]. По данным литературы, гетерогенная реактивность Р450с21-АТ к 21-ОН-гидроксилазе может быть причиной различий в реактивности заболевания у взрослых и детей, т. е. за прогрессирование заболевания могут отвечать определенные эпитопы молекулы фермента. Данное предположение было сделано в связи с разницей в прогрессировании АНН у детей и взрослых. Так, было отмечено медленное развитие АНН у взрослых с АПС, несмотря на наличие надпочечниковых аутоантител в крови больных. Прогрессирование АНН у взрослых, приводящее к развернутой клинике заболевания, отмечалось только у лиц с высокими уровнями АСА и Р450с21-АТ, HLA-DR3 гаплотипом и с начальными проявлениями нарушения функции коры надпочечников. В то же время у большинства детей с наличием АСА и Р450с21-АТ в крови наблюдалось быстрое развитие болезни независимо от пола, возраста, уровня антител и стадии нарушения функции надпочечников [6]. Таким образом, опыт зарубежных исследований позволяет говорить о большой клинической значимости определения надпочечниковых аутоантител. Во- первых, обнаружение АТ является ранним признаком АНН, позволяющим задолго до манифестации болезни поставить диагноз, разработать тактику ведения пациента и при необходимости назначить превентивную терапию, которая позволит предотвратить развитие острой НН, спровоцированное стрессом или инфекцией. Кроме того, назначение кортикостероидов в самые начальные стадии развития болезни, возможно, позволит предупредить или замедлить развитие аутоиммунного процесса. Так, в одной из работ было показано, что 6-месячный курс кортикостероидной терапии (по поводу офтальмопатии при болезни Грейвса) у пациента с начальной стадией субклинической АНН привел к стойкой ремиссии АНН, сохранявшейся и после отмены кортикостероидов [20]. Во-вторых, исследование Р450с21-АТ позволяет проводить скрининг групп риска по АНН, к которым относятся лица с аутоиммунными эндокринными и неэндокринными заболеваниями и родственники пациентов с болезнью Аддисона [55]. В-третьих, была отмечена корреляция уровня аутоантител с выраженностью нарушения функции коры надпочечников: спонтанная ремиссия на начальных стадиях субклинической АНН сопровождалась полным исчезновением аутоантител, а высокий уровень антител на конечной стадии субклинического периода являлся предиктором развернутой клинической картины [34].
Проблемы в изучении патогенеза АНН. Изучение механизмов развития и прогрессии АНН представляет значительные трудности. До сих пор не идентифицированы экспериментально специфичные аутоантигены, которые реагируют с аутореактивными Т-лимфоцитами при АНН. Кроме того, нет доказательств, что аутоантитела к коре надпочечника, в том числе и к Р450с21 — основному маркеру аутоиммунной деструкции, ответственны за развитие АНН. Основными препятствиями в исследовании начальных стадий заболевания являются [37, 43]: