дискинезия левого желудочка сердца что
Дискинезия левого желудочка сердца что
а) Региональная сократимость. Так как в различных слоях миокарда волокна ориентированы по-разному, то движение стенки, видимое при ЭхоКГ, является суммой различно ориентированных сокращений в миокарде. При этом внутренняя (субэндокардиальная) половина стенки утолщается значительно сильнее, чем внешняя, субэпикардиальная. В итоге нормальные сегменты стенки желудочка выполняют в систолу движение, направленное внутрь желудочка, а сама стенка утолщается. При этом утолщение стенки является более надежным параметром, который можно использовать и, например, в случае асинхронного сокращения при блокаде ножки пучка Риса.
Утолщение стенки и направленное внутрь движение наименее выражены в области базальных сегментов. Особое место занимает базальная часть базального переднеперегородочного сегмента, которая во время систолы не совершает направленного внутрь движения или даже немного смещается наружу (прежде всего, это хорошо видно на парастернальном базальном сечении по короткой оси), что, предположительно, обусловлено «пульсовой волной» ударного объема в области выносящего тракта левого желудочка.
1. Качественная оценка. В первую очередь происходит качественная оценка региональной сократимости:
— нормокинезия: нормальное движение и утолщение стенки,
— гипокинезия: сниженное, но определяемое движение и утолщение стенки (это наиболее субъективно вариабельная категория),
— акинезия: отсутствие движения и утолщения стенки,
— дискинезия: систолическое движение стенки наружу,
— аневризма: выпячивание левого желудочка, отмечающееся и во время диастолы, с аномально тонким, не сокращающимся миокардом,
— гиперкинезия: движение и утолщение стенки превышают нормальные показатели, что встречается при клапанной регургитации, в качестве компенсации нарушения локальной сократимости в другой зоне (например, после инфаркта), во время нагрузки или при стимуляции катехоламинами. При этом в конце систолы почти вся полость может быть замещена сокращающимся миокардом (систолическая облитерация полости желудочка). Сама по себе гиперкинезия не имеет патологического значения, однако является указанием на одно из вышеназванных состояний.
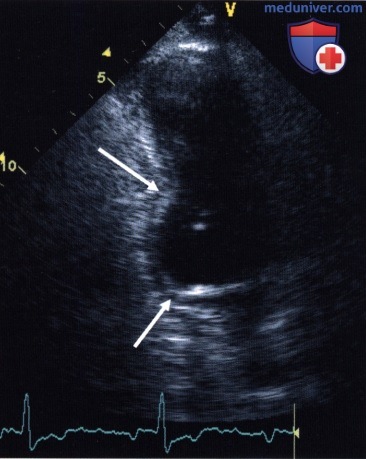

2. Количественный анализ. Многочисленные попытки количественного анализа локальной сократимости, в особенности автоматизации оценки, до сих пор не привели к созданию надежной методики, хотя бы приблизительно равнозначной визуальному заключению опытного исследователя. Поэтому сохраняется проблема субъективной вариабельности оценки локальной сократимости, которая лишь в ограниченной мере решается улучшением качества изображения, параллельным просмотром различных видеофрагментов, введением контрастных средств для левых отделов сердца и другими усовершенствованиями.
Недавно опубликованный систематический обзор различных методических подходов показал степень соответствия между различными визуализирующими методиками и определяемой при помощи согласованного клинического мнения «истиной» (степень соответствия выражалась в виде доверительного интервала значений каппы Кохена). Значение каппы, равное 1, означает полное соответствие бинарного события (нарушение локальной сократимости присутствует/отсутствует). Доверительные интервалы каппы с точки зрения выявления нарушений локальной сократимости составили:
— 0,5-0,7 для нативной ЭхоКГ,
— 0,6-0,8 для ЭхоКГ с контрастированием левых отделов,
— 0,5-0,8 для МРТ.
В рамках каждой из методик вариабельность между двумя исследователями составила:
— 0,3-0,5 для ЭхоКГ,
— 0,7-0,9 для ЭхоКГ с контрастированием левых отделов и
— 0,3-0,6 для МРТ.
Особенное значение эта проблема имеет в стресс-ЭхоКГ и при диагностике жизнеспособного миокарда в зонах с нарушенной сократимостью (см. соответствующие главы).
3. Анализ региональной деформации. В настоящее время наиболее перспективным подходом к количественной оценке локальной сократимости является анализ региональной деформации (strain/strain rate) при помощи тканевой допплерографии. Здесь можно локально и количественно оценить степень выраженности и временную динамику систолической и диастолической деформации (например, продольное укорочение и удлинение на апикальных сечениях). Но до сих пор получаемые данные чувствительны к артефактам, обременены шумовым сигналом, и их часто бывает трудно интерпретировать. Методика двумерного отображения деформации (20-strain), находящаяся ныне в начальной стадии апробации, должна существенно улучшить данный методический подход.
б) Причины нарушения сократимости:
1. Коронарная болезнь сердца. Чаще всего локальные нарушения сократимости развиваются на фоне коронарной болезни сердца:
— После инфаркта развивается необратимое, сохраняющееся в покое нарушение локальной сократимости. При этом большой постинфарктный рубец проявляется в виде акинезии или аневризмы, а после мелких инфарктов остается лишь гипокинезия или существенное нарушение локальной сократимости не определяется. Большие постинфарктные рубцы характеризуются уменьшением толщины стенки примерно на 30% и иногда несколько более высокой эхогенностью, чем окружающий миокард, что объясняется более высоким содержанием коллагена в рубце.
Надежное соотнесение нарушения локальной сократимости с гистологической зоной инфаркта осложняется связностью всех сегментов миокарда: как соседние, нормально сокращающиеся области миокарда могут «увлекать» акинетическую зону инфаркта, так и, наоборот, нарушения локальной сократимости в инфарктной зоне могут снижать амплитуду сокращений соседних здоровых сегментов («теттеринг-эффект»),
— В случае острой ишемии в покое или на фоне нагрузки (обратимые нарушения сократимости, диагностическое использование в стресс-ЭхоКГ).
— В покое в связи с оглушенным (станнинг) или гибернирующим миокардом, т.е. отсутствием (или снижением) сократимости в еще жизнеспособном миокарде.
2. Другие заболевания. Кроме КБС, нарушения локальной сократимости могут развиваться при следующих заболеваниях:
— ДКМП: хотя поражение часто имеет диффузный характер, но нередко обнаруживаются зоны гипокинезии различной степени выраженности. Однако аневризмы при этом заболевании не встречаются.
— Миокардиты: здесь изредка встречаются и более выраженные нарушения локальной сократимости, например, апикальная аневризма при болезни Чагаса (Trypanosoma cruzii).
— Нарушения локальной сократимости, поражающие только межжелудочковую перегородку, без вовлечения остальной перфузионной территории ПМЖВ, т.е. передней стенки: они встречаются относительно часто. С одной стороны, возможно развитие аномального временного паттерна сократимости с сохраненным утолщением перегородки в результате локального замедления механической систолы (например, при блокаде левой ножки пучка Гиса, правожелудочковом кардиостимуляторе, синдроме WPW, после кардиохирургического вмешательства), а также в результате взаимодействия левого и правого желудочков или наложения движения всего сердца в грудной клетке на процессы сокращения, например, после операции на сердце, при повышении нагрузки давлением или объемом на правый желудочек или в случае значительного перикардиального выпота.
Если в начале систолы происходит движение перегородки, направленное наружу, то такая ситуация обозначается термином «парадоксальная перегородка», что, будучи неспецифическим изменением, может встречаться при всех вышеназванных клинических ситуациях. С другой стороны, может развиваться истинное снижение амплитуды сокращений, как, например, при КБС (закупорка септальной ветви) или кардиомиопатии.
Редактор: Искандер Милевски. Дата публикации: 26.12.2019
Какие нарушения сердца видны через ЭхоКГ
Сердце – особенный орган, и УЗИ для него тоже особенное. Называется – ЭхоКГ.
Почему нельзя делать УЗИ сердца на обычном ультразвуковом аппарате?
Можно, но только результат исследования окажется неполным. Дело в том, что у эхокардиографа есть дополнительные возможности и особые датчики, которые позволяют получить качественное изображение органа, постоянно находящегося в движении. Кроме того, любой аппарат способен проводить исследование с эффектом Доплера. Доплерография даёт возможность оценить скоростные показатели потока крови, его направление, наличие патологического сброса. Это принципиально важно при оценке состояния клапанов сердца и перегородок, расположенных между предсердиями и желудочками. Наконец, к эхокардиографу можно подсоединить специальный датчик для проведения чреспищеводной эхокардиографии, который внешне больше напоминает гастроскоп.
Говорят, что ЭхоКГ это золотой стандарт в окончательной диагностике инфаркта?
По сути именно ЭхоКГ ставит точку в решении вопроса, были инфаркт миокарда или всё-таки нет. Такую возможность даёт прицельное изучение стенок сердца – передней, боковой, задней или нижней, а также межжелудочковой перегородки. Если миокард в этих зонах получил некротическое повреждение и там сформировался рубец, на эхокардиографии будет выявлено нарушение его сократимости. Это значит, что стенка сокращаться хуже, отставать от рядом расположенных (гипокинезия), сокращаться в своем режиме, что называется, не попадая в ногу (дискинезия), или вообще не будет сокращаться, выбиваясь из общего марша (акинезия). Если подобные изменения обнаружены (а они нередко бывают случайной находкой, без указания на перенесённый инфаркт), то вероятность инфаркта в прошлом более 90%. Если же в диагнозе стоит инфаркт, а по данным ЭКГ и ЭхоКГ подтверждений этому обнаружить не удаётся, скорее всего, речь идет о гипердиагностике и инфаркта на самом деле не было.
Какие показатели ЭхоКГ можно назвать наиболее важными?
Силу сердечной мышцы показывает так называемая фракция выброса (ФВ). Если этот показатель снижен, речь может идти о хронической сердечной недостаточности. Наличие нарушений локальной сократимости миокарда стенок сердца (гипокинезия, дисикинезия, акинезия) свидетельствует о перенесённом инфаркте или ишемии. Оценка клапанов включает количество створок, размер отверстия, доплерографически определяется наличие обратного сброса крови (недостаточность клапана) или повышенного градиента давления на клапане, свидетельствующего о формировании сужения (стеноза) клапана. Недостаточность клапанов или регургитация измеряется в степенях: от первой до четвёртой. Если первую и вторую можно отнести к варианту нормы, то третью (выраженную,) а тем более четвёртую считают патологией, которая требует хирургической коррекции. Анализ перегородок сердца помогает выявить наличие патологических отверстий и сброса крови через них (дефектов межпредсердной и межжелудочковой перегородок). Важную информацию представляют размеры камер сердца, толщина миокарда и наличие его гипертрофии, тромбы в полости сердца.
Что такое стресс — ЭхоКГ?
Если у пациента подозревают ишемическую болезнь сердца, врач-кардиолог обычно назначает нагрузочный тест. Часто это велоэргометрия или тредмил, когда пациент крутит педали велосипеда или идёт по беговой дорожке, а у него постоянно фиксируют ЭКГ, дожидаясь появления ишемии. Но раньше появления изменений на ЭКГ появляются те самые изменения кинетики стенок, о которых мы уже говорили. Тем более, сразу можно точно обнаружить стенку сердца, которая страдает больше всего, и предположить, какая именно артерия сужена бляшками. Поэтому, стресс-тест с ЭхоКГ считается более информативным. Его проводят с помощью физической нагрузки, когда пациент крутит педали на специальном велосипеде в лежачем положении, либо стимулируя работу сердца с помощью введения в вену специальных лекарств. В результате сердце работает намного активнее, и фрагменты миокарда, испытывающие нехватку питания, сокращаются хуже остальных.
Зачем назначают чреспищеводное ЭхоКГ?
В некоторых случаях даже после проведения стандартного ЭхоКГ кардиологам требуется уточнение. То, что не удалось увидеть через грудную клетку с помощью обычного датчика, можно рассмотреть из пищевода с помощью датчика, больше напоминающего гастроскоп. Оказывается, изнутри лучше видно пороки клапанов сердца, состояние его перегородок и наличие тромбов в предсердиях. Исследование проводится в сознании под действием легких снотворных препаратов, по ощущениям приятным его не назовешь, но и слишком дискомфортным тоже, но напоминает проведение обычной гастроскопии.
Как подготовиться к ЭхоКГ?
Обычное исследование, которое называют трансторакальным, особой подготовки не требует. Если речь идёт о чреспищеводном исследовании, то предварительно нужно будет выполнить гастроскопию, чтобы убедиться, что в пищеводе нет эрозий, варикозно расширенных вен и других нарушений. Если в ходе исследования выясниться, что человек с трудом переносит введение «шланга» и в верхние отделы ЖКТ, чреспищеводное ЭхоКГ можно буде провести под внутривенной анестезий, как говорят пациенты «во сне».
Сегодня ЭхоКГ, как и все исследования, активно развивается. Теперь его делают не только из пищевода, но и непосредственно из полости сердца – так называемое внутрисердечное ЭхоКГ. Для этого датчик доводят до сердца от паховых сосудов. Результаты исследования представляют в виде трёхмерных двигающихся изображений такого качества, что врачу трудно отличить реконструкцию от реального бьющегося сердца.
Если у Вас остались вопросы, Вы можете задать их кардиологу онлайн в приложении Доктис.
Онлайн консультации врачей
в мобильном приложении Доктис
Дежурный терапевт и педиатр консультируют бесплатно
© 2016-2021, ООО «Диджитал Медикэл Оперейшнс»
Лицензия на осуществление мед деятельности ЛО-76-01-002757.
Адрес: 121205, г. Москва, Территория Сколково Инновационного Центра, бульвар Большой, д. 42, стр. 1, эт. 4, пом. 1594, раб. 2
Филиал в г. Ярославль: 150062, Ярославская область, г. Ярославль, ул. 5-я Яковлевская, д.17
Аневризма левого желудочка сердца
Тел.: 8-800-25-03-03-2
(бесплатно для звонков из регионов России)
Санкт-Петербург, наб. реки Фонтанки, д. 154
Тел.: +7 (812) 676-25-25
Санкт-Петербург, В.О., Кадетская линия, д. 13-15
Тел.: +7 (812) 676-25-25
Санкт-Петербург, ул. Циолковского, д.3
Тел.: +7 (812) 676-25-10
В результате ткань истончается и растягивается, образуя выпячивание- аневризму. Чаще всего поражается левый желудочек в передней верхней части.
Аневризма левого желудочка сердца классифицируется по нескольким признакам:
1. По времени появления:
2. По форме проявления:
В практике более часто встречаются диффузные формы, реже диагностируют расслаивающуюся и грибовидную аневризмы.
Симптомы и причины появления
Основная причина появления аневризма — инфаркт миокарда. Так же появление истонченных, выпирающих участков ткани на сердце может быть спровоцировано такими причинами, как:
Симптоматически наличие аневризмы левого желудочка сердца определить невозможно, но поскольку она вызывает нарушения работы сердца то и, соответственно, вызывает общие признаки расстройства сердечной деятельности. Среди них:
Диагностировать аневризму желудочка сердца может врач-кардиолог. После осмотра пациента и получения результатов всех необходимых исследований, в том числе ЭКГ, УЗИ и МРТ. Своевременная диагностика поможет избежать тяжелейших осложнений, часто смертельных. Для определения плана лечения необходимо точно знать локализацию, структуру и размеры аневризмы.
Методы диагностики
Главные способы диагностирования аневризмы основаны на последовательном выявлении клинических и инструментальных признаков. Начинается обследование с опроса больного, сбора анамнеза, некоторых лабораторных исследований крови и мочи — эти данные позволяют обнаружить сопутствующие заболевания, наличие которые может повлиять на развитие аневризмы. Пациент также получает направление на ЭКГ, МРТ или УЗИ и другие исследования.
Традиционные методы диагностики и информация, которую они предоставляют:
Комплексное всестороннее обследование пациента позволяет получить полную картину деформации тканей желудочка, а значит, назначить точное и наиболее эффективное лечение. Помимо медикаментозной терапии, больным с выявленной аневризмой левого желудочка сердца может быть назначено хирургическое вмешательство. Обычно такое решение принимается лечащим врачом в случае, если размеры поврежденной ткани превышают 20% площади стенки.
Методы лечения
В связи с относительно благоприятным прогнозом при бессимптомных аневризмах левого желудочка (ЛЖ), показания к хирургическому лечению у таких пациентов относительны. Тем не менее, у пациентов, которым показана хирургическая реваскуляризация миокарда (АКШ), в некоторых случаях необходимо выполнять хирургическое восстановление правильной формы левого желудочка.
Хирургическое лечение абсолютно показано пациентам, у которых в результате инфаркта миокарда появилась дисфункция ЛЖ с участками акинезии и дискинезии его стенок и закономерным увеличением объема ЛЖ: > 80 мл / м 2 при сокращении и > 120 мл / м 2 в момент расслабления, а также при угрозе разрыва аневризмы и в случае тромбоэмболического синдрома при тромбированных аневризмах.
При правильном профессиональном подходе, внимательном изучении функции ЛЖ по данным ЭхоКГ, оценке формы и локализации аневризмы, фракции выброса сокращающейся (уцелевшей) части ЛЖ – операция по устранению левожелудочковой аневризмы является вполне оправданной, так как впоследствии снижается напряжение в стенке ЛЖ, мышечные волокна вновь направляются в правильную сторону, возрастает систолическая и улучшается диастолическая функция ЛЖ.
Относительные противопоказания: крайне высокий риск анестезии, отсутствие «живого» миокарда за пределами аневризмы, низкий сердечный индекс.
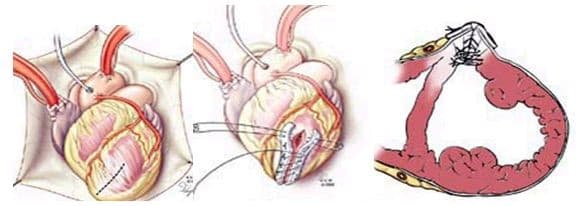
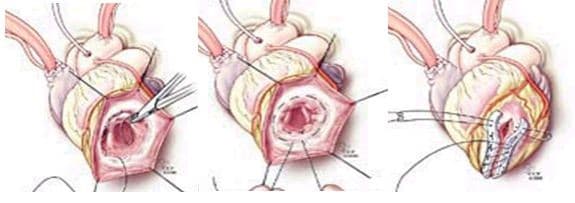
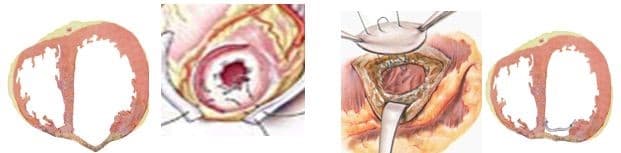
При хирургическом лечении аневризмы ЛЖ выполняется стандартный доступ путем срединной стернотомии. Аппарат искусственного кровообращения подключается как для АКШ, для удобства устанавливается дренаж ЛЖ через правые легочные вены. После кардиоплегии участок аневризмы выглядит как белесая, фиброзная площадка, впалая в полость левого желудочка. Выполняется разрез аневризмы вдоль передней нисходящей артерии, отступая от нее не менее 1,5 см. Имеющийся в полости тромб удаляется, исключая оставление даже очень мелких фрагментов. Часто такие операции сопровождаются вмешательством на митральном клапане, а также шунтированием передней нисходящей артерии и других артерий при наличии показаний. Оценив объем резецированного участка приступают к ремоделированию и восстановлению геометрии ЛЖ. Методик для этого предложено много, ниже мы приведем основные из них. После завершения хирургических манипуляций на сердце, выполняется важный процесс изгнания воздуха из полостей сердца, следом к сердцу пускают кровоток, снимая зажим с аорты, и через пару минут происходит восстановление сердечной деятельности. Окончание сеанса искусственного кровообращения для оперированного ЛЖ может стать настоящим испытанием и потребовать применение до трех инотропных и вазопрессорных препаратов, а также внутриаортальной баллонной контрапульсации.
Техники ремоделирования ЛЖ
Прогресс не стоит на месте, и методики постоянно совершенствуются, но основные хирургические принципы для лечения данной патологии представлены вашему вниманию и заключаются в стремлении к уменьшению полости ЛЖ за счет резекции нефункционального аневризматического мешка и восстановлению близкой к нормальной геометрической формы ЛЖ применяя разной формы заплаты и кисетные пластики.
Результаты хирургического лечения аневризмы левого желудочка сердца
Частым осложнением после операции по поводу аневризмы ЛЖ является синдром малого выброса, который развивается вследствие чрезмерного уменьшения размеров полости ЛЖ, а так же желудочковые нарушения ритма и легочная недостаточность.
30-ти дневная летальность в последние годы снизилась и составляет 3-7%. Факторы повышенного риска операции это: пожилой возраст, женский пол, операция в экстренном порядке, а так же операция дополненная протезированием митрального клапана, исходно низкая сократительная способность миокарда (ФВ менее 30%), умеренная и высокая легочная гипертензия, почечная недостаточность.
В нашей клинике успешно выполняются все виды операций на сердце включая хирургическое ремоделирование и пластику при аневризмах ЛЖ.
Лечение гипертрофической кардиомиопатии
Гипертрофическая кардиомиопатия (ГКМП) – это генетически обусловленное заболевание миокарда, проявляющееся комплексом специфических морфо-функциональных изменений
Лечение гипертрофической кардиомиопатии
Гипертрофическая кардиомиопатия (ГКМП) – это генетически обусловленное заболевание миокарда, проявляющееся комплексом специфических морфо-функциональных изменений и постепенно прогрессирующим течением с высоким риском развития жизнеугрожающих аритмий и внезапной смерти.
Типичными являются морфологические изменения: аномалия архитектоники сократительных элементов миокарда (гипертрофия и дезориентация мышечных волокон), развитие фибротических изменений мышцы сердца, патология мелких интрамиокардиальных сосудов.
При ГКМП происходит массивная гипертрофия миокарда левого (и реже правого желудочка), чаще асимметричного характера за счет утолщения межжелудочковой перегородки, часто с развитием обструкции выходного тракта левого желудочка (ЛЖ) при отсутствии каких-либо явных причин.
Общепризнанной является представление о преимущественно наследственной природе ГКМП. В связи с этим, широкое распространение получил термин «семейная гипертрофическая кардиомиопатия». К настоящему времени установлено, что более половины всех случаев заболевания являются наследуемыми, при этом основной тип наследования – аутосомно-доминантный. Оставшиеся приходятся на так называемую спорадическую форму; в этом случае у пациента нет родственников, болеющих ГКМП или имеющих гипертрофию миокарда. Считается, что большинство, если не все случаи спорадической ГКМП, также имеют генетическую причину, т. е. вызваны случайными мутациями.
Гипертрофическая кардиомиопатия – это генетически гетерогенное заболевание, причиной которого являются более 200 описанных мутаций нескольких генов, кодирующих белки миофибриллярного аппарата. К настоящему времени известны 10 белковых компонентов сердечного саркомера, выполняющих контрактильную, структурную или регуляторную функции, дефекты которых наблюдаются при ГКМП. Причем в каждом гене множество мутаций могут становиться причиной заболевания (полигенное мультиаллельное заболевание).
Наличие той или иной ассоциированной с ГКМП мутации признается «золотым» стандартом диагностики заболевания. При этом описанные генетические дефекты характеризуются разной степенью пенетрантности, выраженностью морфологических и клинических проявлений. Тяжесть клинической картины зависит от присутствия и степени гипертрофии.
Таким образом, ГКМП характеризуется крайней гетерогенностью вызывающих ее причин, морфологических, гемодинамических и клинических проявлений, разнообразием вариантов течения и прогноза, что существенно затрудняет выбор адекватных и наиболее эффективных лечебных подходов по контролю и коррекции имеющихся нарушений.
Возможны три гемодинамических варианта обструктивной ГКМП:
Cимптомы болезни разнообразны и малоспецифичны, связаны с гемодинамическими нарушениями (диастолическая дисфункция, динамическая обструкция путей оттока, митральная регургитация), ишемией миокарда, патологией вегетативной регуляции кровообращения и нарушением электрофизиологических процессов в сердце. Диапазон клинических проявлений крайне велик: от бессимптомных до неуклонно прогрессирующих и трудно поддающихся медикаментозному лечению форм, сопровождающихся тяжелой симптоматикой.
Повышение диастолического давления в левом желудочке из-за диастолической дисфункции, динамическая обструкция выносящего тракта левого желудочка проявляются одышкой в покое и при физической нагрузке, утомляемости, слабости. Нарастание давления в малом круге кровообращения сопровождается развитием острой левожелудочковой недостаточности (чаще в ночные часы – сердечная астма, альвеолярный отек легких).
Падение фракции выброса при физической нагрузке или нарушениях сердечного ритма сопровождается ухудшением кровообращения головного мозга. Преходящая ишемия мозговых структур проявляется кратковременной потерей сознания (обморок) или предобморочными состояниями (внезапная слабость, головокружение, потемнение в глазах, шум и «заложенность» в ушах).
Методы исследования:
ЭХО-КГ – основной метод диагностики ГКМП. Критериями диагностики ГКМП на основании данных ЭХО-КГ являются:
Если в покое обструкции выносящего тракта левого желудочка нет, ее можно спровоцировать медикаментозными (ингаляция амилнитрита, введение изопреналина, добутамина) или функциональными пробами (проба Вальсальвы, физическая нагрузка), которые уменьшают преднагрузку или повышают сократимость левого желудочка.
Катетеризация сердца и коронарная ангиография проводятся для оценки коронарного русла перед миоэктомией или операцией на митральном клапане, а также чтобы выяснить причину ишемии миокарда. При этом к характерным признакам ГКМП относят:
Сцинтиграфия миокарда и позитронно-эмиссионная томография
При гипертрофической кардиомиопатии сцинтиграфия миокарда имеет некоторые особенности, однако в целом ее значение в диагностике ишемии такое же, как и обычно. Стойкие дефекты накопления указывают на рубцовые изменения после инфаркта миокарда, обычно они сопровождаются снижением функции левого желудочка и плохой переносимостью физической нагрузки. Обратимые дефекты накопления указывают на ишемию, вызванную снижением коронарного резерва при нормальных артериях или коронарным атеросклерозом. Обратимые дефекты часто никак не проявляются, однако, по-видимому, они повышают риск внезапной смерти, особенно у молодых больных с гипертрофической кардиомиопатией. При изотопной вентрикулографии можно выявить замедленное наполнение левого желудочка и удлинение периода изоволюмического расслабления.
Позитронно-эмиссионная томография – более чувствительный метод, кроме того, она позволяет учесть и устранить помехи, связанные с затуханием сигнала. Позитронно-эмиссионная томография с фтордезоксиглюкозой подтверждает наличие субэндокарлиальной ишемии, вызванной снижением коронарного резерва.
Современные подходы к лечению ГКМП
По современным представлениям, лечебная стратегия определяется в процессе разделения больных на категории в зависимости от описанных выше вариантов течения и прогноза.
Все лица с ГКМП, включая носителей патологических мутаций без фенотипических проявлений болезни и пациентов с бессимптомным течением заболевания, нуждаются в динамическом наблюдении, в ходе которого оцениваются характер и выраженность морфологических и гемодинамических нарушений. Особое значение имеет выявление факторов, определяющих неблагоприятный прогноз и повышенный риск внезапной смерти (в частности, скрытых, прогностически значимых аритмий).
Общие мероприятия
Ограничение значительных физических нагрузок и запрещение занятий спортом, способных вызывать усугубление гипертрофии миокарда, повышение внутрижелудочкового градиента давления и риска внезапной смерти.
Медикаментозное лечение
До настоящего времени окончательно не решен вопрос о необходимости проведения активной медикаментозной терапии у наиболее многочисленной группы больных с бессимптомной или малосимптомной формами ГКМП и низкой вероятностью внезапной смерти. Противники активной тактики обращают внимание на то, что при благоприятном течении заболевания продолжительность жизни и показатели смертности не отличаются от таковых в общей популяции. Некоторые же авторы указывают на то, что использование в этой группе пациентов β-адреноблокаторов и антагонистов кальция (верапамил) может приводить к сдерживанию гемодинамических нарушений и клинической симптоматики. При этом никто не оспаривает тот факт, что выжидательная тактика в случаях бессимптомного или малосимптомного течения ГКМП возможна лишь при отсутствии признаков внутрижелудочковой обструкции, обмороков и серьезных нарушений сердечного ритма, отягощенной наследственности и случаев ВС у близких родственников.
Следует признать, что лечение ГКМП, генетически обусловленного заболевания, обычно распознаваемого на поздней стадии, пока может быть в большей степени симптоматическим и паллиативным. Тем не менее к основным задачам лечебных мероприятий относятся не только профилактика и коррекция основных клинических проявлений заболевания с улучшением качества жизни пациентов, но и положительное влияние на прогноз, предупреждение случаев ВС и прогрессирования заболевания.
Основу медикаментозной терапии ГКМП составляют препараты с отрицательным инотропным действием: β-адреноблокаторы и блокаторы кальциевых каналов. Для лечения весьма распространенных при этом заболевании нарушений сердечного ритма используются также дизопирамид (антиаритмический препарат IA класса) и амиодарон.
Предпочтение отдается β-блокаторам без внутренней симпатомиметической активности. Наибольший опыт накоплен по применению пропранолола (обзидан, анаприлин). Его назначают начиная с 20 мг 3-4 раза в день, с постепенным увеличением дозы под контролем пульса и артериального давления (АД) до максимально переносимой в большинстве случаев 120–240 мг/сут. Следует стремиться к применению возможно более высоких доз препарата, так как отсутствие эффекта терапии β-блокаторами, вероятно, связано с недостаточной дозировкой. При этом нельзя забывать о том, что повышение дозировок существенно увеличивает риск известных побочных эффектов.
Инвазивные методы лечения:
1. Чрезаортальная септальная миэктомия
2. Вальвулопластики или протезирования митрального клапана
В ряде случаев при наличии дополнительных показаний для уменьшения выраженности обструкции и митральной регургитации одномоментно выполняется операция вальвулопластики или протезирования митрального клапана низкопрофильным протезом. Улучшить отдаленные результаты миэктомии позволяет последующая длительная терапия верапамилом, обеспечивающая улучшение диастолической функции ЛЖ, что не достигается при хирургическом лечении.
3. Иссечения межжелудочковой перегородки
В настоящее время разработаны и успешно применяются отличные от классической миэктомии методики. В частности, в НЦССХ им. А. Н. Бакулева под руководством академика Л. А. Бокерия разработана оригинальная методика иссечения зоны гипертрофированной МЖП из конусной части правого желудочка. Этот способ хирургической коррекции обструктивной ГКМП является высокоэффективным и может стать методом выбора в случаях одновременной обструкции выходных отделов обоих желудочков, а также в случаях среднежелудочковой обструкции ЛЖ.
4. Транскатетерная септальная аблация
Другим альтернативным методом лечения рефракторной обструктивной ГКМП является транскатетерная алкогольная септальная аблация. Методика предполагает инфузию через баллонный катетер в перфорантную септальную ветвь 1–3 мл 95% спирта, вследствие чего возникает инфаркт гипертрофированного отдела МЖП, захватывающей от 3 до 10% массы миокарда ЛЖ (до 20% массы МЖП). Это приводит к значимому уменьшению выраженности обструкции выходного тракта и митральной недостаточности, объективной и субъективной симптоматике заболевания.
В Волынской больнице отработана методика выполнения транскатетерной септальной аблации при ГКМП. Доказан положительный результат данного вмешательства при относительно низком риске развития осложнений.