для чего используется белый фосфор
Легенды о фосфоре. Часть вторая
С начала 1942 года советская авиация на некоторое время перестала использовать фосфорные боеприпасы, однако это не сказалось на разработке и реализации других идей применения фосфора в военных целях. Все стороны, участвующие в войне, так или иначе применяли фосфорсодержащие смеси и составы, используя такие свойства этого элемента, как способности к самовозгоранию и образованию густого белого ядовитого дыма, реже — яркость пламени и его хорошую видимость. За годы Второй мировой войны в разных странах были созданы десятки составов и смесей разного назначения, содержащих фосфор. Всевозможных свидетельств применения таких боеприпасов существует сотни. Однако, как уже говорилось ранее, большинство способов применения белого фосфора во Второй мировой войне подразумевало составы, где он был лишь одним из компонентов. Поэтому далее мы ограничим понятие «фосфорное оружие» и будем считать таковым только те боеприпасы, составы и смеси, где содержание этого элемента составляло более пяти процентов. Только советская авиация (и, возможно, японская) применяла гранулированный белый фосфор «в чистом виде» (да и это несколько условно, так как сам фосфор, заправляемый в ВАПы, содержал до 30 процентов различных добавок).
Зимой 42-43 года некоторыми советскими партизанами применялся специальный состав, получивший название «партизанское мыло». Оно действительно было похоже внешне на хозяйственное мыло, хотя и содержало до 30 % белого фосфора. И в случае досмотра немецкими солдатами или полицаями можно было даже слегка намылить брусок, показав, что ничего опасного в нем нет.
Идея этого состава возникла, скорее всего, из-за того, что сам белый фосфор еще со времен Первой мировой войны, как правило, применялся не в чистом виде, а с добавлением так называемых пластификаторов — специальных добавок, обеспечивающих фосфору не только необходимые пластические свойства но и, что более важно, способность гореть равномерно и достаточно медленно. В странах Антанты для этого использовали чаще всего натуральный каучук, считавшийся наиболее подходящим для этой цели, в Германии — разные синтетические соединения, получаемые из каменноугольных смол. Часто помимо пластификаторов фосфор смешивали с серой. Из-за этих добавок в то время было даже распространено название «желтый фосфор», которым обычно называли белый фосфор в смеси с различными добавками (именно «желтым фосфором» начинялись различные зажигательные фосфорные боеприпасы — пули, снаряды, гранаты). Боеприпасы с желтым фосфором не требовали жестких условий хранения и могли применяться более массово. В Советском Союзе в качестве пластификаторов гранулированного белого фосфора использовались разные вещества — дибутилфталат, вазелин, воск, искусственные каучуки. При слишком большом количестве пластификаторов способность фосфора самовозгораться на воздухе резко снижалась (особенно в холодную погоду). Однако при нагревании такая смесь всё же воспламенялась. Именно это свойство и было использовано в «партизанском мыле». Например, его можно было незаметно спрятать в буксе паровоза, а еще лучше — вагона с боеприпасами. Главное, что возгорание происходило уже во время движения поезда…
Разумеется, «партизанское мыло» было чрезвычайно опасно, прежде всего из-за токсических свойств фосфора. Да и применять его следовало в течение суток после извлечения из специального пакета.
К этому стоит еще добавить, что изобретение «партизанского мыла» приписывается обычно Анатолию Трофимовичу Качугину, под руководством которого были также разработаны рецепты многих зажигательных средств, включая «коктейли Молотова» и жидкости «КС».
В то же время есть более достоверные сведения о применении белого фосфора советскими штурмовиками, действовавшими против судов, снабжавших немецкие и румынские войска, отрезанные от основных сил на Таманском полуострове. С января 1943 года морские коммуникации между Керченским и Таманским полуостровами приобрели решающее значение. Благодаря небольшому расстоянию немцам иногда удавалось провести до 3-х конвоев за сутки. Соответственно возросла и активность советской авиации, налеты совершались непрерывно, на протяжении всего короткого пути между портами. Однако сторожевые корабли, быстроходные десантные баржи (БДБ) типа «F», самоходные паромы типа «Зибель», и другие немецкие транспорты малого тоннажа были прекрасно обеспечены огневыми средствами ПВО. Кроме того, они обладали хорошей маневренностью, а во время авианалетов группировались, образуя плотную завесу огня. Транспорты прикрывали с воздуха значительные силы истребителей. Бомбардировщики «Пе-2» и «А-20» («Бостон»), а также штурмовики «Ил-2» несли большие потери, эффективность их ударов была низкой, особенно в начале 43 года. Возможно поэтому здесь советским командованием было решено вновь использовать фосфор. В книге В. Перова и О. Растренина «Летающий танк» приводится пример одной такой атаки с применением выливных авиаприборов ВАП-250.
«В 6.35 10 августа воздушная разведка по радио донесла, что в районе Панагия — м. Железный Рог обнаружены 8 БДБ противника с грузом и живой силой, идущих на Анапу в двухкильватерной колонне под охраной четырех СКА в голове колонны. Для удара по конвою вылетели 7 Ил-2 8-го гшап (ведущий к-н Вартаньян) под прикрытием 10 Як-1 9-го иап (ведущий к-н Азаров). В 7.55 в районе оз. Соленое с высоты 900 м штурмовики атаковали БДБ (координаты 45° с.ш. и 36°38′ в.д.) с крутого планирования под углом 25-30°. Первый заход выполнялся в боевом порядке «фронт» самолетов с правого борта. Обе атаки производились под углом 80-90° к курсу кораблей. После атаки штурмовики выполнили поворот «все вдруг» и атаковали конвой с левого борта с высоты 25-50 м. БДБ поражались бомбами ФАБ-50, АО-25, РОФС-132, РС-82, пулеметно-пушечным огнем и гранулированным фосфором. Конвой противника во время удара маневрировал, меняя курс и ход, перестраивался в шахматный порядок. В результате удара были потоплены одна БДБ и один СКА, две БДБ загорелись, и люди с них прыгали в воду. На отходе от цели группа была атакована 4 Bf 109 и 21 Fw 190, однако хорошее управление и взаимодействие штурмовиков с истребителями прикрытия в бою обеспечили группу от потерь».
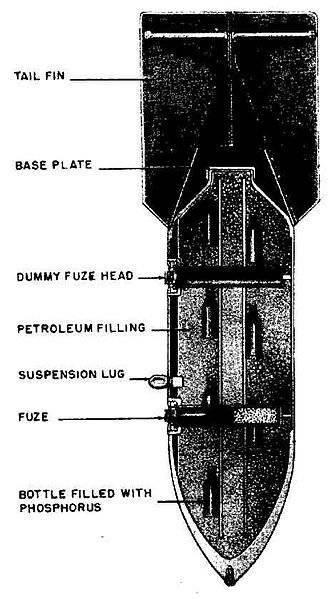
Во время высадки в Нормандии немецкие укрепления обстреливались корабельными снарядами, а также минами из 81-миллиметровых минометов, начиненными фосфорсодержащей смесью. Известно, что пожары, вызываемые такими боеприпасами, вызывали сильную панику, однако подробных сведений об этом найти не удалось.
В отчете американского адмирала Генри Хьюитта, командовавшего военно-морскими силами во время высадки в Сицилии, есть такой пример: «…Особо следует отметить использование дымовых завес при высадке в районе «Джосс» рано утром в D-день. Эсминец «Уолси» поставил очень действенную дымовую завесу на левом фланге одного из участков, используя 127-мм снаряды с белым фосфором. Они полностью укрыли плацдарм и десантные баржи от вражеских батарей, стрелявших из Ликаты…»
Конечно, это неполный обзор всех способов применения фосфора во Второй мировой войне. Наверняка их было намного больше, и в первую очередь на Дальневосточных и Тихоокеанских театрах военных действий. Вообще, большая часть легенд о применении фосфора сосредоточена именно там и связана с японцами. Но это уже требует отдельного исследования. Упомянем лишь об одном таком изобретении. Упоминания о нем неоднократно встречаются в свидетельствах участников боевых действий.
На заключительном этапе войны японцы широко применяли зенитные снаряды с составом, содержащим фосфор. Образуемые им в воздухе густые белые облака представляли собой серьезное затруднение для маневров американских пикировщиков. И дело тут не только в ограничении видимости. Затягиваемые через воздухозаборники «Хеллдайверов» компоненты дымовой смеси могли вывести двигатель из строя.
В книге Питера Смита «Пикирующие бомбардировщики» при описании атаки на «Ямато» в апреле 1945 года есть такой фрагмент: «…Примерно в 12.50 самолеты «Хорнета» атаковали японцев, следом за ними — самолеты «Эссекса». Первыми в атаку ринулись пикировщики, которые начали пике с высоты 6200 футов. Они следили за «Ямато» с помощью радара. Примерно за 30 секунд до начала «Ямато» развернулся правым бортом к атакующим.
Японцы вели жаркий огонь из всех орудий. Разрывы тяжелых снарядов обычно были черными, но примерно одна десятая снарядов давал а белый фосфорный дым. Пилоты видели несколько грязно-желтых облачков, кто-то едва не столкнулся со светящимися красными шариками диаметром около дюйма. Во время атаки японские корабли сумели сохранить строй, оставаясь на своих местах даже после попаданий. Стрельба велась только по атакующим самолетам, а не по тем, кто уходил или готовился атаковать…»
К сожалению, точных данных о составе смеси, применяемой в этих снарядах, в англоязычных источниках нет, так что этот вопрос ждет участия специалистов, способных работать с японскими источниками. Тема применения японцами фосфорных боеприпасов (в том числе против мирного населения) довольно обширна, и она еще ждет своих первооткрывателей.
Белый фосфор: свойства, история открытия и применение
Фосфор – важная составляющая живой и неживой природы. Он находится в недрах Земли, воде и в нашем организме, а академик Ферсман даже прозвал его «элементом жизни и мысли». Несмотря на свою полезность, белый фосфор может быть чрезвычайно опасен и ядовит. Давайте же поговорим подробнее о его характеристиках.
Открытие элемента
История открытия фосфора началась с алхимии. Начиная с XV века европейские ученые жаждали отыскать философский камень или же «великий эликсир», при помощи которого удастся превращать любые металлы в золото.
В XVII веке алхимик Хенниг Бранд решил, что путь к «магическому реактиву» лежит через мочу. Она жёлтая, а, значит, содержит золото или как-то с ним связана. Ученый старательно собирал материал, отстаивал его, а затем перегонял его. Вместо золота он получил белое вещество, которое светилось в темноте и неплохо горело.
Открытие Бранд назвал «холодным огнем». Позже получать фосфор подобным способом додумался ирландский алхимик Роберт Бойль и немец Андреас Магграф. Последний также добавлял в мочу уголь, песок и минерал фосгенит. Впоследствии вещество назвали phosphorus mirabilis, что переводилось как «чудотворный носитель света».
Светоносный элемент
Открытие фосфора стало настоящей сенсацией среди алхимиков. Одни то и дело пытались выкупить у Бранда секрет получения вещества, другие пробовали дойти до этого самостоятельно. В XVIII веке было доказано, что элемент содержится в костных останках организмов, и вскоре открылось несколько заводов по его производству.
Французский физик Лавуазье доказал, что фосфор является простым веществом. В таблице Менделеева он стоит под номером 15. Вместе с азотом, сурьмой, мышьяком и висмутом он относится к группе пниктидов и характеризуется как неметалл.
Элемент довольно распространенный в природе. В процентном соотношении в массе земной коры он занимает 13 место. Фосфор активно взаимодействует с кислородом и не встречается в свободном виде. Он существует в составе многочисленных минералов (больше 190), таких как фосфориты, апатиты и т.д.
Белый фосфор
Фосфор существует в виде нескольких форм или аллотропных модификаций. Они отличаются друг от друга плотностью, цветом и химическими свойствами. Обычно выделяют четыре главные формы: белый, черный, красный и металлический фосфор. Другие модификация представляют собой только смесь из вышеперечисленных.
Белый фосфор очень неустойчив. При нормальных условиях на свету он быстро переходит в красный, а высокое давление превращает его в черный. Его атомы расположены в виде тетраэдра. Он обладает кристаллической молекулярной решеткой, с формулой молекулы Р4.
Выделяю также жёлтый фосфор. Это не ещё одна модификация вещества, а название неочищенного белого фосфора. Он может иметь как светлый, так и темно-бурый оттенок и характеризуется сильной ядовитостью.
Свойства белого фосфора
По консистенции и внешнему виду вещество напоминает воск. Оно обладает чесночным запахом и жирное на ощупь. Фосфор мягкий (без особых усилий его можно разрезать ножом) и деформируется. После очищения становится бесцветным. Его прозрачные кристаллы радужно переливаются на солнце и похожи на алмазы.
Он плавится при 44 градусах. Активность вещества проявляется даже при комнатной температуре. Основная характеристика фосфора – его способность к хемилюминесценции или свечению. Окисляясь на воздухе, он излучает бело-зеленый свет, а со временем самовоспламеняется.
Вещество практически не растворяется в воде, но может гореть в ней при длительном контакте с кислородом. Оно хорошо растворяется в органических растворителях, например, в сероуглероде, жидком парафине и бензоле.
Применение фосфора
Человек «приручил» фосфор как в мирных, так и в военных целях. Вещество используют для производства фосфорной кислоты, которую применяют для удобрений. Раньше она широко использовалась для окраски шерсти, изготовления фоточувствительных эмульсий.
Красный фосфор используется более широко. Из него делают топливо, смазочные материалы, взрывчатые вещества и головки спичек. Различные соединения фосфора используют в промышленности в средствах для смягчения воды, добавляют в пассиваторные средства, чтобы защитить металл от коррозии.
Содержание в организме и влияние на человека
Фосфор является одним из жизненно необходимых элементов для нас. В виде соединений с кальцием он присутствует в зубах и скелете, придавая костям твердость и прочность. Элемент присутствует в соединениях АТФ и ДНК. Он имеет важнейшее значение для деятельности мозга. Находясь в нервных клетках, он способствует передаче нервных импульсов.
Фосфор содержится в мышечной ткани. Он участвует в процессе преобразования энергии из белков, жиров и углеводов, поступающих в организм. Элемент поддерживает кислотно-щелочной баланс в клетках, осуществляется их деление. Он способствует метаболизму, крайне необходим во время роста организма и его восстановления.
Вместе с тем, фосфор может быть опасен. Сам по себе белый фосфор является очень токсичным. Доза выше 50 миллиграмм приводит к летальному исходу. Отравление фосфором сопровождается рвотой, головной и желудочной болью. Попадание вещества на кожу вызывает ожоги, которые заживают очень медленно и болезненно.
Избыток фосфора в организме приводит к ломкости костей, возникновению сердечно-сосудистых заболеваний, появлению кровотечений, анемии. От перенасыщения фосфором страдают также печень и система пищеварения.
Белый фосфор
Белый фосфор
Полезное
Смотреть что такое «Белый фосфор» в других словарях:
белый фосфор — baltasis fosforas statusas T sritis chemija apibrėžtis Alotropinė P atmaina, sudaryta iš P₄ molekulių. atitikmenys: angl. yellow phosphorus; white phosphorus rus. белый фосфор … Chemijos terminų aiškinamasis žodynas
белый фосфор — baltasis fosforas statusas T sritis apsauga nuo naikinimo priemonių apibrėžtis Kietoji vaško pavidalo nuodingoji medžiaga. Gerai tirpsta skystuose organiniuose tirpikliuose. Laikomas vandenyje. Ore savaime užsidega ir dega išskirdamas baltus… … Apsaugos nuo naikinimo priemonių enciklopedinis žodynas
белый фосфор — обыкновенный фосфор, жёлтый фосфор … Cловарь химических синонимов I
Белый фосфор — … Википедия
ФОСФОР — ФОСФОР, хим. элемент (символ Р) с ат. в. 31,02, принадлежащий к V группе и 3 ряду периодической системы Менделеева (порядковый номер 15). Ф. широко распространен в природе, но лишь в виде кислородных соединений: почва содержит его в виде солей… … Большая медицинская энциклопедия
ФОСФОР — (символ Р), химический элемент пятой группы периодической таблицы, впервые обнаруженный в 1669 году. Встречается в виде ФОСФАТОВ в минералах, главный источник фосфора АПАТИТ. Этот элемент применяется для изготовления ФОСФОРНОЙ КИСОЛТЫ,… … Научно-технический энциклопедический словарь
Фосфор — представляет собой твердое вещество, мягкое и пластичное по консистенции, получаемое путем обработки природных фосфатов, смешанных с песком и углеродом, в электрической печи. Существуют две основные разновидности фосфора: а) белый фосфор,… … Официальная терминология
ФОСФОР — (лат. Phosphorus) Р, химический элемент V группы периодической системы Менделеева, атомный номер 15, атомная масса 30,97376. Название от греч. phosphoros светоносный. Образует несколько модификаций Белый фосфор (плотность 1,828 г/см³, tпл… … Большой Энциклопедический словарь
ФОСФОР — (Phosphorus), P, химический элемент V группы периодической системы, атомный номер 15, атомная масса 30,97376; неметалл белого (светится на воздухе, tпл 44,14шC), красного (tпл 593шC) или черного (tпл 1000шC) цвета. Фосфор используют в… … Современная энциклопедия
Фосфор — (Phosphorus), P, химический элемент V группы периодической системы, атомный номер 15, атомная масса 30,97376; неметалл белого (светится на воздухе, tпл 44,14°C), красного (tпл 593°C) или черного (tпл 1000°C) цвета. Фосфор используют в… … Иллюстрированный энциклопедический словарь
Белый фосфор
Описание презентации по отдельным слайдам:
Описание слайда:
Белый фосфор
Выполнила
Султангулова Екатерина
9-б класс
МБОУ СОШ №4
г.Урай
январь 2011
Описание слайда:
Белый фосфор представляет собой белое вещество (из-за примесей может иметь желтоватый оттенок) с температурой плавления 44,1 °С. По внешнему виду он очень похож на очищенный воск или парафин, легко режется ножом и деформируется от небольших усилий.
Белый фосфор имеет молекулярное строение; формула P4. Отливаемый в инертной атмосфере в виде палочек (слитков), он сохраняется в отсутствии воздуха под слоем очищенной воды или в специальных инертных средах.
Описание слайда:
Описание слайда:
Описание слайда:
Описание слайда:
Легко растворим в органических растворителях. Растворимостью белого фосфора в сероуглероде пользуются для промышленной очистки его от примесей. Плотность белого фосфора из всех его модификаций наименьшая и составляет около 1823 кг/м³.
Плавится белый фосфор при 44,1 °C. В парообразном состоянии происходит диссоциация молекул фосфора.
Белый фосфор не только активен химически, но и весьма ядовит (вызывает поражение костей, костного мозга, некроз челюстей). Летальная доза белого фосфора для взрослого мужчины составляет 0,05—0,1 г.
Описание слайда:
Открытие фосфора
Хенниг Бранд
Джозеф Райт
1771 год
Описание слайда:
Описание слайда:
Неочищенный белый фосфор обычно называют «жёлтый фосфор». Сильно ядовитое (ПДК в атмосферном воздухе 0,0005 мг/м³), огнеопасное кристаллическое вещество от светло-жёлтого до тёмно-бурого цвета.
В воде не растворяется, на воздухе легко окисляется и самовоспламеняется.
Горит ослепительным ярко-зеленым пламенем с выделением густого белого дыма — мелких частичек декаоксида тетрафосфора P4O10. Несмотря на то, что в результате реакции между фосфором и водой (4Р + 6Н2О → РН3 + 3Н3РО2) выделяется ядовитый газ фосфин (РН3), для тушения фосфора используют воду в больших количествах (для снижения температуры очага возгорания и перевода фосфора в твердое состояние) или раствор сульфата меди (медного купороса), после гашения фосфор засыпают влажным песком.
Для предохранения от самовозгорания желтый фосфор хранится и перевозится под слоем воды (раствора хлорида кальция).
Желтый фосфор на воздухе.
Описание слайда:
Красный фосфор
Красный фосфор, также называемый фиолетовым фосфором, — это более термодинамически стабильная модификация элементарного фосфора. Впервые он был получен в 1847 году в Швеции австрийским химиком А. Шрёттером при нагревании белого фосфора при 500 °С в атмосфере угарного газа (СО) в запаянной стеклянной ампуле.
Описание слайда:
Ядовитость его в тысячи раз меньше, чем у белого, поэтому он применяется гораздо шире, например, в производстве спичек (составом на основе красного фосфора покрыта тёрочная поверхность коробков). Плотность красного фосфора также выше, и достигает 2400 кг/м³ в литом виде.
При хранении на воздухе красный фосфор в присутствии влаги постепенно окисляется, образуя гигроскопичный оксид, поглощает воду и отсыревает («отмокает»), образуя вязкую фосфорную кислоту; поэтому его хранят в герметичной таре. При «отмокании» — промывают водой от остатков фосфорных кислот, высушивают и используют по назначению.
Описание слайда:
Чёрный фосфор — это наиболее стабильная термодинамически и химически наименее активная форма элементарного фосфора. Впервые чёрный фосфор был получен в 1914 году американским физиком П. У. Бриджменом из белого фосфора в виде чёрных блестящих кристаллов, имеющих высокую (2690 кг/м³) плотность. Для проведения синтеза чёрного фосфора Бриджмен применил давление в 2×109 Па (20 тысяч атмосфер) и температуру около 200 °С. Начало быстрого перехода лежит в области 13 000 атмосфер и температуре около 230 °С.
Описание слайда:
Чёрный фосфор представляет собой чёрное вещество с металлическим блеском, жирное на ощупь и весьма похожее на графит, и с полностью отсутствующей растворимостью в воде или органических растворителях.
Поджечь чёрный фосфор можно, только предварительно сильно раскалив в атмосфере чистого кислорода до 400 °С.
Удивительным свойством чёрного фосфора является его способность проводить электрический ток и свойства полупроводника.
Температура плавления чёрного фосфора 1000 °С под давлением 18×105 Па.
Описание слайда:
Спасибо за
внимание!!
Если Вы считаете, что материал нарушает авторские права либо по каким-то другим причинам должен быть удален с сайта, Вы можете оставить жалобу на материал.
Фосфор: физические и химические свойства
Содержание:
Каждый человек знаком с 15 элементом таблицы Менделеева – фосфором, ведь каждый в своей жизни хотя бы раз пользовался спичками, имеющими фосфор в своем составе. Более того, все люди содержат фосфор в своем организме, не в чистом виде, разумеется, а в виде химических соединений, но тем не менее. Особенно много фосфора находится в наших костях и зубах, чей химический состав почти полностью совпадает с формулой минерала фосфорита Ca3(PO4)2.Также фосфорсодержащие белки находятся в наших мышцах, нервах и мозговой ткани, именно поэтому фосфор особенно полезен для мозга. О физических и химических свойствах этого важного химического элемента, о его применении и влиянии на человека читайте далее.
История открытия
В 1669 гамбургский купец и по совместительству алхимик Хенниг Брандт в очередной раз пытался осуществить мечту всех средневековых алхимиков – найти легендарный философский камень, якобы превращающий все металлы в золото и дарующий бессмертие. Увы, философский камень и в этот раз найти не удалось, но, тем не менее, Хеннигу посчастливилось сделать другое не менее важное открытие в химии. На этот раз в качестве эксперимента немецкий алхимик решил выпаривать воду из… человеческой мочи. В результате череды сложных химических манипуляций над собственной мочой в реторте у алхимика образовалось неведомое до того светящееся вещество – фосфор.
Впрочем, Хенинг Брандт был не первым, кто добыл фосфор опытным путем. Еще до него, в XII веке это удалось сделать арабскому алхимику Алхиду Бехилу, все также благодаря химическим манипуляциям с мочой и глиной, но его открытие затерялось, и именно повторное открытие фосфора немецким алхимиком принесло широкую популярность этому химическому элементу.
Первое время после открытия фосфор вызывал лишь любопытство своим свечением и только в конце XIX века ученые поняли, что фосфор также является чрезвычайно важным полезным микроэлементом для жизнедеятельности человеческого организма.
Физические свойства
Как и азот, фосфор способен образовывать двухатомные молекулы Р2.. Однако подобные молекулы фосфора могут быть устойчивыми лишь при очень высокой температуре – около 1000 С. В обычных же условиях атомы фосфора соединяются в молекулы других составов. Например, белый фосфор состоит из четырехатомных молекул Р4. Между собой атомы белого фосфора соединены в виде простейшего многогранника тетраэдра.
Так схематически выглядит строение молекулы белого фосфора, состоящей из четырех атомов.
Сам белый фосфор являет собой практически бесцветное твердокристаллическое вещество, моментально окисляемое кислородом воздуха, при этом во время окисления фосфора идет дым, а в воздухе появляется явный чесночный запах. Своим внешним видом белый фосфор похож на воск, такой же мягкий и легкоплавкий, при этом светится в темноте и является чрезвычайно опасным, так как очень ядовит и огнеопасен.
Помимо белого фосфора физики также различают красный фосфор, черный фосфор, желтый фосфор и металлический фосфор, каждый из них имеет свои особенные физические свойства.
Так если белый фосфор нагревать до температуры 300 С без доступа воздуха и в присутствии катализаторов (ими может быть йод или натрий), то он превратится в красный фосфор. В отличие от белого фосфора его красный собрат не светится в темноте и не является ядовитым и опасным, к слову именно его используют при производстве спичек.
Красный фосфор это аморфное вещество, состоящее из полимерных молекул Px, он нерастворим в воде и других органических растворителях, а при нагревании без доступа воздуха не возгорается.
Если белый фосфор поместить под очень большое давление (в сотни атмосфер) то из него получится черный фосфор, который своими свойствами напоминает металл: он блестит и проводит электрический ток. Если еще больше увеличить давление, то черный фосфор превратится в металлический, его кристаллическая решетка будет такой же плотной как у металлов. Металлический фосфор очень хорошо проводит электрический ток.
Так выглядят разные виды фосфора.
Хотя фосфор и является одним из самых распространенных химических элементов на нашей планете, в чистом виде в природных условиях его не бывает, добыть чистый фосфор возможно лишь в химической лаборатории. Однако фосфор входит в состав многих важных химических и биологических соединений: фосфолипидов, фосфидов (соединения фосфора и металлов), фосфинов (соединений водорода с фосфором), фосфорной кислоты и так далее.
Химические свойства
Как мы писали выше, фосфор занимает 15 место в периодической таблице Менделеева и входит в одну группу с азотом, мышьяком и сурьмой. Хотя на валентном уровне он и имеет целых 5 электронов, однако 5 связей образуются довольно редко.
Фосфор – очень химически активный элемент, особенно белый фосфор. Как следствие он может вступать в самые разнообразные химические реакции, выступая как в качестве окислителя (с элементами, расположенными ниже и левее в таблице Менделеева), так и восстановителя (с элементами, расположенными выше и правее в таблице Менделеева).
При взаимодействии с кислородом воздуха образуются оксиды – ангидриды соответствующих кислот:
При взаимодействии фосфора с галогенами образуются галогениды с общей формулой PHal3 и PHal5:
При взаимодействии фосфора с серой образуются сульфиды:
При взаимодействии с металлами фосфор проявляет свойства окислителя, продукты реакции называют фосфидами.
Например, кальций и магний реагируют с фосфором с образованием фосфидов кальция и магния:
Применение
Научившись добывать фосфор в чистом виде человек нашел ему самое разнообразное применение, причем не только созидательное, но порой и очень разрушительное. Так еще во время первой мировой войны немецкими химиками был использован желтый фосфор в качестве начинки зажигательных боеприпасов и отравляющих газов.
Впоследствии применение таких газов на поле боя было запрещено Женевской конвенцией. Увы, такая наша глупая человеческая природа – использовать научные открытия в разрушительных целях, как впрочем, и открытие энергии расщепления атома было применено для создания атомной бомбы, и лишь потом для атомной энергетики.
Но вернемся к фосфору, в мирных целях этот химический элемент активно используется в сельском хозяйстве для создания эффективных удобрений для растений. Фосфор входит в состав некоторых лекарственных препаратов, к примеру, в антибиотик фосфомицин, в состав моющих средств, наконец, из безопасного красного фосфора делают спички.
Фосфор имеет свое применение и в металлургии, в качестве сверхпрочных и антикоррозийных покрытий (черный и металлический фосфор). А многие фосфиды (соединения фосфора и металлов) обладают отличными полупроводниковыми свойствами и активно задействуются в микроэлектронике.
Получения
Для получения белого фосфора в чистом виде химики прокалывают природные фосфаты вместе с коксом и песком в электрической печи. Впрочем, вместо фосфатов можно использовать и другие неорганические соединения фосфора, например, метафосфорную кислоту. Красный и черный фосфор получают уже из белого фосфора путем разных манипуляций над последним (нагревание, увеличение давления).
Действие фосфора, его функции и роль в организме человека
Теперь давайте ответим на вопрос, какая роль фосфора в организме человека. А она очень большая, так как фосфор принимает участие во всех обменных процессах, происходящих в нашем организме. Основная масса фосфора находится в костях и зубах. Совместно с кальцием фосфор формирует правильную структуру костной ткани, и если пропорция содержания кальция и фосфора будет нарушена, то кости могут стать хрупкими, увеличится риск переломов.
Помимо костей и зубов фосфор имеет влияние и на самое главное – мыслительное деятельность человека, ведь он содержится в нашей мозговой ткани и нервах. От фосфора зависит работа нервной системы, с его помощью осуществляется метаболизм липидов и протеинов, биосинтез всех необходимых органических веществ. Наконец фосфор входит в состав ДНК и РНК, участвует в ферментивных процессах, поддерживающих кислотно-щелочной баланс в организме.
Фосфор для ребенка
Особенно необходим фосфор для растущего детского организма, ведь у ребенка идет активное формирование костей скелета, развиваются клетки головного мозга. Поэтому очень важно чтобы малыш получал фосфор в необходимых количествах и при этом регулярно, ведь значительная его часть вымывается из организма с мочой.
Поэтому важно знать, какие продукты содержат фосфор.
Продукты, содержащие фосфор
К счастью фосфор содержится во многих доступных продуктах питания: орехах, морепродуктах (особенно в рыбе), в сыре, капусте, моркови, чесноке, куриных яйцах (особенно в желтке). Особенно много фосфора имеется в яблоках, грецких орехах, говяжьей печени, гречке и икре рыб семейства осетровых.
Теперь вы знаете, какие продукты могут увеличить содержание фосфора в вашем организме и организме ваших детей.
Суточная норма
Суточная норма фосфора для взрослого человека составляет 1200-1600 мг. Также стоит учесть, что для людей занимающихся интенсивными физическими нагрузками, а также для беременных и кормящих матерей суточная норма фосфора выше и составляет приблизительно 3000-3800 мг.
Детям требуется от 300 до 1800 мг фосфора каждый день, в зависимости от их возраста.
Недостаток (дефицит) фосфора в организме
Недостаток или дефицит фосфора в человеческом организме может быть обусловлен разными причинами:
Симптомами недостатка фосфора является общее недомогание, слабость, апатичность, депрессия, физическое и умственное истощение. Если у вас проявляются эти симптомы, то лучше чем скорее обратится к врачу, чтобы он прописал вам правильное лечение.
Избыток фосфора в организме и симптомы отравления им
Избыток фосфора в человеческом организме может быть столь же вредным, как и его недостаток. Обычно причиной избытка фосфора является злоупотребление человеком мясной пищей. Когда фосфора становится слишком много, нарушается его пропорция содержания с кальцием. Кальция становится меньше чем нужно, его вытесняет фосфор, от чего кости человека становятся более хрупкими, может возникнуть остеопороз (снижение плотности костей, повышение их хрупкости).
Также переизбыток фосфора может привести к возникновению проблем с зубами, нарушению работы нервной системы, почек и щитовидных желез. Чтобы предотвратить все это важно вести здоровый образ жизни, правильно питаться (не одним лишь хлебом и мясом, а обязательно фруктами, овощами), избегать вредных привычек.
Видео
И в завершение, образовательное видео по теме нашей статьи.














