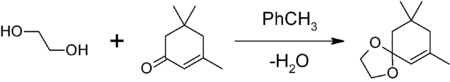
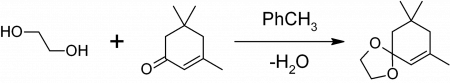
для чего нужен этиленгликоль
В космосе, в боулинге и в косметичке: этиленгликоль всегда рядом с нами
Простейший двухатомный спирт, органическое химическое соединение, сырье для изготовителей антифризов, пластика и красок. Описание, которое кажется максимально далеким от повседневной жизни, но на самом деле этиленгликоль (моноэтиленгликоль, или МЭГ) встречается в быту чуть ли не каждый день, а области его применения не исчерпываются только химической промышленностью.

Главный герой на сцене и танцполе
Белый туман окутывает сценическую площадку, создает таинственную или устрашающую атмосферу в киносценах, добавляет остроты ощущений в ночных клубах.
Каждый раз, когда вы видите живописные клубы дыма, а характерный запах не чувствуете, и огня рядом не наблюдаете, знайте – скорее всего, в деле дымогенераторы, которые используют химические вещества на основе этиленгликоля или пропиленгликоля. При их нагреве образуется тот самый пар.
Современные требования по безопасности не рекомендуют применять собственно этиленгликоль, а вот другие его соединения (бутандиол, триэтиленгликоль, полиэтиленгликоль) – обычные ингредиенты жидкостей для получения искусственного дыма.
Боулинг в разрезе
Покатать шары – популярное на Западе и прежде всего в США развлечение. В России боулинг пока не стал настолько массовым, но и у нас в распоряжении любителей этого вида спорта несколько тысяч дорожек.
Ключевой инвентарь для боулинга – тяжелый шар, которым игроки меткими (или не очень) бросками сбивают кегли, – сделан с использованием этиленгликоля.
Стандартный шар устроен просто: ядро и покрытие. И как правило, ядро заполнено пенополиуретаном – материалом, который выпускается на основе МЭГ.
И пакет, и модный жакет
Искусственные материалы — самая привычная и знакомая каждому область применения этиленгликоля. Благодаря ему производится полиэтилентерефталат, тот самый ПЭТ для производства бутылок, целлофановых пакетов, пленок и тому подобного, а также синтетические ткани.
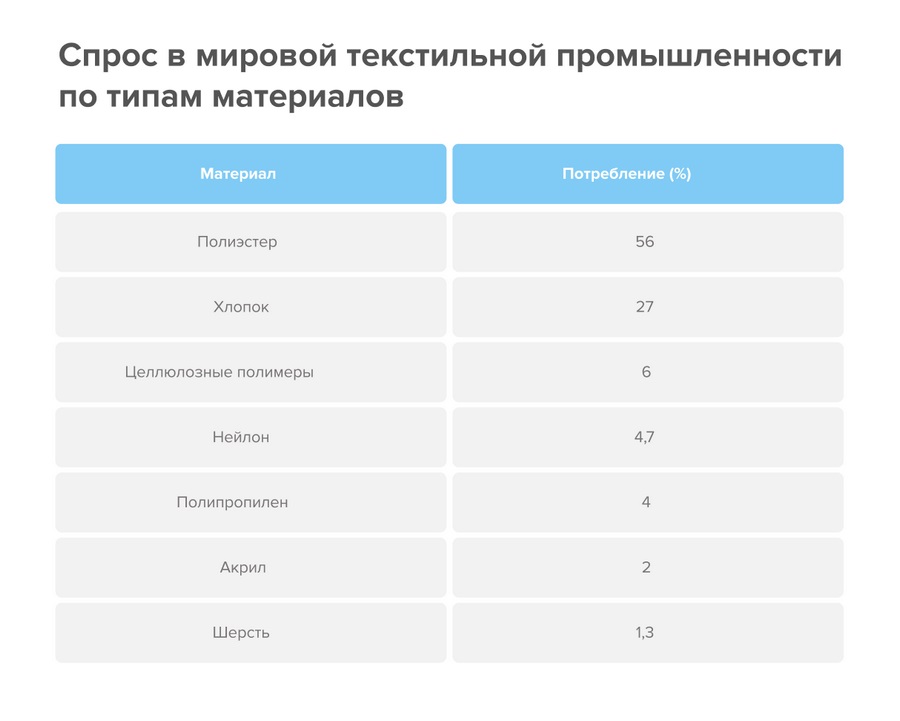
В любой одежде, сделанной из полиэстера, есть этиленгликоль. Он добавляет готовому сырью требуемую вязкость и гигроскопичность. На полиэстер приходится более 50% потребления мировой текстильной промышленности, следовательно, примерно половина всей одежды в мире изготовлена с помощью МЭГ.
На страже красоты и чистоты
Для индустрии красоты и отрасли бытовой химии этиленгликоль играет не меньшую роль, чем для автохимической промышленности. Без него привычные для нас средства справлялись бы со своими задачами хуже.
На рынке широко представлена косметическая и гигиеническая продукция с содержанием этиленгликоля или его производных: бутандиола, триэтиленгликоля, полиэтиленгликоля. Они используются для производства шампуней, лаков для ногтей, увлажнителей, масок для лица, губной помады, туши для ресниц, различных видов масел и кремов для тела в качестве растворителей, модификаторов вязкости или увлажнителей.
Благодаря свойствам антифриза – в соединении с водой этиленгликоль замерзает только при – 75°С – его часто включают в состав средств для ухода за обувью и изделиями из кожи. Благодаря ему они не трескаются от мороза и служат дольше.
Старый знакомый автолюбителей
Каждый автолюбитель знаком с этиленгликолем, поскольку тот из-за низкой температуры замерзания входит в состав жидкостей-антифризов. Сегодня большинство категорий автомобильных антифризов включает этиленгликоль или пропиленгликоль в качестве одного из компонентов наряду со множеством других элементов и присадок, снижающих токсичность и обеспечивающих дополнительную защиту двигателя: антикоррозийные эффекты, устойчивость к кавитации — «закипанию» в результате вибрации и другие.
Из космоса на железную дорогу
Благодаря характеристикам теплоносителя – низкой температуре замерзания в смеси с водой (до –75°С) и высокой температуре кипения (+197 °C) – этиленгликоль широко применяется в качестве элемента промышленных систем охлаждения и терморегуляции.
Раньше его использовали не только на Земле, но и в космосе. Однако утечка этиленгликоля едва не стоила жизней космонавтам, работавшим на российской орбитальной станции «Мир» в 1997 году.
Американское аэрокосмическое агентство (НАСА) в том же году разработало более надежный, биоразлагаемый и безопасный аналог этого химического соединения, но неожиданным образом коммерчески востребованным продуктом новинка стала в виде реагента, предотвращающего обледенение железных дорог.
Спрос будет только расти
Прогноз не кажется необоснованно оптимистичным для соединения со столь широким спектром применения: от автомобилей и космических станций до одежды, пластиковых бутылок и шаров для боулинга.
Этиленгликоль
| Этиленгликоль | |
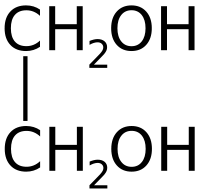 | |
 | |
| Общие | |
|---|---|
| Систематическое наименование | этан диол-1,2 |
| Традиционные названия | этиленгликоль, 1,2-диоксиэтан, 1,2-этандиол |
| Химическая формула | C2H4(OH)2 |
| Физические свойства | |
| Состояние (ст. усл.) | жидкость |
| Молярная масса | 62,068 г/моль |
| Термические свойства | |
| Температура плавления | −12,9 °C |
| Температура кипения | 197,3 °C |
| Классификация | |
| Рег. номер CAS | 107-21-1 |
| SMILES | OCCO |
| Безопасность | |
| Токсичность | токсичен |
Содержание
История открытий и производства
Этиленгликоль впервые был получен в 1859 французским химиком Вюрцом из диацетата этиленгликоля омылением гидроксидом калия и в 1860 гидратацией этиленоксида. Он не находил широкого применения до Первой мировой войны, когда в Германии его стали получать из дихлорэтана для использования в качестве замены глицерина при производстве взрывчатых веществ. В США полупромышленное производство начато в 1917 году через этиленхлоргидрин. Первое крупномасштабное производство начато с возведением завода в 1925 году около Южного Чарлстона (западная Вирджиния, США) компанией «Carbide and Carbon Chemicals Co.» К 1929 году этиленгликоль использовался практически всеми производителями динамита. В 1937 кампания Carbide начало первое крупномасштабное производство, основанное на газофазном окислении этилена до этиленоксида. Монополия компании Carbide на данный процесс продолжалась до 1953 года.
Получение
В промышленности этиленгликоль получают путём гидратации оксида этилена при 10 атм и 190—200°С или при 1 атм и 50—100°С в присутствии 0,1—0,5 % серной или ортофосфорной кислоты, достигая 90% выхода. Побочными продуктами при этом являются этиленгликоль, триэтиленгликоль и незначительное количество высших полимергомологов этиленгликоля.
Применение
Благодаря своей дешевизне этиленгликоль нашёл широкое применение в технике.
1,3-диоксоланы могут быть получены также при реакции этиленгликоля с карбонильными соединениями в присутствии триметилхлорсилана [2] или комплекса диметилсульфат-ДМФА [3] 1,3-диоксалана устойчивы к действию нуклеофилов и оснований. Легко регенерируют исходное карбонильное соединение в присутствии кислоты и воды.
Этиленгликоль также применяется:
Очистка и осушение
Осушается молекулярным ситом 4А, полуводным сульфатом кальция, сульфатом натрия, Mg+I2, фракционной перегонкой под пониженным давлением, азеотропной отгонкой с бензолом. Чистота полученного продукта легко определяется по плотности.
Таблица плотности водных растворов этиленгликоля, 20°С
| Концентрация % | 30 | 35 | 40 | 45 | 50 | 55 | 60 |
|---|---|---|---|---|---|---|---|
| Плотность, г/мл | 1,050 | 1,058 | 1,067 | 1,074 | 1,082 | 1,090 | 1,098 |
Меры безопасности
Этиленгликоль
| Этиленгликоль | |||
|---|---|---|---|
| |||
| Систематическое наименование | этандиол-1,2 | ||
| Традиционные названия | гликоль, этиленгликоль, 1,2-диоксиэтан, 1,2-этандиол | ||
| Хим. формула | C2H6O2 | ||
| Рац. формула | C2H4(OH)2 | ||
| Состояние | бесцветная жидкость | ||
| Молярная масса | 62,068 г/моль | ||
| Плотность | 1,113 г/см³ | ||
| Температура | |||
| • плавления | −12,9 °C | ||
| • кипения | 197,3 °C | ||
| • вспышки | 111 °C | ||
| Пределы взрываемости | 3,2 ± 0,1 об.% | ||
| Давление пара | 0,06 ± 0,01 мм рт.ст. | ||
| Константа диссоциации кислоты pKa | 15,1 ± 0,1 | ||
| Показатель преломления | 1,4318 | ||
| ГОСТ | ГОСТ 19710-83 | ||
| Рег. номер CAS | 107-21-1 | ||
| PubChem | 174 | ||
| Рег. номер EINECS | 203-473-3 | ||
| SMILES | |||
| RTECS | KW2975000 | ||
| ChEBI | 30742 | ||
| ChemSpider | 13835235 | ||
| Предельная концентрация | 5 мг/м 3 | ||
| ЛД50 | 4700 мг/кг (крысы, перорально) | ||
| Токсичность | ядовит | ||
| Пиктограммы СГС |  | ||
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. | |||
Этиленгликоль (гликоль, 1,2-диоксиэтан, этандиол-1,2), HO—CH2—CH2—OH — кислородсодержащее органическое соединение, двухатомный спирт, простейший представитель полиолов (многоатомных спиртов). В очищенном виде представляет собой прозрачную бесцветную жидкость слегка маслянистой консистенции. Не имеет запаха и обладает сладковатым вкусом. Токсичен. Попадание этиленгликоля или его растворов в организм человека может привести к необратимым изменениям в организме и к летальному исходу.
Содержание
История открытий и производства
Этиленгликоль впервые был получен в 1859 году французским химиком Вюрцем из диацетата этиленгликоля омылением гидроксидом калия и в 1860-м гидратацией этиленоксида. Он не находил широкого применения до Первой мировой войны, когда в Германии его стали получать из дихлорэтана для использования в качестве замены глицерина при производстве взрывчатых веществ. В США полупромышленное производство начато в 1917 году через этиленхлоргидрин. Первое крупномасштабное производство начато с возведением завода в 1925 году около Саут Чарлстона (Западная Вирджиния, США) компанией «Carbide and Carbon Chemicals Co.» (англ.). К 1929 году этиленгликоль использовался практически всеми производителями динамита.
В 1937 компания Carbide начала первое крупномасштабное производство, основанное на газофазном окислении этилена до этиленоксида. Монополия компании Carbide на данный процесс продолжалась до 1953 года.
Получение
В промышленности этиленгликоль получают путём гидратации оксида этилена при 10 атм и 190‒200 °С или при 1 атм и 50‒100 °С в присутствии 0,1‒0,5% серной или ортофосфорной кислоты, достигая 90% выхода. Побочными продуктами при этом являются диэтиленгликоль, триэтиленгликоль и незначительное количество высших полимергомологов этиленгликоля.
Применение
Благодаря своей дешевизне этиленгликоль нашёл широкое применение в технике.
1,3-диоксоланы могут быть получены также при реакции этиленгликоля с карбонильными соединениями в присутствии триметилхлорсилана или комплекса диметилсульфат-ДМФА 1,3-диоксалана устойчивы к действию нуклеофилов и оснований. Легко регенерируют исходное карбонильное соединение в присутствии кислоты и воды.
Этиленгликоль также применяется:
Очистка и осушение
Осушается молекулярным ситом 4А, полуводным сульфатом кальция, сульфатом натрия, Mg+I2, фракционной перегонкой под пониженным давлением, азеотропной отгонкой с бензолом. Чистота полученного продукта легко определяется по плотности.
Таблица плотности водных растворов этиленгликоля, 20°С
| Концентрация % | 30 | 35 | 40 | 45 | 50 | 55 | 60 |
|---|---|---|---|---|---|---|---|
| Плотность, г/мл | 1,050 | 1,058 | 1,067 | 1,074 | 1,082 | 1,090 | 1,098 |
Меры безопасности
Этиленгликоль — горючее вещество. Температура вспышки паров 120 °C. Температура самовоспламенения 380 °C. Температурные пределы воспламенения паров в воздухе, °С: нижний — 112, верхний — 124. Пределы воспламенения паров в воздухе от нижнего до верхнего, 3,8‒6,4% (по объему).
Этиленгликоль умеренно токсичен. По степени воздействия на организм относится к веществам 3-го класса опасности.
Летальная доза при однократном пероральном употреблении составляет 100‒300 мл этиленгликоля (1,5‒5 мл/кг массы тела). Имеет относительно низкую летучесть при нормальной температуре, пары обладают не столь высокой токсичностью и представляют опасность лишь при хроническом вдыхании. Определённую опасность представляют туманы, однако при их вдыхании об опасности сигнализируют раздражение и кашель. Противоядием при отравлении этиленгликолем являются этанол и 4-метилпиразол.
В организме метаболизируется путём окисления до альдегида гликолевой кислоты и далее до гликолевой кислоты, которая затем распадается до муравьиной кислоты и диоксида углерода. Также он частично окисляется до щавелевой кислоты, которая вызывает повреждения почечной ткани. Этиленгликоль и его метаболиты выводятся из организма с мочой.
Этиленгликоль (моноэтиленгликоль)
Этиленгликоль (альтернативные названия – диоксиэтан, этандиол, моноэтиленгликоль) – представитель двухатомных спиртов. Химическая формула вещества – С2H6О2. Внешне это бесцветная прозрачная жидкость без запаха. По общепринятой международной классификации отнесен к третьему классу опасности. Употребление внутрь 100 мл этиленгликоля смертельно для человека. Пары диоксиэтана токсичны, попадание в чистом виде или в водном растворе опасно для здоровья и жизни.
Физические свойства этиленгликоля
Физические и теплофизические свойства вещества зависят от концентрации в растворе. Высококонцентрированный гликоль выдерживает нагрев до высокой температуры, поэтому он подходит для теплоносителей инженерных систем. Низкая температура кристаллизации (достигает нижних пределов в 65 градусов ниже нуля примерно при 40 % в растворе) позволяет использовать диоксиэтан в качестве сырья для антифризов систем охлаждения.
История и современное производство
В промышленных масштабах двухатомный спирт начали производить в 20-ых годах прошлого столетия в США. Американские специалисты спроектировали и построили завод в Западной Вирджинии и наладили массовое изготовления гликоля. На протяжении долгих лет его закупали практически все крупные компании, специализирующиеся на изготовлении динамита.
Сегодня этиленгликоль в промышленных масштабах синтезируется в ходе гидратации этилена двумя способами:
На выходе получается смесь, содержащая до 90 процентов чистого высококонцентрированного этиленгликоля. Побочные продукты реакции – полимергомологи и триэтиленгликоль, нашли широкое применение в промышленности. Системы охлаждения воздуха, производство пластификаторов и препаратов для дезинфекции – наиболее популярные сферы использования.
Применение этиленгликоля в промышленности
Охлаждающие жидкости на основе этиленгликоля
Двухатомный спирт используется при изготовлении антифризов для охлаждающих систем двигателя, теплоносителей инженерных систем отопления и кондиционирования воздуха. Раствор с деминерализованной водой и пакетом антикоррозионных присадок обладает антикавитационными и антипенными свойствами.
Преимущество этиленгликоля – низкая температура кристаллизации в сравнении с водой. Даже при достижении точки замерзания гликоль имеет более низкий коэффициент температурного расширения в сравнении с водой (на 1,5-3 % меньше). Высокая температура кипения позволяет использовать водно-гликолевую смесь в экстремальных производственных условиях, при подогревании нефти и газа и других технологических процессах.
Дополнительные преимущества антифризов на основе этиленгликоля:
Класс опасности этиленгликоля
Этиленгликоль — базовое вещество, используемое для производства антифризов и теплоносителей (класс опасности этиленгликоля — 3). Благодаря его отличительным параметрам, материалы на его основе эффективны для работы в транспортных системах, в оборудовании, применяемом для охлаждения и отопления. Главное, что стоит помнить, при работе с растворами — этиленгликоль вреден для человека, он токсичен. Требуется особая осторожность и внимательность при обращении.
Особенности этиленгликоля
Этот материал классифицируют как вещество третьей группы опасности. Класс опасности этиленгликоля говорит о способе транспортировки и хранении. Растворы с его содержанием перевозят в специализированных емкостях, оцинкованных резервуарах, которые герметично закрыты. Можно перевозить и в автоцистернах, только их нужно подготовить для этих целей. Водитель должен следовать инструкции во время доставки раствора, чтобы избежать разгерметизации ёмкости.
Этиленгликоль — бесцветная жидкость, не имеющая запаха, обладающая слегка сладковатым вкусом и маслянистой структурой. Физические характеристики дают возможность применять вещество в производстве.
Сфера применения
Этиленгликоль может использоваться не только как антифриз, его применяют в промышленности в разных сферах.
Чем опасен этиленгликоль?
Материалы, которые относятся к третьей группе опасности (среди них и этиленгликоль) необходимо хранить в герметичных емкостях. Их контакт с окружающей средой должен быть минимизирован. Человеку опасно находиться при концентрации этого вещества в атмосфере больше 5 миллиграмм/метр кубический. Отличительные особенности при постоянном попадании этиленгликоля в организм:
Постоянное вдыхание паров эфира приводят к развитию вегетососудистой дистонии.
Все сотрудники, которые имеют отношение к химическому производству и к работе с токсическими веществами третьего класса опасности, должны строго соблюдать все правила техники безопасности. В противном случае не исключен и летальный исход.
На производстве работают в специальных костюмах, надевая:
Важно закрыть все открытые участки тела и предотвратить попадание паров в дыхательные органы.
Длительность работы раствора
Раствор на базе этиленгликоля может работать в течение 5 лет, не теряя своих характеристик. Затем жидкость подлежит замене. Для того, чтобы определить, когда вещество подлежит замене, проводятся специальные исследования. На основе результатов принимается соответствующее решение. Делают целый ряд тестов, в которых проверяются характеристики рабочей жидкости. Если раствор утратил часть своих свойств, его нужно заменить, чтобы восстановить эффективность работы всей системы и не привести к повреждению отдельных элементов теплообменника. Купить раствор этиленгликоля в воде можно на нашем сайте.