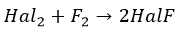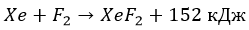для чего нужен галоген
Галогены
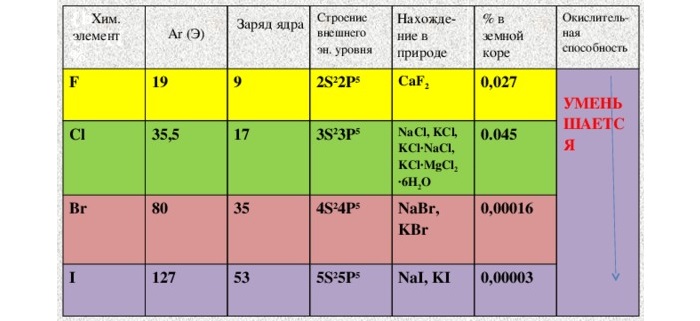
Галогены широко распространены в природе. Их химическая активность падает от фтора к астату.
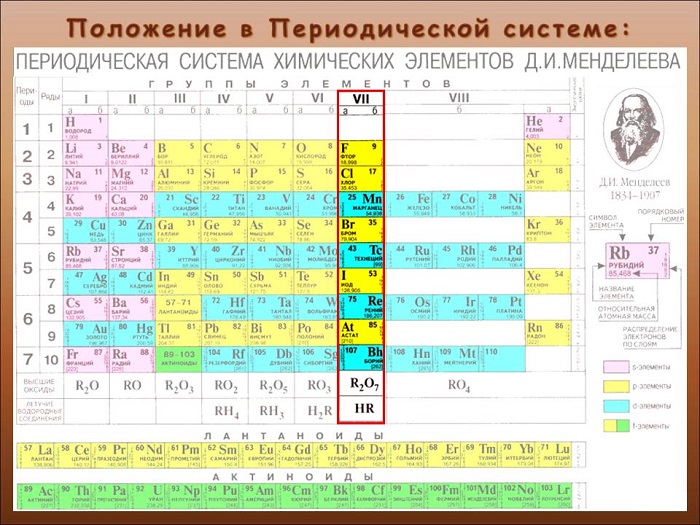
Общая характеристика элементов VIIa группы
От F к At (сверху вниз в периодической таблице) происходит увеличение: атомного радиуса, металлических, основных, восстановительных свойств. Уменьшается электроотрицательность, энергия ионизация, сродство к электрону.
Все галогены относятся к неметаллам, являются сильными окислителями.
Природные соединения
Галогены в чистом виде можно получить путем электролиза водных растворов и расплавов их солей. Например, хлор в промышленности получают электролизом водного раствора хлорида натрия.
Более активные галогены способны вытеснять менее активные. Активность галогенов убывает: F → Cl → Br → I.
В лабораторных условиях галогены могут быть получены следующими реакциями.
Для галогенов характерна высокая реакционная способность. Фтор реагирует со всеми металлами без исключения, некоторые из них в атмосфере фтора самовоспламеняются.
Хлор, как и фтор, химически весьма активен. Не реагирует только с кислородом, азотом и благородными газами.
F2 + H2 → HF (в темноте со взрывом)
Галогены вступают в реакцию друг с другом. Чтобы определить степени окисления в получающихся соединениях, вспомните электроотрицательность 😉
Реакция фтора с водой протекает очень энергично, носит взрывной характер.
Cl2 + NaOH → NaCl + NaClO + H2O
Галогены способны вытеснять друг друга из солей. Более активные вытесняют менее активные.
KBr + I2 ⇸ (реакция не идет, так как йод менее активен, чем бром)
Галогеноводороды
В промышленности применяют получение прямым методом: реакцией водорода с галогенами.
В лабораторных условиях галогеноводороды можно получить в реакциях обмена между галогенсодержащими солями и сильными кислотами.
Галогеноводороды реагируют с основными, амфотерными оксидами и основаниями с образованием соответствующих солей.
KOH + HCl → KCl + H2O (реакция нейтрализации)
Реакции протекают в тех случаях, если в результате выпадает осадок, выделяется газ или образуется слабый электролит (вода).
В некоторых реакциях проявляют себя как сильные восстановители, особенно HI.
В целом взаимодействие галогеноводородов с оксидами неметаллов нехарактерно. В этой связи важно выделить реакцию SiO2 с плавиковой кислотой.
© Беллевич Юрий Сергеевич 2018-2021
Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение (в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования, обратитесь, пожалуйста, к Беллевичу Юрию.
Не все знают, что под пугающим названием «галогены» зачастую скрываются распространенные в быту вещества. Не в чистом виде, но все-таки. Отдельными представителями «семейства» ежедневно пользуется каждый человек.
На упаковке любой зубной пасты имеется словосочетание со словом «фтор». Полезен для зубной эмали.
Хлор знаком любой домохозяйке и сотруднику клининговой компании. А уж его запах знают все, кто посещал бассейн или лечебные учреждения России. Не пустой звук для советских школьников. Даже не из курса химии, а из уроков химзащиты в рамках начальной военной подготовки (НВП).
Про «бром» ходили легенды среди военнослужащих СССР. Насколько сведения достоверны – неизвестно.
Темно-коричневая бутылочка с «йодом» – постоянный спутник любителя поиграть с котенком и непоседливого ребенка. Распространенный антисептик.
Что такое галогены
Определяют, как элементы 17-ой группы таблицы Менделеева. Сторонники «старой школы» выразились бы: «главной подгруппы VII группы».
Название представляет собой компиляцию греческих слов. Означает приблизительно «солерождающий». Такое определение было дано в XIX веке британским ученым Гэмфри Дэви.
Перечень и общая характеристика галогенов
С первыми четырьмя элементами из списка некоторое знакомство имеется. Надо заметить, что вещества хоть и достаточно распространенные, но в чистом виде в природе не встречаются. Только в составе соединений.
Астат – элемент не просто редкий, а самый редкий из всех встречающихся на планете. Его «запасы» оцениваются в 1 г. Свойства доподлинно не известны. Так как из-за радиоактивности и мизерной «продолжительности жизни» в достаточных количествах выделить не получилось.
Теннессин существует скорее теоретически. На Земле, по крайней мере, не нашли. Рекордное зафиксированное (и признанное) в лаборатории количество – 6 ядер. Включая изотоп.
Легко заметить, что до «идеальных» инертов не хватает всего-то электрончика. А так хочется. Не удивительно, что так агрессивны.
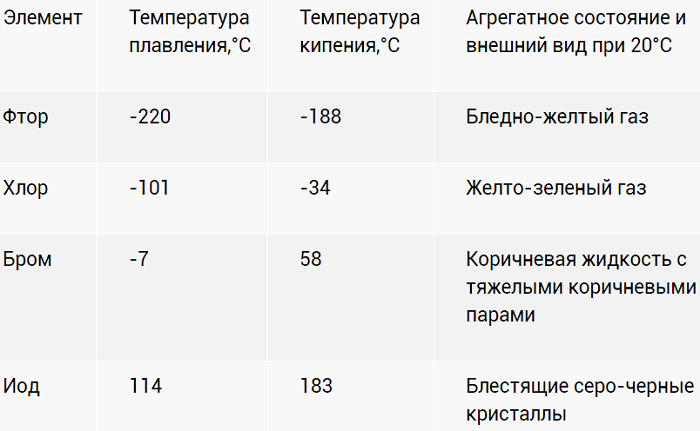
Физические свойства
Галогены – ярко выраженные неметаллы. Летучи, с характерно едким «ароматом». Причем для йода (I2) жидкое агрегатное состояние вообще не характерно. При разогреве просто испаряется фиолетовым дымком.
Хлор – настоящее боевое отравляющее вещество. И применялось в таком качестве. Попадая в незащищенные глаза и органы, образует кислоты. С соответствующими последствиями. Для летального исхода достаточно концентрации в воздухе 2 мг/л.
Насыщенность цветов с «утяжелением» ядер возрастает. Активность, напротив, падает.
В воде растворимость ограничена. Лучше ведёт себя с органическими растворителями. Растворы оригинально окрашены: от слабо желтого до фиолетового.
Химические свойства галогенов
Можно сказать, что F реагирует со всеми простыми субстанциями, кроме отдельных благородных газов. А так (с облучением):
Остальные элементы ряда не взаимодействуют с:
О галогенах и здоровье человека.
Галогены – это класс родственных элементов, которые включают йод, бром, фтор и хлор. С их соединениями, то есть с йодидом, бромидом, фторидом и хлористыми солями мы сталкиваемся в пищевых продуктах, лекарственных препаратах и окружающей среды. О йоде многие знают с детства, им обрабатывали сбитые коленки в детстве.
Позже мы узнали о том, что этот галоген необходим для синтеза гормонов щитовидной железы. Прочитать об этом можно в статье «Правда и мифы о йоде»
Да, йод необходим организму, его дефицит опасен для организма также как и его избыток.
Но почему, то мало говорят и пишут о токсичности галогенов. Более того, их добавляют в продукты питания, воду, средства по уходу за телом и с их помощью отравляют людей.
О токсическом действии галогенов.
1. Что надо знать о токсическом действии галогенов.
1) Йод и хлориды полезны в небольших количествах, другие являются токсичными.
2) Галогены могут связываться с рецепторами йода, блокировать действие йодида и гормонов щитовидной железы, и вызывать многие тяжелые заболевания.
3) Токсичные галогены очень медленно выделяются из организма, и не известны пути их детоксикации из печени.
4) Выведение токсичных галогенов может быть увеличено следующими способами:
2. Токсичность бромида/брома.
1) Бром является ядом и в пище не должен применяться.
2) Бром может связываться с рецепторами йода и блокировать их функцию.
3) Однако, этот галоген заменяет йодид во многих продуктах, лекарственных препаратах и в окружающей среде, несмотря на то, что это пестицид.
4) Он заменил йод при обработке белой муки и уменьшил потребление йода человеком на 726 мкг/день.
5) Симптомы интоксикации брома.
Эти симптомы включают:
6) Признаки тяжелой интоксикации бромом.
7) Некоторые лекарства содержат бром.
Есть и другие препараты. Будьте с ними осторожнее, до покупки препарата прочитайте его состав, инструкции есть в Интернете.
«8)» Продукты питания, содержащие бром.
3. Токсичность фторида/фтора.
Фтор известен как токсин и может привести к летальному исходу.
Но уже более 50 лет его добавляют в питьевую воду, чтобы не было кариеса у людей.
Это было сделано в законодательном порядке без всяких научных исследований.
Позднее было показано, что нет никакой разницы в заболевании зубов с фтором или без него.
Сразу после того, как в Америке стали фторировать водопроводную воду, многие страны также перешли на фторирование воду.
После того, как ученые установили, что фтор не сохраняет зубы от кариеса, многие страны перестали фторировать питьевую воду.
Сейчас широко известно вредное действие фтора на организм человека:
2) Фтор может содержаться в лекарствах.
Поэтому внимательно изучайте состав препарата до его покупки.
3) Фтор может содержаться в средствах гигиены.
Наиболее часто он содержится в зубной пасте, даже в детской.
Вам может быть полезна статья «Сделайте самую лучшую зубную пасту, рецепты»
4. Токсичность хлорида/ хлора.
1) Хлорид является важным элементом во внеклеточной жидкости, он необходим в виде соляной кислоты в желудке для пищеварения.
2) Но в больших количествах он токсичен и с его побочными продуктами он может вызвать:
3) Избыток натрия хлорида (соли) конкурирует с йодидом и может вызвать гипотиреоз.
4) Источники хлорида.
5. Перхлорат.
Перхлорат – это один атом хлора, окруженный 4 атомами кислорода. Является токсином.
Его наличие в организме может привести к:
1) гипотиреозу,
2) раку щитовидной железы,
3) зобу,
4) мастопатии,
5) нарушению менструального цикла,
6) дисфункции иммунной системы,
7) плохому развитию плода,
«8)» умственной отсталости новорожденных.
Дополнительно о перхлорате вы можете прочитать в статье «Йод, щитовидная железа, перхлорат и здоровье»
Будьте здоровы! И пишите комментарии.
Галина Лушанова
Галина Лушанова имеет высшее образование (окончила НГУ по специальности цитолог-генетик), к.б.н. по специальности фармакология. Прошла обучение по диетологии, является действительным членом сообщества «Диетологи России». Ведет блог «Пища и Здоровье» с 2011г. Организатор Первой в России онлайн школы «Пища и Здоровье»
Получение и применение галогенов
Получение и применение галогенов

Получение галогенов
Как известно, процесс электролиза сопровождается переходом электронов с катода на положительно заряженные ионы и с отрицательно заряженных ионов на анод. Следовательно, у катода происходит процесс восстановления, у анода — процесс окисления. Таким образом, окисление или восстановление может быть осуществлено не только путем воздействия одного вещества на другое, но и при помощи электрического тока.
Электрический ток — наиболее мощное средство для окисления и восстановления.
Фтор, вследствие огромного сродства к электрону, может быть выделен из своих соединений исключительно электролитическим путем. Впервые он был получен в 1886 г. путем разложения электрическим током безводного жидкого фтористого водорода HF, к которому было прибавлено около 20% фтористого калия KF. Разложение производилось в приборе, выполненном из меди, на которую фтор не действует (после того, как медь покроется слоем фтористой меди). Электроды были сделаны из платины.
Метод, использованный для выделения элементарного фтора, осуществляется в настоящее время и при промышленном получении этого вещества. Разложению электрическим током подвергают расплав состава KF • 2HF (темп. пл. 70° С). Электролиз ведут в стальных ваннах, пользуясь угольными электродами.
В лабораториях хлор получают действием различных окислителей на соляную кислоту. Напомним, например, известный из школьного курса лабораторный способ получения хлора действием двуокиси марганца на соляную, кислоту:
В ионной форме эта реакция выразится уравнением:
из которого видно, что здесь происходит окисление ионов Сl’ в атомы хлора (образующие затем молекулы Сl2) и восстановление четырехвалентного марганца, входящего в состав МnO2, в двухвалентный (ионы Мn •• ). При помощи этой реакции хлор был впервые получен Шееле в 1774 г.
Аналогичным путем можно получить хлор из соляной кислоты, действуя на нее вместо МnO2 другими окислителями (например, РbO2, КClO3, КМnO4).
Кислород не взаимодействует при обычных условиях с НСl в сколько-нибудь заметной степени Но если пропускать смесь НСl и О2 через трубку, нагретую до 400° и содержащую кусочки пемзы, на которых распределена в качестве катализатора хлорная медь СuСl2, то происходив окисление хлористого водорода (ионов Сl—) кислородом:
причем выход хлора достигает 80%. Этой реакцией раньше часто пользовались для получения хлора.
Бром и иод могут быть получены аналогично хлору окислением НВr и HJ различными окислителями. В промышленном масштабе их обычно получают из бромистых или йодистых солей металлов, действуя на растворы последних хлором. Таким образом, получение брома и иода тоже основано на окислении их ионов, только в качестве окислителя применяется хлор. Например:
В СНГ бром добывают из воды Сакского озера (в Крыму), содержащей довольно большое количество бромистых солей, и из «рапы» (насыщенного раствора) залива Кара-Богаз-Гол. Освоено также получение брома из буровых вод.
Главным источником получения иода в СНГ служат воды буровых скважин. Для извлечения из этих вод иода к концу первой пятилетки были выстроены два больших завода в Сураханах и в Нефге-Чале, производительность которых вполне обеспечивает потребность нашей страны в иоде.
Применение галогенов
Галогены, особенно хлор, широко применяются в химической промышленности.
Фтор используется в настоящее время для получения некоторых очень ценных фторпроизводных углеводородов, обладающих уникальными свойствами, как, например, смазочные вещества, выдерживающие высокую температуру, пластмасса, устойчивая по отношению к химическим реагентам (тефлон), жидкости для холодильных машин (фреоны) и др.
Хлор служит для приготовления многочисленных неорганических и органических соединений. Он применяется в производстве соляной кислоты, хлорной извести, гипохлоритов и хлоратов, хлористой серы и др. Большое количество хлора, как в свободном состоянии, так и в виде белильных солей, используется для отбелки тканей и целлюлозы, идущей на изготовление бумаги. Хлор применяется также для стерилизации питьевой воды и обеззараживания сточных вод. В цветной металлургии его используют для получения некоторых металлов путем хлорирования их руд.
Особенно большое значение приобрели за последнее время различные хлорорганические продукты. Хлорсодержащие органические растворители — дихлорэтан, четыреххлористый углерод и др. — широко применяются для экстракции жиров и обезжиривания металлов. Хлорорганические препараты — ДДТ, гексахлоран и др. — служат эффективным средством борьбы с вредителями сельскохозяйственных культур. На основе хлорорганических продуктов изготовляются различные пластические массы, синтетические волокна, высококачественные каучуки, заменители кожи. С развитием техники область применения хлорорганических продуктов все время расширяется; это ведет к непрерывному увеличению производства хлора.
Широкое использование хлора в различных отраслях народного хозяйства, а также масштабы его производства и потребления позволяют отнести хлор, наряду с серной кислотой, аммиаком и содой, к числу важнейших продуктов, выпускаемых химической промышленностью.
Бром необходим для выработки различных лекарственных веществ, некоторых красителей, а также бромистого серебра, потребляемого в больших количествах фотографической промышленностью.
Иод широко применяется в медицине в виде так называемой йодной тинктуры (10%-ный раствор иода в спирте), превосходного антисептического и кровеостанавливающего средства. Кроме того, иод входит в состав ряда фармацевтических препаратов.
Вы читаете, статья на тему Получение и применение галогенов
Похожие страницы:
Понравилась статья поделись ей
Галогены — особая группа химически активных веществ
Галогены — класс простых неорганических веществ с похожими 
Все галогены химически активны, поэтому в естественном виде встречаются только (кроме йода) в минералах, а также в морской воде и подземных рассолах.
Физические свойства различны. Фтор и хлор — газообразны. Бром — жидкий, легко испаряется. Йод — твердый кристаллический, переходит в газообразное состояние, минуя жидкое. Астат — твердый. Все галогены плохо растворяются в воде, но способны образовывать «хлорную», «йодную» и «бромную» воду, частично вступая в реакцию с водой. Растворяются в неполярных органических растворителях. Все галогены ядовиты, пахнут неприятно.
Польза и опасность
Все галогены крайне токсичны. Например, пары йода, попав в легкие в больших количествах, вызывают отек легких, поражение почек, отрицательно влияют на сердечно-сосудистую систему. Если вовремя не принять меры, то человек может умереть. Еще более опасны хлор и фтор. Хлор, в свое время, стал первым боевым отравляющим газом. А воздействие фтора на кожу всего в течение двух секунд приведет к сильнейшему ожогу из-за крайней химической агрессивности реактива. Поэтому все работы с галогенами следует проводить с использованием средств защиты, включая противогазы.
Несмотря на то, что галогены токсичны, они являются биогенными элементами, важными для функционирования организма человека.
Фтор необходим для формирования эмали зубов и костной ткани.
Хлор играет важнейшую роль в регулировании водно-солевого баланса, нужен для работы нервной и мышечной системы, ЖКТ, эритроцитов.
Недостаток брома в организме приводит к бессоннице, замедлению роста детей, прерыванию беременности, снижению уровня гемоглобина.
Йод жизненно важен для работы щитовидной железы, влияет на развитие организма и на его обмен веществ. Недостаток йода отрицательно сказывается на памяти и интеллекте, работе сердечно-сосудистой системы, уровне гемоглобина.