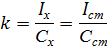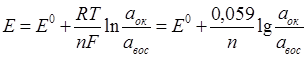для чего нужен градуировочный график
Метод градуировочного графика



Метод градуировочного графика – это графический приём нахождения неизвестной концентрации (Сх) по величине аналитического сигнала пробы (Iх).
Для проведения анализа готовят серию стандартных растворов, измеряют величины АС этих растворов и строят градуировочный график I = f(C) (рис.6).
Рис. 6. Определение неизвестной концентрации методом градуировочного графика.
Затем в точно таких же условиях измеряют аналитический сигнал пробы Iх и по графику определяют концентрацию анализируемого вещества в пробе Сх.
Метод стандартов (метод молярного свойства)
Метод стандартов – это расчётный приём нахождения неизвестной концентрации. Он имеет две разновидности (рис. 5).
1. Метододного стандарта. Для проведения анализа готовят один стандартный раствор с концентрацией определяемого вещества Сст, затем измеряют величины АС этого раствора (Iст) и пробы (Iх) в одинаковых условиях.
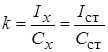
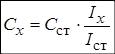
2. Метод двух стандартов (ограничивающих растворов). Для проведения анализа готовят серию стандартных растворов и измеряют величины АС этих растворов и пробы в одинаковых условиях. Затем выбирают два стандартных раствора – «ограничивающие растворы» – так, чтобы С1
Метод градуированного графика
Для определения содержания вещества методом градуи-ровочного графика готовят серию из 5-8 стандартных растворов разных концентраций (не менее 3 параллельных растворов для каждой точки).
При выборе интервала концентраций стандартных растворов руководствуются следующими положениями:
• он должен охватывать область возможных изменений концентраций исследуемого раствора, желательно, чтобы оптическая плотность исследуемого раствора соответствовала примерно середине градуировочной кривой;
• желательно, чтобы в этом интервале концентраций при выбранных толщины кюветы I и аналитической длины волны лсоблюдался основной закон светопоглощения, т. е. график D = /(С) был линейным;
• интервал рабочих значений D, соответствующий интервалу стандартных растворов, должен обеспечивать максимальную воспроизводимость результатов измерений.
При совокупности перечисленных условий измеряют оптические плотности стандартных растворов относительно растворителя и строят график зависимости D = /(С).
Полученная кривая называется градуировочной (градуи-ровочным графиком).
Определив оптическую плотность раствора Dx, находят ее значения на оси ординат, а затем на оси абсцисс — соответствующее ей значение концентрации Сх. Этот метод применяют при выполнении серийных фотометрических анализов.
Метод добавок
Метод добавок представляет собой разновидность метода сравнения. Определение концентрации раствора этим методом основано на сравнении оптической плотности исследуемого раствора и того же раствора с добавкой известного количества определяемого вещества. Метод добавок обычно применяют для упрощения работы, для устранения мешающего влияния посторонних примесей, в ряде случаев для оценки правильности методики фотометрического определения. Метод добавок требует обязательного соблюдения основного закона светопоглощения.
Неизвестную концентрацию находят расчетным или графическим способами.
При соблюдении основного закона светопоглощения и постоянной толщине слоя отношение оптических плоскостей исследуемого раствора и исследуемого раствора с добавкой будет равно отношению их концентраций:
где Dx — оптическая плотность исследуемого раствора;
Dx + a — оптическая плотность исследуемого раствора с добавкой;
Сх — неизвестная концентрация исследуемого вещества в исследуемом окрашенном растворе;
Са — концентрация добавки в исследуемом растворе.
Источник:http://www.znaytovar.ru/new117.html
Метод градуировочного графика. Для определения содержания вещества методом градуировочного графика при выбранных оптимальных условиях обычно готовят серию не менее чем из 5 стандартных растворов разных концентраций (не менее 3 параллельных растворов для каждой точки).
При выборе интервала концентраций стандартных растворов руководствуются следующими положениями:
1) интервал должен охватывать область возможных изменений концентраций исследуемого раствора; желательно, чтобы оптическая плотность исследуемого раствора соответствовала примерно середине градуировочной кривой;
2) желательно, чтобы в этом интервале концентраций при выбранных толщине кюветы (l) и аналитической длине волны l * (в большинстве случаев l = l макссветопоглощающего соединения) соблюдался основной закон светопоглощения, т. е. график А = f(c) был прямолинейным;
При совокупности перечисленных условий измеряют оптические плотности стандартных растворов относительно растворителя и строят график зависимости А = f(с). Полученная кривая (рис. 14.4.18) называется градуировочной (градуировочным графиком). Периодически (раз в неделю или реже) ее проверяют по двум-трем свежеприготовленным стандартным растворам.
Рис. 14.4.18. Градуировочный график
Вопрос № 9 условия ф.о
Для достижения высокой воспроизводимости и правильности результатов фотометрического анализа важное значение имеют селективность выбранного реагента и условия проведения фотометрических определений.
Выбор реагента
Для оценки специфических реагентов используют критерии, сформулированные А.К. Бабко [19]. Лучшим реагентом при прочих равных условиях считают такой, который при образовании окрашенного соединения обеспечивает:
1. Наибольшее смещение максимума поглощения D l = l к – l R (где l к и l R — длины волн максимального поглощения комплекса и реагента), характеризующее контрастность реакции. Контрастность фотометрической реакции считается достаточно высокой, если обеспечивается D l = l к – l R ³ 100 нм.
2. Наибольшие абсолютное и относительное изменения молярного коэффициента светопоглощения: D e = e к – e R и 
В тех случаях, когда молярные коэффициенты светопоглощения комплекса и реагента неизвестны, реагенты выбирают по наибольшей разности между суммарной оптической плотностью раствора Асм и оптической плотностью реагента: D А = Асм – АR.
3. Наибольшую разность в значениях рН при образовании окрашенных форм комплекса и реагента: D рН = рНк – рНR.
4. Наибольший интервал значений рН, в котором соблюдается постоянство оптической плотности раствора.
Практическим критерием чувствительности реагента служит угол наклона прямой, характеризующей зависимость оптической плотности (или разности оптических плотностей) от концентрации окрашенного вещества. Графическая, зависимость определяется при длине волны, где значение А (или D А) является максимальным. Чем больше угол наклона (или тангенс угла наклона) этой прямой, тем чувствительнее реагент.
Аналогично по тем же критериям можно оценивать селективные и групповые фотометрические реагенты, но их практическое применение для определения отдельных элементов возможно только в отсутствие мешающих компонентов либо в специальных условиях, при которых мешающее влияние сопутствующих элементов проявляется в незначительной степени.
В тех случаях, когда фотометрическая реакция характеризуется невысокой контрастностью и при выбранной длине волны наблюдается светопоглощение не только анализируемого комплекса, но и фотометрического реагента, находят разность оптических плотностей анализируемого комплекса и чистого реагента при той же концентрации, что и в анализируемом растворе.
Однако эту разность оптической плотности можно отождествлять с оптической плотностью раствора светопоглощающего комплекса только в тех случаях, когда светопоглощение комплекса и реагента обусловлено разными хромофорными группами, что на практике встречается сравнительно редко. Если светопоглощение комплекса и реагента обусловлено одной и той же функциональной группой, то этот прием можно использовать только в условиях большого избытка реагента, когда концентрацией реагента, затраченной на комплексообразование, можно пренебречь.
Метод градуировочного графика
Метод градуировочного графика – это приём нахождения неизвестной концентрации (Сх) по величине аналитического сигнала пробы с помощью градуировочного графика. В аналитических определениях чаще всего имеют дело с прямолинейной градуировочной зависимостью. Уравнение прямой имеет вид y = a + bx, где у – аналитический сигнал, х – концентрация (может быть логарифм концентрации), коэффициент а – отрезок, отсекаемый прямой на оси ординат, коэффициент b –тангенс угла наклона прямой.
На практике устанавливают градуировочную зависимость путем измерения аналитического сигнала в стандартных растворах. Для проведения анализа необходимо иметь исходный стандартный раствор, который готовят по точной навеске, растворённой в мерной колбе. Если стандартный раствор нельзя приготовить по точной навеске, готовят раствор приблизительной концентрации, а затем устанавливают его концентрацию другим методом анализа. Концентрацию исходного стандартного раствора рассчитывают с четырьмя значащими цифрами.
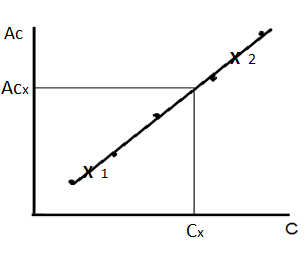
Из исходного стандартного раствора, то есть точно известной концентрации, путем разбавления приготавливают серию стандартных растворов. Во всех приготовленных стандартных растворах измеряют аналитический сигнал. Строят график зависимости аналитического сигнала Ас i от концентрации определяемого компонента С i.
Затем измеряют аналитический сигнал в анализируемой пробе, строго соблюдая те же условия определения и режим работы прибора, как в стандартных растворах. По градуировочному графику находят концентрацию определяемого компонента в анализируемом растворе (рисунок 1.1). Более точные результаты получают, если для линейного участка градуировочного графика выводят уравнение Ас = a + b С и по нему рассчитывают концентрацию определяемого компонента.
Если измеренный аналитический сигнал превышает верхний предел линейной области графика, то анализируемый раствор разбавляют и повторяют измерения. Необходимую степень разбавления анализируемого раствора выбирают таким образом, чтобы концентрация определяемого компонента в разбавленном растворе и, соответственно, аналитический сигнал попадали в линейную область.
Рисунок 1.1 – Метод градуировочного графика
Построение градуировочного графика Ас = f (С) на миллиметровой бумаге проводят в следующем порядке:
1. Выбирают масштаб с учетом ошибки измерения и отмечают на осях координат ряд чисел, характеризующих масштаб. Значения концентрации С откладывают на оси абсцисс, а значения аналитического сигнала Ас – на оси ординат, указывают единицы измерения физических величин. Экспериментальные значения величин на осях координат откладывать не следует.
2. В координатах Ас – C наносят экспериментальные точки, полученные после измерения Ас в стандартных растворах.
3. Рассчитывают значения коэффициентов a и b для уравнения графика y = a + bx и коэффициент корреляции r, используя данные измерений в стандартных растворах (y = Aci, x = Ci). Расчёт проводят методом наименьших квадратов на компьютере (например, в программе Exel) или по формулам [1, c.48]. Записывают уравнение Ас = a + b С, подставив найденные значения коэффициентов a и b.
Коэффициент корреляции r отражает корреляцию параметров Ас и С:
– если r близок к единице (r ≥ 0,99), то корреляция характеризует между Ас и С количественную зависимость;
– если r ≈ 0,95, то зависимость считается полуколичественной;
– если r ≈ 0,90 и ниже, то зависимость считается качественной.
Метод стандартов
Метод стандартов – это расчётный приём нахождения неизвестной концентрации. Он имеет две разновидности.
Метод одного стандарта. Для проведения анализа готовят один стандартный раствор с концентрацией определяемого вещества Сст. Затем измеряют величины аналитического сигнала этого раствора (Iст ) и анализируемой пробы ( Ix ) в одинаковых условиях.
Из выражения для k выводим формулу для расчёта неизвестной концентрации:
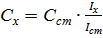
Метод двух стандартов (ограничивающих растворов)
Метод ограничивающих растворов используют в том случае, если концентрация определяемого компонента в анализируемом растворе приблизительно известна и попадает в интервал линейной зависимости показаний прибора (аналитический сигнал) от концентрации. Этим методом пользуются после установления линейности градуировочного графика в определенном диапазоне концентраций.
Результат анализа представляют в форме среднего значения из серии параллельных определений с рассчитанным доверительным интервалом:
Подробные рекомендации и примеры по проведению и оформлению расчетов приведены в пособии [3].
Округление результата определенияx ср ± δ выполняют на последней стадии обработки результатов и начинают с округления значения погрешности δ, а не среднего значения.
Погрешность результата определения δ принято записывать одной цифрой одной или двумя значащими цифрами:
– однойцифрой, если первая цифра погрешности равна 3 или более.
– двумяцифрами, если первая из них равна 1 или 2.
Результат определения x ср должен заканчиваться цифрой того же разряда, что и последняя значащая цифра погрешности. Например, 20,5 ± 0,4; 0,2236 ± 0, 0015; 10,00 ± 0,24.
Обработанные результаты определения представляют в виде таблицы 1.1.
2. ПОТЕНЦИОМЕТРИЧЕСКИЕ МЕТОДЫ АНАЛИЗА
Потенциометрические методы анализа основаны на измерении разности потенциалов (ЭДС) между двумя электродами, опущенными в анализируемый раствор. Один электрод является индикаторным, его потенциал зависит от концентрации (активности) определяемого иона. Потенциал другого электрода, который называется электродом сравнения, не зависит от концентрации определяемого иона и в процессе определения остается постоянным. Зависимость равновесного потенциала индикаторного электрода от активности иона в растворе описывается уравнением Нернста:
В потенциометрии используют два вида индикаторных электродов.
1. Электроды, на поверхности которых или в приэлектродном слое протекают электронообменные процессы. К ним относятся инертные электроды (платиновый, золотой) и металлические электроды 1-го рода (серебряный, медный и др.).
2. Электроды, у которых на межфазных границах (мембрана – раствор) протекают ионообменные процессы – ионоселективные (мембранные) электроды (ИСЭ).
В качестве электрода сравнения в лабораторной практике чаще всего используют электрод 2-го рода – хлоридсеребряный.
Потенциометрические методы разделяют на две группы: методы прямой потенциометрии (ионометрия) и методы косвенной потенциометрии (потенциометрическое титрование).
Основным условием выполнения определения потенциометрическим методом является правильный выбор индикаторного электрода. В прямой потенциометрии используют ионоселективные электроды. При потенциометрическом титровании выбор индикаторного электрода зависит от природы определяемого иона и типа химической реакции при титровании.
Метод градуировочного графика
Метод градуировочного графика – это графический приём нахождения неизвестной концентрации (Сх) по величине аналитического сигнала пробы (Iх).
Для проведения анализа готовят серию стандартных растворов, измеряют величины АС этих растворов и строят градуировочный график I = f(C) (рис.6).
Рис. 6. Определение неизвестной концентрации методом градуировочного графика.
Затем в точно таких же условиях измеряют аналитический сигнал пробы Iх и по графику определяют концентрацию анализируемого вещества в пробе Сх.
§ желательно, чтобы график был линеен, т. к. нелинейность градуировочного графика снижает точность проведения анализа;
§ желательно, чтобы график выходил из начала координат;
§ график надо периодически проверять, а при замене каких-либо реагентов, растворов, приборов, условий проведения анализа – построить заново;
§ в случае большого разброса точек надо применять метод наименьших квадратов, а не строить график «на глаз», особенно при работе с малыми концентрациями.
Метод стандартов (метод молярного свойства)
Метод стандартов – это расчётный приём нахождения неизвестной концентрации. Он имеет две разновидности (рис. 5).
1. Метододного стандарта. Для проведения анализа готовят один стандартный раствор с концентрацией определяемого вещества Сст, затем измеряют величины АС этого раствора (Iст) и пробы (Iх) в одинаковых условиях.
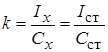
Отсюда выводим формулу, по которой рассчитывают неизвестную концентрацию:
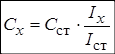
2. Метод двух стандартов (ограничивающих растворов). Для проведения анализа готовят серию стандартных растворов и измеряют величины АС этих растворов и пробы в одинаковых условиях. Затем выбирают два стандартных раствора – «ограничивающие растворы» – так, чтобы С1
Нам важно ваше мнение! Был ли полезен опубликованный материал? Да | Нет
Научная электронная библиотека
Дорогова В Б, Игнатьева Л П,
3.2. Метод градуировочного графика
Для определения содержания вещества методом градуировочного графика готовят серию из 5–8 стандартных растворов разных концентраций и измеряют оптическую плотность каждого из растворов, делая не менее 3-х параллельных определений для каждой точки.
При выборе интервала концентраций стандартных растворов руководствуются следующими положениями:
1) он должен охватывать область возможных изменений концентраций исследуемого раствора. Желательно, чтобы оптическая плотность исследуемого раствора соответствовала примерно середине градуировочной кривой;
Полученная кривая (рис. 3.1) называется градуировочной кривой или градуировочным графиком.
Периодически 1 раз в месяц или в квартал, при замене новой партии реактивов, либо после ремонта фотоколориметра градуировочную кривую проверяют по 2–3 свежеприготовленным стандартным растворам и реагентам.
В общем случае, когда свет поглощается не только определяемым соединением, но и реагентом, экспериментальные данные измерений оптической плотности могут быть представлены следующими вариантами:
3. Оптическую плотность растворов измеряют относительно растворителя. Результат холостой пробы и его погрешность рассчитывают методом линейного регрессионного анализа.
Определив оптическую плотность исследуемого раствора АХ, находят ее значение на оси координат, а затем на оси абсцисс – соответствующее ей значение концентрации СХ.
Этот метод применяют при выполнении серийных фотометрических анализов, он дает хорошие результаты при соблюдении основного закона светопоглощения.
угловой коэффициент линейного градуировочного графика и он равен
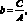
В дальнейшем, при расчете искомой концентрации СХ пользуются только градуировочным коэффициентом:
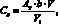
оптическая плотность анализируемого раствора;