для чего нужна энтальпия
Энтальпия — что это такое простыми словами
Про энтальпию на простом языке
При работе с какими-либо расчётами, вычислениями и выполнении прогноза разнообразных явлений, связанных с теплотехникой, каждый сталкивается с понятием энтальпия. Но для людей, специальность которых не касается теплоэнергетики или которые лишь поверхностно сталкиваются с подобными терминами, слово «энтальпия» будет наводить страх и ужас. Итак, давайте разберёмся, действительно ли всё так страшно и непонятно?
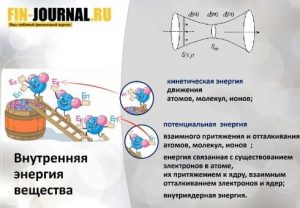
Если попытаться сказать совсем просто, под термином энтальпия понимается энергия, которая доступна для преобразования в теплоту при некотором постоянном давлении. Понятие энтальпия в переводе с греческого значит «нагреваю». То есть формулу, содержащую элементарную сумму внутренней энергии и произведенную работу, называют энтальпией. Эта величина обозначается буквой i.
Если записать вышесказанное физическими величинами, преобразовать и вывести формулу, то получится i = u + pv (где u – внутренняя энергия; p, u – давление и удельный объем рабочего тела в том же состоянии, для которого взято значение внутренней энергии). Энтальпия — аддитивная функция, т. е. энтальпия всей системы равна сумме всех составляющих её частей.
Термин «энтальпия» сложен и многогранен.
Но если постараться в нём разобраться, то всё пойдёт очень просто и понятно.
Ну, что же, механизм работы понятен. Вам лишь нужно внимательно читать и вникать. С термином «Энтальпии» мы уже разобрались, также привели и его формулу. Но тут же возникает ещё один вопрос: откуда взялась эта формула и почему энтропия связана, к примеру, с внутренней энергией и давлением?
Суть и смысл
Для того, чтобы попытаться выяснить физический смысл понятия «энтальпия» нужно знать первый закон термодинамики:
энергия не исчезает в никуда и не возникает из ничего, а лишь переходит из одного вида в другой в одинаковых количествах. Таким примером может служить переход теплоты (тепловой энергии) в механическую энергию, и наоборот.
Уравнение первого закона термодинамики нам нужно преобразить в вид dq = du + pdv = du + pdv + vdp – vdp = d(u + pv) – vdp. Отсюда мы видим выражение (u + pv). Именно это выражение и называется энтальпией (полная формула приводилась выше).
Энтальпия также является величиной состояния, потому что составляющие u (напряжение) и p (давление), v (удельный объём) имеют для каждой величины определенные значения. Зная это, первый закон термодинамики возможно переписать в виде: dq = di – vdp.
В технической термодинамике используются значения энтальпии, которые высчитываются от условно принятого нуля. Все абсолютные значения этих величин весьма трудно определить, так как для этого необходимо учесть все составляющие внутренней энергии вещества при изменении его состояния от О к К.
Формулу и значения энтальпии привёл в 1909 г. учёный Г.Камерлинг-Оннесом.
В выражении i — удельная энтальпия, для всей массы тела полная энтальпия обозначается буквой I, по всемирной системе единиц энтальпия измеряется в Джоулях на килограмм и рассчитывается как:
Функции
Энтальпия («Э») является одной из вспомогательных функций, благодаря использованию которой можно значительно упростить термодинамический расчёт. Так например, огромное количество процессов подвода теплоты в теплоэнергетике (в паровых котлах или камере сгорания газовых турбин и реактивных двигателей, а также в теплообменных аппаратах) осуществляют при постоянном давлении. По этой причине в таблицах термодинамических свойств обычно приводят значения энтальпии.
Условие сохранения энтальпии лежит, в частности, в основе теории Джоуля — Томсона. Или эффекта, нашедшего важное практическое применение при сжижении газов. Таким образом, энтальпия есть полная энергия расширенной системы, представляющая сумму внутренней энергии и внешней – потенциальной энергии давления. Как любой параметр состояния, энтальпия может быть определена любой парой независимых параметров состояния.
Также, исходя из приведённых выше формул, можно сказать: «Э» химической реакции равна сумме энтальпий сгорания исходных веществ за вычетом суммы энтальпий сгорания продуктов реакции.
В общем случае изменение энергии термодинамической системы не является необходимым условием для изменения энтропии этой системы.
Итак, вот мы и разобрали понятие «энтальпии». Стоит отметить, что «Э» неразрывно связана с энтропией, о которой вы также можете прочесть позже.
Основы теплотехники
Что такое энтальпия?
Попробуем уяснить физический смысл и суть понятия энтальпия, которое широко используется при расчетах и прогнозировании различных процессов в теплотехнике.
Уравнение первого закона термодинамики, выражающее закон сохранения энергии в термодинамических процессах, можно преобразовать к следующему виду:
Слово энтальпия в переводе с греческого означает «нагреваю».
Энтальпия тоже является параметром состояния, поскольку составляющие u и pv имеют для каждого состояния вполне определенные значения. Тогда первый закон термодинамики можно записать в виде:
Выражение (cv + T) в соответствии с уравнением Майера можно выразить через cp :
Значение энтальпии различных веществ в разных состояниях приведены в справочниках.
Энтальпия используется в вычислениях для определения разницы уровней энергии между двумя состояниями термодинамической системы.
Это бывает необходимо для настройки оборудования и определения коэффициента полезного действия процесса.
Понятие энтропии
В переводе с греческого слово «энтропия» означает превращение.
Этот параметр не имеет физического смысла и введен формально на основании математических построений для облегчения решения многих теплотехнических задач применительно к идеальному газу.
Произведение энтропии на изменение температуры системы характеризует изменение энергии системы. При этом даже если энергия системы будет изменяться, энтропия этой системы может оставаться неизменной. Очевидно, что при изотермических процессах (температура системы неизменна) составляющая энергии системы в которую входит энтропия равна нулю.
В общем случае изменение энергии термодинамической системы не является обязательным условием изменения энтропии этой системы.
Скачать теоретические вопросы к экзаменационным билетам
по учебной дисциплине «Основы гидравлики и теплотехники»
(в формате Word, размер файла 68 кБ)
Скачать рабочую программу
по учебной дисциплине «Основы гидравлики и теплотехники» (в формате Word):
Скачать календарно-тематический план
по учебной дисциплине «Основы гидравлики и теплотехники» (в формате Word):
Что такое энтальпия
Итак, что же такое энтальпия? Если говорить совсем упрощенно, энтальпия — это энергия, которая доступна для преобразования в теплоту при определенном постоянном давлении. Когда я учился в университете, преподаватель помню, говорил нам, что энтальпию условно можно называть теплосодержанием, так как при постоянном давлении изменение энтальпии равно количеству теплоты, подведенной к системе.
И вообще, сам термин энтальпия составлен из древнегреческих слов — тепло и приставки — в. Это сочетание слов можно понимать как «нагревать». А впервые в термодинамику этот термин был введен ученым Д.Гиббсом. Ну это чтобы понятнее было, так как энтальпия, также кстати, как и энтропия, не может быть измерена непосредственно, как например давление или температура. Энтальпия определяется только расчетным путем. То есть, образно говоря, ее нельзя «потрогать», «пощупать».
Рассмотрим более подробно. Значение энтальпии вещества определяется из выражения:
где u – внутренняя энергия; p, u – давление и удельный объем рабочего тела в том же состоянии, для которого взято значение внутренней энергии.
То есть, можно сказать, что энтальпия любой термодинамической системы представляет собой сумму внутренней энергии системы и потенциальной энергии источника внешнего давления.
Энтальпия находится как сумма величин, которые определяются состоянием вещества, представляет собой функцию состояния и измеряется в Дж/кг. Чаще энтальпия во внесистемной системе измерений измеряется в ккал/кг. Энтальпия является одной из вспомогательных функций, использование которой позволяет значительно упрощать термодинамические расчеты. Так например, огромное количество процессов подвода теплоты в теплоэнергетике (в паровых котлах, камерах сгорания газовых турбин и реактивных двигателей, теплообменных аппаратах) осуществляется при постоянном давлении. По этой причине в таблицах термодинамических свойств обычно приводятся значения энтальпии.
В технической термодинамике пользуются значениями энтальпии, которые отсчитываются от условно принятого нуля. Абсолютные значения этих величин весьма трудно определить, так как для этого необходимо учесть все составляющие внутренней энергии вещества при изменении его состояния от 0 К. В таблицах и на диаграммах часто приводятся значения i и s, которые отсчитываются от 0 °С.
В заключение можно сказать, что энтальпия аналогично внутренней энергии и другим термодинамическим параметрам имеет вполне определенное значение для каждого состояния, то есть является функцией состояния рабочего тела.
N1 ТЕРМОДИНАМИЧЕСКИЙ ЛИКБЕЗ: ЭНТАЛЬПИ’Я, или тепловая функция и теплосодержание
Есть идея. Через публикации о цикле Майсоценко на странице популярно рассказывать посетителям о главных понятиях и терминах термодинамики. Сеять разумное, доброе, вечное знание и пожинать безумное, злое, быстрое продвижение науки. Сегодня первый блог про тепловую функцию или теплосодержание.
Наука | Научпоп
6.1K поста 69K подписчиков
Правила сообщества
ВНИМАНИЕ! В связи с новой волной пандемии и шумом вокруг вакцинации агрессивные антивакцинаторы банятся без предупреждения, а их особенно мракобесные комментарии — скрываются.
Основные условия публикации
— Посты должны иметь отношение к науке, актуальным открытиям или жизни научного сообщества и содержать ссылки на авторитетный источник.
— Посты должны по возможности избегать кликбейта и броских фраз, вводящих в заблуждение.
— Научные статьи должны сопровождаться описанием исследования, доступным на популярном уровне. Слишком профессиональный материал может быть отклонён.
— Видеоматериалы должны иметь описание.
— Названия должны отражать суть исследования.
— Если пост содержит материал, оригинал которого написан или снят на иностранном языке, русская версия должна содержать все основные положения.
Не принимаются к публикации
— Точные или урезанные копии журнальных и газетных статей. Посты о последних достижениях науки должны содержать ваш разъясняющий комментарий или представлять обзоры нескольких статей.
— Юмористические посты, представляющие также точные и урезанные копии из популярных источников, цитаты сборников. Научный юмор приветствуется, но должен публиковаться большими порциями, а не набивать рейтинг единичными цитатами огромного сборника.
— Посты с вопросами околонаучного, но базового уровня, просьбы о помощи в решении задач и проведении исследований отправляются в общую ленту. По возможности модерация сообщества даст свой ответ.
— Оскорбления, выраженные лично пользователю или категории пользователей.
— Попытки использовать сообщество для рекламы.
— Многократные попытки публикации материалов, не удовлетворяющих правилам.
— Нарушение правил сайта в целом.
Окончательное решение по соответствию поста или комментария правилам принимается модерацией сообщества. Просьбы о разбане и жалобы на модерацию принимает администратор сообщества. Жалобы на администратора принимает @SupportComunity и общество пикабу.
А это точно не какая-то петриковщина? Погуглил Майсоценко, уж больно на шарлатана смахивает.
Я теплоэнергетик. И не совсем въехал в эту статью. Распишите более простым языком
Экологи из Иркутской области сообщают о ЧП на водном объекте, несущим свои воды в озеро в Байкал
Экологи из Иркутской области сообщают о ЧП на водном объекте, несущим свои воды в озеро Байкал. Сообщает корреспондент «ЭкоГрада» Любовь Аликина ссылаясь в свою очередь на информацию от эколога Марию Перцулу. По словам Перцулы, в реку Похабиха произошел сброс неочищенных стоков от очистных сооружений города Слюдянка. Сброс опасных стоков сопровождается выделением в атмосферу неприятных запахов. На одном из видео зафиксирована значительная популяция спирогиры
Мария Перцула: Здравствуй СПИРОГИРА. Слюдянка. Прогулка на Байкал неприятно удивила «новой» рекой Похабиха, где она втекает в Байкал. В прошлом году ни чего подобного не было, в январе тоже, на устье сидели рыбаки. А сегодня увидели и осязали зрелище. Ядовитая вонь в воздухе началась после того, как прошли трубу с очистных, которая выходит в речку Похабиха. Когда подошли к месту, где река впадает в Байкал, увидели зелёные водоросли и чёрные воды, впадающие в озеро. Всё прекрасно видно на втором видео. Первое видео, это река до трубы очистных, чистая и прозрачная, как обычно. Что происходит на очистых? Что сливают в Похабиху? Как долго это происходит?
Местные экологи утверждают, что сброс от очистных сооружений Слюдянки происходит систематично, в течении прошедшего года, но, в том числе из-за ограничительных мер пандемии на него практически никто не обратил внимание. Экологи также утверждают, что за прошедший год количество спирогиры в окрестностях Слюдянки увеличилось значительно.
Спирогира – разновидность нитчатых харофитовых водорослей из семейства зигнемовых. Представляет собой неветвящуюся нить, состоящую из одного ряда цилиндрических клеток величиной до 0,01 мм. Каждая клетка спирогиры находится в целлюлозной стенке, покрытой слизью. Водоросль легко распознать по спирально закрученным хлоропластам.
Открытие этого вида нитчатки произошло почти два столетия назад. Спирогира является одной из самых распространенных водорослей и встречается в пресных (реже в солоноватых) водах по всему миру. Она образует большие ватообразные скопления, которые плавают на поверхности воды, стелются по дну или смешиваются с тиной в озерах, болотах, прудах, ручьях и других видах водоемов.
Чем она опасна для экологии Байкала?
1. Вытесняет байкальских эндемиков.
Из-за большого количества цветущей нитчатки на дне озера (спирогира обнаружена даже на глубине в 40 метров), вытесняются некоторые виды микроорганизмов. Например, коренные обитатели Байкала – брюхоногие моллюски. После появления в озере спирогиры их число значительно уменьшилось. Она уничтожает байкальских губок-эндемиков, благодаря которым вода в озере остается кристально чистой. Также она занимает места нерестилищ бычка желтокрылки, которым питается байкальский омуль.
В некоторых районах берега Байкала покрыты толстым слоем сгнившей спирогиры. Это существенно сказывается на качестве воды – она становится непригодной для употребления людьми и животными. Чтобы очистить пляж от водоросли, требуется немало усилий. Приходится копать почти на 30 сантиметров в глубину. Рыбалка также становится практически невозможной. Густая тина заполоняет лодки и сети.
На сегодняшней день изучением байкальской спирогиры активно занимаются ученые из Лимнологического института СО РАН. Пока исследователи не пришли к единому мнению, представляет ли спирогира реальную угрозу для озера или же перечисленные последствия являются результатом совокупности многих факторов. Но уже сейчас неблагоприятные последствия распространения водоросли очевидны.
Какова причина распространения нитчатой водоросли?
Одни полагают, что причиной размножения спирогиры стали благоприятные для нее теплые погодные условия, которыми характеризовался один из сезонов на Байкале. Однако с наступлением холодов количество нитчатки ничуть не уменьшилось. Ледяная вода не стала препятствием для образования густой зеленой пелены на озере.
Другие связывают заполонение воды спирогирой с резким ухудшением экологической обстановки в районе Байкала. Очистные сооружения, установленные в окрестностях, давно устарели и не справляются со своей задачей. Оборудование нуждается в срочной модернизации.
Кроме того, из года в год проблемы с экологией усугубляют незаконные свалки и нелегальные застройки. Туристическая инфраструктура и частный сектор тоже оказывают неблагоприятное влияние на и без того ухудшающуюся обстановку.
Похабиха — река в Слюдянском районе Иркутской области. Длина — около 25 километров. Впадает в озеро Байкал на территории Слюдянского муниципального образования.
Журнал «ЭкоГрад» просит считать данную публикацию публичным обращением в Росприроднадзор, Роспотребнадзор в Байкальскую межрегиональную природоохранную прокуратуру с просьбой проведения компетентной проверки сообщения от экологов из Слюдянки о сбросе неочищенных вод от очистных сооружений в озеро Байкал.
Энтальпия
Энтальпия — это термодинамическое свойство вещества, которое указывает уровень энергии, сохраненной в его молекулярной структуре. Это значит, что, хотя вещество может обладать энергией на основании температуры и давления, не всю ее можно преобразовать в теплоту. Часть внутренней энергии всегда остается в веществе и поддерживает его молекулярную структуру. Часть кинетической энергии вещества недоступна, когда его температура приближается к температуре окружающей среды. Следовательно, энтальпия — это количество энергии, которая доступна для преобразования в теплоту при определенной температуре и давлении.
Единицы энтальпии — британская тепловая единица или Джоуль для энергии и Btu/lbm или Дж/кг для удельной энергии.
Количество энтальпии
Количество энтальпии вещества основано на его данной температуре.
Данная температура — это значение, которая выбрано учеными и инженерами, как основание для вычислений. Это температура, при которой энтальпия вещества равна нулю Дж. Другими словами, у вещества нет доступной энергии, которую можно преобразовать в теплоту. Данная температура у различных веществ разная. Например, данная температура воды — это тройная точка (0°С), азота −150°С, а хладагентов на основе метана и этана −40°С.
Если температура вещества выше его данной температуры или изменяет состояние на газообразное при данной температуре, энтальпия выражается положительным числом. И наоборот при температуре ниже данной энтальпия вещества выражается отрицательным числом. Энтальпия используется в вычислениях для определения разницы уровней энергии между двумя состояниями. Это необходимо для настройки оборудования и определения коэффициента полезного действия процесса.
Энтальпию часто определяют как полную энергию вещества, так как она равна сумме его внутренней энергии (и) в данном состоянии наряду с его способностью проделать работу (pv). Но в действительности энтальпия не указывает полную энергию вещества при данной температуре выше абсолютного нуля (-273°С). Следовательно, вместо того, чтобы определять энтальпию как полную теплоту вещества, более точно определять ее как общее количество доступной энергии вещества, которое можно преобразовать в теплоту.