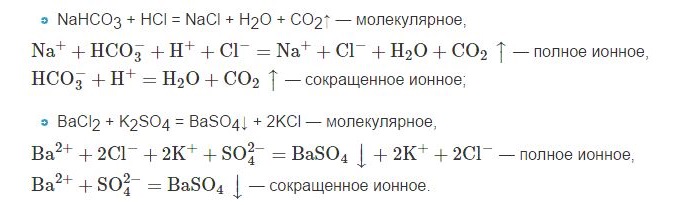для чего нужны ионные уравнения
Реакции ионного обмена
Реакции ионного обмена – это реакции между сложными веществами в растворах, в результате которых реагирующие вещества обмениваются своими составными частями. Так как в этих реакциях происходит обмен ионами – они называются ионными.
| Правило Бертолле: Реакции обмена в растворах электролитов протекают до конца (возможны) только тогда, когда в результате реакции образуется либо твердое малорастворимое вещество (осадок), либо газ, либо вода или любой другой слабый электролит. |
| Например, нитрат серебра взаимодействует с бромидом калия |
AgNО3 + КВr = АgВr↓ + КNО3
Правила составления уравнений реакций ионного обмена
1. Записываем молекулярное уравнение реакции, не забывая расставить коэффициенты:
3KOH +FeCl3 = Fe(OH)3 + 3KCl
2. С помощью таблицы растворимости определяем растворимость каждого вещества. Подчеркнем вещества, которые мы не будем представлять в виде ионов.
р р н р
3KOH + FeCl3 = Fe(OH)3 + 3KCl
3. Составляем полное ионное уравнение. Сильные электролиты записываем в виде ионов, а слабые электролиты, малорастворимые вещества и газообразные вещества записываем в виде молекул.
3K + + 3OH — + Fe 3+ + 3Cl — = Fe(OH)3 + 3K + + 3Cl —
4. Находим одинаковые ионы (они не приняли участия в реакции в левой и правой частях уравнения реакции) и сокращаем их слева и справа.
3K + + 3OH — + Fe 3+ + 3Cl — = Fe(OH)3 + 3K + + 3Cl —
5. Составляем итоговое сокращенное ионное уравнение (выписываем формулы ионов или веществ, которые приняли участие в реакции).
Fe 3+ + 3OH — = Fe(OH)3
На ионы мы не разбиваем:
| Например, взаимодействие сульфида цинка и серной кислоты |
Составляем уравнение реакции и проверяем растворимость всех веществ. Сульфид цинка нерастворим.
ZnS + H2SO4 = ZnSO4 + H2S
Реакция протекает до конца, т.к. выделяется газ сероводород, который является слабым электролитом. Полное ионно-молекулярное уравнение:
ZnS + 2H + + SO4 2 — = Zn 2+ + SO4 2 — + H2S
Сокращаем ионы, которые не изменились в процессе реакции – в данном случае это только сульфат-ионы, получаем сокращенное ионное уравнение:
ZnS + 2H + = Zn 2+ + H2S
| Например, взаимодействие гидрокарбоната натрия и гидроксида натрия |
Составляем уравнение реакции и проверяем растворимость всех веществ:
NaHCO3 + NaOH = Na2CO3 + H2O
Кислые анионы слабых кислот являются слабыми электролитами и на ионы не разбиваются:
Na + + НСО3 — + Na + + ОН — = 2Na + + CO3 2- + H2O
Сокращаем одинаковые ионы, получаем сокращенное ионное уравнение:
НСО3 — + ОН — = CO3 2- + H2O
| Например, взаимодействие тетрагидроксоалюмината натрия и соляной кислоты |
Составляем уравнение реакции и проверяем растворимость всех веществ:
Na[Al(OH)4] + 4HCl = NaCl + AlCl3 + H2O
Комплексные ионы являются слабыми электролитами и на ионы не разбиваются:
Na + + [Al(OH)4] — + 4H + + 4Cl — = Na + + Cl — + Al 3+ + 3Cl — + H2O
Сокращаем одинаковые ионы, получаем сокращенное ионное уравнение:
[Al(OH)4] — + 4H + = Al 3+ + 4H2O
Для чего нужны ионные уравнения
Когда химические вещества вступают во взаимодействие, химические связи между их атомами разрушаются и образуются новые, уже в других сочетаниях. В результате одни вещества превращаются в другие.
Рассмотрим реакцию горения метана, происходящую в конфорке газовой плиты:
Молекула метана (CH₄) и две молекулы кислорода (2O₂) вступают в реакцию, образуя молекулу углекислого газа (CO₂) и две молекулы воды (2H₂O). Связи между атомами углерода (С) и водорода (H) в метане, а также между атомами кислорода (O) разрываются, и образуются новые связи между атомами углерода и кислорода в молекуле углекислого газа (CO₂) и между атомами водорода и кислорода в молекуле воды (H₂O).
Картинка даёт наглядное представление о том, что произошло в ходе реакции. Но зарисовывать сложные химические процессы такими схемами неудобно. Вместо этого учёные используют уравнения химических реакций.
Химическое уравнение — это условная запись химической реакции с помощью формул и символов.
Их записывают в виде схемы, в которой отражён процесс превращения. В левой части располагаются формулы реагентов — веществ, вступающих в реакцию. Завершается уравнение продуктами реакции — веществом или веществами, которые получились в результате.
Новые вещества образуются потому, что изменяются связи между атомами, но сами атомы не возникают из ниоткуда и не исчезают в никуда. На рисунке видно, что атом углерода из состава метана перешёл в состав углекислого газа, атом водорода — в состав воды, а атомы кислорода распределились между молекулами углекислого газа и воды. Число атомов не изменилось.
Согласно закону сохранения массы, общая масса реагентов всегда равна общей массе продуктов реакции. Именно поэтому запись химической реакции называют уравнением.
Виды химических реакций
Вещества вступают в реакции по-разному, можно выделить четыре наиболее частых варианта:
Сложное вещество негашёная известь соединяется с водой, и образуется новое сложное вещество — гашёная известь:
Стрелка вверх означает, что образовался газ. Он улетучивается и больше не участвует в реакции.
В примере атомы цинка замещают атомы водорода в составе хлороводорода, и образуется хлорид цинка:
Стрелка вниз означает, что вещество выпало в осадок, поскольку оно нерастворимо.
Коэффициенты в уравнениях химических реакций
Чтобы составить уравнение химической реакции, важно правильно подобрать коэффициенты перед формулами веществ.
Коэффициент в химических уравнениях означает число молекул (формульных единиц) вещества, необходимое для реакции. Он обозначается числом перед формулой (например, 2NaCl в последнем примере).
Коэффициент не следует путать с индексом (числом под символом химического элемента, например, О₂). Индекс обозначает количество атомов этого элемента в молекуле (формульной единице).
Чтобы узнать общее число атомов элемента в формуле, нужно умножить его индекс на коэффициент вещества. В примере на картинке (2H₂O) — четыре атома водорода и два кислорода.
Подобрать коэффициент — значит определить, сколько молекул данного вещества должно участвовать в реакции, чтобы она произошла. Далее мы расскажем, как это сделать.
Алгоритм составления уравнений химических реакций
Для начала составим схему химической реакции. Например, образование оксида магния (MgO) в процессе горения магния (Mg) в кислороде (O₂). Обозначим реагенты и продукт реакции:
Чтобы схема стала уравнением, нужно расставить коэффициенты. В левой части схемы два атома кислорода, а в правой — один. Уравняем их, увеличив число молекул продукта:
Теперь число атомов кислорода до и после реакции одинаковое, а число атомов магния — нет. Чтобы уравнять их, добавим ещё одну молекулу магния. Когда количество атомов каждого из химических элементов в составе веществ уравнено, вместо стрелки можно ставить равно:
Уравнение химической реакции составлено.
Рассмотрим реакцию разложения. Нитрат калия (KNO₃) разлагается на нитрит калия (KNO₂) и кислород (О₂):
В обеих частях схемы по одному атому калия и азота, а атомов кислорода до реакции 3, а после — 4. Необходимо их уравнять.
Для начала удвоим коэффициент перед реагентом:
Теперь в левой части схемы шесть атомов кислорода, два атома калия и два атома азота. В левой по-прежнему по одному атому калия и азота и четыре атома кислорода. Чтобы уравнять их, в правой части схемы нужно удвоить коэффициент перед нитритом калия.
Снова посчитаем число атомов каждого химического элемента в составе веществ до и после реакции: два атома калия, два атома азота и шесть атомов кислорода. Равенство достигнуто.
Химические уравнения не только позволяют предсказать, что произойдёт при взаимодействии тех или иных веществ, но и помогают рассчитать их количественное соотношение, необходимое для реакции.
Учите химию вместе с домашней онлайн-школой «Фоксфорда»! По промокоду CHEMISTRY892021 вы получите бесплатный недельный доступ к курсам химии за 8 класс и 9 класс.
У нас вы сможете учиться в удобном темпе, делать упор на любимые предметы и общаться со сверстниками по всему миру.

Интересное по рубрике
Найдите необходимую статью по тегам
Подпишитесь на нашу рассылку
Мы в инстаграм
Домашняя онлайн-школа
Помогаем ученикам 5–11 классов получать качественные знания в любой точке мира, совмещать учёбу со спортом и творчеством

Рекомендуем прочитать
Реальный опыт семейного обучения
Звонок по России бесплатный
Посмотреть на карте
Если вы не нашли ответ на свой вопрос на нашем сайте, включая раздел «Вопросы и ответы», закажите обратный звонок. Мы скоро свяжемся с вами.
Химическое преобразование, где участвуют вещества, находящиеся в виде вводных растворов – это реакция ионного обмена.
В данном процессе степень окисления составляющих веществ остается неизменной. Это объясняется тем, что этими веществами являются электролиты.
Условия протекания реакций между электролитами
В химии такие взаимодействия называют гидролизом. Этот процесс можно описать по правилам составления уравнений.
Их суть заключается в следующем:
должны быть уравнены суммы электрических зарядов ионов в правой и левой стороне уравнения;
в растворах компонентами являются вещества в виде ионов;
если в уравнении описывается нерастворимый компонент, то это означает, что он в природе слаборастворимый;
если в решение уравнения включены не растворяющиеся в водной среде вещества, то это значит что они не диссоциируют.
Молекулярные уравнения реакций
В таких уравнениях компоненты описываются в виде молекул. Их записывают таким образом:
Из формулы видно, что к положительному заряду одного компонента добавляется противоположный заряд другого вещества.
Стрелка вниз указывает, что реакция химических компонентов образует осадок. Если в результате преобразований происходит выделение газа, то ставят стрелку вверх.
Алгоритм взаимодействия других ионов описывается по той же схеме.
Важно помнить, что составить ионное уравнение возможно на основе молекулярной формулы. Должна быть четкая последовательность.
Полные ионные уравнения
Практически с помощью молекулярного уравнения нельзя в полном объеме описать химическую реакцию.
Например, реакция соляной кислоты с гидроксидом натрия записывается в молекулярном виде:
HCl + NaOH = NaCl + H2O.
Но по этой формуле невозможны расшифровки процесса в полном объеме. Точно это записывают так:
Теперь видно, что все необратимые реакции разбиты по отдельным частицам. Такая разбивка на ионы называется полной формулой ионного обмена.
Сокращенные ионные уравнения
На практике реакцию ионного обмена нельзя описать полностью полным уравнением. Это объяснятся присутствием с обеих сторон идентичных составляющих – катионов.
Из этого становится понятным, что происходит нейтрализация воды. К этому все сводится. Хотя все описанные правила имеют одинаковую цель – полностью описать химические процессы.
1.4.6. Реакции ионного обмена.
Реакции ионного обмена — реакции в водных растворах между электролитами, протекающие без изменений степеней окисления образующих их элементов.
Необходимым условием протекания реакции между электролитами (солями, кислотами и основаниями) является образование малодиссоциирующего вещества (вода, слабая кислота, гидроксид аммония), осадка или газа.
Расcмотрим реакцию, в результате которой образуется вода. К таким реакциям относятся все реакции между любой кислотой и любым основанием. Например, взаимодействие азотной кислоты с гидроксидом калия:
Исходные вещества, т.е. азотная кислота и гидроксид калия, а также один из продуктов, а именно нитрат калия, являются сильными электролитами, т.е. в водном растворе они существуют практически только в виде ионов. Образовавшаяся вода относится к слабым электролитам, т.е. практически не распадается на ионы. Таким образом, более точно переписать уравнение выше можно, указав реальное состояние веществ в водном растворе, т.е. в виде ионов:
Уравнения вида (3) называют сокращенными ионными уравнениями, вида (2) — полными ионными уравнениями, а вида (1) — молекулярными уравнениями реакций.
Фактически ионное уравнение реакции максимально отражает ее суть, именно то, благодаря чему становится возможным ее протекание. Следует отметить, что одному сокращенному ионному уравнению могут соответствовать множество различных реакций. Действительно, если взять, к примеру, не азотную кислоту, а соляную, а вместо гидроксида калия использовать, скажем, гидроксид бария, мы имеем следующее молекулярное уравнение реакции:
Соляная кислота, гидроксид бария и хлорид бария являются сильными электролитами, то есть существуют в растворе преимущественно в виде ионов. Вода, как уже обсуждалось выше, – слабый электролит, то есть существует в растворе практически только в виде молекул. Таким образом, полное ионное уравнение данной реакции будет выглядеть следующим образом:
2H + + 2Cl − + Ba 2+ + 2OH − = Ba 2+ + 2Cl − + 2H2O
Сократим одинаковые ионы слева и справа и получим:
Разделив и левую и правую часть на 2, получим:
Полученное сокращенное ионное уравнение полностью совпадает с сокращенными ионным уравнением взаимодействия азотной кислоты и гидроксида калия.
При составлении ионных уравнений в виде ионов записывают только формулы:
1) сильных кислот (HCl, HBr, HI, H2SO4, HNO3, HClO4 ) (список сильных кислот надо выучить!)
2) сильных оснований (гидроксиды щелочных (ЩМ) и щелочно-земельных металлов(ЩЗМ))
3) растворимых солей
В молекулярном виде записывают формулы:
1) Воды H2O
2) Слабых кислот (H2S, H2CO3, HF, HCN, CH3COOH (и др. практически все органические)).
3) Слабых оcнований («NH4OH» и практически все гидроксиды металлов кроме ЩМ и ЩЗМ.
4) Малорастворимых солей (↓) («М» или «Н» в таблице растворимости).
5) Оксидов (и др. веществ, не являющихся электролитами).
Попробуем записать уравнение между гидроксидом железа (III) и серной кислотой. В молекулярном виде уравнение их взаимодействия записывается следующим образом:
Сократив сульфат-ионы слева и справа, получаем:
разделив обе части уравнения на 2 получаем сокращенное ионное уравнение:
Теперь давайте рассмотрим реакцию ионного обмена, в результате которой образуется осадок. Например, взаимодействие двух растворимых солей :
Все три соли – карбонат натрия, хлорид кальция, хлорид натрия и карбонат кальция (да-да, и он тоже) – относятся к сильным электролитам и все, кроме карбоната кальция, растворимы в воде, т.е. есть участвуют в данной реакции в виде ионов:
2Na + + CO3 2- + Ca 2+ + 2Cl − = CaCO3↓+ 2Na + + 2Cl −
Сократив одинаковые ионы слева и справа в данном уравнении, получим сокращенное ионное:
Последнее уравнение отображает причину взаимодействия растворов карбоната натрия и хлорида кальция. Ионы кальция и карбонат-ионы объединяются в нейтральные молекулы карбоната кальция, которые, соединяясь друг с другом, порождают мелкие кристаллы осадка CaCO3 ионного строения.
Примечание важное для сдачи ЕГЭ по химии
Чтобы реакция соли1 с солью2 протекала, помимо базовых требований к протеканиям ионных реакций (газ, осадок или вода в продуктах реакции), на такие реакции накладывается еще одно требование – исходные соли должны быть растворимы. То есть, например,
реакция не идет, хотя FeS – потенциально мог бы дать осадок, т.к. нерастворим. Причина того что реакция не идет – нерастворимость одной из исходных солей (CuS).
протекает, так как карбонат кальция нерастворим и исходные соли растворимы.
То же самое касается взаимодействия солей с основаниями. Помимо базовых требований к протеканию реакций ионного обмена, для того чтобы соль с основанием реагировали необходима растворимость их обоих. Таким образом:
т.к. Cu(OH)2 нерастворим, хотя потенциальный продукт CuS был бы осадком.
А вот реакция между NaOH и Cu(NO3)2 протекает, так оба исходных вещества растворимы и дают осадок Cu(OH)2:
Внимание! Ни в коем случае не распространяйте требование растворимости исходных веществ дальше реакций соль1+ соль2 и соль + основание.
Например, с кислотами выполнение этого требования не обязательно. В частности, все растворимые кислоты прекрасно реагируют со всеми карбонатами, в том числе нерастворимыми.
1) Соль1+ соль2 — реакция идет если исходные соли растворимы, а в продуктах есть осадок
2) Соль + гидроксид металла – реакция идет, если в исходные вещества растворимы и в продуктах есть осадок или гидроксид аммония.
Рассмотрим третье условие протекания реакций ионного обмена – образование газа. Строго говоря, только в результате ионного обмена образование газа возможно лишь в редких случаях, например, при образовании газообразного сероводорода:
В большинстве же остальных случаев газ образуется в результате разложения одного из продуктов реакции ионного обмена. Например, нужно точно знать в рамках ЕГЭ, что с образованием газа в виду неустойчивости разлагаются такие продукты, как H2CO3, «NH4OH» и H2SO3:
(«NH4OH» — такая запись формулы в кавычках подразумевает, что в реальности вещества с такой формулой не существует. Формула используется для большей простоты промежуточных записей. В реальности вместо «гидроксида аммония» правильнее писать формулу гидрата аммиака NH3·H2O).
Другими словами, если в результате ионного обмена образуются угольная кислота, гидроксид аммония или сернистая кислота, реакция ионного обмена протекает благодаря образованию газообразного продукта:
Запишем ионные уравнения для всех указанных выше реакций, приводящих к образованию газов. 1) Для реакции:
В ионном виде будут записываться сульфид калия и бромид калия, т.к. являются растворимыми солями, а также бромоводородная кислота, т.к. относится к сильным кислотам. Сероводород же, являясь малорастворимым и плохо диссоциирцющим на ионы газом, запишется в молекулярном виде:
2K + + S 2- + 2H + + 2Br — = 2K + + 2Br — + H2S↑
Сократив одинаковые ионы получаем:
В ионном виде запишутся Na2CO3, Na2SO4 как хорошо растворимые соли и H2SO4 как сильная кислота. Вода является малодиссоциирующим веществом, а CO2 и вовсе неэлектролит, поэтому их формулы будут записываться в молекулярном виде:
Полное и сокращенное уравнение будут иметь вид:
.jpg)
.jpg)
.jpg)
.jpg)


.jpg)
.jpg)
.jpg)
.jpg)
.jpg)
.jpg)
.jpg)
.jpg)