для чего нужны рибосомы в живой клетке
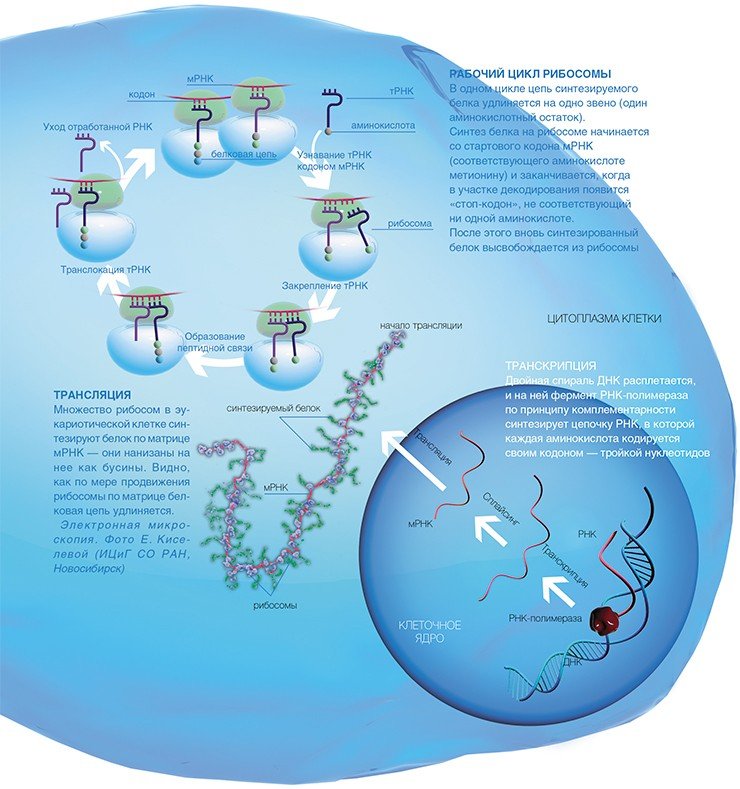
Рибосома – минифабрика по производству белков
Одним из наиболее сложных процессов, осуществляемых живыми существами, является, пожалуй, синтез белков — важнейших структурных и функциональных «кирпичиков» любого организма. Подлинное понимание молекулярных процессов, лежащих в его основе, могло бы пролить свет на неимоверно давние события, связанные с тайной зарождения самой Жизни.
Во всех живых организмах, от простейших бактерий до человека, белки синтезируются специальными клеточными устройствами рибосомами. На этих уникальных фабриках происходит образование белковой цепи из отдельных аминокислот.
В клетках, ведущих интенсивный белковый синтез, рибосом очень много: так, в одной бактериальной клетке содержится около 10 тыс. этих минифабрик, составляющих до 30% общей сухой массы клетки! В клетках высших организмов рибосом содержится меньше — их число зависит от типа ткани и уровня метаболизма клетки.
Рибосома синтезирует белок со средней скоростью 10—20 аминокислот в секунду. Точность трансляции исключительно высока — ошибочное включение «неправильного» аминокислотного остатка в цепь белка составляет в среднем одну аминокислоту на 3 тыс. звеньев (при средней длине белковой цепи у человека в 500 аминокислотных остатков), т. е. всего одна ошибка на шесть белков.
О генетическом коде
Программа, задающая последовательность аминокислотных остатков в белке, записана в геноме клетки: около полувека назад было установлено, что аминокислотные последовательности всех белков непосредственно закодированы в ДНК с помощью так называемого генетического кода. Согласно этому коду, универсальному для всех живых организмов, каждой из двадцати существующих аминокислот соответствует свой кодон — тройка нуклеотидов, представляющих собой элементарные единицы цепочки ДНК. Любой белок закодирован в ДНК определенной последовательностью кодонов. Эта последовательность называется геном.
Одна клетка может содержать до 10 тыс. рибосом — белковых минифабрик, составляющих до 30% сухой клеточной массы
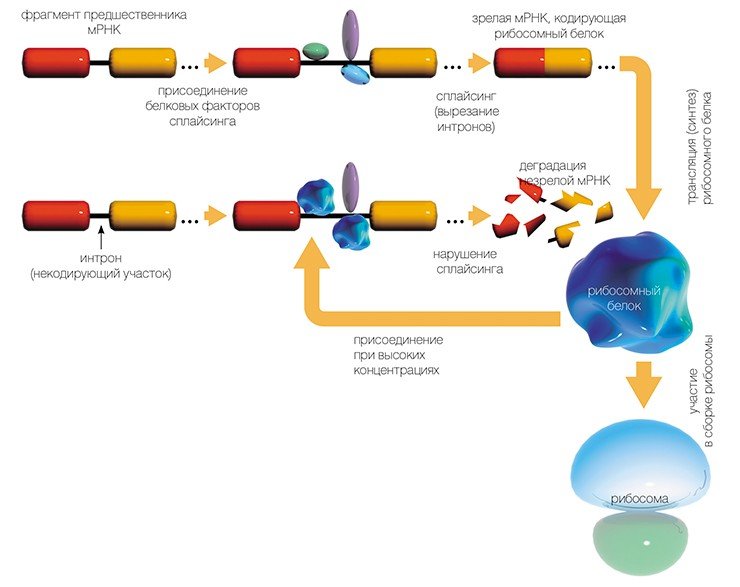
Как же эта генетическая информация доходит до рибосомы? На отдельном гене, как на матрице, синтезируется цепь еще одной информационной молекулы — рибонуклеиновой кислоты (РНК). Этот процесс копирования гена, называемый транскрипцией, осуществляется специальными ферментами — РНК-полимеразами.
Но РНК, полученная таким образом, еще не является матрицей для синтеза белка: из нее, вырезаются определенные «некодирующие» куски нуклеотидной последовательности (процесс сплайсинга).
Точность белкового синтеза рибосомой исключительно высока — у человека ошибка составляет один на три тысячи «неправильный» аминокислотный остаток
В результате получается матричная РНК (мРНК), которая и используется рибосомами в качестве программы для синтеза белка. Сам синтез, т.е. перевод генетической информации с языка нуклеотидной последовательности мРНК на язык аминокислотной последовательности белка, называется трансляцией.
Декодирование и синтез
В клетках эукариот одну мРНК обычно транслирует сразу множество рибосом, образуя так называемые полисомы, которые можно отчетливо видеть с помощью электронной микроскопии, позволяющей получать увеличение в десятки тысяч раз.
Как поступают в рибосому аминокислоты, являющиеся строительными кирпичиками для синтеза белка? Еще в 50-х годах прошлого столетия были открыты особые «перевозчики», доставляющие аминокислоты в рибосому, — короткие (длиной менее 80 нуклеотидов) транспортные РНК (тРНК). Специальный фермент присоединяет аминокислоту к одному из концов тРНК, причем каждой аминокислоте соответствует строго определенная тРНК. Синтез белка на рибосоме включает три основные стадии: начало, удлинение полипептидной цепи и окончание.
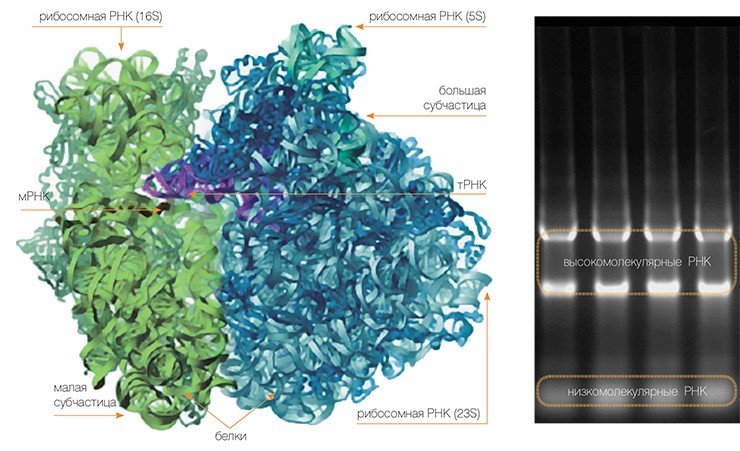
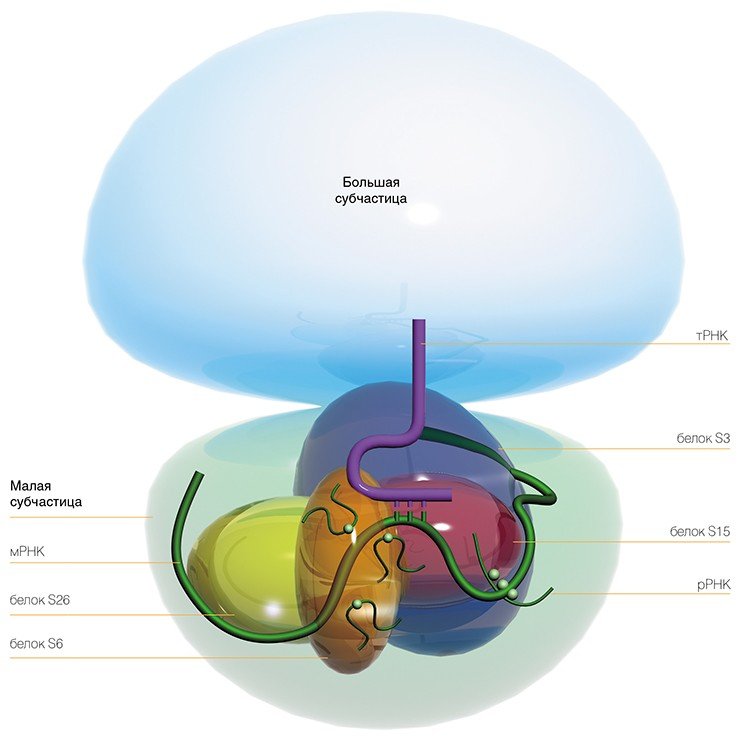
Сама рибосома — одна из самых сложно организованных молекулярных машин клетки — состоит из двух неравных частей, так называемых субчастиц (малой и большой). Ее можно легко разделить на части центрифугированием при сверхвысоких скоростях в специальных пробирках с раствором сахарозы, концентрация которой увеличивается сверху вниз. Поскольку малая субчастица в два раза легче большой, они движутся от верха пробирки к дну с разными скоростями.
Малая субчастица отвечает за декодирование генетической информации. Она состоит из высокомолекулярной рибосомной РНК (рРНК) и нескольких десятков белков (около 20 у прокариот и более 30 — у эукариот).
В раковых клетках резко повышается уровень некоторых рибосомных белков. Возможная причина — сбои в механизмах авторегуляции их производства
Большая субчастица, ответственная за образование пептидной связи между аминокислотными остатками, состоит из нескольких рРНК: одной высокомолекулярной и одной (или двух в случае эукариот) низкомолекулярной, а также нескольких десятков белков (более 30 у прокариот и до 50 у эукариот). О масштабе деятельности рибосом можно судить хотя бы по тому факту, что рибосомная РНК составляет около 80 % всей РНК клетки, тРНК, транспортирующая аминокислоты, — около 15 %, тогда как матричная РНК, несущая информацию о белковой последовательности, — лишь 5 %!
Нужно отметить, что рибосомные белки наделены множеством других, дополнительных функций, которые могут проявляться на разных этапах жизнедеятельности клетки. Например, рибосомный белок S3 человека — один из ключевых белков центра связывания мРНК на рибосоме — принимает также участие в «ремонте» повреждений в ДНК (Kim et al., 1995), участвует в апоптозе (запрограммированной гибели клетки) (Jung et al., 2004), а также защищает от разрушения белок теплового шока (Kim et al., 2006).
Кроме того, чересчур интенсивный синтез некоторых рибосомных белков может свидетельствовать о развитии злокачественной трансформации клетки. Например, значительное повышение уровня пяти рибосомных белков было обнаружено в опухолевых клетках толстого кишечника (Zhang et al., 1999). Недавно сотрудниками лаборатории структуры и функции рибосом ИХБФМ СО РАН был открыт новый механизм авторегуляции биосинтеза рибосомных белков у человека, основанный на принципе обратной связи. Неуправляемый синтез рибосомных белков, характерный для опухолевых клеток, вероятно, вызван сбоями именно в этом механизме. Дальнейшие исследования в этой области представляют особый инте¬рес не только для ученых, но и для медиков.
Работает как «рибозим»
Удивительно, но, несмотря на миллиарды лет эволюции, разделяющие бактерии и человека, вторичная структура рибосомальных РНК у них мало различается.
О том, как уложена рРНК в субчастицах и каким образом она взаимодействует с рибосомными белками, до недавнего времени было известно не много. Революционный сдвиг в понимании устройства рибосомы на молекулярном уровне произошел на рубеже нового тысячелетия, когда с помощью рентгеноструктурного анализа удалось расшифровать на уровне отдельных атомов структуру рибосом простейших организмов и их модельных комплексов с мРНК и тРНК. Это позволило понять молекулярные механизмы декодирования генетической информации и образования связей в молекуле белка.
Оказалось, что оба важнейших функциональных центра рибосомы — как декодирующий на малой субчастице, так и отвечающий за синтез белковой цепочки на большой субчастице — сформированы не белками, а рибосомной РНК. То есть, рибосома работает подобно рибозимам — необычным ферментам, состоящим не из белков, а из РНК.
Рибосомные белки, тем не менее, также играют важную роль в работе рибосомы. В отсутствие этих белков рибосомные РНК совершенно неспособны ни декодировать генетическую информацию, ни катализировать образование пептидных связей. Белки обеспечивают необходимую для работы рибосомы сложную «укладку» рРНК в функциональных центрах, служат «передатчиками» изменений пространственной структуры рибосомы, необходимых в процессе работы, а также связывают различные молекулы, влияющие на скорость и точность процесса белкового синтеза.
Сама рабочая схема белкового цикла в принципе одинакова для рибосом всех живых существ. Однако до сих пор неизвестно, до какой степени схожи молекулярные механизмы работы рибосом у разных организмов. Особенно не хватает информации об устройстве функциональных центров рибосом высших организмов, которые изучены гораздо хуже, чем рибосомы простейших.
Это связано с тем, что многие из методов, успешно использованных для исследования рибосом прокариот, оказались для эукариот неприменимыми. Так, из рибосом высших организмов не удается получить кристаллы, пригодные для рентгеноструктурного анализа, а их субчастицы невозможно «собрать» в пробирке из смеси рибосомных белков и рРНК, как это делается у простейших.
От низших — к высшим
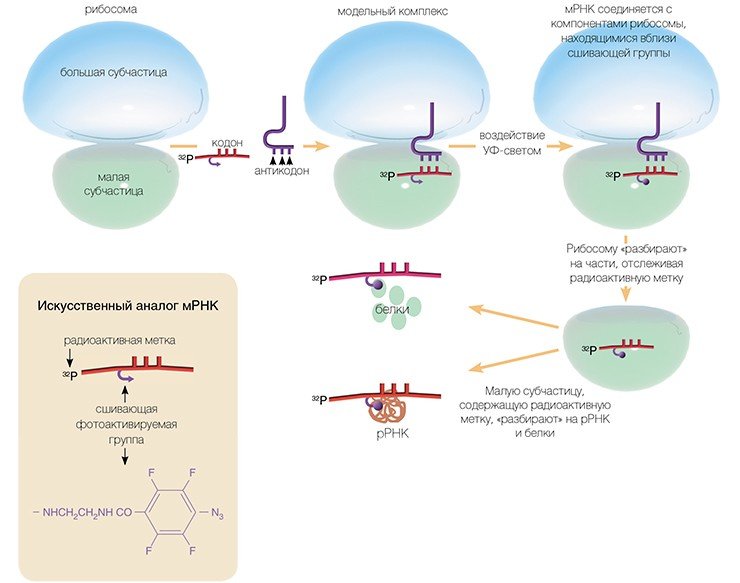
И все-таки способы получения сведений о строении функциональных центров рибосом высших организмов существуют. Одним из таких методов является метод химического аффинного сшивания, разработанный 35 лет назад в отделе биохимии НИОХ СО АН СССР (ныне ИХБФМ СО РАН) под руководством академика Д. Г. Кнорре.
Метод основан на использовании коротких синтетических мРНК, несущих в выбранном положении химически активные («сшивающие») группы, которые в нужный момент можно активировать (например, облучая мягким ультрафиолетовым светом).
Метод аффинного химического сшивания был разработан 35 лет назад в отделе биохимии НИОХ СО АН СССР (ныне ИХБФМ СО РАН) под руководством академика Д. Г. Кнорре.До появления рентгеноструктурного анализа рибосом он использовался во всем мире для изучения рибосом у прокариот.
Этот метод и сегодня является основным для изучения структурно-функциональной организации рибосом высших организмов
Достоинство этого метода в том, что сшивающую группу можно присоединить практически к любому нуклеотидному остатку мРНК и в результате получить детальную информацию о его окружении на рибосоме. Используя набор коротких мРНК с разным расположением сшивающей группы, нам удалось определить рибосомные белки и нуклеотиды рРНК рибосомы человека, образующие канал для считывания генетической информации в процессе трансляции.
Впервые экспериментально удалось показать, что все нуклеотиды рРНК малой рибосомной частицы человека, соседствующие с кодонами мРНК, расположены в консервативных районах вторичной структуры молекулы рРНК. Более того, их расположение совпадает с положением соответствующих нуклеотидов во вторичной структуре рРНК рибосом низших организмов. Это позволило сделать вывод, что эта часть рибосомной РНК малой субчастицы составляет эволюционно консервативный «кор» (сердцевину) рибосомы, структурно идентичный у всех организмов.
С другой стороны, в устройстве мРНК-связывающего канала рибосом у человека и низших организмов обнаружен ряд принципиальных различий. Оказалось, что у высших организмов рибосомные белки играют намного большую роль в формировании этого канала, чем у прокариот, кроме того, в этом участвуют также белки, не имеющие «двойников» (гомологов) у низших организмов.
Почему же, несмотря на то, что функция рибосомы практически не изменилась в процессе эволюции, в организации декодирующего центра рибосом у высших организмов появились специфичные черты? Вероятно, это связано с более сложной и многостадийной регуляцией белкового синтеза у эукариот по сравнению с прокариотами, в ходе которой рибосомные белки мРНК-связывающего канала могут взаимодействовать не только с мРНК, но и с различными факторами, влияющими на эффективность и точность трансляции. Так ли это, покажут дальнейшие исследования.
Строение и функции рибосом. Биосинтез белков и значение рибосом для организма
Рибосомы — субмикроскопические немембранные органеллы, необходимые для синтеза белка. Они объединяют аминокислоты в пептидную цепь, образуя новые белковые молекулы. Биосинтез осуществляется по матричной РНК путем трансляции.
Особенности строения
Рибосомы находятся на гранулярном эндоплазматическом ретикулуме или свободно плавают в цитоплазме. Крепятся они к эндоплазматической сети своей большой субъединицей и синтезируют белок, который выводится за пределы клетки, используется всем организмом. Цитоплазменные рибосомы в основном обеспечивают внутренние потребности клетки.
Форма шаровидная или овальная, в диаметре около 20нм.
На этапе трансляции к мРНК может прикрепляться несколько рибосом, образуя новую структуру – полисому. Сами же они образуются в ядрышке, внутри ядра.
Выделяют 2 вида рибосом:
Строение обоих видов идентичное. В состав рибосомы входят две субъединицы — большая и малая, которые в сочетании напоминают гриб. Объединяются они при помощи ионов магния, сохраняя между соприкасающимися поверхностями небольшую щель. При дефиците магния субъединицы отдаляются, происходит дезагрегация и рибосомы уже не могут выполнять свои функции.
Химический состав
Рибосомы состоят из высокополимерной рибосомальной РНК и белка в соотношении 1:1. В них сосредоточено примерно 90% всей клеточной РНК. Малая и большая субъединицы содержат около четырех молекул рРНК, которая имеет вид нитей собранных в клубок. Окружены молекулы белками и формируют вместе рибонуклеопротеид.
Полирибосомы – это объединение информационной РНК и рибосом, которые нанизываются на нить иРНК. В период отсутствия синтезирующих процессов, рибосомы разъединяются и обмениваются субъединицами. При поступлении иРНК они снова собираются в полирибосомы.
Количество рибосом может изменяться в зависимости от функциональной нагрузки на клетку. Десятки тысяч находятся в клетках с высокой митотической активностью (меристема растений, стволовые клетки).
Образование в клетке
Субъединицы рибосом формируются в ядрышке. Матрицей для синтеза рибосомальной РНК является ДНК. Для полного созревания они проходят несколько этапов:
Биосинтез белков на рибосомах
Трансляция или синтез белков на рибосомах с матрицы иРНК – конечный этап преобразования генетической информации в клетках. Во время трансляции информация, закодированная в нуклеиновых кислотах, переходит в белковые молекулы со строгой последовательностью аминокислот.
Трансляция – весьма непростой этап (в сравнении с репликацией и транскрипцией). Для проведения трансляции в процесс включаются все виды РНК, аминокислот, множество ферментов, которые могут исправлять погрешности друг друга. Самые важные участники трансляции – это рибосомы.
После транскрипции, новообразованная молекула иРНК, выходит из ядра в цитоплазму. Здесь после нескольких преобразований она соединяется с рибосомой. При этом аминокислоты приводятся в действие после взаимодействия с энергетическим субстратом – молекулой АТФ.
Аминокислоты и иРНК имеют разный химический состав и без постороннего участия не могут взаимодействовать между собой. Для преодоления этой несовместимости существует транспортная РНК. Под действием ферментов аминокислоты соединяются с тРНК. В таком виде они переносятся на рибосому и тРНК, с определенной аминокислотой, прикрепляется на иРНК в предназначенном месте. Далее рибосомальные ферменты формируют пептидную связь между присоединенной аминокислотой и строящимся полипептидом. После рибосома перемещается по цепи информационной РНК, оставляя участок для прикрепления следующей аминокислоты.
Рост полипептида идет до того момента, пока рибосома не встретит «стоп-кодон», который сигнализирует об окончании синтеза. Для освобождения новосинтезированного пептида от рибосомы включаются факторы терминации, окончательно завершающие биосинтез. К последней аминокислоте прикрепляется молекула воды, а рибосома распадается на две субъединицы.
Когда рибосома продвигается дальше по иРНК, она освобождает начальный отрезок цепи. К нему снова может присоединиться рибосома, которая начнет новый синтез. Таким образом, используя одну матрицу для биосинтеза, рибосомы создают одномоментно множество копий белка.
Роль рибосом в организме
Рибосомы клетки
Особенности строения
Рибосомы находятся на гранулярном эндоплазматическом ретикулуме или свободно плавают в цитоплазме. Крепятся они к эндоплазматической сети своей большой субъединицей и синтезируют белок, который выводится за пределы клетки, используется всем организмом. Цитоплазменные рибосомы в основном обеспечивают внутренние потребности клетки.
Форма шаровидная или овальная, в диаметре около 20нм.
На этапе трансляции к мРНК может прикрепляться несколько рибосом, образуя новую структуру – полисому. Сами же они образуются в ядрышке, внутри ядра.
Выделяют 2 вида рибосом:
Строение обоих видов идентичное. В состав рибосомы входят две субъединицы — большая и малая, которые в сочетании напоминают гриб. Объединяются они при помощи ионов магния, сохраняя между соприкасающимися поверхностями небольшую щель. При дефиците магния субъединицы отдаляются, происходит дезагрегация и рибосомы уже не могут выполнять свои функции.
Химический состав
Рибосомы состоят из высокополимерной рибосомальной РНК и белка в соотношении 1:1. В них сосредоточено примерно 90% всей клеточной РНК. Малая и большая субъединицы содержат около четырех молекул рРНК, которая имеет вид нитей собранных в клубок. Окружены молекулы белками и формируют вместе рибонуклеопротеид.
Полирибосомы – это объединение информационной РНК и рибосом, которые нанизываются на нить иРНК. В период отсутствия синтезирующих процессов, рибосомы разъединяются и обмениваются субъединицами. При поступлении иРНК они снова собираются в полирибосомы.
Количество рибосом может изменяться в зависимости от функциональной нагрузки на клетку. Десятки тысяч находятся в клетках с высокой митотической активностью (меристема растений, стволовые клетки).
Видео
Что же дальше?
Пока рано говорить о том, куда приведут нас исследования гетерогенности рибосом. Несомненно, они позволят человечеству лучше понимать механизмы многих заболеваний, в том числе онкологических.
Например, уже выявлены заболевания, именуемые рибосомопатиями, причиной которых являются генетические мутации компонентов рибосом [21].
Анемия Даймонда—Блэкфана — типичный пример рибосомопатии, выявляется в течение первого года жизни ребенка. Это заболевание названо в честь врачей, впервые его описавших и классифицировавших в 30-е годы двадцатого века. Оно относится к числу редких, встречается в пяти случаях из миллиона, с одинаковой вероятностью и у мальчиков, и у девочек. Первичным симптомом болезни является повышенная бледность кожи ребенка, описаны случаи рождения детей с «заячьей губой». К возрасту шести месяцев могут появиться такие симптомы как увеличение размеров печени и селезенки, нарушения работы сердечно-сосудистой системы. Также происходит процесс торможения выработки эритроцитов в костном мозге, из-за чего наблюдаются бледность, вялость, быстрая утомляемость. При отсутствии лечения заболевание приводит к тяжелой сердечной недостаточности и смерти. Как оказалось, причиной, вызывающей анемию Даймона—Блэкфана, являются мутации в генах, кодирующих некоторые рибосомные белки, что приводит к неправильной работе рибосом, снижению их количества в клетках и, как следствие, негативным последствиям.
Расположение в клетке
Есть два места, где рибосомы обычно существуют в эукариотической клетке: суспендированы в цитозоле (свободные рибосомы) и связаны с эндоплазматическим ретикулумом (связанные рибосомы). В обоих случаях рибосомы обычно образуют агрегаты, называемые полисомами или полирибосомами во время синтеза белка. Полирибосомы представляют собой кластеры рибосом, которые присоединяются к молекуле мРНК во время биосинтеза белка.
Это позволяет синтезировать сразу несколько копий белка из одной молекулы мРНК. Свободные рибосомы обычно производят белки, функционирующие в цитозоле (жидкий компонент цитоплазмы), тогда как связанные рибосомы обычно синтезируют белки, которые экспортируются из клетки или включаются в мембраны клетки.
Интересно, что свободные рибосомы и связанные рибосомы взаимозаменяемы, и клетка может изменять их число в соответствии с потребностями метаболизма.
Органеллы, такие как митохондрии и хлоропласты в эукариотических организмах, имеют свои собственные рибосомы, которые больше похожи на рибосомы, обнаруженные у бактерий. Субъединицы, содержащие рибосомы в митохондриях и хлоропластах, меньше (30S – 50S), чем субъединицы, обнаруженные во всей остальной части клетки (40S – 60S).
Работает как «рибозим»
Удивительно, но, несмотря на миллиарды лет эволюции, разделяющие бактерии и человека, вторичная структура рибосомальных РНК у них мало различается.
О том, как уложена рРНК в субчастицах и каким образом она взаимодействует с рибосомными белками, до недавнего времени было известно не много. Революционный сдвиг в понимании устройства рибосомы на молекулярном уровне произошел на рубеже нового тысячелетия, когда с помощью рентгеноструктурного анализа удалось расшифровать на уровне отдельных атомов структуру рибосом простейших организмов и их модельных комплексов с мРНК и тРНК. Это позволило понять молекулярные механизмы декодирования генетической информации и образования связей в молекуле белка.
Оказалось, что оба важнейших функциональных центра рибосомы — как декодирующий на малой субчастице, так и отвечающий за синтез белковой цепочки на большой субчастице — сформированы не белками, а рибосомной РНК. То есть, рибосома работает подобно рибозимам — необычным ферментам, состоящим не из белков, а из РНК.
Рибосомные белки, тем не менее, также играют важную роль в работе рибосомы. В отсутствие этих белков рибосомные РНК совершенно неспособны ни декодировать генетическую информацию, ни катализировать образование пептидных связей. Белки обеспечивают необходимую для работы рибосомы сложную «укладку» рРНК в функциональных центрах, служат «передатчиками» изменений пространственной структуры рибосомы, необходимых в процессе работы, а также связывают различные молекулы, влияющие на скорость и точность процесса белкового синтеза.
Сама рабочая схема белкового цикла в принципе одинакова для рибосом всех живых существ. Однако до сих пор неизвестно, до какой степени схожи молекулярные механизмы работы рибосом у разных организмов. Особенно не хватает информации об устройстве функциональных центров рибосом высших организмов, которые изучены гораздо хуже, чем рибосомы простейших.
Это связано с тем, что многие из методов, успешно использованных для исследования рибосом прокариот, оказались для эукариот неприменимыми. Так, из рибосом высших организмов не удается получить кристаллы, пригодные для рентгеноструктурного анализа, а их субчастицы невозможно «собрать» в пробирке из смеси рибосомных белков и рРНК, как это делается у простейших.
Роль рибосом в организме
Рибосомы. Часть 1
Совет автора: перед прочтением статьи повторите, как в общих чертах идет процесс трансляции.
«Жизнь есть способ существования белковых тел. », — дает нам определение жизни известный классик. И действительно, белки выполняют в наших (да и во всех остальных) организмах практически все функции: структурную, каталитическую, транспортную и многие-многие другие. Пожалуй, белки не могут только хранить и передавать наследственную информацию, но даже к этим процессам они все равно «прикладывают руку». Белки, или протеины, — это полимеры, состоящие из мономеров — аминокислот. Белки синтезируются в ходе матричного синтеза, называемого трансляцией, который протекает на рибосомах*. Более подробно о самой трансляции вы узнаете из наших следующих статей, а пока сосредоточимся на главном действующем лице этого процесса — на рибосоме. Рибосомы по своей природе — это немембранные органоиды, состоящие из РНК и белка. Рибосомы есть во всех формах клеточной жизни и даже иногда встречаются у вирусов (!)**. Давайте подробнее поговорим о строении, образовании и разнообразии этих важнейших органоидов.
*Есть еще пептиды, которые синтезируются не в ходе трансляции и без участия рибосом. Такие пептиды называются «нерибосомальные», о некоторых из них мы рассказывали в предыдущей статье.
**«Вирусные» рибосомы — это, на самом деле, рибосомы клетки-хозяина, которые включились в вирусную частицу при ее выходе из клетки. По-видимому, вирусы никак не используют эти рибосомы — они остаются в качестве своеобразного сувенира от бывшего хозяина и в дальнейшем бесполезны (источник).
Сколько рибосом в клетке?
Органоиды, на которых протекает трансляция, — это необходимый компонент любой живой клетки. Чем «активнее» клетка, тем больше ей нужно синтезировать белка, и тем больше в ней рибосом. В клетке кишечной палочки (Escherichia coli) их насчитывают от нескольких тысяч до нескольких десятков тысяч в зависимости от фазы роста клеточной культуры и интенсивности клеточного деления. Если мы посмотрим на микрофотографию бактериальной клетки (рис.1), то увидим, что цитоплазма буквально «набита» рибосомами, из-за них она имеет зернистую структуру.
У млекопитающих количество рибосом еще более впечатляющее — в одной клетке их содержится порядка 10 миллионов!
Внешний вид рибосом
Под микроскопом рибосомы выглядят как компактные частички порядка 20–30 нм в диаметре (рис. 2).
Каждая рибосома состоит из двух частей — большой и малой субъединиц (рис.3). Они контактируют друг с другом определенным образом, и рибосома может работать только в таком «собранном» виде. По-отдельности субъединицы не могут выполнять свои функции в клетке.
Рибосомы прокариот и эукариот отличаются между собой. Первое отличие, которое мы рассмотрим, касается их массы (рис.3).
Прокариотическая рибосома (рис.3) имеет молекулярную массу 2,5 млн Дальтон (4,15х10^(-18) грамм). Исследования методом центрифугирования (рис.4) показали, что у целой рибосомы коэффициент седиментации — 70S (часто прокариотические рибосомы так и называют — 70S рибосомы). S — это Сведберг, единица коэффициента седиментации. Большая субъединица имеет коэффициент седиментации 50S, а малая — 30S.
! Обратите внимание. При соединении 50S субъединицы и 30S субъединицы константа седиментации целой прокариотической рибосомы получается не 80S, как можно было бы подумать, а 70S. Это происходит потому, что седиментация (осаждение) при центрифугировании зависит не только от массы, но и от формы частицы. Поэтому, когда две субъединицы объединяются в целую рибосому, происходит не просто суммирование их масс, но и появление новой формы, которую нельзя рассматривать как сумму составляющих ее частей. То же самое справедливо и для эукариотической рибосомы.
Эукариотическая рибосома (рис.3) имеет молекулярную массу 4,2 миллиона Дальтон (6,97х10^(-18) грамм). Константа седиментации целой рибосомы — 80S, большой субъединицы — 60S, малой субъединицы — 40S.
Как вы могли заметить из предыдущих рисунков, ни целая рибосома, ни её субъединицы не являются по форме шариками, а имеют сложную структуру. Давайте немного подробнее рассмотрим морфологию рибосомальных субъединиц (рис. 5).
Помимо формы и размера большая и малая субъединица отличаются своими функциями. Важнейшая функция большой субъединицы — образование пептидной связи (рис.6). Малая субъединица ответственна за правильное декодирование триплетов иРНК. Ни большая, ни малая субъединица не могут работать по отдельности, для трансляции обязательно требуется их объединение.
3D-моделирование позволило увидеть рибосомы в объёме. На этом сайте вы можете подробнее рассмотреть 3D структуру рибосомы и «поиграть» с ней: покрутить и посмотреть на нее с разных ракурсов, попробовать найти описанные части рибосомальных субъединиц и туннель для иРНК. Осторожно, это очень залипательное занятие! 🙂
Из каких молекул состоит рибосома
Рибосомы по своей природе являются нуклеопротеидами и состоят из РНК и белков.
Сначала рассмотрим рибонуклеиновый компонент рибосом. РНК, которая находится в рибосоме, называется рРНК, на её долю приходится примерно 80% от всей РНК в клетке. Рибосомальная РНК выполняет в рибосоме важнейшие функции, в том числе катализирует образование пептидной связи. Это может показаться очень странным, ведь обычно за катализ химических реакций в клетке отвечают ферменты — белки, а это другой класс соединений. Тот факт, что в рибосоме основную функцию выполняют именно РНК, является одним из аргументов в пользу гипотезы РНК-мира. Возможно, что рибосома изначально вообще состояла только из РНК, а белки присоединились к ней позднее в ходе эволюции (см. статью).
В рибосоме содержится несколько видов молекул рРНК. Молекулы рРНК у эукариот и прокариот гомологичны, то есть схожи между собой, однако имеются и некоторые отличия.
В прокариотической рибосоме есть три вида РНК: 5S, 16S и 23S РНК. Буква S здесь также означает «Сведберг». Иными словами, разные рРНК имеют свои собственные константы седиментации, соответствующие их названиям. 16S рРНК находится в малой субъединице, и одна из её функций — прикрепить иРНК на рибосому, чтобы начать трансляцию. У прокариот в иРНК перед старт-кодоном есть особая последовательность — последовательность Шайна-Дальгарно. Она нужна, чтобы рибосома могла «ухватиться» за иРНК и начать синтезировать белок. В 16S рРНК содержится участок, который комплементарно связывается с последовательностью Шайна-Дальгарно и обеспечивает эту самую связь.
В большой субъединице у прокариот содержатся два вида рРНК — 23S и 5S рРНК. 23S рРНК ответственна за катализ образования пептидной связи. Зачем нужна 5S рРНК, до сих пор непонятно, хотя на этот счет выдвигаются разнообразные гипотезы.
В большой субъединице находятся три молекулы рРНК. 5S рРНК гомологична такой же рРНК у прокариот. 5.8S и 28S РНК гомологичны 23S рРНК прокариот и, по сути, являются двумя отдельными ее кусочками.
Как и все другие РНК (за исключением РНК некоторых вирусов), рРНК синтезируются на матрице ДНК с использованием ферментов РНК-полимераз. У бактерий один и тот же вид РНК-полимеразы транскрибирует все виды РНК. У эукариот РНК-полимераз несколько. РНК-полимераза III синтезирует 5S рРНК, а все другие виды рРНК транскрибируются РНК-полимеразой I. Из-за этого факта некоторые ученые предполагают эволюционное родство 5S рРНК и тРНК, которые синтезируются той же РНК-полимеразой.
Все сказанное о рРНК бактерий и эукариот суммировано в таблице 1.
Рибосомальные РНК имеют очень сложную пространственную структуру. Чтобы убедиться в этом, посмотрите на рисунок 7. В качестве примера здесь показана структура 16S рРНК. Обратите внимание на многочисленные шпильки — самокомплементарные участки РНК, которые обеспечивают ее сворачивание и стабилизируют эту сложную структуру. В линейном виде рРНК не может выполнять свои функции.
Особенностью рРНК также являются химические модификации нуклеотидов. У рРНК модифицированы около 2% всех нуклеотидов, и это необходимо для правильного сворачивания рРНК и выполнения ею своих функций. Модификации рРНК происходят при созревании рибосом. Для осуществления некоторых модификаций необходимы другие виды РНК, например, малая ядрышковая РНК. Примеры химических модификаций нуклеотидов рРНК представлены на рисунке 8.
Второй вид молекул, из которых состоят рибосомы, это белки. Они синтезируются в цитоплазме (с помощью рибосом, как и все другие белки), затем проходят через ядерные поры в ядро. В ядре идёт сборка рибосом, и рибосомальные белки, уже в составе рибосомы, снова возвращаются в цитоплазму. Вот такой сложный у них жизненный путь.
Некоторые из рибосомальных белков очень консервативны. Термин «консервативный» означает, что эти белки мало изменялись в ходе эволюции и очень схожи во всех доменах жизни. Помимо таких «всеобщих» белков в рибосомах также имеются и специфические. Они характерны либо только для эукариот, либо только для архей, либо только для бактерий. У эукариот рибосомальных белков больше, они составляют примерно половину массы рибосомы. У прокариот доля белков в рибосоме меньше — около 40%, а 60% приходится на рРНК. Белки и рРНК тесно взаимодействуют в рибосоме, формируя сложную пространственную структуру. Белковый и рибонуклеиновый состав рибосом бактерий и эукариот показан на рисунке 9.
Внутреннее строение рибосом
Внутри рибосома имеет сложное строение, где как раз и происходит «все самое интересное». Её можно сравнить с пещерой, в которой много полостей, ниш и ходов. Своды этой «пещеры» образованы рРНК и белками, причем ученые до сих пор спорят, как именно они там расположены и как друг с другом взаимодействуют.
Внутри рибосомы выделяют следующие важные части (рис.10):
— сайт связывания иРНК;
— туннель для выхода белка.
Термин «сайт» в данном случае означает «место». О функциях этих сайтов могут рассказать расшифровки названий. А-сайт назван так потому, что сюда приходит аминоцил-тРНК — транспортная РНК, несущая аминокислоту. В Р-сайте находится пептидил-тРНК (peptidyl) — это «предыдущая» тРНК, её аминокислота уже образовала пептидную связь с растущей белковой цепочкой, но все еще связана с принесшей ее тРНК. Е-сайт (от слова “exit” — «выход») нужен для выхода тРНК, которая уже выполнила свою функцию и отдала аминокислоту растущему белку. Поверхности этих сайтов составлены в основном из рРНК, что опять же указывает на их главную роль в функционировании рибосомы.
Для того, чтобы растущий пептид мог выходить из рибосомы, в большой субъединице образован специальный выходной туннель. Стенки этого туннеля сформированы таким образом, чтобы белок не мог там «залипнуть» и быстро проскальзывал наружу.
Образование пептидной связи происходит между аминоацил-тРНК, находящейся в А-сайте и пептидом в Р-сайте. За катализ образования пептидной связи отвечает пептидилтрансфераза (рис.11). По своей природе пептидилтрансфераза — это участок 23S рРНК у прокариот или 28S у эукариот, то есть она является рибозимом. Это место — «святая святых» рибосомы, именно здесь осуществляется одна из ключевых реакций жизни — образование пептидной связи.
В строении рибосомы можно выделить еще и другие важные области — это места связывания с факторами трансляции. Факторы трансляции — это особые белки, которые необходимы для инициации, элонгации и терминации трансляции, без них рибосома функционировать не может. Подробнее о роли этих факторов мы расскажем в статье, посвященной трансляции.
Итак, мы с вами разобрали «морфологию» и «анатомию» рибосомы — как она выглядит внешне и как устроена внутри. Во второй части нашего рассказа вы узнаете, откуда рибосомы берутся в клетке, какими они бывают и как ученые придумали их использовать для установления родства организмов. Ну а в заключительной части мы расскажем о функционировании рибосом и подробнее разберем механизм трансляции.
Источники
1) Farber FE, Rawls WE. Isolation of ribosome-like structures from Pichinde virus. J Gen Virol. 1975 Jan;26(1):21-31. doi: 10.1099/0022-1317-26-1-21. PMID: 1168240.
3) Г.М. Гонгадзе Г.М. 5S рРНК И РИБОСОМА // Успехи биологической химии, Т. 51, 2011, С. 165–192.
4) Рибозимы — катализаторы древнего мира / Доклады Академии наук, Т. 42, №3., 2005, портал «Элементы».