для чего нужны теломеры
Что такое теломеры и теломераза
Доктор Элизабет Блэкберн, открывшая теломеразу, получила мировую славу и Нобелевскую премию. Она сравнила теломеры с пластиковыми наконечниками на концах шнурков, которые не дают им распутаться.
Этот фермент способен компенсировать износ теломер. Однако у людей теломераза активна только на эмбриональном этапе развития. У взрослых же этот фермент ограничивают стволовые и половые клетки, а также некоторые клетки крови.
Теломеры защищают концы хромосом, где записано наше генетическое наследие. Этот код ДНК используется, в том числе, для передачи информации клеткам, чтобы они производили определенные белки ( гормоны, ферменты и т. д.), обеспечивающие их правильное функционирование.
По теории доктора Блэкберн, концевые участки ДНК могут удлиняться и, тем самым, тормозить старение организма.
Теломеры и старение
Исследователи обнаружили, что длина теломер связана с потенциальной продолжительностью жизни каждого человека и помогает определить возраст клетки. К 80 годам длина теломер с рождения сокращается вдвое.
Укорочение теломер и активность теломеразы связаны, например, с развитием рака и сердечно-сосудистых заболеваний, а также со снижением иммунитета.
Считается, что биологический возраст человека можно определить по длине его теломер. Несколько лабораторий в разных странах мира даже предлагают такую услугу за несколько сотен евро.
Кроме того, о состоянии теломер может рассказать образ жизни человека. По крайней мере, об этом говорят исследования 2011 и 2012 годов.
Теломеры укорачиваются из-за следующих факторов:
нездоровое питание (переизбыток сахара и омега-6 в рационе, употребление переработанных продуктов);
переедание и лишний вес;
загрязнение окружающей среды (химическое, электромагнитное, звуковое);
плохие эмоциональные и социальные отношения с другими людьми;
Структура и длина теломер: загадкам нет конца
Хотя теломерной биологии по современным меркам уже немало лет и по этой теме имеется большой экспериментальный материал, вопросов со временем становится больше, чем ответов. Являются ли теломеры «молекулярными часами», отсчитывающими время жизни? Почему у слона они короткие, а у мыши длинные? Почему они могут быть разными у идентичных близнецов? Связан ли размер теломер с размером организма? А от чего зависит активность фермента теломеразы, способного восстанавливать теломеры?
Все же кое-какие закономерности ученым удалось выявить, несмотря на то что эта область науки постоянно преподносит новые сюрпризы
Теломерная биология – это область науки, которая изучает теломеры – концевые районы хромосом, неспособные к соединению с другими хромосомами и в силу этого играющие роль «защитных колпачков». Широкий же интерес к этим структурным элементам хромосм был вызван появлением теории старения, согласно которой этот процесс – следствие укорачивания теломер с возрастом из-за их неполного копирования в процессе удвоения ДНК.
Я вся такая. внезапная, такая противоречивая!
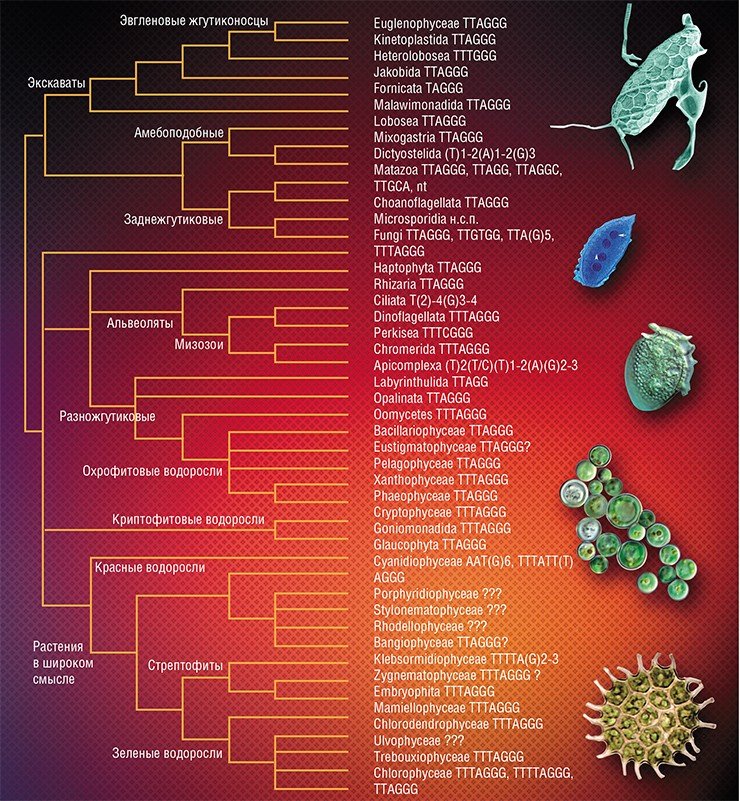
Первым организмом, у которого определили последовательность нуклеотидов теломерной ДНК, была инфузория тетрахимена (Блекберн, 1978). Оказалось, что теломерная ДНК этого простейшего состоит из шести нуклеотидов TTGGGG, повторяющихся четыре-пять раз – такие структуры называют короткими повторами (мини- и микросателлитами). Затем структуру теломерных районов определили у других организмов из разных таксономических групп. Оказалось, что у большинства позвоночных это короткий повтор TTAGGG, у членистоногих (Arthropoda) – TTAGG, у круглых червей (Nematoda) – TTAGGC, у растений – TTTAGGG.
Со временем короткие повторы стали называть согласно таксономической группе, у которой они впервые были прочитаны. В результате TTAGGG стал «позвоночным» или «человеческим» типом теломер, TTAGG – «артроподным», TTAGGC – «нематодным», а TTTAGGG – «арабидопсисным» – по названию растения Arabidopsis thaliana. Позже выяснилось, что эти названия не соответствуют реальному положению вещей. «Позвоночный» тип теломер широко распространен среди беспозвоночных животных – кишечнополостных, плоских червей, моллюсков, встречается у некоторых простейших, членистоногих, растений и грибов, характерен для самого примитивного многоклеточного животного – трихоплакса. Во избежание путаницы было бы разумнее назвать этот теломерный повтор, например, базовым или первичным, но он остался «человеческим». Правда остальные типы повторов, за некоторым исключением, действительно характерны для тех организмов, в честь которых названы.
На путанице в названиях дело не закончилось. Достаточно обескураживающим открытием стало то, что не у всех организмов теломеры состоят из микросателлитов. Прежде считалось, что только короткие повторы ДНК консервативной структуры могут защищать концы хромосом, но у двукрылых насекомых и некоторых растений были выявлены теломерные структуры, значительно отличающиеся от типичных коротких повторов.
Так, у комаров рода Chironomus и Anopheles в роли теломер выступает сателлитная ДНК, представляющая собой повторы из нескольких сотен пар нуклеотидов, которые образуют теломерные области в несколько сотен тысяч пар нуклеотидов. У дрозофилы теломеры состоят из перемещающихся по геному мобильных элементов – ретротранспозонов HeT-A, TART и TAHRE. Один из них, TART, был также обнаружен на концах хромосом мухи Rhinchosciara americana. Возможно, нетипичные теломеры характерны для всех представителей многочисленного (более 150 тыс. видов) отряда двукрылых насекомых. Среди растений нетипичные теломеры найдены у некоторых видов подсемейств Alliaceae (луковые), Asphodelaceae (асфоделовые) и семейства Solonaceae (пасленовые): на концах их хромосом локализуются последовательности рибосомальной или сателлитной ДНК.
Более того, существуют промежуточные типы теломер: например, у тутового шелкопряда Bombyx mori теломерная ДНК состоит как из повторов TTAGG, так и из ретротранспозонов TRAS и SART – это говорит об эволюционной связи разных теломерных структур. У некоторых организмов определить структуру теломерных регионов пока не удалось: это тихоходки и поденки среди животных и, например, ульвовые и красные водоросли среди низших растений. Так что, возможно, существуют и другие варианты структуры теломерных районов.
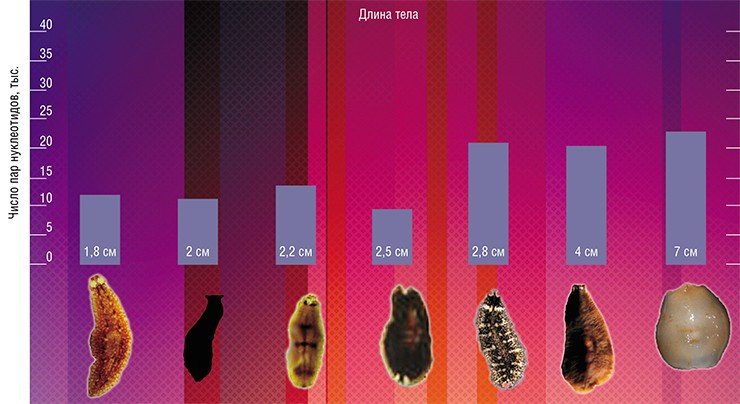
Не только по структуре, но и по длине теломерные участки очень вариабельны. Размер теломер может отличаться на разных плечах одной хромосомы, у гомологичных и негомологичных хромосом, в разных клетках, тканях, органах, у близнецов, у разных индивидов, принадлежащих одному виду, у разных видов. С чем такая изменяемость связана и каково ее функциональное значение, до сих пор не понятно. При этом в исследованиях вариабельность обычно не учитывают, используя в анализе средние значения размера теломер, который определяют, расщепив ДНК изучаемой ткани ферментами рестриктазами, не трогающими теломерную ДНК. Оставшуюся ДНК метят, визуализируют и с помощью специального прибора определяют длину фрагмента самой многочисленной фракции – это и будет средний размер теломер.
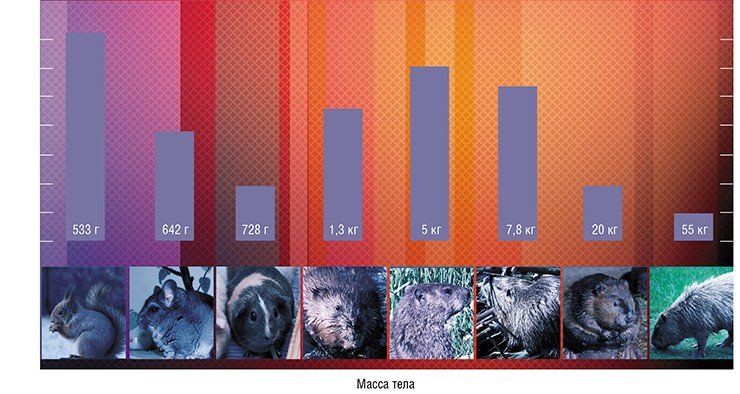
Длина теломер всегда вызывала и продолжает вызывать много вопросов. Почему у слона она составляет всего 14 тыс. пар нуклеотидов, а у некоторых линий лабораторных мышей – в 10 раз больше? Есть ли какая-нибудь связь с размером тела? С продолжительностью жизни? С приспособленностью к меняющимся условиям окружающей среды? С болезнями? С наследственностью? Со скоростью старения? Это лишь небольшой перечень вопросов, возникающих в отношении размера теломер, правда на некоторые из них ученые уже нашли ответы.
Размер теломер, размер тела и продолжительность жизни – есть ли связь?
Как уже упоминалось выше, существует теория старения, согласно которой этот процесс происходит вследствие укорачивания теломер с возрастом из-за их неполного копирования в процессе удвоения ДНК. Теломеры называли (а некоторые до сих пор называют) митотическими часами клеток, хронометрами, счетчиками клеточных делений, потому что у человека в клетках тела они укорачиваются с возрастом. Рождается человек с длиной теломер 15—20 тыс. пар нуклеотидов, а умирает с длиной 5—7 тыс. Сейчас известно, что зависимость размера теломер от возрастных изменений не универсальна, длина теломерной ДНК у разных организмов (а иногда и у одного и того же организма) может со временем не только уменьшаться, но и расти, а у многих организмов такой зависимости вообще нет.
Но все же объяснить различия в длине теломер у разных организмов разной продолжительностью их жизни – красиво и логично. Может быть, долгожители имеют необычайно длинные теломеры? К сожалению, по пальцам одной руки можно пересчитать организмы-долгожители с длинными теломерами. Это некоторые виды долгоживущих (сто и больше лет) черепах с теломерами длиной 50—60 тыс. пар нуклеотидов, аллигаторы, живущие больше полувека с теломерами размером около 30 тыс. пар нуклеотидов. Но у большинства других долгоживущих организмов теломеры довольно скромного размера. Например, у деревьев-долгожителей (более тысячи лет) сосны Pinus longaeva и гинкго Ginkgo biloba длина теломер составляет, соответственно, около 13 и 5 тыс. пар нуклеотидов. То есть длина теломер и продолжительность жизни не имеют явной связи. Другой вопрос, что эти организмы имеют активный механизм поддержания теломерных районов – фермент теломеразу, способную удлинять спонтанно укорачивающиеся при делении клетки теломерные участки ДНК, но это совсем другая история.
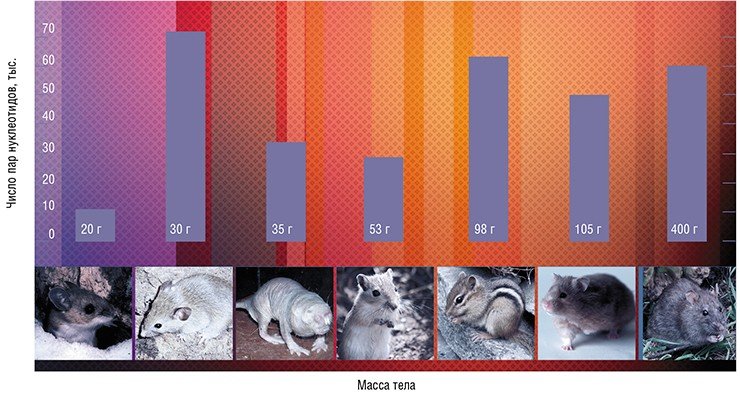
Больше повезло ученым, которые искали связь между размером теломер и размером организма. Сначала некоторая зависимость была обнаружена у грызунов: оказалось, что большинство крупных видов имеет короткие теломерные районы (10—18 тыс. пар нуклеотидов), а теломеры небольших грызунов могут достигать 72 тыс. пар (Seluanov et al., 2007). Возникла гипотеза, что эти данные отражают имеющийся у крупных организмов механизм защиты от рака в виде репликативного старения, когда клетки теряют способность делиться. Ведь чем больше в организме клеток, тем больше риск, что какая-то из них переродится в раковую. Тогда все логично: теломерная ДНК должна иметь достаточно небольшую длину, чтобы при постепенном укорочении вовремя запустилось репликативное старение, при этом теломераза, которая может поддерживать длину теломер (как в нормальных клетках, так и в раковых) должна быть неактивна.
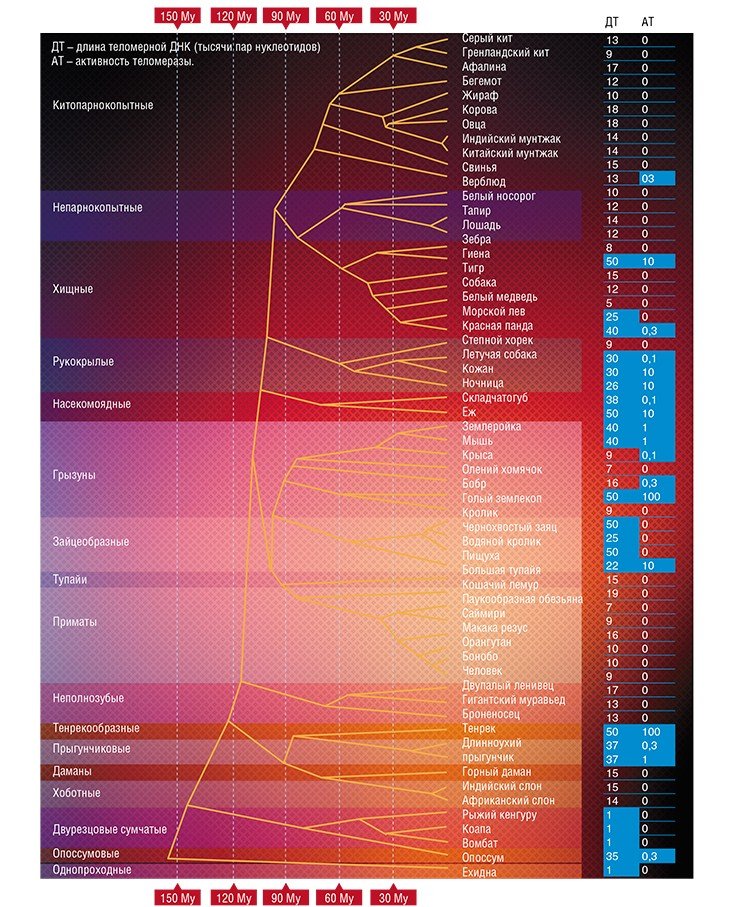
Исследования на других видах млекопитающих частично подтвердили данные, полученные на грызунах: длина теломерной ДНК действительно имеет отрицательную корреляцию с продолжительностью жизни и массой тела, и массивные животные с короткими теломерами не имеют активной теломеразы. Возможно, репрессия теломеразы и наличие более коротких теломер у крупных животных могут быть адаптацией к теплокровности, так как с увеличением температуры тела увеличивается частота мутаций и, следовательно, вероятность возникновения рака (Gomes et al., 2011). У небольших млекопитающих репликативного старения, видимо, нет, а физиологические процессы регулируются иным образом.
Конечно, предложенные объяснения имеют гипотетический характер, они не могут быть универсальными. Подтверждением этому служит, например, исследование длины теломер у байкальских планарий и моллюсков, при котором была обнаружена противоположная картина: более крупные животные имели более длинные теломеры, хотя не без исключений из правила.
Наша работа в ЛИН СО РАН посвящена исследованию изменения длины теломерной ДНК и активности теломеразы у двух групп байкальских гидробионтов – планарий (плоских червей) и моллюсков. Эти организмы обитают в одинаковых условиях и подвергаются влиянию сходных факторов среды, демонстрируя такие свойственные байкальской фауне явления, как гигантизм и карликовость. Они имеют разную продолжительность жизни, которую у моллюсков, в отличие от планарий, можно точно определить, и различные стратегии выживания.
Анализ динамики теломерной ДНК с учетом особенностей этих животных поможет оценить влияние на нее внешних и внутренних факторов. По предварительным данным, во-первых, более крупные виды имеют более длинную теломерную ДНК. Во-вторых, длина теломерной ДНК с возрастом у разных видов животных меняется по-разному: у одних она увеличивается, а у других – уменьшается.
Такая видовая специфичность размера и динамики теломерной ДНК может иметь как адаптивный характер, так и наследственный, определяемый филогенетическим родством. А исследование активности теломеразы, которое тоже планируется осуществить, может пролить свет на внутреннюю причину различий в возрастной динамике теломерной ДНК у разных видов
Нет сомнений, что теломеры вовлечены во многие процессы в клетке, поэтому так трудно найти закономерность в распределении их размеров, и тем более предложить теорию, которая бы обладала предсказательными свойствами. Пока остается лишь перечислять те взаимосвязи, которые все же удалось обнаружить в разных исследованиях.
Одно из таких открытий относится к экстрадлинным (до 1 млн пар нуклеотидов) теломерным районам, которые были обнаружены у некоторых видов птиц. В кариотипах у них присутствуют микрохромосомы, и, возможно, такие аномально длинные теломеры нужны для их стабилизации.
Выше мы затронули лишь некоторые возможные варианты объяснений изменчивости размеров теломер и роли их длины в жизни организма, не коснувшись внутривидовых отличий, связанных с полом, репродуктивным успехом, условиями обитания, образом жизни и т. п. Но даже то, что уже сказано, дает представление о всей сложности и многогранности этой актуальной области биологии.
Зверева М., Рубцова М. Нобелевская премия по физиологии и медицине 2009 года. Счетчик клеточного времени // Наука и жизнь. 2010. № 1. С. 2—5.
Bombarova M., Vitkova M., Spakulova M. et al. Telomere analysis of platyhelminths and acanthocephalans by FISH and Southern hybridization // Genomes. 2009. V. 52. P. 897—903.
Fulneckova J., Sevcikova, Fajkus J. et al. A broad phylogenetic survey unveils the diversity and evolution of telomeres in eukaryotes // Genome Biol. Evol. 2013. V. 5, N. 3. P. 468—483.
Gomes N., Ryder O., Houck M. et al. Comparative biology of mammalian telomeres: hypotheses on ancestral states and the roles of telomeres in longevity determination // Aging Cell. 2011. V. 10. P. 761—768.
Seluanov A., Chen Z., Hine C. et al. Telomerase activity coevolves with body mass, not lifespan // Aging Cell. 2007. V. 6(1). P. 45—52.
Zellinger B., Riha K. Composition of plant telomeres // Biochim. et Biophys. Acta. 2007. N 1769 (5–6). P. 399—409.
Zhdanova N., Minina J., Karamisheva T. et al. The very long telomeres in Sorex granarius (Soricidae, Eulipothyphla) contain ribosomal DNA // Chromosome Res. 2007. V. 15. P. 881—890
Теломеры и новые мишени протоонкогенной терапии
Теломеры и новые мишени протоонкогенной терапии
Автор
Редактор
Теломеры — это не просто концы молекулы ДНК, а важный регуляторный элемент. Механизмы их удлинения представляют большой интерес для науки и медицины. Данная статья посвящена открытию новых деталей регуляции длины теломер в раковых клетках, а также потенциальному терапевтическому агенту против остеосаркомы и глиобластомы.
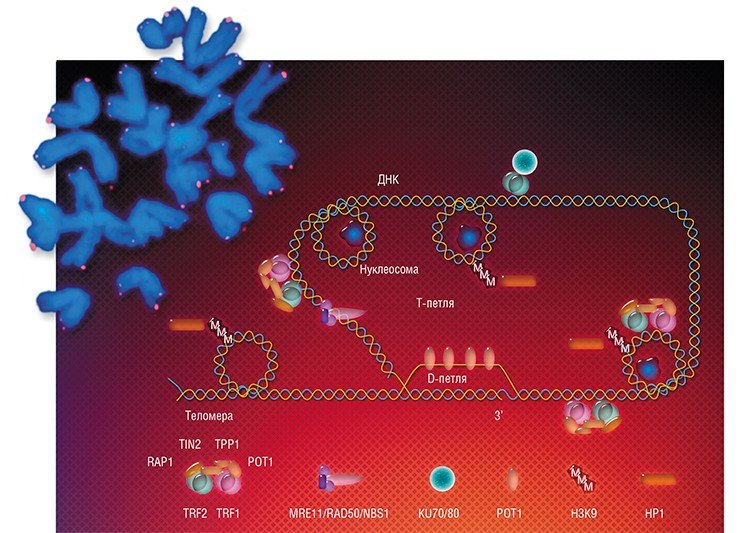
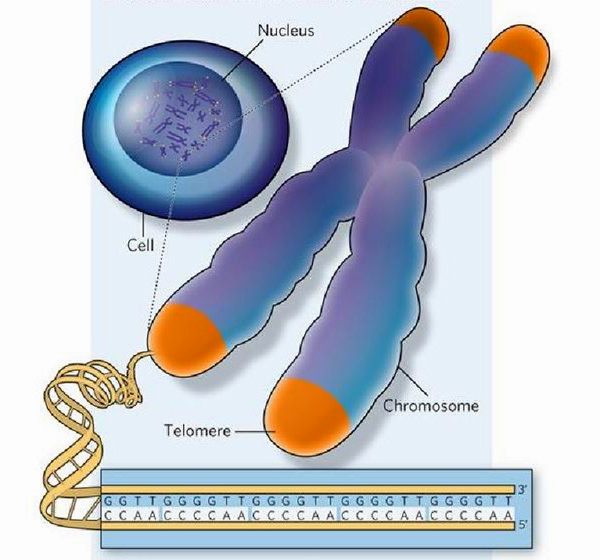
Генетический материал эукариот представлен молекулами ДНК, которые уложены определенным образом, взаимодействуя с белками и образуя хромосомы. Особенно плотно ДНК упакована во время деления клетки. В хромосомах можно выделить определенные структуры, в частности, на их концах имеются теломеры, состоящие из тандемных нуклеотидных повторов (рис. 1). У человека последовательность 5’—TTAGGG—3’ повторяется а на 3’-конце теломеры находится длинный однонитевой участок ДНК, образующий петлю. Комплекс из шести белков, связанных с теломерами, — шелтерѝн — образует защитный «колпачок», предохраняющий хромосомы от действия нуклеаз и слипания [1].
Рисунок 1. Локализация и нуклеотидная последовательность теломер. Концевые фрагменты хромосом содержат длинные нуклеотидные повторы (приведенная последовательность характерна для Tetrahymena). Эти зоны называются теломерами (показаны оранжевым) и играют важную регуляторную роль в жизни клетки. Иллюстрация с сайта www.nature.com.
Механизм удвоения генетического материала устроен так, что теломерные повторы не могут воспроизводиться полностью. Поэтому после каждого деления клетки концы хромосом укорачиваются. Когда они становятся слишком маленькими, то появляется угроза повреждения экспрессируемых участков генома: «обглоданные», уже не защищенные шелтерином, концы хромосом активируют репарацию ДНК, что приводит к различным мутациям вплоть до хромосомных аберраций. Во избежание таких нарушений «постаревшая» клетка перестает делиться. Получается, репликативное старение просто необходимо, ведь слишком большое число делений порождает множество мутаций и ведет к онкогенезу [2].
Однако описанный алгоритм в природе не универсален: длина теломерной ДНК у разных организмов (а иногда и у одного и того же) может со временем как уменьшаться, так и расти [3]. Например, раковые клетки способны делиться бесконечно. В них работают специальные механизмы для восстановления концов хромосом. Удлиняться теломеры могут двумя способами. Во-первых, с помощью специального фермента — теломеразы, который достраивает концевые повторы ДНК [4]. В нормальных клетках взрослого организма этот фермент не работает, но при патологии может активироваться. Во-вторых, существует путь удлинения концов хромосом с помощью гомологичной рекомбинации Его также называют альтернативным путем удлинения теломер — ALT (alternative lengthening of telomeres). Интересно, что такой механизм является основным в ряде опухолей, например, в остеосаркоме и глиобластоме [8]. Получается, что такие опухоли попадают в зависимость от рекомбинации, а это уже можно использовать в терапевтических целях.
Почему гомологичная рекомбинация концов ДНК становится возможной?
Молекула ДНК представляет собой двойную спираль. Когда создается копия генома для дальнейшего деления клетки, то двойная спираль частично расплетается и появляются участки одноцепочечной ДНК. Такие участки покрываются специальным белком — репликационным белком А [9], за счет чего приобретают способность к гомологичной рекомбинации. Обычно этот белок связан с теломерами временно [10, 11]. А именно — в момент синтеза дочерней цепи ДНК. Однако при патологии репликационный белок А не уходит с теломерных участков, способствуя развитию «назапланированных» рекомбинационных событий [12].
Роль некодирующей РНК в удлинении теломер
Известно, что при реализации генетической информации с ДНК считывается РНК, а с РНК — белок. Но так происходит не всегда. Наравне с молекулами РНК, кодирующими белок, синтезируются некодирующие РНК, которые выполняют разнообразные важные функции в клетке. Вот и в гомологичной рекомбинации концов хромосом без них не обошлось. Оказалось, что репликационный белок А поддерживает особая некодирующая РНК (TERRA — telomere repeat-containing RNA) [10, 13, 14, 15]. Именно ее регуляция и нарушается в раковых клетках. Обнаружили, что эту некодирующую РНК должен убирать с теломер белок ATRX — АТФ-зависимая хеликаза, ремоделирующая хроматин. Выстроилась такая последовательность событий: когда ATRX перестает правильно работать, некодирующая РНК продолжает удерживать репликационный белок А на ДНК дольше, чем необходимо, и концы ДНК становятся готовыми к удлинению [12].
Важно заметить, что просто описанной подготовки теломер недостаточно для их удлинения путем гомологичной рекомбинации. Видимо, это только один из ключевых моментов.
Прикладное значение
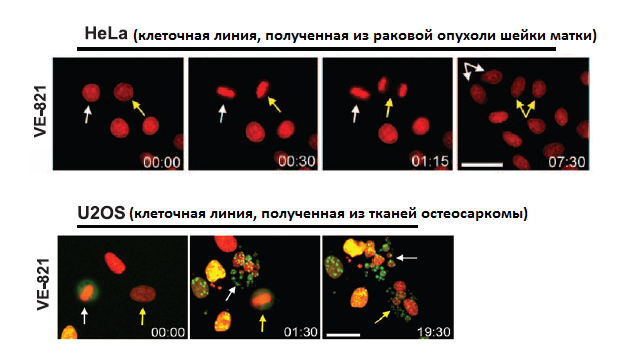
Изучать механизмы восстановления теломер интересно не только с точки зрения фундаментальной науки. Ученые разрабатывают подходы к применению таких знаний в терапии злокачественных опухолей. Проверка предположения, что ингибирование ключевых белков, ответственных за рекомбинацию, может специфично убивать раковые клетки, дала положительный результат (рис. 2).
Рисунок 2. Действие ингибитора VE-821 на клеточные линии HeLa и U2OS. Изменения фиксировались через определенные промежутки времени. Желтые и белые стрелки указывают на клетки, которые переходят в следующую фазу клеточного цикла и начинают делиться. Клетки HeLa (верхняя панель) не чувствительны к действию ингибитора, т.к. для удлинения теломер используют теломеразу, а не гомологичную рекомбинацию. Клетки остеосаркомы под действием ингибитора перестают делиться и разрушаются. Рисунок из [12], адаптирован.
Было выявлено разрушительное действие на клетки опухолей ингибитора протеинкиназы ATR, которую репликационный белок А привлекает для осуществления рекомбинации. Ингибитор VE-821 избирательно воздействовал на клетки, способные удлинять теломеры с помощью гомологичной рекомбинации. Он вызывал фрагментацию их хромосом и способствовал клеточной гибели. Интересно, что ингибитор считают безопасным для нормальных тканей. Проверка воздействия VE-821 на клетки эпителия выявила лишь замедление их деления, но не гибель. Ингибитор оказался бесполезным для предотвращения роста опухолей, в которых концы ДНК удлиняются с помощью теломеразы. Однако VE-821 эффективно блокирует деление клеток, полученных из остеосаркомы и детской глиобластомы, что авторы исследования [12] и предлагают использовать в терапевтических целях.
Теломеры – индикатор биологического возраста. Учёные приблизились к разгадке тайны вечной молодости
Когда размер имеет значение. Короче теломеры – короче жизнь
Теломеры (от др.-греч. τέλος – конец и μέρος — часть) представляют собой некие наконечники на концах хромосом, состоящие из строго определённой последовательности сложных органических соединений – нуклеотидов. При рождении длина таких наконечников составляет 15 тысяч пар нуклеотидов, к пятилетнему возрасту она сокращается до 12 тысяч, а хронические заболевания могут уменьшить размеры концевых участков хромосом до 5–2 тысяч пар нуклеотидов.
Учёные обнаружили теломеры в середине прошлого столетия в клетках ядерных живых организмов (то есть организмов, клетки которых содержат ядро). Поначалу их роль не была понятна. Наконечники не содержат генов, несут довольно-таки мало информации, которая ничего не кодирует и не считывается на информационные рибонуклеиновые кислоты.
Позже стало ясно: их функция – в обеспечении защиты хромосом от разрушения и слипания, а также сохранности наследственного материала (генома) в процессе деления клетки и удвоения ДНК (дезоксирибонуклеиновой кислоты).
Последняя представляет собой своеобразный биологический жёсткий диск с записанной на нём генетической программой развития и функционирования живого организма. ДНК позволяет хранить, передавать следующему поколению и реализовывать названную программу.
Объёмы памяти созданного природой «диска» поражают: вместимость грамма одной нити ДНК сопоставима с аналогичным показателем 100 миллиардов DVD – 455 экзабайт. А информацию, записанную на нём, можно прочитать даже по прошествии нескольких тысячелетий.
Механизм удвоения ДНК не позволяет копировать теломеры, а потому при каждом делении клетки – а большинство человеческих клеток способно делиться лишь 52 раза (предел Хейфлика) – наконечники хромосом укорачиваются на 50–200 нуклеотидов (согласно Harley C. B., Futcher A. B., Greider C. W.).
Почему клетки стареют
Если же клетка категорически не желает гибнуть, её уничтожают клетки иммунной системы. В тех случаях, когда последние по тем или иным причинам не выполняют должным образом свои функции, в организме накапливается большое количество старых клеток.
Об их влиянии на состояние окружающих молодых «коллег» и в целом на организм, осуществляемом, по-видимому, при помощи неких сигнальных молекул, пока можно лишь догадываться. Предполагается, что присутствие нефункционирующих долгожителей может стать причиной воспаления, перерождения молодых клеток в злокачественные. Клеточное старение (сенессенс) и старение организма – два звена одной цепи.
Ещё одно негативное последствие того, что хромосомы утрачивают свои защитные колпачки, состоит в опасности склеивания «оголённых» концов молекул ДНК. Дело в том, что клетка воспринимает сверхкороткие теломеры как разрывы хромосом и стремится их починить путём их соединения. Подобное чревато появлением мутаций, приводящих к развитию онкологических заболеваний.
Теломеры помогают предсказать развитие рака
Специалисты Медицинского университета г. Инсбрук (Австрия) с 1995 по 2005 год наблюдали за 787 добровольцами 40–79 лет, не страдавших раком. В начале исследования у каждого из них была определена длина теломер в лейкоцитах капиллярной крови. За 10 лет у 11,7 % испытуемых развилось какое-либо онкологическое заболевание. Средняя длина концевых участков хромосом у заболевших была значительно меньше, чем у здоровых участников. Причём самые короткие теломеры наблюдались у пациентов с наиболее тяжёлыми формами рака – желудка, яичников и лёгких. Учёные сделали выводы: у людей с критически короткими хромосомными наконечниками риск возникновения злокачественного новообразования в 3 раза выше, чем у тех, кто может похвастать максимальной длиной теломер, а риск умереть от рака в десятилетний период – в 11 раз выше.
Теломеры: какие факторы определяют их длину
Теломеры могут укорачиваться быстрее или медленнее. Исследования показали, какие факторы влияют на длину хромосомных наконечников.
В общем все исследования последних лет лишь объяснили с точки зрения физиологии человеческого организма то, что и так было давно известно из практики и наблюдений: правильное питание, здоровый сон, физическая активность, оптимизм продлевают жизнь, а вредные привычки, стрессы и болезни, напротив, укорачивают её.
Теломеры: можно ли сделать их бессмертными и остановить клеточное старение
Одиннадцатью годами ранее, в 1973 году, существование особого вещества, способного удлинять концевые участки хромосом, предположил советский биолог, специалист Института Биохимической физики РАН Алексей Матвеевич Оловников.
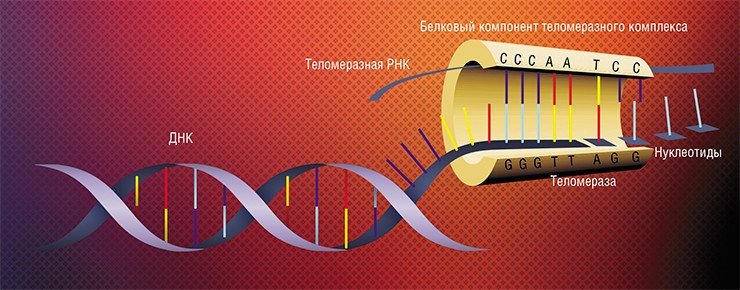
Теломераза присоединяется к концу ДНК, спрятанному под теломерой, и использует его в качестве стартовой точки для добавления пар нуклеотидов и наращивания концевых участков хромосомы.
К сожалению, активно функционирующий «молодильный» фермент обнаружен лишь в трёх типах клеток человеческого организма: половых, стволовых и раковых. Остальным типам клеток не повезло: ген теломеразы в них прекращает своё функционирование уже в эмбриональный период развития, как бы выключается, и клетка даже не подозревает о его существовании.
Однако наука не стоит на месте. Учёные нашли способ заставить работать омолаживающий клетки фермент и даже встроить его ген в любую клетку. Правда, по понятным причинам массовые эксперименты пока проводились лишь на животных. Заслуживают внимания результаты исследования, организованного в 2012 году специалистами Испанского национального центра по исследованию рака. Двум группам мышей – взрослым и старым – вводили вирус, активизирующий теломеразу. Это позволило значительно увеличить продолжительность их жизни: взрослых животных – на 24 %, старых – на 13 %.
Воодушевлённая такими результатами 44-летняя глава фармкомпании из США Элизабет Пэрриш повторила опыт на себе. Ей вкололи ослабленный аденоассоциированный вирус, в который был предварительно встроен ген теломеразы. Уже спустя 6 месяцев теломеры женщины удлинились на 9 %, что соответствует омоложению тканей на 20 лет.
Однако радоваться рано: безопасность подобных экспериментов ещё не исследована. Чем они могут аукнуться в дальнейшем для здоровья человека и его потомков пока неизвестно. Некоторые специалисты предполагают, что такие опыты на людях могут закончиться увеличением количества онкологических и других смертельно опасных заболеваний. Время покажет. А пока расскажем о безопасных способах удлинить теломеры.
Доступные и безопасные активаторы теломеразы
Помимо описанного выше способа пробудить теломеразу каждой клетки и заставить её встать на защиту организма человека от клеточного старения, существуют более доступные и менее рискованные пути – с помощью определённых природных веществ. Назовём некоторые из них.
Практически все перечисленные ингредиенты для омоложения организма, кроме, пожалуй, фолиевой кислоты, присутствуют в пчелопродукте, приготовленном из личинок пчелиных самцов – трутневом гомогенате. В домашних условиях сохранить этот продукт на долгое время без потери его омолаживающих свойств нереально. Однако на отечественном фармацевтическом рынке уже существуют препараты, изготовленные на основе трутневого молочка по особой технологии, позволяющей сделать это.
Профессор анатомии из Университета Калифорнии, вице-председатель Американского геронтологического общества Леонард Хейфлик, разработавший теорию старения клеток, утверждал, что максимальная потенциальная продолжительность жизни человека составляет 120 лет. Доживём ли мы до этого возраста, зависит по большей части от нас самих.