для профилактики герпеса что принимать
Актуальные вопросы тяжелой герпетической инфекции у взрослых
В настоящее время неуклонно увеличивается число больных рецидивирующей герпетической инфекцией, вызванной вирусами простого герпеса (ВПГ) 1 и 2 типа различной локализации. Наиболее распространенная локализация у взрослых лиц — аногенитальная и лабиальная
В настоящее время неуклонно увеличивается число больных рецидивирующей герпетической инфекцией, вызванной вирусами простого герпеса (ВПГ) 1 и 2 типа различной локализации. Наиболее распространенная локализация у взрослых лиц — аногенитальная и лабиальная. Многие вопросы патогенеза и терапии тяжелого и крайне-тяжелого течения герпесвирусной инфекции по-прежнему не решены.
Вид ВПГ относится к семейству Herpesviridae, подсемейству L-Herpesviridae, виду ВПГ. Различают два основных типа вируса — ВПГ 1 и ВПГ 2. Инфицирование возможно как одним, так и двумя типами возбудителя. ВПГ способен внедряться в различные клетки организма человека: в клетки кожи, слизистых оболочек урогенитального и желудочно-кишечного трактов (ЖКТ), дыхательных путей, центральной и периферической нервной системы, печени, эндотелия сосудов, а также в клетки крови — лимфоциты и др. [1]. Место постоянного обитания (пожизненного персистирования) ВПГ — паравертебральные сенсорные ганглии. ВПГ передается прямым контактным путем, возможна передача возбудителя контактно-бытовым и вертикальным путем (от матери к плоду), а также трансфузионным и парентеральным путями через инструменты при оперативных вмешательствах, стоматологических процедурах и т. д.
Как известно, большинство людей инфицированы ВПГ. Первичный иммунный ответ на инфекцию протекает латентно или с герпетическими высыпаниями с местной и общей воспалительной реакцией. У лиц с нормальным иммунным ответом размножение (репликация) ВПГ находится под иммунологическим контролем, и рецидивы бывают крайне редко или не возникают в течение всей жизни. В противовирусной защите организма участвуют факторы неспецифической защиты, уничтожающие или блокирующие вирусы: макрофаги и другие клетки-продуценты интерферонов (ИФН) α, β и γ, ряд интерлейкинов (ИЛ) (фактор некроза опухоли (ФНО), ИЛ-6 и др.), естественные киллеры и факторы, формирующие специфический иммунный ответ против конкретного вируса: цитотоксические Т-лимфоциты (ЦТЛ) (CD 8+ Т-лимфоциты) и В-лимфоциты, ответственные за продукцию специфических антител, блокирующих репликацию вируса и расположенные вне клетки вирусы. Для адекватного функционирования этих клеток и поддержания иммунного ответа необходима соответствующая продукция ИФН и ИЛ.
Под влиянием различных экзогенных и эндогенных факторов, повреждающих иммунную систему, возможно ослабление контроля над репликацией вируса и соответственно развитие рецидива. Рецидив ВПГ-инфекции могут спровоцировать другие инфекционные заболевания, переохлаждение, чрезмерная инсоляция, психические или физические стрессы, интоксикации различного генеза, в том числе употребление алкоголя, циклические изменения гормонального статуса (менструации), особенно при дисбалансе уровня гормонов у женщин, резкая смена климатических поясов и др.
При длительной хронической инфекции вирусы оказывают многостороннее неблагоприятное действие на иммунную систему человека. ВПГ прямо повреждают клетки иммунной системы (лимфоциты, макрофаги и естественные киллеры). Синтезируя белки-супрессоры и химерные белки, вирусы угнетают многие реакции иммунитета: ВПГ могут блокировать действие ИФН, нарушать распознавания инфицированных клеток и другие защитные реакции. Кроме того, высокая мутационная активность вирусного генома также способствует ускользанию вируса от иммунологического контроля.
Хроническая, часто рецидивирующая ВПГ-инфекция может провоцировать развитие аутоиммунных состояний (антифосфолипидный синдром, аутоиммунный тиреоидит, аутоиммунные васкулиты и др.). Кроме того, при интеграции ВПГ в генетический аппарат клеток возможна неопластическая трансформация клеток. Так, ВПГ является одним из факторов повышенного риска развития рака тела и шейки матки и других онкологических заболеваний. Также ВПГ-инфекция является одной из ведущих причин самопроизвольных абортов, преждевременных родов, рождения детей с патологией центральной нервной системы и внутренних органов. ВПГИ ассоциирована со многими «болезнями цивилизации» — атеросклерозом, ишемической болезнью сердца у лиц моложе 50 лет и др. Тяжелое течение ВПГИ может быть маркером онкологических заболеваний и СПИДа [7].
В зависимости от числа и выраженности рецидивов, выделяют легкое, среднетяжелое и тяжелое течение болезни (табл. 1).
При тяжелом течении ВПГ-инфекции возможно одновременное появление нескольких очагов поражения (например, в области половых органов, губ, крыльев носа), а также последовательное возникновение высыпаний разной локализации (один рецидив на фоне другого), продолжительность обострения при этом может достигать 16–20 дней. В месте высыпания больные ощущают жар, жжение, боль, напряжение и/или зуд кожи. На инфильтрированной коже появляется группа пузырьков, заполненных прозрачным содержимым. Пузырьки могут сливаться в сплошной многокамерный элемент. Прозрачное их содержимое затем мутнеет. Пузырьки в дальнейшем вскрываются, образуя мелкие эрозии, или подсыхают и превращаются в корочки. Возможно наслоение вторичной бактериальной инфекции. При рецидивах ВПГ часто поражает одни и те же участки кожи. Как правило, при тяжелом течении инфекции значительно ухудшается физическое и психическое состояние больных. У части пациентов в период рецидива увеличиваются или появляются слабость, лихорадка, озноб, миалгии, цефалгии, артралгии, раздражительность, нарушение сна, эмоциональная лабильность, также могут развиваться тяжелые депрессивные состояния, требующие медикаментозной коррекции. По данным органов здравоохранения США, ВПГ-инфекция аногенитальной локализации является примерно в 10% случаев причиной депрессий и суицидов. Тяжелое течение генитальной формы ВПГ-инфекции с частыми рецидивами приводит к нарушению нормальной половой функции пациента, болезнь нередко создает конфликтные ситуации в семье, на работе. Лечение больных с тяжелым течением ВПГ-инфекции представляет собой сложную задачу и должно включать как медикаментозную терапию, так и психологическую адаптацию пациента.
У больных с тяжелой ВПГ-инфекцией в большинстве случаев не наблюдается стойкого и значимого клинического эффекта в ответ на эпизодические курсы комбинированной терапии (противовирусные и иммунотропные средства, общеукрепляющие препараты). Как правило, такие больные меняют много лечебных учреждений в поисках адекватной помощи.
С течением заболевания появляется много побочных реакций на медикаменты или их непереносимость, в ряде случаев развивается устойчивость ВПГ к ацикловиру, ИФН a, другим средствам. Иммуностимуляторы, используемые эмпирически, могут приносить облегчение в период их приема, но во многих случаях они оказываются неэффективными и даже ухудшают клиническое течение болезни. Усугубляются проявления вторичного иммунодефицита, присоединяются другие инфекции, субдепрессивные состояния переходят в стойкие нарушения психики, теряется вера больных в выздоровление, в возможность современной медицины им помочь.
Для разработки современных подходов к лечению и контролю над ВПГ-инфекцией и более углубленного понимания патогенеза заболевания нами было изучено состояние различных звеньев противовирусной защиты и системы цитокинов у больных с тяжелым и крайне тяжелым течением ВПГ-инфекции аногенитальной и лабиальной локализации, а также степень инфицированности (системности заболевания) и частота сочетания с другими герпесвирусными инфекциями.
Обследовано 102 больных, страдающих тяжелой ВПГ-инфекцией более 2 лет (28 мужчин и 74 женщины, средний возраст — 34 ± 1,5 года) и имеющих частоту рецидивов более шести в год.
При этом у 60 больных наблюдалось от 6 до 11 рецидивов ВПГ-инфекции в год, а у 42 больных — от 12 до 20 рецидивов. У большинства пациентов преобладала аногенительная или смешанная локализация герпеса. Средняя длительность тяжелого течения заболевания составила 9,3 ± 1,2 года. Группу контроля составили 32 практически здоровых добровольца (14 мужчин и 18 женщин, средний возраст — 32 ± 1,6 года). Анализ ряда изучаемых параметров включал результаты обследования пациентов с легким течением заболевания (36 человек — 10 мужчин, 26 женщин, средний возраст — 33,4 ± 2,1 года, с частотой рецидивов 2,9 ± 0,8 в год). При рецидивах жалобы больных были характерными. Часто встречались депрессия, раздражительность, снижение памяти и другие нарушения физического и психического состояния и познавательных функций.
У многих больных в анамнезе были указания на повторные курсы противовирусной и/или иммунотропной терапии, оказывавшей неоднозначное влияние: или кратковременное положительное влияние на течение ВПГ-инфекции, или ухудшение и развитие рецидива на фоне или после отмены иммунокоррекции. Такие анамнестические данные отражают тяжесть иммунной недостаточности и неадекватность проводимой эмпирической терапии без оценки иммунного статуса и индивидуального подбора иммунокорректоров, а также восстановительной терапии — иммунореабилитации [5].
При обследовании больных с тяжелым течением ВПГ-инфекции выявлялись многие маркеры вторичного иммунодефицита в виде хронических инфекционно-воспалительных заболеваний различной локализации, со смешанным характером микрофлоры и в большинстве случаев ее устойчивостью к повторным курсам антибиотикотерапии. Из 102 больных хронической ВПГ-инфекцией тяжелого течения выявлены:
Эти данные свидетельствуют о необходимости комплексного подхода к лечению ВПГ-инфекции тяжелого течения с учетом осложнений вторичного иммунодефицита.
Кроме того, проводили ПЦР-исследование биологических материалов на наличие ДНК ВПГ 1 и 2 типа и других вирусов герпес-группы: цитомегаловируса, вируса герпеса человека (ВГЧ) 6 типа, вируса Эпштейна–Барр. Используемые нами программы амплификации позволяли выявлять ДНК вирусов на уровне, соответствующем активной их репликации. Наличие активной репликации вирусов подтверждали полуколичественным ПЦР-исследованием и серологическими тестами.
В результате исследования у больных с тяжелым течением ВПГ-инфекции обнаружены лабораторные признаки вторичного иммунодефицита.
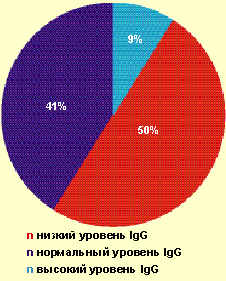 |
| Рисунок 1. Частота выявления различных значений IgG у больных с тяжелым течением ВПГ-инфекции |
Так, у большинства пациентов (91%) отсутствовало адекватное повышение продукции IgG в ответ на рецидив ВПГ-инфекции (рис. 1). При частоте рецидивов ВПГ-инфекции 6–11 рецидивов в год низкий уровень IgG выявлялся у 25% больных, при частоте — 12–20 рецидивов в месяц — уже у 64,3% больных. Более чем у 70% больных был повышен уровень ЦИК в 1,5–2,0 раза от показателей нормы. Известно, что длительная циркуляция ЦИК может приводить к отложению их на эндотелии сосудов и служить одним из факторов формирования аутоиммунной патологии.
У большинства больных с ВПГ-инфекцией тяжелого течения (70%) были обнаружены нарушения в системе естественной и/или специфической цитотоксичности (рис. 2) — снижение содержания зрелых активированных естественных киллеров CD16 + (менее 11%), Т-киллеров и/или ЦТЛ CD8 + (менее 27%). Важно отметить, что выраженное снижение уровня CD8 + (в состав которых входят также и супрессорные клетки) в большинстве случаев сочеталось с повышением уровня CD4 + и иммунорегуляторного индекса, что является фактором риска в отношении формирования аутоиммунных процессов. Как известно, системы естественной и специфической цитотоксичности играют ведущую роль в противовирусной защите.
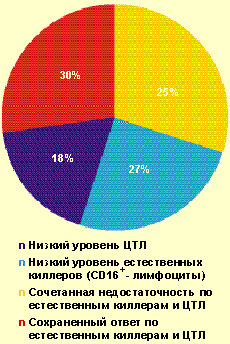 |
| Рисунок 2. Частота выявления нарушений в системе естественной и специфической цитотоксичности у больных с тяжелым течением ВПГ-инфекции (n = 102) |
Обнаруженные нарушения в системах цитотоксичности и их активационных маркерах при ВПГ-инфекции косвенно свидетельствуют о недостаточном уровне продукции Т-хелперами 1 типа ИЛ-2 — одного из важнейших звеньев цитокиновой сети, необходимого для полноценного противовирусного иммунного ответа.
При исследовании функционального состояния нейтрофилов у больных с тяжелым течением ВПГ-инфекции повышение спонтанного НСТ-теста было выявлено почти в половине случаев. Однако показатели стимулированного НСТ-теста и индекса стимуляции, напротив, были существенно снижены у большинства больных, что свидетельствует об истощении у них резервных способностей нейтрофилов.
Н. А. Дидковский, доктор медицинских наук, профессор
И. К. Малашенкова, кандидат медицинских наук
Ж. Ш. Сарсания, кандидат биологических наук
А. Н. Танасова, И. Н. Зуйкова, И. А. Зуйков, Н. М. Хитрик
НИИ физико-химической медицины, ММА им. И. М. Сеченова, Москва
Герпес: что это и какие препараты применять?
Герпес в переводе с греческого «ползущий». На данный момент актуальность этого заболевания не уменьшилась. Оно встречается более чем у 90% населения.
Что такое герпес
Как понять, что это именно герпес?
Но для достоверного подтверждения диагноза необходим анализ крови на наличие специфической реакции организма на вирус (IgM) он будет говорить о том, что на момент сдачи крови у вас протекает острый период болезни.
При генитальном герпесе, также берут на исследование выделения из половых путей и уретры. Обязательна консультация специалиста (дерматовенеролога).
Стоит обратить внимание, что вирус не выводится из организма после перенесенной ветрянки, а остается «жить» в определенном отделе нашей нервной системы, поэтому сдавать анализ на Ig G не имеет смысла.
Как можно заразиться
Заражение происходит через слизистые:
То есть чаще всего заражение происходит при несоблюдении гигиены и защиты при половом акте. Так же при расчесывании уже появившихся пузырьков происходит занос на новые участки кожи и слизистых.
Отдельный путь заражения от матери к плоду, на данный момент является обязательным обследование на ВПГ-1,2 у планирующих беременность и беременных женщин.
Инфекция поражает нервную систему и опасна своими последствиями для организма.
Как себя вести при герпесе

Препараты
Рассмотрим подробно группы препаратов для лечения
Данная группа препаратов воздействуют непосредственно на причину, сам вирус. Курс и схему приема назначает врач после комплексного обследования.
Переносимость препаратов достаточно хорошая, противопоказаны при беременности и кормлении грудью. Так же осторожно и под контролем врача применение у лиц с почечной и печеночной недостаточностью. Детям дозу определяет педиатр исходя из расчета по весу.
2. Препараты интерферона:
Противопоказаний у данной группы практически нет. Она является основным способом лечения такой уязвимой группы как беременные и кормящие женщины.
Используют для стимуляции выработки собственного интерферона и избежания усугубления течения и распространения инфекции. Переносится достаточно хорошо. Противопоказания у каждого препарата определенный возраст указанный в инструкции.
Данные препараты применяются при герпетических поражения слизистой рта, обладают антибактериальным, противовирусным действием, а также снимают воспаление и обезболивают.
Обладают местным противовирусным действием, Зовиракс Дуо Актив в сочетании с гормоном гидрокортизоном дает быстрое снятие воспаления и соответственно боли, также не дает образоваться новым пузырькам. Но так как в составе гормональная составляющая, очень внимательно необходимо прочитать инструкцию. Только с 12 лет. Перед применением любых мазей и гелей необходимо очистить кожу от косметики и загрязнений.
Только под контролем иммунолога.
Снимают боль, воспаление и так же при необходимости температуру.
Помогают избежать отечности.
Также отдельно можно выделить вакцину против герпеса. Показана она взрослым, которые болеют герпесом более 3 раз в год и высоким титром антител, пожилым лицам, ВИЧ-инфицированным. Также детям которые не переболели ветрянкой.
Лечение беременных женщин выбирается в зависимости от срока беременности, строго акушером-гинекологом и зависит от степени тяжести течения!
Герпес-является комплексной проблемой. Причиной повторяющегося или впервые возникшего герпеса является снижение иммунитета, гормональные изменения.
Главной профилактикой является поддержание работы иммунитета:
Федеральные клинические рекомендации по ведению больных генитальным герпесом- Москва 2015; Клинические рекомендации простой герпес у взрослых-2014 год;
Иммуномодуляторы в терапии и профилактике респираторных и герпесвирусных инфекций
Вирусы гриппа и герпеса вызывают эпидемии и пандемии среди людей. Они поражают различные органы, могут персистировать в клетках нервной и иммунной систем, вызывая развитие вторичной иммунологической недостаточности. Развивается дисбаланс систем Ти В-клеточного иммунитета, нарушается синтез эндогенных интерферонов. Инозин пранобекс (Гроприносин ® ) обладает доказанной противовирусной и иммуномодулирующей активностью. В обзоре литературы обсуждается эффективность препарата в лечении и профилактике респираторных инфекций и герпеса у детей и взрослых.
Грипп и другие острые респираторные вирусные инфекции
Грипп и другие острые респираторные вирусные инфекции (ОРВИ) по социальной значимости и ущербу здоровью населения и экономике страны находятся на первом месте среди болезней человека. Ежегодно в России гриппом и ОРВИ заболевают до 40 млн человек, а экономические потери достигают 100 млрд руб. в год [1]. На территории нашей страны циркулируют три вируса гриппа: A(H1N1)pdm09, А(H3N2), грипп В. В структуре других респираторных вирусов преобладают вирусы парагриппа, риносинтициальные (РС) вирусы и аденовирусы. Вирус гриппа А(Н1N1)pdm обладает пневмотропностью и нейровирулентностью и низкой иммуногенной активностью, что объясняет возможность тяжелого течения инфекции у лиц с сохранным иммунитетом, длительное персистирование вируса гриппа в клетках респираторного тракта и поражение нервной системы. При гриппе А(H1N1)pdm описано поражение межреберных нервов, которое сопровождалось нарушением функции межреберных мышц, вызывавшим усугубление дыхательной недостаточности и нередко служившим причиной ранней интубации и искусственной вентиляции легких, а также смерти [2].
Более 250 различных РНК- и ДНК-содержащих вирусов вызывают ОРВИ, которые всегда сопровождаются воспалением различных отделов респираторного тракта и проявляются риносинуситом, фарингитом, ларингитом, трахеобронхитом, обострением бронхиальной астмы (БА) или хронической обструктивной болезни легких (ХОБЛ) Нередко регистрируются вирусно-вирусные или вирусно-бактериальные ассоциации, которе могут привести к более выраженному угнетению местного и общего иммунитета и развитию бактериальных суперинфекций, в том числе внебольничной пневмонии, которые удлиняют течение заболевания и являются основной причиной инвалидизации и смерти больных [3,4].
Тяжесть течения гриппа прямо связана с его вирулентностью, которая обусловливает разнообразие клинических форм инфекции. Грипп характеризуется уникальным меха низмом развития иммуносупрессии, обус лов ленной впервые описанной транскрип цией сегмента 3 вируса гриппа со второй открытой рамки считывания (“X-ORF») [6]. Экспериментально показано, что первичная гриппозная инфекция усиливает колонизацию пневмококками носоглотки мышей и способствует их дальнейшему распространению в легкие [4].
Вирусы являются обязательными внутриклеточными генетическими инфекционными агентами. Весь репликативный цикл вируса осуществляется с использованием метаболических и генетических ресурсов клеток, поэтому патогенез вирусных инфекций следует рассматривать на молекулярном и клеточном уровнях. Вместе с тем, инфекционный процесс, вызванный вирусами, развивается в пределах того или иного органа или ткани, так как большинство вирусов обладают достаточно высокой органной или тканевой тропностью. В связи с этим развитие внутритканевых процессов при вирусных инфекциях определяется, с одной стороны, цитопатическим действием вируса на клетки данной ткани и органа, а с другой стороны, реакцией внутритканевых и органных систем защиты. Понимание патогенеза вирусных инфекций важно для создания рациональных схем лечения, включающих сочетание противовирусной этиотропной химиотерапии, иммунотерапии и симптоматического лечения [7,10].
При тяжелых и осложненных формах гриппа и других ОРВИ отмечаются длительная транзиторная Т-клеточная иммуносупрессия, снижение функциональной активности натуральных киллеров, фагоцитарной и метаболической активности нейтрофилов периферической крови, продукции эндогенных интерферонов, накопление продуктов перекисного оксиления липидов (ПОЛ) [1,5,7]. Вирусы гриппа и герпеса оказывают супрессивное действие на клеточный иммунитет и систему интерферонов. Это во многом определяет возможность развития бактериальных осложнений, обострения хронических заболеваний органов дыхания и сердечно-сосудистой системы, затяжного течения инфекции и персистирования респираторных вирусов.
Доказано длительное бессимптомное персистирование вируса гриппа А в организме человека [3,8]. Использование нами (совместно с проф. А.А. Соми ни ной) полимеразной цепной реакции и иммуноферментной тест-системы с моноклональными антителами 1С6 к нуклеопротеиду вируса гриппа А позволило выявлять антигены сезонного вируса гриппа А(H1N1) в лейкоцитах крови и носовых секретах в течение от 3-х недель до 1,5-3 месяцев после перенесенного заболевания [9]. На основании этих данных можно сделать два важных вывода. Во-первых, больные острой гриппозной инфекцией эпидемиологически опасны не менее 2-3 недель. Во-вторых, результаты исследований обосновывают пересмотр нашей прежней тактики назначения ремантадина в первые 2-3 дня болезни. Считаем возможным использование у таких больных противогриппозных препаратов с прямым механизмом действия не только в первые дни, но и в период разгара заболевания (в более поздние сроки болезни) совместно с другими препаратами, обладающими противовирусной и иммуномодулирующей активностью, патогенетическими средствами [3]. Нередко, особенно при тяжелом гриппе, отмечаются лейкопения, лимфопения и нейтропения, наиболее выраженные в конце 1-й недели болезни.
Диагностика и прогнозирование тяжести течения гриппа и ОРВИ имеют важное значение для выбора тактики лечения больных. Интересный подход предложен в работе по проспективной оценке типа “ответа на возбудитель» и его ассоциации с тяжестью и длительностью заболевания у больных гриппом A H1N1pdm2009 (pH1N1) в период эпидемий 2009–2010 гг. и 2010–2011 гг. Авторы проводили изучение РНК транскриптома цельной периферической крови, различных иммунологических медиаторов в сыворотке крови и носовых смывах, а также количественную оценку числа копий бактериальной 16S рРНК в мазках из зева пациентов и здоровых людей [11]. По тяжести течения гриппа пациенты на момент госпитализации были разделены на три группы: 1-я – без дополнительного введения кислорода; 2-я – кислородная маска; 3-я – ИВЛ. У пациентов первых двух групп наблюдали доминирование “ответа на вирус» с активацией транскриптома ответа на интерфероны (ИФН) I и II типов. В то же время у пациентов третьей группы был выражен “ответ на бактерии» с преобладанием маркеров воспаления, клеточного стресса/апоптоза и активации нейтрофилов, независимо от наличия или отсутствия повышенной бактериальной обсемененности в образцах мазков из зева, что сопровождалось менее благоприятным течением, большей длительностью заболевания, а также смазанным “ответом на вирус» на ранних сроках заболевания.
Полагаем, что более благоприятное течение гриппа ассоциировано с ранней активацией “ответа на вирус» и усиленной экспрессией генов-мишеней ИФН I типа, что может обосновывать применение препаратов рекомбинантных человеческих ИФН и их индукторов при легком и среднетяжелом течении гриппа [11,12]. Следовательно, для лечения ОРВИ и герпесвирусных инфекций (ГВИ) необходимо применение препаратов, оказывающих влияние как на вирус, так и на иммунитет. Минздрав России в комплексной терапии гриппа рекомендует сочетанное использование специфических противогриппозных средств (ремантадин, осельтамивир и др.) либо препаратов с прямым механизмом действия совместно с индукторами интерферонов – препаратами с противовирусной и иммуномодулирующей активностью [13,14]. Следует отметить, что ингаляции занамивира могут вызывать бронхоспазм на фоне бронхообструктивных заболеваний (ХОБЛ, БА). В России и за рубежом разрабатываются новые препараты против гриппа [3,15].
Использование препаратов с разнонаправленным механизмом действия обеспечивает синергидный эффект, снижает риск развития осложнений и формирования резистентных штаммов вирусов. Такая тактика способствует восстановлению иммунного ответа, сокращению сроков болезни [7,14,16]. Эффективность имму но модуляторов в лечении и профилактике ОРВИ у взрослых и часто болеющих детей подтверждена в ряде клинических исследований [17,18,19].
Герпес
Наряду с гриппом и ОРВИ важной проблемой современного здравоохранения является высокая заболеваемость герпесвирусными инфекциями (ГВИ). Это обусловлено широкой распространенностью герпесвирусов (ГВ) среди людей и способностью поражать различные органы и системы человека, что позволяет рассматривать ГВИ как системное заболевание. ГВ могут вызывать латентную, острую, хроническую и медленную формы инфекции.
Семейство Herpesviridae включает 8 антигенных серотипов ДНК содержащих вирусов, вызывающих заболевания у людей. В 2012 г. 3,7 (67%) из 6 млрд населения Земли перенесли простой герпес с поражением различных органов [20]. ВОЗ объявила о пандемии ГВИ в мире, что подчеркивает медико-социальное значение проблемы [21]. ГВИ являются одной из СПИД-индикаторных инфекций [10,22]. Ухудшение экологии и социального положения людей, миграция населения и, как следствие этого, угнетение защитных сил организма способствовали существенному увеличению числа больных герпесом в России. Считают, что на территории России и СНГ различными формами ГВИ ежегодно страдают около 20 млн человек. Рецидивы герпеса встречаются у 2-15% больных, в том числе у 50% онкологических больных и пациентов старше 50 лет и 100% пациентов со СПИДом [23,24]. Анализ заболеваемости ГВИ в России и наши расчеты показывают, что в Санкт-Петербурге на 5 млн жителей у 15% взрослого населения (до 370000 человек) имеется герпетическое поражение кожи и слизистых оболочек. Генитальный герпес (ГГ) встречается у 230000 взрослого населения, заболевания нервной системы, обусловленные ГВ, – у 20000-23000, офтальмогерпес – у 8000. При этом в 1430% случаев длительно сохраняются остаточные явления (вплоть до инвалидизации), а летальность достигает 5-70% в зависимости от клинической формы поражения ЦНС. Герпетические и аденовирусные поражения глаз протекают наиболее тяжело и требуют длительного лечения [10,25].
Рецидивирующий ГГ развивается у сексуально активных людей молодого и среднего возраста, чаще в группах риска, в том числе у проституток, гомосексуалистов, а также лиц, имеющих многочисленных и случайных половых партнеров [26,27]. При ГГ рецидивы заболевания возникают в 50-75% случаев, что значительно выше частоты обострения при экстрагенитальной локализации инфекции. По нашим данным, ГГ в 76% случаев был обусловлен вирусом простого герпеса 2 типа (ВПГ)-2 и в 24% – ВПГ-1, причем моноинфекция, вызванная ГВ, наблюдалась лишь у 24-27% больных [10,28].
В Москве за последние годы заболеваемость ГГ увеличилась в 6 раз, а в Московской области – в 2 раза, причем в 30% случаев причиной его был ВПГ-1, который, в отличие от ВПГ-2, вызывает стертое течение инфекции [26,29]. Важно отметить, что бессимптомное (субклиническое) течение ГВИ представляет угрозу инфицирования полового партнера. В процессе репликации ВПГ может инфицировать половые клетки и нарушать сперматогенез, что в конечном счете проявляется нарушением генетического аппарата гамет. Не исключено также встраивание вирусной ДНК в геном гамет [23,30].
Большое значение имеют нейрогенный и гематогенный пути распространения ВПГ. ГВ не только персистируют, но и репродуцируются в клетках иммунной системы, обусловливая гибель или снижение функциональной активности этих клеток, что способствует развитию вторичных иммунодефицитных состояний (или вторичной иммунологической недостаточности), поддерживающих длительное персистирование вируса. При нарушении иммунного статуса ГВИ развивается чаще и характеризуется более тяжелым течением, что связано с недостаточностью иммунитета или избыточной иммунной реакцией. Таким образом, возникает своеобразный “порочный круг» [10,31].
Доказано, что при рецидивирующей ГВИ, обусловленной ВПГ-1/2, снижены общее число CD3+ и CD4+ клеток и иммунорегуляторный индекс, угнетена активность ЕК-клеток и антителозависимая клеточная цитотоксичность, а также способность лимфоцитов к синтезу эндогенных ИФН-α/β и ИФН-g. Т-клетки, в том числе Т клетки-памяти, ЕK-клетки и цитотоксические лимфоциты – основные участники противовирусных реакций, поэтому многие вирусы приобрели механизмы, позволяющие избегать распознавания их антигенов эффекторными клетками либо модулировать активность последних [10,32]. В фазе рецидива герпеса показано усиление окислительно-восстановительного потенциала нейтрофилов, повышение уровня циркулирующих иммунных комплексов и снижение содержания катионных белков, свидетельствующее об их активном вовлечении в защитные реакции организма [24,33,34].
В 2006-2008 гг. в РФ заболеваемость ветряной оспой у детей составила 58-28 на 100 тыс. детского населения [35]. По данным годовой статистики за 2010 г. можно говорить об эпидемии ветряной оспы в Санкт-Петер бурге и Ленинградской области: в Санкт-Петербурге заболеваемость среди детей до 14 лет составила 4709,7, в Ленинградской области среди детей до 17 лет – 3551,0 на 100 тыс. детей соответствующего возраста [35]. При ветряной оспе у детей в 27,5% случаев развиваются неврологические осложнения, среди которых 2,3% связано с поражением периферической, а 97,7% – центральной нервной системы (доля энцефалита достигает 70,5%). Ветряная оспа у детей протекает с системным дисбалансом иммунной системы со значительной продукцией как провоспалительных (интерлейкин [ИЛ]-1β, ИЛ-6, ИФН-g, ИФН-α, ИЛ-8), так и противовоспалительных (ИЛ-4 и ИЛ-10) цитокинов [36]. Ко-факторами формирования постгерпетической невралгии могут быть пожилой возраст (старше 60 лет), тяжелое течение болезни, локализация высыпаний в области головы, наличие сопутствующих заболеваний, наличие ДНК вируса ветряной оспы в крови на 4-й неделе болезни, снижение уровней sCD95 и sCD54 в 1,5-2 раза по сравнению с контрольными показателями [37].
В настоящее время вирус Эпштейна-Барр (ВЭБ) – один из самых распространенных ГВ у населения всего земного шара. ВЭБ представляет собой лимфотропный ДНС-содержащий вирус человека, особенностью которого является способность вызывать не гибель клеток, в которых происходит его репродукция, а, напротив, их патологическую пролиферацию. Обладает тропизмом к В-лимфоцитам и способен к длительному персистированию в них. ВЭБ может вызывать острую, или литическую (инфекционный мононуклеоз, гемофагоцитарный синдром, ассоциированный с ВЭБ, синдром ДжаноттиКрости), и непродуктивную (латентную) инфекцию. В сыворотке крови взрослых больных инфекционным мононуклеозом, обусловленным ВЭБ [38]:
Подробно молекулярные аспекты патогенеза ВЭБинфекции изложены ранее [39].
Таким образом, при ГВИ угнетены и разбалансированы системы Т- и В-клеточного иммунитета. Вместе с тем, наблюдается функциональная неполноценность системы неспецифической резистентности организма. Выявленные нарушения в иммунном гомеостазе регистрируются в фазе рецидива и ремиссии заболевания, тем самым во многом предопределяя и объясняя длительное персистирование в организме человека и рецидивирующее течение болезни. Вышеизложенные обстоятельства должны учитываться практическими врачами при лечении больных рецидивирующими ГВИ [10,23,34,40].
Перспективы лечении гриппа и герпеса
В лечении среднетяжелого и осложненного гриппа А(H1N1)pdm Минздрав России рекомендует сочетанное использование специфических противогриппозных средств либо препаратов с прямым механизмом действия совместно с индукторами интерферонов. Такой подход обеспечивает синергидный эффект, снижает риск формирования резистентных штаммов вирусов, развития осложнений. При этом восстанавливается эффективный иммунный ответ, сокращаются сроки выздоровления при остром заболевании и быстрее наступает клинико-иммунологическая ремиссия при хроническом его течении. В лечении гриппа и других ОРВИ и герпеса обосновано использование иммуномодуляторов, обладающих противовирусной и иммуномодулирующей активностью [1,13,41,42], которые могут ускорить разрешение воспалительного процесса, ограничить избыточную активацию Т-клеток и/или способствовать переходу на новый цитокиновый профиль, например, с Th-2 на Th-1 тип иммунного ответа у детей и лиц с аллергическими заболеваниями, что является оптимальным для выздоровления [43,44].
Считаем важной инициативу ВОЗ по борьбе с ОРВИ (BRaVe) [45], в которой указано, что “существующие фармакологические вмешательства представлены в основном вакцинами и противовирусными препаратами против гриппа». Поэтому необходимо “…расширение вариантов лечения ОРВИ с разработкой эффективных противовирусных препаратов для наиболее значимых патогенов и/или безопасных и эффективных модификаторов биологических реакций». Для реализации инициативы ВОЗ в отношении гриппа возможно применение стратегии “repurposing/host-directed therapy» (перенаправление поиска/терапия через метаболизм хозяина), которая предполагает использование одобренных по иным показаниям лицензированных препаратов, способных влиять на узловые белки клеток человека, особенно важных для реализации жизненного цикла вируса [45].
Определенные трудности связаны с лечением больных рецивирующими ГВИ. Мы придаем большое значение подбору оптимальных лекарственных форм и схем лечения, последующему диспансерному наблюдению. Клинический опыт применения противогерпетических химиопрепаратов (ацикловира, валацикловира, фамцикловира) показал, что, быстро купируя острые проявления инфекции, они не снижают частоту и тяжесть рецидивов герпеса. Поэтому для повышения эффективности лечения в схемы терапии необходимо включать иммунобиологические препараты (ИФН, индукторы ИФН, вакцины), способствующие коррекции иммунологического статуса больного, а также патогенетические средства, облегчающие состояние пациента [28,46,47,48]. Таким образом, больные с рецидивирующими ГВИ требуют лечения в остром (рецидив) и межрецидивном (ремиссия) периодах болезни. Изложенные выше общие принципы терапии предопределяют комплексный системный подход к лечению больных РГИ, объединенный в 4 взаимосвязанных между собой этапа [10,28]. Лечение мы проводим под тщательным клинико-иммунологическим контролем, подбирая индивидуальную терапию больному.
Иммуномодуляторы – лекарственные средства, обладающие иммунотропной активностью, которые в терапевтических дозах восстанавливают функции иммунной системы (эффективную иммунную защиту) [23,34]. Показанием для назначения иммуномодуляторов является наличие клинических признаков иммунной недостаточности (хронический инфекционно-воспалительный процесс, отсутствие эффекта от стандартной фармакотерапии). Иммуномодуляторы часто назначают вместе с этиотропной терапией, например, у часто и длительно болеющих пациентов. Иммуномодуляторы в этих случаях применяют с целью предупреждения развития постинфекционных осложнений. Назначение иммуномодуляторов предпочтительно больным, которые находятся в пролиферативной фазе иммунного ответа, либо по указанным выше показаниям [49,50].
Гроприносин® (инозин пранобекс компании “Гедеон Рихтер») – иммуностимулирующий препарат с противовирусной активностью, который представляет собой комплекс инозина с димепранолом и ацедобеном и зарегистрирован в странах Европы и Российской Федерации. Эффективность комплекса определяется присутствием инозина, второй компонент повышает его доступность для лимфоцитов [51,52,53]. Инозин пранобекс сочетает в себе свойства универсального иммуномодулятора с прямой противовирусной активностью в отношении широкого спектра ДНК- и РНКвирусов (гриппа А и В, парагриппа, риновирусов и аденовирусов, вирусов простого герпеса, ветряной оспы, инфекционного мононуклеоза). Выпускается в таблетках по 500 мг, которые назначают после еды 3-4 раза в сутки.
В зараженной вирусом клетке инозин пранобекс связывается с рибосомами и вызывает изменения их конфигурации. Клеточная РНК получает преимущества перед вирусной РНК в конкуренции за места связывания на рибосомах. Вирусная РНК транслируется неправильно или образуется нетранслируемая вирусная РНК. В итоге подавляется репликация вируса, а сниженная скорость транскрипции РНК лимфоцитов повышается. Иными словами, инозин пранобекс обладает двойным механизмом противовирусного действия: подавляет репликацию ДНК и РНК вирусов и активирует противовирусный иммунитет. Иммуномодулирующий эф фект при применении Гроприносина® проявляется активацией системы комплемента, синтеза эндогенного ИФН-α и усилением гуморального иммунного ответа (повышение синтеза антител). При наличии вторичного клеточного иммунодефицита отмечается тимозиноподобное действие препарата: усиление дифференцировки и пролиферации Т-лимфоцитов, регуляция соотношения субпопуляций хелперных и супрессорных клеток, повышение функциональной активности Т-лимфоцитов и синтеза интерлейкина-2, активация ЕК-клеток и фагоцитоза [20,52,53].
Доказана высокая безопасность Гроприносина®. Он не обладает антигенностью, не вызывает передозировку и гиперстимуляцию иммунитета (обеспечивает физиологичный иммунный ответ). Препарат не токсичен, хорошо переносится даже при длительных курсах терапии. Совместим с антибиотиками, ИФН и другими лекарственными препаратами. Поэтому назначение Гроприносина® возможно без каких-либо специальных иммунологических исследований. Его можно включать в схему лечения, основываясь на клинической симптоматике и применять у пациентов всех возрастных групп (у детей с 3-х лет).
Противопоказан при подагре, мочекаменной болезни, аритмии, гиперчувствительности к препарату, во время беременности и кормления грудью (безопасность применения не установлена).
Инозин пранобекс в лечении гриппа и ОРВИ. У взрослых применяют в дозе 50 мг/кг/сут (обычно по 1 г 3 раза в день) в течение 5-14 дней, для поддерживающего лечения – по 1 г 3 раза в сутки 3 раза в неделю в течение 4 недель. У детей в возрасте от 3 до 12 лет лечебная суточная доза составяет 50 мг/кг (в среднем 1 г на 10 кг массы тела 3 раза в день) в течение 5-7 дней. Возможны другие схемы использования Гроприносина® [14,54]. Схемы терапии инозином пранобексом часто и длительно болеющих ОРВИ и гриппом взрослых и детей представлены в табл. 1.
| Период | Режим приема | Суточная доза | Курс терапии | Рекомендуемая форма выпуска |
|---|---|---|---|---|
| Взрослые | ||||
| Острый | 2 табл. 3 раза в день | 3 г | 5-14 дней, до исчезновения симптомов | 5 дней – №30, 6-14 дней – №50 |
| Поддерживающий | 1 табл. 2 раза в день | 1 г | 5-10 дней, перерыв 8 дней, 2-3 курса | 5 дней – №30, 6-10 дней – №50 |
| Дети | ||||
| Острый | 50 мг/кг/сут в 3 приема | 50 мг/кг | 5-14 дней, до исчезновения симптомов | 5 дней – №20, 6-10 дней – №30 |
| Поддерживающий | 1 табл. 1 раз в день | 500 мг | 5-10 дней, перерыв 8 дней, 2-3 курса | 5 дней – №20, 6-10 дней – №30 |
В сравнительном исследовании у 58 часто болеющих детей с подтвержденной ГВИ инозин пранобекс по эффективности (77%) превосходил ацикловир (50%), умифеновир (33%) и меглюмина акридонацетат (30%). При лечении смешанных ГВИ в настоящее время препаратом выбора считают инозин пранобекс [55]. В проспективном сравнительном рандомизированном много центровом открытом наблюдательном исследовании ГОРИЗОНТ принимали участие 103 практикующих врача из 92 лечебных учреждений в 19 городах России. В исследование были включены 1047 пациентов, часто и длительно болеющих ОРВИ и/или ГВИ, у которых сравнивали эффективность Гроприносина® и общепринятой терапии [56]. Пациенты основной группы получали Гроприносин® в таблетках по 500 мг (схемы выбирали с учетом диагноза), контрольной – разные противовирусные препараты, в том числе ацикловир, валацикловир, имидазолил этанамид, умифеновир, ремантадин. В основной группе эффективность лечения была выше (97,7%), чем в контрольной (79,6%, р Гроприносин® в лечении и профилактике рецидивов герпеса. Многочисленными исследованиями отечественных и зарубежных авторов убедительно доказана высокая эффективность и безопасность инозина пранобекса в лечении и иммунореабилитации больных с рецидивирующим герпесом и папилломавирусными урогенитальными инфекциями [10,47,53,59-62]. При назначении Гроприносина® происходит быстрое купирование клинических проявлений герпеса (зуда, воспаления и отечности), достоверно уменьшается количество рецидивов и частота выделения ВПГ, устраняются иммунные нарушения, вызванные вирусной инфекцией, и “скрытые» иммунодефицитные состояния [59,61]. Инозин пранобекс, в отличие от других иммуномодуляторов, имеет наиболее высокий уровень доказательности исследований (уровень А) [53,60,61]. Препарат обладает определенными преимуществами по сравнению с интерферонами и их индукторами, полиоксидонием. Показано качество иммуномодуляции со стимуляцией преимущественно клеточного иммунитета. Инозин пранобекс (Гроприносин®) не обладает антигенностью и не вызывает аутоиммунных реакций.
Для купирования рецидива герпеса необходимо в самом начале обострения с учетом его тяжести назначать максимальную дозу препарата (3-4 г/сут в 3-4 приема взрослым), а не ограничиваться малыми дозами. Лечение продолжают до исчезновения высыпаний на коже (обычно 5-7 дней), а затем еще в течение 2 дней, т.е. в целом 7-9 дней. Для постоянного супрессивного лечения Гроприносин® применяют в дозе 3-4 г/сут в 3-4 приема в течение 5-7 дней, а затем по 1 г/сут (в один прием в первой половине дня). При тяжелом течении инфекции длительность поддерживающей терапии составляет 6-12 мес, при среднетяжелой – 3 мес, при легкой – 1 мес. Если во время приема иммуномодулирующей дозы возникает очередной рецидив ГВИ, пациенту вновь назначают максимальную дозу препарата.
П.С. Русакевич и соавт. [61] обследовали (кольпоскопия, гистологическое исследование, иммунограмма и др.) 232 женщины в возрасте 30,1±8,8 года с различной патологией шейки матки. У 121 из них выявили инфекцию, вызванную ВПГ или вирусом папилломы человека. Эти пациентки составили основную группу и дополнительно получали иммуномодулирующую терапию Гроприносином®. В контрольную группу вошли 30 пациенток с идентичной патологией шейки матки, которым назначали иммуномодулирующую терапию. В период ремиссии рецидивирующего ГГ назначали супрессивную терапию Гроприносином® по 1 г/сут в один прием на протяжении от 2 до 6-12 месяцев с обязательным удалением очага на шейке матки путем радиоволновой аблации/эксцизии. В отдельных случаях при наличии активности герпетической инфекции препарат применяли по 1 г 3 раза в день в течение 5–7 дней в виде монотерапии или в комбинации с противовирусными препаратами. Суммарная эффективность этапной терапии с использованием в качестве иммуномодулятора Гроприносина® составила 97,2±1,6% при ВПГ-инфекции, 83,8±3,4% − при инфекции, вызванных вирусом папилломы человека, и 78,2±1,6% − при сочетанных вирусных поражениях цервикса [61].
резистентности организма. Инозин пранобекс вызывает секрецию ИФН-α и стимулирует естественные механизмы иммунной защиты организма с восстановлением количества и активности Т-лимфоцитов, Т-хелперов, ЕК-клеток и макрофагов, что обосновывает его применение для для противорецидивной терапии ГВИ.
Мы также имеем положительный опыт использования Гроприносина® в сочетании с ацикловиром для купирования рецидивов ГГ [10]. Под наблюдением находились 55 женщин в возрасте 18-50 лет, у которых частота рецидивов ГГ составляла 4-5 в год. 35 женщин основной группы получали ацикловир по 200 мг 5 раз в сутки в течение 5 дней в сочетании с Гроприносином® по 0,5 г 2 раза в сутки в течение 10-12 дней, а 20 пациенток контрольной группы – только ацикловир по 200 мг 5 раз в сутки в течение 5 дней. На фоне сочетанной терапии продолжительность вирусовыделения и рецидива были достоверно короче, а сроки ремиссии – более продолжительными (5,2 мес и 1,7 мес в основной и контрольной группах, соответственно). Одновре менно с клиническим улучшением достоверно повышались число CD3+, CD4+, CD8+ Т-лимфоцитов, ЕК клеток, синтез ИФН-α и ИФН-g. В наших исследованиях показана высокая эффективность Гроприносина® в лечении рецидивирующего ГГ и ВЭБ-инфекции и иммунореабилитации таких больных [10].
Доказана противовирусная активность инозина пранобекса в отношении ВПГ, цитомегаловируса, ВЭБ [14,63,64]. Важно отметить, что наличие длительных периодов немотивированной слабости, повышение температуры тела, увеличение двух и более групп лимфатических узлов, дискомфорт в зеве служат показанием для обследования взрослых и детей на цитомегаловирус, ВЭБ и вирус герпеса человека 6 типа [10,14,63,65]. Косвенными признаками активности ГВИ являются относительный лимфоцитоз и моноцитоз.
Терапевтический эффект инозина пранобекса и ацикловира был изучен у 352 больных ветряной оспой и 284 пациентов опоясывающим герпесом [66]. Паци енты были распределены на 4 группы: 1) только паллиативное лечение; 2) паллиативное лечение + инозин пранобекс; 3) паллиативное лечение + ацикловир; 4) паллиативное лечение + инозин пранобекс + ацикловир. Комбинированная терапия инозина пранобексом и ацикловиром по эффективности превосходила монотерапию обоими препаратами. Авторы рекомендовали применять ацикловир при тяжелых формах ветряной оспы и герпеса зостер, сочетая его с инозином пранобексом и пассивной иммунотерапией на ранней стадии заболевания [66].
Мы наблюдали 80 больных в возрасте от 19 до 60 лет с воспалительными заболеваниями верхних дыхательных путей, в том числе острым и обострением хронического риносинусита (у 24), хроническим (де)компенсированным тонзиллитом (у 36) и хроническим фарингитом (у 20) [10]. Частота рецидивов составляла 4-8 раз в год, а длительность каждого рецидива – до 2-3 недель. С помощью полимеразной цепной реакции в реальном
времени в крови, слюне или мазке из ротоглотки у 70% пациентов выявили ВЭБ, у 40% – вирус герпеса человека 6 типа в сочетании со стрептококком группы А, что позволило диагностировать вирусно-бактериальную инфекцию. При наличии признаков острого или обострения хронического ринотонзиллофарингита назначали антибиотики и симптоматическую терапию на 5-6 дней. В последующем проводили лечение Гроприносином® по 1 г 3 раза в день и человеческим рекомбинантным интерфероном α-2b по 1 млн МЕ (одна свеча) 2 раза в течение в течение 10-14 дней, а затем иммунореабилитацию Гроприносином® в виде двух 30-дневных курсов по 0,5 г 2 раза в день с 7-8-дневным перерывом. На фоне комплексной терапии отмечены более быстрая положительная клиническая динамика, достоверное повышение показателей неспецифической резистентности организма (число CD4+ Т клеток, ЕК-клеток, синтез эндогенных ИФН). После завершения терапии наблюдалось значительное снижение частоты определения ВЭБ и вируса герпеса человека 6 типа (р
Заключение
Доказана высокая эффективность Гроприносина® (инозин пранобекс) в лечении и профилактике повторных ОРВИ, снижении частоты рецидивов ГВИ и ОРВИ в 2,5–3 раза и более у 85% пациентов [10,14]. Приме нение Гроприносина® сопровождалось быстрой локализацией очагов инфекции, уменьшением основных симптомов заболевания, снижением риска развития осложнений. Одновременно отмечались нормализация показателей иммунограммы (клеточные реакции, фагоцитоз) и восстановление синтеза эндогенных интерферонов, что предполагает активацию Тh1-типа иммунного ответа. Это доказывает, что Гроприносин® является эффективным иммуномодулятором с противовирусной активностью. Препарат хорошо переносится при длительном приеме и может применяться в сочетании с другими лекарственными средствами. Гропри носин® рекомендуется назначать для монотерапии или комбинированной терапии и профилактики (иммунореабилитации) респираторных вирусных инфекций и рецидивирующих ГВИ у детей и взрослых.