до чего окисляется озон
Свойства озона, его взаимодействие с различными веществами и области применения
Растворимость и расщепление озона в водной среде
Озон является газом, прекрасно растворяющимся в воде, причем этот показатель растет с понижением температуры. Его растворимость намного выше, чем у азота и кислорода, хотя и меньше, чем у хлора и его диоксида. При растворении озона в воде также идет и его разложение, протекающее с одновременным взаимодействием с загрязняющими веществами, имеющимися в воде. Реакции расщепления озона в водной среде связаны с его взаимодействием с молекулами воды и гидроксид-ионами. В результате этих реакций идет выделение молекул двухатомного кислорода, обладающего так же высокими окислительными свойствами, и образование ионов водорода и гидроксида, а так же перекиси водорода. При диссоциации перекись водорода образует ионы водорода и частицы свободных радикалов, ускоряющих процесс разложения озона, а так же приводящие к началу цепных реакций разложения примесей. К ним таким частицам относятся радикалы супер-кислорода, состоящие из двух атомов и имеющие отрицательный заряд. Тормозом процесса разложения являются ионы карбонатов и гидрокарбонатов, нейтрализующие при взаимодействии ионы гидроксида путем образования углекислого газа и воды. Таким образом, процессы, протекающие при растворении озона в водной среде, проходят одновременно по нескольким механизмам. По выводам из практики принимается, что при растворении в воде одна половина озона существует в виде молекул, а вторая распадается с образованием гидроксильных радикалов.
Взаимодействие озона с различными веществами и механизмы протекания этих процессов
Взаимодействие загрязняющих веществ с озоном происходит за счет прямой реакции с молекулами озона или же с радикалами, появляющимися в процессе его распада. Более активно озон взаимодействует с анионами, чем с нейтральными и катионными веществами.
Озон, являясь активным окислителем, взаимодействует со многими органическими и неорганическими веществами. Из галогенов с озоном не реагирует фтор и практически не вступает во взаимодействие хлор. Бром окисляется озоном сначала до гипобромита, а затем и до броматных соединений. При этом образующийся бромид может параллельно взаимодействовать с веществами органического происхождения и аммиаком. Йод окисляется озоном очень быстро с образованием йодатов и йодноватистой кислоты. Соли галогеносодержащих кислот уже не поддаются озоновому окислению. Практически нейтральными к озону являются азот и его соединения, в том числе аммиак и ионы аммония, а так же нитраты, за исключением аминов, хорошо взаимодействующих с гидроксильными радикалами. Токсичные цианиды легко окисляются озоном в цианаты, дальнейшее окисление которых происходит очень медленно и ускоряется только в присутствии ионов меди, замедляясь при наличии в растворе ионов железа. Сера и сульфитные при взаимодействии с озоном окисляются до сульфатов. Что же касается реакций с металлами, то озон достаточно активно окисляет железо и марганец, кобальт и никель, образуя оксиды и гидроксиды, удаляемые из раствора при флокуляции или фильтрации. Практически пассивен в отношении озона хром, хотя при определенных условиях он может быть окислен им до максимальной степени окисления, шестивалентного хрома.
Применении озона
Благодаря своим свойствам, озон широко используется для очищения воды от фенолов, нефти и нефтепродуктов, поверхностно-активных веществ, аминов, железа и марганца, растворенного сероводорода, а также многих других веществ органического и неорганического происхождения, которые не могут быть эффективно удалены при использовании других методов очистки водной среды. Кроме того, с помощью озонового окисления проводится полное обеззараживание воды даже при значительном бактериальном ее загрязнении, в том числе и от патогенных микроорганизмов, устойчивых к действию хлора и хлоросодержащих дезинфектантов.
Это определяет так же и области его применения, к которым относится очистка воды, применяемой в оборотном водоснабжении, в схемах очищения сточных вод как бытового, так и производственного характера, при очистке нефотесодержащих стоков и сточных вод пищевой промышленности, характеризуемых высоким содержанием органических веществ.
До чего окисляется озон
Растворимость воде (от 0 ° до 30 °С)
В 13 раз выше, чем кислорода
Коэффициент растворимости в воде при температуре 0 °С,20 °С
Разложение озона в воде
Одновременно с растворением озона в воде происходит его разложение. При этом скорость его распада, как и обратная величина «время жизни», зависит от температуры воды и, в основном, от состава воды- в первую очередь от наличия в воде различных примесей, особенно некоторых органических соединений и ионов металлов. Эти положения хорошо иллюстрируются данными, приведенными на рисунке 1.2.
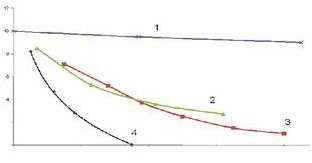
Рисунок 1.2. [4]. Разложение озона в различных видах воды при температуре 20 °С.
Время жизни в однократно дистиллированной воде 20 минут, а в обычной воде несколько минут.
Реакция озона с неорганическими веществами.
Окислительный потенциал (Вольт)
Относит. окслит. потенциал к ОК пот. хлор
Из таблицы 1.3. следует, что озон является сильнейшим окислителем. Из стабильных веществ он уступает только фтору, резко превосходя хлор.Эффективность реакции озона с некоторыми неорганическими веществами можно оценить по начальным скоростям взаимодействующего с ними озона (точнее по удельным скоростям реакций, так называемым константам скоростей или их обратным величинам – временам реакций). Частично эти данные представлены на рисунке 1.3.
Меркаптаны окисляются с озоном до сульфоновых кислот. Бисульфиты и сульфоновые соединения являются промежуточными веществами. Аминокислоты, в состав которых входит сера (цистеин, цестин и метионин), реагируют быстро.• Аминокислоты (составляющая часть белков) реагируют по электрофильному механизму.• Среди пестицидов, содержащих эфиры фосфорной кислоты, наиболее известным является паратион. Озонирование этого соединения приводит к появлению параоксона, который более токсичен, чем паратион. Дальнейшее озонирование превращает параоксон в менее токсичные вещества (например, в нитрофенол, который затем окисляется до конечных продуктов – нитратов и СО2).
При обработке питьевой воды механизм прямого окисления через озон в молекулярной форме является основным. Константы скоростей большого числа органических соединений с озоном представлены в обзоре Hoigne [12].
Как уже упоминалось выше, озон обладает мощным бактерицидным и вирулентным (инактивирующим вирусы) действием.В научной литературе (особенно популярной) часто утверждается, что озон действительно дезактивирует бактерии и вирусы сильнее, чем хлор (и это будет проиллюстрировано ниже), но к качественным оценкам этого преимущества надо относиться с определенными оговорками.Эффективность различных дезинфектантов хорошо иллюстрируется данными рисунка 2.1.
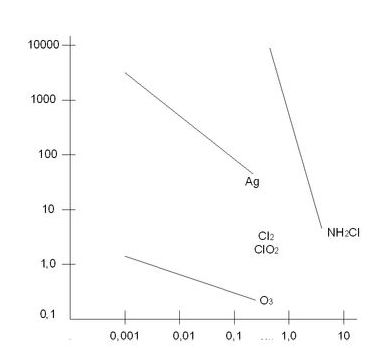
Рисунок 2.1. Скорость дезактивации патогенна Е-coli различными дезактивирующими агентами.
В настоящее время при оценке эффективности того или иного дезинфектанта используются так называемые С х Т критерий, т.е. произведение концентрации реагента на время действия. Можно сказать, что ВОЗДЕЙСТВИЕ (ИНАКТИВАЦИЯ) = Концентрация • Время воздействия.В таблице 2.1. представлены для сравнения значения СхТ критерии для различных микроорганизмов – дезинфицирующих агентов.Таблица 2.1. Значение СхТ критерия для различных микроорганизмов (99% инактивации при 5-25 °С. СхТ критерий (Мб/л •мин) )
Свободный хлор рН:6/7
Двуокись хлора рН:6/7
Для 90% инактивации (1 log)
2.4. Действие озона на споры, цисты и другие патогенны.
По отношению к этой микрофлоре озон также выступает как эффективный бактериальный агент. В частности по Брингманну Bacillus subtilis уничтожались в воде озоном в 3000 раз быстрее, чем хлором [18].М. Кейн и Глекнер [18] изучали действие озона и хлора на цисты (плотные оболочки, образующиеся вокруг одноклеточных организмов) Endamoeba hystolica и на бактерии, сопутствующие этим культурам. Установлено, что время, необходимое для уничтожения этих организмов при остаточной концентрации озона 0.3 мг/л, составляет 2-7.5 мин, а для хлора (остаточная концентрация 0.5-1 мг/л) гораздо больше – 15-20 мин.
Действие озона на вирусы
Озон оказывает ярко выраженное, радикальное воздействие на многие вирусы, что сопровождается полной гибкостью вирусного протеина. Вирусологи США и Германии в 40х-60х годах провели ряд исследований с суспензиями вируса полиоэмилита в целях его инактивации с помощью хлора, озона и двуокиси хлора [19]. Выводы из этих исследований могут быть представлены в следующем виде:
Газ озон: химические, физические свойства, формула, отличия и другое
Содержание:
Кислород – элемент VIA группы. Для него свойственны две аллотропные модификации с разными химическими формулами – кислород О2 и озон О3. Они отличаются не только составом молекул, но и различными характеристиками.
В конце XVIII века ученый Мартин Ван Марум провел эксперимент, в результате которого получил озон. Он через воздушное пространство пропускал электричество. Таким образом, образовался озон – это голубоватый газ с необычным запахом. Ученый предполагал, что полученный газ представляет собой электрическую материю.
В 1840 году ученый Кристиан Фридрих Шенбейн раскрыл структуру и свойства озона. Полученный газ он назвал «озоном» (с греч. языка «пахнуть»). Кристиан Фридрих Шенбейн провел эксперимент, где озон вытеснил йод из иодида калия.
Получение озона
Существует несколько способов получения молекул озона.
Физические свойства озона
Озон – бесцветный (в толстых слоях голубоватый) газ. Он почти в два раза тяжелее воздуха. Озон обладает специфическим запахом свежести.
Озон растворим в воде. Примеси позволяют растворяться еще быстрее. Если озон находится в состоянии газа, то он выступает в роли диамагнетика. Если озон – это жидкость, то проявляет свойства слабого парамагнетика.
Озон ядовит и губителен для бактерий. Его используют при обеззараживании воздуха и воды.
Химические свойства озона
Озон обладает сильными окислительными свойствами по сравнению с кислородом. Он реагирует с рядом веществ.
Если озон находится в состоянии газа, то реакция с сероводородом выглядит следующим образом:
H2S + O3 = SO2 + H2O
Озон способен взаимодействовать со ртутью при обычных условиях. В результате металл теряет блеск и способность липнуть к стеклу.
Токсичность озона
При умеренных концентрациях озон безвреден. Реакции с озоном характеризуются формированием свободных радикалов кислорода, которые губительны для организма при высоком содержании. Чрезмерное воздействие озона часто приводит к гибели. Озон особенно губителен для органов дыхания.
Озоновый слой в верхних слоях атмосферы
Озоновый слой – слой в верхней части атмосфера Земли, который состоит из бесцветного нестабильного газа. Он располагается на высоте 15-20 км над поверхностью планеты. Стратосфера – слой атмосферы, в котором содержится много озона.
Озон образуется в результате воздействия ультрафиолета на кислород. Слой газа задерживает все формы поступающей ультрафиолетовой коротковолновой радиации.
Озоновый экран защищает от вредного излучения, длина волн которого 290-320 нм. Это излучение может спровоцировать рак кожи. Озоновый слой появился на Земле около 600 млн лет назад в результате процесс фотосинтеза. Благодаря озоновому слою первые живые организмы смогли выйти из океана на сушу.
Дыры в озоновом слое
Озоновые дыры – локальное истощение озонового слоя. Самая большая озоновая дыра находится над Антарктидой. Если озоновый слой полностью исчезнет, то все живое на планете погибнет.
Озоновые дыры возникают по многим причинам, главная из которых – загрязнение окружающей среды. Озоновый слой разрушается под воздействием хлора, водорода, кислорода, брома и других продуктов сгорания. Выбросы фабрик, заводов и различных производств негативно влияют на выработку озона в верхних слоях атмосферы.
Реактивные самолеты выбрасывают окислы азота. Чем выше мощность турбореактивного двигателя, тем больше разрушающего вещества попадает в атмосферу. Ежегодно в воздух выбрасывается более 1 млн т соединений азота, из которых треть выбрасывают самолеты.
Защита озонового слоя
До 1989 года на производствах часто применялись галогенированные углеводороды, которые разрушают озоновый слой. Монреальская конвенция разработала программу по сокращению использования хлорфторуглеродов, которые быстро испарялись и достигали стратосферы. Они разлагаются на компоненты и разрушают озоновый слой. Из этих соединений раньше изготавливали аэрозоли, растворители и др.
Озоновые дыры произвольно создаются и исчезают. Это связано с некоторыми природными явлениями и даже климатическими особенностями. Газ озон образуется в результате воздействия ультрафиолета на кислород. Во время полярной ночи дыры образуются из-за того, что солнце не заходит несколько недель и ультрафиолет постоянно влияет на кислород. Во время полярного дня озоновый слой восстанавливается и воздействие ультрафиолета на живые организмы снижается.
Дыры могут формироваться в период активности Солнца. В результате этого они появляются и пропадают. Иногда это занимает несколько дней, реже растягивается на несколько месяцев.
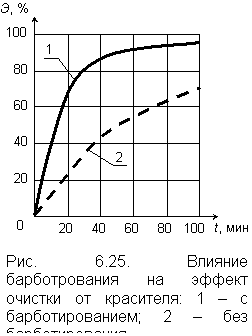
6.3.2.4. Озонирование
6.3.2.4. Озонирование
Озон – сильнейший окислитель. В реакции О3 + 2Н + + 2ē ↔ О2 + Н2О окислительно-восстановительный потенциал равен +2,07 [В]; в щелочной среде Е 0 = 1,24 [В].
Окисление сопровождается потерей озоном атома кислорода или внедрением молекул О3 в окисляемое вещество (процесс ознолиза).
Примером первого вида окисления служит деструкция цианидов (см. ниже).
Озонолиз происходит при разрушении органических соединений, например, гуминовых кислот, придающих воде цветность. Как отмечается в [1], озонолиз приводит к разрыву молекул гумуса и разрушению хромоформных групп с образованием более простых и менее окрашенных соединений. Гуминовые кислоты превращаются в апокреновые, затем в креновые и, наконец, в малоокрашенные кислоты (субкреновая, уксусная, щавелевая).
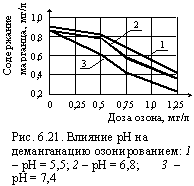
В зависимости от окислительно-восстановительного потенциала или рН, факторов определяющих окислительно-восстановительную мощность системы (см. рис. 6.14) процесс окисления озоном, как и многие другие процессы окисления и восстановления, могут идти по разным маршрутам и приводить к образованию разных конечных продуктов.
Окисление сероводорода озоном завершается образованием двуокиси серы, а при больших дозах озона и больших значениях rH 2 – серной кислоты. В первом случае двухвалентная сера окисляется до четырехвалентной, во втором – до шестивалентной.
Оба процесса идут одновременно, но чем больше доза озона, тем более превалирует второй. Двухвалентный марганец окисляется до четырехвалентного или шестивалентного в зависимости от концентрации озона в воде:




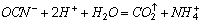 ;
;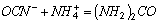 .
.
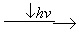 О 2 + Н 2 О 2 ;
О 2 + Н 2 О 2 ;
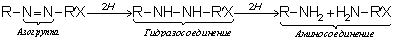 .
.