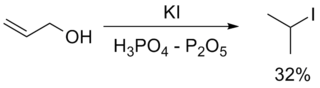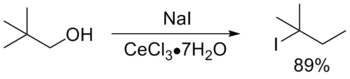до чего окисляются спирты
Спирты
Классификация спиртов
Одноатомные спирты также подразделяются в зависимости от положения OH-группы: первичные (OH-группа у первичного атома углерода), вторичные (OH-группа у вторичного атома углерода) и третичные (OH-группа у третичного атома углерода).
Номенклатура и изомерия спиртов
Названия спиртов формируются путем добавления суффикса «ол» к названию алкана с соответствующим числом атомов углерода: метанол, этанол, пропанол, бутанол, пентанол и т.д.
Для спиртов характерна изомерия углеродного скелета (начиная с бутанола), положения функциональной группы и межклассовая изомерия с простыми эфирами, которых мы также коснемся в данной статье.
Получение спиртов
Присоединения молекулы воды (HOH) протекает по правилу Марковникова. Атом водорода направляется к наиболее гидрированному атому углерода, а гидроксогруппа идет к соседнему, наименее гидрированному, атому углерода.
В результате восстановления альдегидов и кетонов получаются соответственно первичные и вторичные спирты.
Синтез газом в промышленности называют смесь угарного газа и водорода, которая используется для синтеза различных химических соединений, в том числе и метанола.
В ходе брожения глюкозы выделяется углекислый газ и образуется этанол.
Химические свойства спиртов
Щелочные металлы (Li, Na, K) способны вытеснять водород из спиртов с образованием солей: метилатов, этилатов, пропилатов и т.д.
Необходимо особо заметить, что реакция с щелочами (NaOH, KOH, LiOH) для предельных одноатомных спиртов невозможна, так как образующиеся алкоголяты (соли спиртов) сразу же подвергаются гидролизу.
Реакция с галогеноводородами протекают как реакции обмена: атом галогена замещает гидроксогруппу, образуется молекула воды.
В результате реакций спиртов с кислотами образуются различные эфиры.
Дегидратация спиртов (отщепление воды) идет при повышенной температуре в присутствии серной кислоты (водоотнимающего) компонента.
Качественной реакцией на спирты является взаимодействие с оксидом меди II. В ходе такой реакции раствор приобретает характерное фиолетовое окрашивание.
Замечу, что в обычных условиях третичные спирты окислению не подвергаются. Для них необходимы очень жесткие условия, при которых углеродный скелет подвергается деструкции.
Вторичные и третичные спирты определяются другой качественной реакцией с хлоридом цинка II и соляной кислотой. В результате такой реакции выпадает маслянистый осадок.
Такой реакцией является взаимодействие многоатомного спирта со свежеприготовленным гидроксидом меди II. В результате реакции раствор окрашивается в характерный синий цвет.
Важным отличием многоатомных спиртов от одноатомных является их способность реагировать со щелочами (что невозможно для одноатомных спиртов). Это говорит об их более выраженных кислотных свойствах.
© Беллевич Юрий Сергеевич 2018-2021
Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение (в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования, обратитесь, пожалуйста, к Беллевичу Юрию.
Окисление спиртов
Вы будете перенаправлены на Автор24
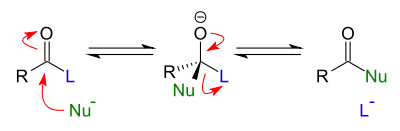
Окисление первичных спиртов в альдегиды и вторичных спиртов в кетоны является одним из важнейших превращений функциональных групп и оценкой избирательного действия окислительного агента:
Третичные спирты в обычных условиях не окисляются, а в очень жестких условиях их окисление сопровождается деструкцией углеродного скелета.
Окисление первичных спиртов до карбоновых кислот
Окисление первичных спиртов в соответствующие карбоновые кислоты легко осуществить действием большинства известных окислителей. Так, концентрированная азотная кислота быстро превращает спирты в соответствующие карбоновые кислоты. Этот метод можно применить ко всем первичным спиртам, при условии, что они не содержат групп, чувствительных к действию азотной кислоты:
Карбоновые кислоты также образуются при окислении первичных спиртов щелочным раствором перманганата калия. Надо отметить, что в этих условиях не разрушаются группы, чувствительные к кислой среде. Это обстоятельство может быть использована для окисления первичных спиртовых групп в присутствии альдегидных. Для этого из альдегидоспиртов получают ацетали, затем окисляют первичную спиртовую группу в карбоксильную и кислотным гидролизом снимают защиту, освобождая альдегидную группу. Например, таким путем можно превратить гликолевый альдегид в глиоксиловую кислоту:
Готовые работы на аналогичную тему
Окисления щелочным раствором перманганата калия ароматических первичных спиртов является удобным методом синтеза ароматических кислот:
Окисление спиртов до карбонильных соединений
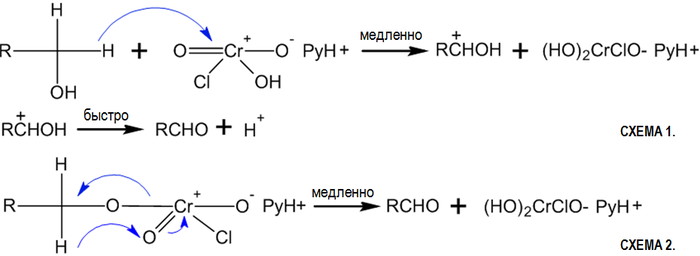
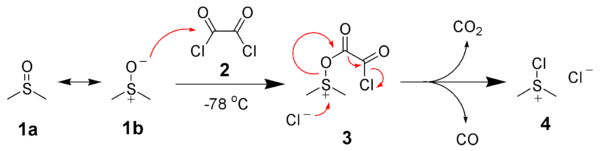
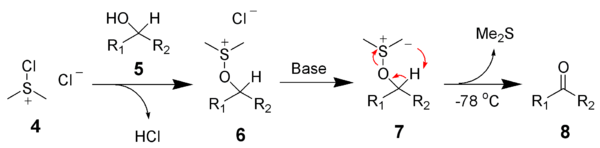
Для окисления первичных и вторичных спиртов в соответствующие альдегиды или кетоны используют смесь бихромата с серной кислотой, хромовый ангидрид, перманганат калия, диоксид марганца, а также каталитическое дегидрирование.
Получение альдегидов
Принципиальной проблемой, которая возникает при окислении спиртов до альдегидов, является то, что альдегиды очень легко подвергаются дальнейшему окислению по сравнению с исходными спиртами. По сути альдегиды являются активными органическими восстановителями. Так, при окислении первичных спиртов бихроматом натрия в серной кислоте (смесь Бекмана), альдегид, который образуется, необходимо защитить от дальнейшего окисления до карбоновой кислоты. Можно, например, удалять альдегид из реакционной смеси. И это широко применяется, так как температура кипения альдегида как правило ниже, чем температура кипения исходного спирта. Таким путем могут быть получении, в первую очередь, низкокипящие альдегиды, например, уксусный, пропионовый, изомасляный:
Лучшие результаты можно получить, если вместо серной кислоты использовать ледяную уксусную кислоту.
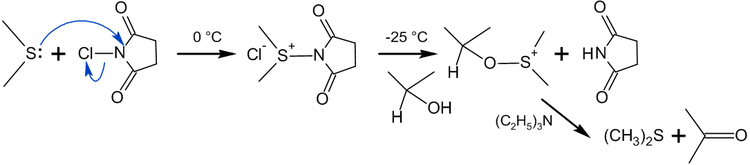
Для получения высококипящих альдегидов из соответствующих первичных спиртов в качестве окислителя используют трет-бутиловый эфир хроматных кислоты:
При окислении трет-бутилхроматом ненасыщенных спиртов (в апротонных неполярных растворителях) кратные связи не занимаются, и ненасыщенные альдегиды образуются с высокими выходами.
Достаточно селективным является метод окисления, в котором используют диоксид марганца в органическом растворителе, пентан или хлористый метилен. Например, алил- и бензил- спирты таким образом можно окислять в соответствующие альдегиды. Выходные спирты мало растворимые в неполярных растворителях, а альдегиды, которые образуются в результате окисления, значительно лучше растворимые в пентан или хлористый метилен. Поэтому карбонильные соединения переходят в слой растворителя и таким образом можно предотвратить контакт с окислителем и дальнейшем окислению:
Проводить окисление вторичных спиртов в кетоны значительно проще, чем первичных спиртов в альдегиды. Выходы здесь выше, так как, во-первых, реакционная способность вторичных спиртов выше, чем первичных, а во-вторых, кетоны, которые образуются значительно более стойки к действию окислителей чем альдегиды.
Получение кетонов
Общим методом является окисление оксидом хрома ($VI$) в воде или разведенной уксусной кислоте. Хромовый ангидрид в ацетоне и дихроматы пиридиния можно использовать для окисления ненасыщенных вторичных спиртов, не нарушая двойных и тройных связей:
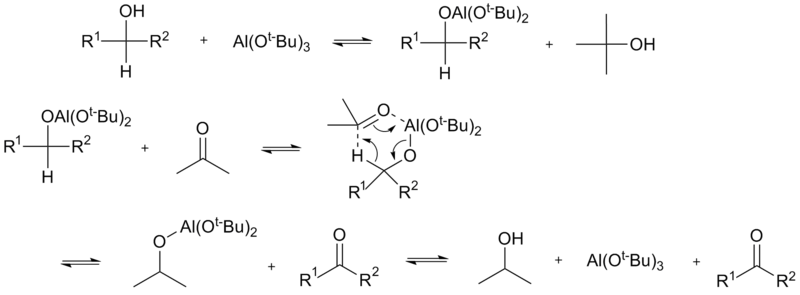
Вторичные спирты сложного строения, содержащие чувствительные к действию окислителей группы, можно с хорошими выходами окиснюваты в соответствующие кетонов, используя метод Оппенауера. В системе, содержащей вторичный спирт и кетоны (как правило ацетон) в присутствии алкоголятов алюминия устанавливается равновесие:
Химические свойства спиртов
Химические свойства спиртов — это химические реакции спиртов во взаимодействии с другими веществами.
Они определяются в основном наличием гидроксильной группы и строением углеводородной цепи, а также их взаимным влиянием:
Все химические реакции спиртов можно разделить на три условные группы, связанные с определёнными реакционными центрами и химическими связями:
Содержание
Реакции с участием гидроксильной группы (связи С−O и О−H)
Кислотно-основные реакции спиртов
Со щелочными и щелочноземельными металлами, алюминием, галлием, таллием и некоторыми другими металлами, а также сильными основаниями (например: амидами или гидридами) спирты способны реагировать с образованием алкоголятов [1] :


С сильными кислотами Льюиса спирты ведут себя подобно основаниям, образуя донорно-акцепторные комплексы [2] :

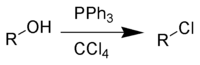
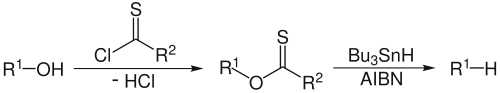
Превращение спиртов в галогеналканы
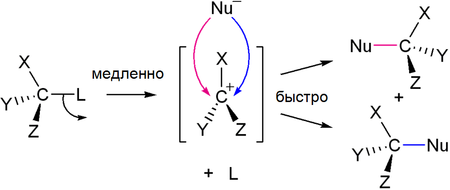
Одной из наиболее важных реакций с участием связи C−O является превращение спиртов в галогеноалканы. Гидроксильная группа в спиртах может быть замещена на атом галогена несколькими способами [2] :
Взаимодействие спиртов с галогенводородами
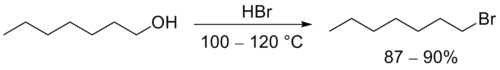
Взаимодействие спиртов с галогенводородными кислотами приводит к замещению гидроксильной группы на галоген:
В зависимости от строения субстрата возможны побочные процессы изомеризации и дегидратации. Из-за относительно жестких условий проведения данные реакции применимы только к соединениям, устойчивым к кислотам.
Незамещенные первичные спирты превращаются в алкилбромиды с помощью горячей концентрированной бромоводородной кислоты [4] :
Прямое взаимодействие спиртов с фтороводородом возможно только при использовании третичных, аллиловых и бензиловых спиртов. Так, например, реакция трет-бутилового спирта c 60 % водным раствором HF при нагревании приводит к образованию трет-бутилфторида [9] :
Вместо чистой HF для фторирования обычно используют 70 % раствор фтороводорода в пиридине, так называемый реактив Олаха.
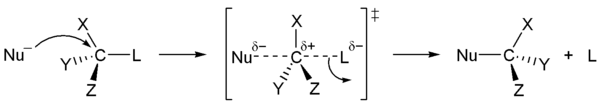
Первичные и вторичные спирты реагируют с галогенводородами по механизму SN2 (общая схема):
Для третичных спиртов характерен механизм SN1:
В ходе такого замещения образуется промежуточный карбокатион, поэтому SN1 реакции могут сопровождаться перегруппировками и элиминированием. Таким образом, практический интерес представляют только те третичные спирты, которые дают карбокатион, не способный к перегруппировкам.
Взаимодействие спиртов с галогенидами фосфора
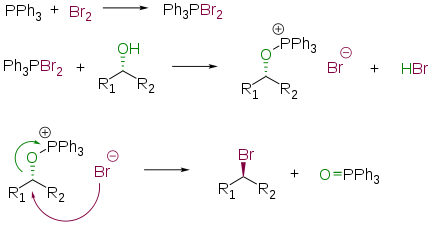
Распространённым способом превращения спиртов в алкилгалогениды является их взаимодействие с галогенидами фосфора: нуклеофильному механизму с образованием галогенфосфита в качестве интермедиата [10] :[стр. 142—143] :
Для повышения выхода конечного продукта и уменьшения доли побочных реакций замещение ведут в присутствии пиридина.
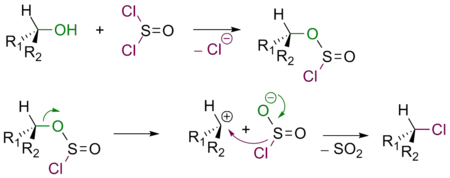
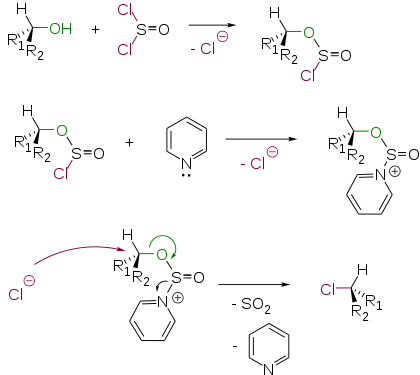
Взаимодействие спиртов с тионилхлоридом
В зависимости от условий взаимодействие спиртов с SOCl2 протекает либо по механизму SNi, либо по механизму SN2. В обоих случаях спирт превращается в соответствующий алкилхлорид.
Если реакция проходит в отсутствие пиридина, продукт имеет такую же конфигурацию реакционного центра, что и исходный спирт (механизм SNi):
Добавление пиридина в реакционную смесь приводит к изменению стереохимического результата процесса. Полученный алкилхлорид имеет обращенную конфигурацию. Этот факт можно объяснить следующим механизмом SN2 [4] :
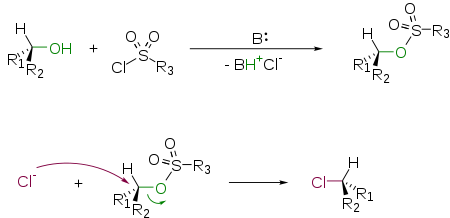
Взаимодействие спиртов с хлорангидридами сульфокислот и последующим замещением
Сульфонаты являются прекрасными уходящими группами и легко замещаются на атом галогена по механизму SN2:
Взаимодействие спиртов с квазифосфониевыми солями
Частный случай взаимодействия — превращение спиртов в алкилхлориды под действием трифенилфосфина и тетрахлорметана — в заграничной литературе получил название реакции Аппеля (англ. Appel reaction ) [13] [14] :
Прочие методы замещения гидроксильной группы на галоген
Приведём примеры некоторых дополнительных агентов, позволяющих провести замещение гидроксильной группы на галоген.
Превращение спиртов в эфиры неорганических кислот
Получение нитратов и нитритов
Этерификацией спиртов концентрированной азотной кислотой получают органические нитраты [22] :
Используя нитрозирующие агенты (NaNO2+H2SO4; NOCl; NOBF4 и пр.) по аналогии можно получить эфиры азотистой кислоты [23] :
Получение сульфитов и сульфатов
Серная кислота способна давать при взаимодействии со спиртами при низких температурах кислые и средние эфиры (алкилсульфаты):

Взаимодействием спиртов с тионилхлоридом или диоксидом серы (в присутствии иода или брома) в пиридине можно получить органические сульфиты [27] :
Получение гипогалогенитов
Стандартным способом получения органических гипохлоритов из спиртов является действие на последние раствора гипохлорита натрия при охлаждении и отсутствии прямого солнечного света [15] :[стр. 62—63] :
Похожим способом можно получить из первичных спиртов гипобромиты, при этом для этанола наблюдается очень высокий выход (92 %) [28] :
Отметим, что в этанол при взаимодействии с гипогалогенитами в других условиях окисляется с образованием хлороформа, бромоформа или иодоформа (галоформная реакция) [29] :


Получение прочих эфиров неорганических кислот
Реакцией спиртов с некоторыми неорганическими кислотами, их ангидридами или галогенангидридами можно получить различные эфиры:
Превращение спиртов в простые эфиры
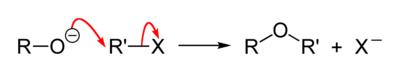
Взаимодействие алкоголятов с алкилгалогенидами или алкилсульфонатами (Реакция Вильямсона)
В отличие от спиртов, являющихся слабыми нуклеофилами, алкоголяты, образующие алкоксид-ионы RO − — сильные нуклеофилы и легко реагируют с алкилгалогенидами по механизму SN2 с образованием простых эфиров [34] :
Побочными продуктами реакции являются алкены, образующиеся в результате конкурирующего процесса элиминирования спирта [34] :
Межмолекулярная и внутримолекулярная дегидратация спиртов
При осторожном нагревании в присутствии серной кислоты происходит межмолекулярная дегидратация спиртов с образованием простых эфиров [36] :
Если в реакцию с кислотой вступают двухатомные спирты, будет протекать реакция внутримолекулярной дегидратации с образованием гетероциклических соединений. Так например, 1,4-бутандиол образует тетрагидрофуран [36] :
Существуют и методы термокаталитической дегидратации спиртов. Например, первичные спирты в присутствии смешанного Ni−Al2O3−SiO2 катализатора и водорода при нагревании превращаются в простые эфиры [37] :
Прочие методы превращения спиртов в простые эфиры
Среди прочих методов превращения спиртов в простые эфиры [38] :
Превращение спиртов в сложные эфиры
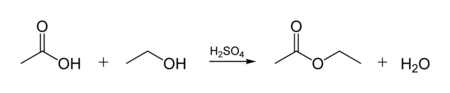
Кислотно-каталитическая реакция этерификации
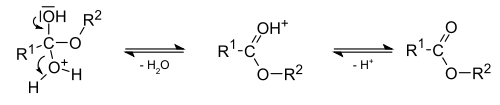
Спирты способны образовывать сложные эфиры в реакциях с органическими кислотами при нагревании в присутствии кислотного катализатора (как правило, концентрированной H2SO4). Этот процесс получил название кислотно-каталитической реакции этерификации (также известен как реакция Фишера). Например, взаимодействие этанола с уксусной кислотой дает этилацетат [3] :


Для пространственно затруднённых и склонных к элиминированию под действием кислот реагентов, например — трет-бутанола, существует метод мягкой этерификации, носящий имя этерификации Стеглиха (англ. Steglich Esterification ). Реакция между спиртом и кислотой происходит в присутствии дициклогексилкарбодиимида (ДЦК) и небольших количеств 4-N,N-диметиламинопирнидина. ДЦК и карбоновая кислота на первом этапе образует O-ацилизомочевинный интермедиат, который в дальнейшем вступает в реакцию со спиртом, образуя сложный эфир [41] :

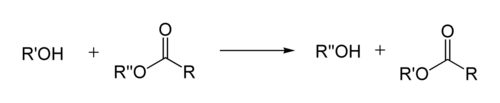
Реакция переэтерификации
Реакция переэтерификации или алкоголиза сложных эфиров имеет следующий общий вид:
Для успешного осуществления переэтерификации используются различные методы: отгонка низкокипящих продуктов, использование специальных катализаторов, в том числе межфазного переноса и др. Механизм реакции переэтерификации аналогичен механизму гидролизау эфиров, поэтому в качестве побочного процесса возможно алкильное расщепление [42] :[стр. 130—131] :
Взаимодействие спиртов с хлорангидридами, ангидридами кислот и нитрилами
С хлорангидридами карбоновых кислот спирты довольно легко вступают в реакцию, образуя сложные эфиры (реакция ацилирования) [25] :[стр. 20] :
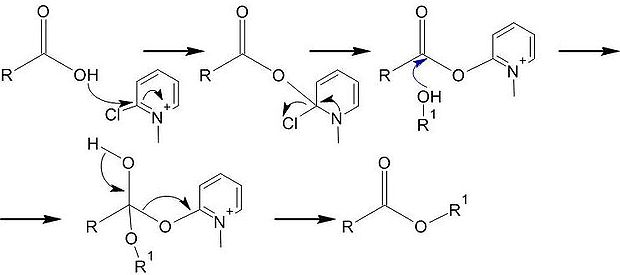
В 1898 году немецким химиком Айнхорном была предложена модификация этого метода: ацилирование проводится в избытке пиридина. Амин на первом этапе реагирует с хлорангидридом с образованием пиридиниевой соли, которая благодаря высокой ацилирующей способности под действием спирта легко трансформируется в эфир [45] :
Вместо ацилгалогенидов, для синтеза сложных эфиров может быть использована схожая реакция ангидридов карбоновых кислот со спиртами. В качестве катализаторов используют кислоты, кислоты и основания Льюиса, а также — пиридин и N-4,4-диметиламинопиридин [42] :[стр. 126] :
Другой путь получения эфиров: взаимодействие спиртов с нитрилами кислот в среде безводного хлороформа в присутствии газообразного хлороводорода приводит к иминоэфиру (реакция Пиннера), гидролизом которого можно получить сложный эфир [46] :

Этерификация Мукаямы
В 1975 году Мукаяма с сотрудниками предложил для достижения высоких выходов в реакции этерификации использовать специальный реагент — 2-хлор-1-метилпиридиния иодид [47] :
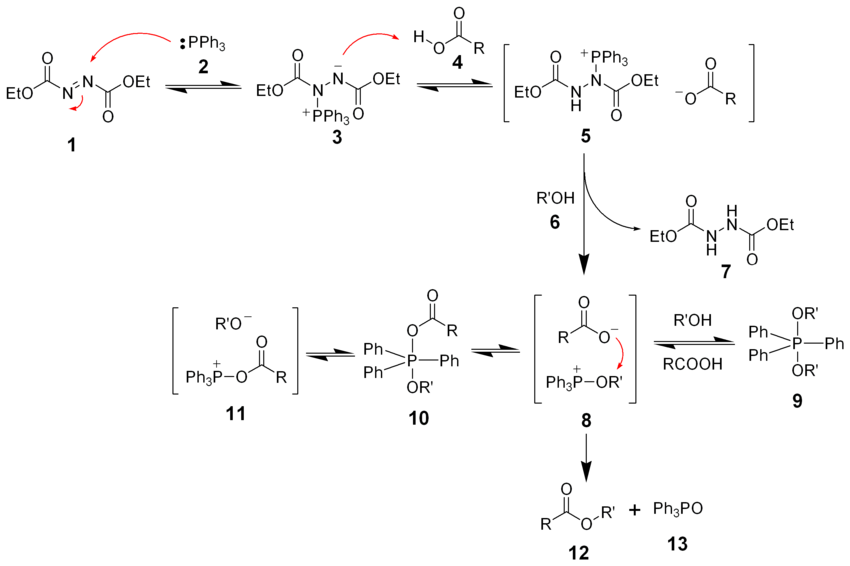
Реакция Мицунобу
Механизм реакции Мицунобу [49] [50] [51] :
Прочие реакции замещения гидроксильной группы
Хлорокарбонилирование спиртов
Фосген COCl2 — источник хлоркарбонильной группы −C(O)Cl — способен реагировать с различными нуклеофильными агентами и, в частности, со спиртами в соответствии с механизмом SN1 или ацильным механизмом замещения (тетраэдрический переходный интермедиат) [52] :[стр. 46] :
Аналогично фосгену, в реакцию хлорокарбонилирования со спиртами вступают и его производные: дифосген, трифосген, оксалилхлорид.
Замещение гидроксильной группы на амидную
Нуклеофильное замещение гидроксильной группы на амидную возможно только в случае её модификации: перевода в оксониевую форму (−O + H2) под действием сильных кислот или предварительно получая диалкиловые эфиры серной кислоты (R−OSO2O−R), с последующим их замещением:
Взаимодействие спиртов с аммиаком в присутствии катализаторов дегидрирования (медь, никель, кобальт на оксиде алюминия и пр.) осуществляется через механизм дегидрирования с последующим аминированием [55] :
Также в промышленности используют конденсацию некоторых аминов со спиртами. Например, анилин в жёстких условиях (170—280 °С, давление 10 МПа, катализаторы: минеральные кислоты, никель) реагирует со спиртами с образованием смеси моно- и дизамещённых производных [56] :
Третичные спирты, обладающие подвижной гидроксильной группой, реагируют с мочевиной, образуя N-алкилпроизводные [57] :[стр. 77] :
Замещение гидроксильной группы на меркаптогруппу
Замещение гидроксильной группы на меркаптогруппу (−SH) с образованием тиолов можно осуществить действием на спирты P4S10 или взаимодействием паров спирта с сероводородом в присутствии гетерогенного катализатора [58] :
Альтернативным методом получения органических производных сероводородной кислоты является взаимодействие спиртов с тиомочевиной в кислой среде с последующим гидролизом [59] [57] :[стр. 72] :
Замещение гидроксильной группы на нитрильную
Замещение гидроксильной группы на азидную
Спирты не вступают в прямое взаимодействие с неорганическими азидами, однако их нагревание с азидом дифенилфосфорила позволяет в одну стадию перейти к органическим азидам [61] :
Реакции элиминирования спиртов
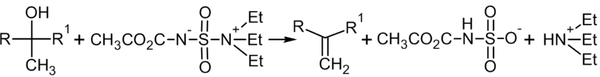
Кислотно-каталитическая дегидратация
В ненуклеофильной среде спирты, подвергаясь протонированию со стороны кислоты, элиминируются по механизму Е1. Механизм E2 для реакции дегидратации встречается редко [62] :[стр. 260—261] :


Расщепление спиртов практически во всех случаях происходит по правилу Зайцева, то есть атом водород элиминируется от наименее гидрогенизированного атома углерода.
Оригинальным методом дегидратации является обработка алкоголятов соответствующих спиртов бромоформом (элиминирование происходит через образование промежуточных карбониевых интермедиатов) [63] :
Термокаталитическая дегидратация
Реакция дегидратации осуществляется при высокой температуре, при этом в качестве побочных процессов наблюдается дегидрирование спиртов [65] [68] :

Недостатком термической дегидратации спиртов, как и каталитической дегидратации, является отсутствие контроля положения двойной связи, а также невозможность использования этого метола для соединений, содержащих различные термически неустойчивые функциональные группы.
Дегидратация с использованием специальных агентов
Дегидратация по Бургессу
Термолиз вторичных и третичных спиртов с метил N-(триэтилдаммонийсульфонил)карбаматом (реактив Бургесса) мягко и селективно приводит к алкенам [73] :
Дегидратация по Мартину
Наряду с реактивом Бургесса, для дегидратации спиртов используется ещё один органический реагент: сульфуран Мартина или дифенилбис(1,1,1,3,3,3-гексафторо-2-фенил-2-пропокси)сульфуран [74] :[стр. 811] :
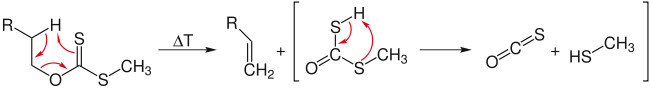
Элиминирование по Чугаеву
Реакция Чугаева — взаимодействие спиртов с CS2 и NaOH с последующим пиролизом образующегося ксантата [76] :

Продуктом реакции являются алкены, как правило, в цис-конфигурации. Главное преимущество метода — сведением к минимуму изомеризации и миграции кратной связи.
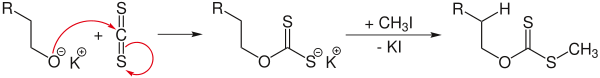
Строго говоря, элиминирование по Чугаеву аналогично получению алкенов пиролизом различных сложных эфиров. Подробнее см. статью Алкены.
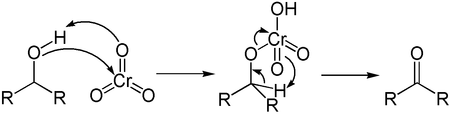
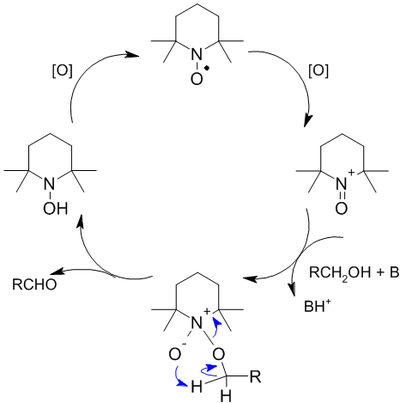
Реакции окисления спиртов
Первичные спирты в зависимости от выбора агента окисляются до альдегидов или карбоновых кислот, вторичные — до соответствующих кетонов и кислот. Третичные спирты устойчивы к окислению, однако под действием сильных окислителей могут быть расщеплены с разрывом углеродной цепи в различные карбонильные соединения.
Реакции окисления спиртов, иначе — превращения в карбонильные соединения, можно разделить на две условные группы [77] :[cтр. 114] :
[T 1] Таблица 12. Окисление первичных, вторичных и третичных спиртов до различных производных.