добавочная долька плаценты при беременности что это такое
Возможности эхографии в дородовой диагностике предлежания сосудов
УЗИ сканер HS60
Профессиональные диагностические инструменты. Оценка эластичности тканей, расширенные возможности 3D/4D/5D сканирования, классификатор BI-RADS, опции для экспертных кардиологических исследований.
Введение
Предлежание сосудов является одним из вариантов оболочечного прикрепления, при котором сосуды пуповины пересекают амниофетальные оболочки на более низком уровне, нежели расположена предлежащая часть плода. Эти незащищенные вартоновым студнем сосуды могут разорваться в любое время при беременности, привести к профузному кровотечению и антенатальной гибели плода. Кроме того, их повреждение возможно при выполнении амниотомии и при родоразрешении через естественные родовые пути, поэтому пренатальная диагностика предлежания сосудов имеет важное практическое значение.
Представляем первый отечественный случай пренатальной диагностики предлежания сосудов.
Материал и методы
Беременная П., 32 лет, в 11 недель беременности проходила скрининговое ультразвуковое исследование в женской консультации. Изменений ультразвуковой анатомии плода и плаценты не обнаружено. Настоящая беременность вторая, в анамнезе одни нормальные срочные роды, ребенок здоров. Мужу 35 лет, соматически здоров. Супруги производственных вредностей не имеют.
Ультразвуковое исследование в 24-25 недель беременности проведено на аппарате SonoAce-8000 (Medison, Южная Корея).
Результаты и обсуждение
При ультразвуковом исследовании в 24-25 недель беременности был обнаружен один живой плод. Показатели фетометрии полностью соответствовали сроку беременности. Врожденных пороков и эхографических маркеров хромосомных аномалий не выявлено, околоплодные воды в нормальном количестве.
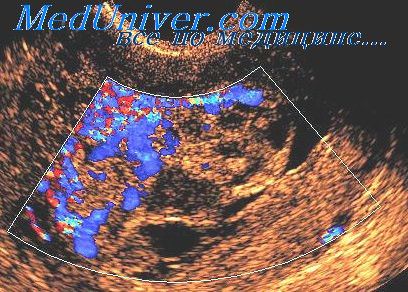
При ультразвуковой плацентографии на правой боковой стенке матки была обнаружена добавочная долька плаценты, основная плацента была расположена на задней стенке с переходом на правую боковую стенку матки. Учитывая достаточно низкое расположение плаценты было проведено тщательное изучение области внутреннего зева шейки матки для исключения предлежания сосудов, соединяющих добавочную дольку с основной плацентой. При сканировании в двухмерном режиме сосудов в области внутреннего зева шейки матки не обнаружено. Дополнительно было использовано цветовое допплеровское картирование (ЦДК), при котором идентифицированы сосудистые структуры (рис. 1).
Добавочная долька плаценты при беременности что это такое
К концу четвертого месяца беременности плацента приобретает свою окончательную форму и толщину, однако продолжает увеличиваться по площади и в третьем триместре. Вид плаценты и подлежащего миометрия при ультразвуковом исследовании, как уже описывалось выше, могут изменяться вследствие сокращений матки.
Также форма плаценты может меняться в зависимости от степени наполнения мочевого пузыря, особенно этот эффект бывает заметен во втором триместре беременности. Наполненный мочевой пузырь оказывает давление на миометрий нижнего сегмента передней стенки матки, прижимая его к задней стенке, что искусственно удлиняет шейку матки.
В связи с этим может оказаться необходимым повторение ультразвукового исследования после опорожнения мочевого пузыря, чтобы исключить диагноз предлежания плаценты.
В 8% случаев могут обнаруживаться добавочные дольки плаценты (placenta succenturata). Они представляют собой отдельно лежащие участки плацентарной ткани, которые соединяются с основной плацентой сосудами, проходящими между оболочками.
Весьма важным является установление диагноза добавочных долек плаценты до родов, поскольку при их наличии может возникнуть ряд осложнений. Добавочная долька может задержаться в полости матки, что приведет к возникновению кровотечения в послеродовом периоде. Кроме того, предлежание добавочной дольки или питающих ее сосудов, которые могут повреждаться, приводит к угрожающему кровотечению из плодовых сосудов.
Пленчатая плацента и плацента при заболеваниях
Из других аномалий развития плаценты клиническое значение имеет формирование аномально тонкой плаценты (пленчатой плаценты, placenta membranacea) и различных, связанных с этим состоянием вариантов ее формы, в частности кольцевидной плаценты. Оба вида данной патологии сопровождаются возникновением кровотечений во время беременности и после родов.
Они формируются в результате нарушения процессов регресса ворсин в области формирования гладкого хориона в первом триместре беременности, в связи с чем ворсинчатый хорион начинает покрывать большую или даже почти всю поверхность плодного яйца.
Диагноз пленчатой плаценты при ультразвуковом исследовании устанавливается в случае, если обнаруживается, что плацентарная ткань практически полностью покрывает внутреннюю поверхность полости матки.
Плацента способна терять до 30% своей площади, продолжая сохранять свою функцию по жизнеобеспечению плода. Однако сосудистые нарушения у матери могут вызывать в плаценте ответную реакцию на гипоксию, которая возникает в результате снижения маточно-плацентарного кровобращения.
Считается, что именно нарушение маточно-плацентарной циркуляции играет основную роль в формировании синдрома задержки внутриутробного развития плода (ЗВРП). До появления в акушерской практике допплерографических методов исследования не существовало неинвазивных методов исследования кровотока у беременных. По мере накопления данных стало очевидно, что допплерография является наиболее предпочтительным инструментальным методом, который обеспечивает получение полезной информации в отношении выявления и определения способов лечения в некоторых случаях ЗВРП.
Одними из постоянно регистрируемых нарушений при таких заболеваниях беременных, как резус-сенсибилизация, сахарный диабет, анемия и гестоз, являются изменения в размерах плаценты. Визуальной оценки бывает вполне достаточно, чтобы сделать вывод об Увеличении или уменьшении размеров плаценты.
При возникновении гемолитической болезни плода плацента может значительно увеличиваться. Это является следствием как отека ворсин, так и процессов гиперплазии ворсин. Выраженность отека ворсин может варьировать в различных областях в пределах одной и той же плаценты. При эхографическом обследовании в этих случаях будет выявляться увеличенная плацента, структура которой будет аналогична нормальной.
Нередко могут обнаруживаться кисты перегородок, которые формируются в связи с механической обструкцией путей венозного оттока от области перегородки отечными ворсинами.
При сахарном диабете у матери плацента также часто увеличивается за счет отека, а в ее структуре нередко визуализируются кисты перегородок. У пациенток с тяжелыми формами анемии отмечается тенденция к увеличению плаценты, однако в этих случаях ее морфологическая структура сохраняется нормальной.
У беременных, страдающих гестозом, имеется тенденция к незначительному уменьшению размеров плаценты без изменения морфологического строения. У таких пациенток отмечается высокая частота выявления инфарктов плаценты, которая варьирует от 33% при средней до 60% при тяжелой степени выраженности гестоза. Кроме того, при гестозе повышается частота возникновения ретроплацентарных гематом, которые, несомненно, вносят свой вклад в увеличение частоты случаев инфарктов плаценты у этих больных. Маленькие размеры плаценты также обнаруживаются при хромосомных аномалиях плода, тяжелых формах сахарного диабета у матери и при хронической инфекции.
Плацента и ее роль в развитии беременности
УЗИ аппарат HS40
Лидер продаж в высоком классе. Монитор 21,5″ высокой четкости, расширенный кардио пакет (Strain+, Stress Echo), экспертные возможности для 3D УЗИ в акушерско-гинекологической практике (STIC, Crystal Vue, 5D Follicle), датчики высокой плотности.
С самого начала беременности и вплоть до ее окончания формируется и функционирует система мать-плацента-плод. Важнейшим компонентом этой системы является плацента, которая представляет собой комплексный орган, в формировании которого принимают участие производные трофобласта и эмбриобласта, а также децидуальная ткань. Функция плаценты, в первую очередь, направлена на обеспечение достаточных условий для физиологического течения беременности и нормального развития плода. К этим функциям относятся: дыхательная, питательная, выделительная, защитная, эндокринная. Все метаболические, гормональные, иммунные процессы во время беременности обеспечиваются через сосудистую систему матери и плода. Несмотря на то, что кровь матери и плода не смешивается, так как их разделяет плацентарный барьер, все необходимые питательные вещества и кислород плод получает из крови матери. Основным структурным компонентом плаценты является ворсинчатое дерево.
При нормальном развитии беременности имеется зависимость между ростом плода, его массой тела и размерами, толщиной, массой плаценты. До 16 недель беременности развитие плаценты опережает темпы роста плода. В случае смерти эмбриона (плода) происходит торможение роста и развития ворсин хориона и прогрессирование инволюционно-дистрофических процессов в плаценте. Достигнув необходимой зрелости в 38-40 недель беременности, в плаценте прекращаются процессы образования новых сосудов и ворсин.
Схема структуры плаценты и маточно плацентарного кровообращения
Межворсинчатое пространство с плодовой стороны образовано хориальной пластиной и прикрепленными к ней ворсинами, а с материнской стороны оно ограничено базальной пластиной, децидуальной оболочкой и отходящими от неё перегородками (септами). Большинство ворсин плаценты свободно погружены в межворсинчатое пространство и омываются материнской кровью. Различают также и якорные ворсины, которые фиксируются к базальной децидуальной оболочке и обеспечивают прикрепление плаценты к стенке матки.
Схема циркуляции крови в организме плода
Спиральные артерии, которые являются конечными ветвями маточной и яичниковой артерий, питающих беременную матку, открываются в межворсинчатое пространство 120-150 устьями, обеспечивая постоянный приток материнской крови, богатой кислородом, в межворсинчатое пространство. За счет разницы давления, которое выше в материнском артериальном русле по сравнению с межворсинчатым пространством, кровь, насыщенная кислородом, из устьев спиральных артерий направляется через центр котиледона к ворсинам, омывает их, достигает хориальной пластины и по разделительным септам возвращается в материнский кровоток через венозные устья. При этом кровоток матери и плода отделены друг от друга. Т.е. кровь матери и плода не смешивается между собой.
Переход газов крови, питательных веществ, продуктов метаболизма и других субстанций из материнской крови в плодовую и обратно осуществляется в момент контакта ворсин с кровью матери через плацентарный барьер. Он образован наружным эпителиальным слоем ворсины, стромой ворсины и стенкой кровеносного капилляра, расположенного внутри каждой ворсины. По этому капилляру течет кровь плода. Насыщаясь таким образом кислородом, кровь плода из капилляров ворсин собирается в более крупные сосуды, которые в конечном итоге объединяются в вену пуповины, по которой насыщенная кислородом кровь оттекает к плоду. Отдав кислород и питательные вещества в организме плода, кровь, обедненная кислородом и богатая углекислым газом, оттекает от плода по двум артериям пуповины к плаценте, где эти сосуды делятся радиально в соответствии с количеством котиледонов. В результате дальнейшего ветвления сосудов внутри котиледонов кровь плода вновь попадает в капилляры ворсин и вновь насыщается кислородом, и цикл повторяется. За счет перехода через плацентарный барьер газов крови и питательных веществ реализуется дыхательная, питательная и выделительная функция плаценты. При этом в кровоток плода попадает кислород и выводится углекислый газ и другие продукты метаболизма плода. Одновременно в сторону плода осуществляется транспорт белков, липидов, углеводов, микроэлементов, витаминов, ферментов и многого другого.
Схема строения плацентарного барьера
Плацента анатомически и функционально связана с амнионом (водная оболочка), который окружает плод. Амнион представляет собой тонкую мембрану, которая выстилает поверхность плаценты, обращенной к плоду, переходит на пуповину и сливается с кожей плода в области пупочного кольца. Амнион активно участвует в обмене околоплодных вод, в ряде обменных процессов, а также выполняет и защитную функцию.
Плаценту и плод соединяет пуповина, которая представляет собой шнуровидное образование. Пуповина содержит две артерии и одну вену. По двум артериям пуповины течет обедненная кислородом кровь от плода к плаценте. По вене пуповины к плоду течет кровь, обогащенная кислородом. Сосуды пуповины окружены студенистым веществом, которое получило название «вартонов студень». Эта субстанция обеспечивает упругость пуповины, защищает сосуды и обеспечивает питание сосудистой стенки. Пуповина может прикрепляться (чаще всего) в центре плаценты и реже сбоку пуповины или к оболочкам. Длина пуповины при доношенной беременности в среднем составляет около 50 см.
Плацента, плодные оболочки и пуповина вместе образуют послед, который изгоняется из матки после рождения ребенка.
УЗИ аппарат HS40
Лидер продаж в высоком классе. Монитор 21,5″ высокой четкости, расширенный кардио пакет (Strain+, Stress Echo), экспертные возможности для 3D УЗИ в акушерско-гинекологической практике (STIC, Crystal Vue, 5D Follicle), датчики высокой плотности.
Мезенхимальная дисплазия плаценты. Возможности пренатальной диагностики (клинические наблюдения)
УЗИ сканер HS50
Доступная эффективность. Универсальный ультразвуковой сканер, компактный дизайн и инновационные возможности.
Некоторые случаи МДП обусловлены триплоидией, хотя в большинстве зарегистрированных случаев плоды имели нормальный женский кариотип 46,ХХ. На сегодняшний день из описанных в литературе случаев соотношение женского и мужского кариотипа плодов составляет 3,6: 1 [2].
Также в качестве патогенетического механизма формирования МДП рассматриваются гипоксия и гипоперфузии различной этиологии. Считается, что во время гипоксии происходит стимуляция фибробластов, что ведет к увеличению массы соединительной ткани с последующим увеличением производства сосудистого эндотелиального фактора роста (VEGFs), ведущего к ангиогенезу.
По данным ряда авторов, данная патология плаценты часто сочетается с пороками развития плода и имеет неблагоприятный исход. Клиническими проявлениями МДП могут быть задержка внутриутробного роста плода, антенатальная гибель, некоторые хромосомные аномалии, синдром Беквита-Видемана, транзиторный неонатальный сахарный диабет, отцовская однородительская дисомия 6, трисомия 13 и синдром Клайнфелтера 6.
В 23% случаев МДП сочетается с синдромом Беквита-Видемана. В большинстве случаев данный синдром возникает спорадически и имеет аутосомно-доминантный тип наследования. Предполагается, что данное заболевание может возникать вследствие перестроек, вовлекающих участок короткого плеча хромосомы 11 р15. Выявление макросомии, омфалоцеле и макроглоссии в сочетании с нормальным кариотипом позволяет диагностировать синдром Беквита-Видемана. С различной частотой обнаруживаются нефромегалия, гепатомегалия, многоводие, складки мочек уха, диафрагмальная грыжа и пороки сердца [5, 6]. Гиперплазия клеток поджелудочной железы встречается в 30-50% случаев, вызывает повышение уровня инсулина и неонатальную гипогликемию, манифестирующую на 2-й или 3-й день жизни [7].
МДП не имеет специфических клинических проявлений. В большинстве случаев в начале беременности диагностируется при ультразвуковом исследовании (УЗИ) в скрининговые сроки и первично обозначается как частичный пузырный занос, в отличие от которого большинство плодов имеют нормальный кариотип, уровень β-ХГЧ на протяжении всей беременности несколько повышен или остается в пределах нормы, уровень α-фетопротеина повышен [8].
Многие случаи протекают бессимптомно и диагностируются после родов на основании морфологического исследования гиперплазированной плаценты. Макроскопически плацента с МДП представляет собой увеличенную по объему и массе плаценту с чередованием кистозных структур и нормальной паренхимы. Кистозные структуры представляют собой кистозные расширения вен стволовых ворсин. Иногда возникают тромбозы и аневризмы, расширение стволовых сосудов ворсин. Сосуды на плодовой части плаценты извиты и расширены. Гистологически для МДП характерны увеличенные отечные стволовые ворсины с расширенными сосудами и отсутствием трофобластической пролиферации. Сосуды толстостенные, с фибромускулярной гиперплазией. Терминальные ворсины, как правило, нормальные. В отличие от пузырного заноса ворсины обычно хорошо васкуляризированы и не имеют признаков пролиферации трофобласта [4, 7].
Приводим 4 законченных наблюдения беременности при МДП.
Клиническое наблюдение 1
Добавочная долька плаценты при беременности что это такое
Многообразие функций плаценты связано с ее структурой на этапах имплантации, плацентации (12 нед), фетализации (II триместр беременности) [1]. В формировании хориона различают 3 периода: предворсинчатый (7—12-й день развития эмбриона); период образования ворсин (13—50-й день внутриутробного периода); период образования котиледонов (50—90-й день эмбриогенеза). Плацентация начинается с 3-й недели развития эмбриона, характеризуется развитием сосудов в ворсинах, проникновением трофобласта в спонгиозный слой эндометрия, вскрытием спиральных артерий, формированием межворсинчатого пространства. С 8-й недели образуются структурные единицы плаценты — котиледоны. Процессы плацентации охватывают 6—18 нед гестации. При физиологическом течении беременности спиральные артерии подвергаются значительным морфологическим изменениям: их эндотелий, внутренняя эластическая мембрана и гладкомышечные клетки замещаются клетками трофобласта.
Плацента формируется из базальной части децидуальной оболочки и разросшихся ворсин ветвистого хориона. Большинство ворсин «плавают» в крови матери, циркулирующей в межворсинчатом пространстве. Поверхность ворсин покрыта синцитиотрофобластом, поверхность которого имеет микроворсинки для резорбции. Цитотрофобласт образует сплошной слой в первой половине беременности, во второй половине беременности ворсины утрачивают цитотрофобласт.
Материнская часть плаценты представляет собой утолщенную часть децидуальной оболочки. В ней образуются углубления, в которых циркулирует материнская кровь и в которые погружаются ворсины. Между углублениями образуются выступы (перегородки), в которых проходят спиральные маточные артерии и к которым прикрепляются якорные ворсины. Клиническая картина многих осложнений беременности, развивающихся во II—III триместрах беременности, часто служит проявлением патологического процесса, сформировавшегося еще в период плацентации.
В современной литературе относительно возможностей оценки структуры и функции плаценты существуют совершенно полярные точки зрения — от традиционной приверженности к оценке ее структуры до полного отрицания данной оценки. В разные годы проводились попытки при помощи структуры плаценты уточнить степень зрелости внутриутробного плода, выявить течение внутриутробной инфекции. Большинство из предложенных критериев имеет ограниченное значение в диагностике антенатальной патологии и может быть интерпретировано только в совокупности данных, полученных при УЗИ. Во многих ситуациях выявляемые при эхографии нарушения структуры плаценты бесспорны и играют важную роль в оценке и прогнозировании течения гестации.
Аномалии локализации. Низкое расположение плаценты: край плаценты определяется менее чем на 6 см от уровня внутреннего зева во II и III триместрах беременности. Предлежание плаценты определяют в случае, если ткань плаценты перекрывает внутренний зев шейки матки. Виды предлежания: полное, частичное, краевое [2, 3].
Особенности структуры. Старение плаценты — инволютивно-дистрофические процессы, которые происходят с увеличением срока беременности, имеют эхографические признаки. По классификации P. Grannum, при неосложненном течении беременности плацента последовательно проходит степени созревания от 0 до III. Степень обнаруживается в сроке до 30 нед; I степень в 27—36 нед; II степень в 34—39 нед; III степень после 36 нед. Ультразвуковые признаки преждевременного созревания плаценты: обнаружение II степени до 32 нед; III — до 36 нед (цит. по [4]). Если нет задержки роста и нарушений гемодинамики плода, кальциноз плаценты следует рассматривать как фактор риска снижения функциональной активности плаценты.
Приращение (врастание) плаценты. По данным литературы [5—10], placenta creta является редкой формой плацентарных аномалий — около 15% случаев среди всех наблюдений приросшей плаценты. Заболеваемость возросла в 10 раз за последние 50 лет, что отражает быстро растущее число кесаревых сечений. Врастание плаценты является результатом частичного или полного отсутствия губчатого слоя децидуальной оболочки вследствие атрофических процессов в эндометрии. Различают три варианта инвазии плаценты: pl. accreta, pl. increta, pl. percreta. Эта классификация условная, поэтому в настоящее время рекомендуют употреблять термин creta [11].
Ультразвуковые признаки аномального прикрепления плаценты: расположение плаценты в зоне рубца на матке; истончение или отсутствие миометрия на отдельных участках в зоне расположения плаценты; лакуны в структуре, диффузное утолщение плаценты; диффузный или локальный интраплацентарно-лакунарный кровоток с высокоскоростным турбулентным потоком венозного типа; типичный хориальный кровоток в атипичном месте; патологическое сосудистое соединение плаценты с мочевым пузырем с низкорезистентным артериальным плацентарным кровотоком; расширение периферических субплацентарных васкулярных каналов с венозным пульсационным потоком над шейкой матки [5—10].
Ретрохориальные гематомы, отслойки плаценты. Отслойка плаценты возникает вследствие нарушения ее прикрепления к стенке матки, что приводит к кровотечению из сосудов децидуальной оболочки.
Частота преждевременной отслойки нормально расположенной плаценты (ПОНРП) колеблется от 20,0 до 45,1% [12—14].
Среди причин ПОНРП называют гипертоническую дисфункцию миометрия [15], гипертоническую болезнь, травмы живота, курение, отслойки и субхориальные гематомы в анамнезе [16—18]; восходящий амниохорионит, многократные аборты, привычное невынашивание, преэклампсию, аутоиммунные заболевания [13, 19], а также аденомиоз плацентарного ложа и хронический эндометрит [15].
Современная гипотеза ПОНРП [16, 17] предполагает участие в отслойке в условиях дефицита протеина C и протромбина гемореологических и генетических факторов в сочетании с доминированием генетических дефектов гемостаза — мутации фактора V Лейдена. Утверждают, что первичные гемореологические нарушения в плаценте обусловлены структурными изменениями микроворсинок или щеточной каемки синцитиотрофобласта (СЦТБ), с нарушением их целостности, высоты и регулярности распределения на поверхности клеток в условиях нарушенного гемостаза [20]. Деструкция микроворсин сочетается с недостаточностью первой, второй волны инвазии цитотрофобласта и децидуализации, а также склерозом базального эндометрия, возникающего в исходе эндометрита [20, 21]. Развившийся дисбаланс между гиперкоагуляционными возможностями материнской крови и противосвертывающей системой микроворсинок сопровождается нарушениями маточного и плацентарного кровообращения. Изменения гемостаза — причина и следствие ПОНРП. В развитии ПОНРП большое значение придают антифосфолипидному синдрому (АФС), генетическим дефектам гемостаза (мутация фактора V Лейдена, дефицит ангиотензина-II, дефицит протеина C и пр.), предрасполагающим к тромбозам. Тромбофилия, развивающаяся вследствие этих нарушений, препятствует полноценной инвазии трофобласта, способствуя дефектам плацентации, ПОНРП [20].
Выявлено 4 взаимосвязанных механизма развития ПОНРП. Первые 2 предусматривают расстройства гемодинамики в маточно-плацентарной области в период нидации, имплантации и плацентации, сочетающиеся с нарушением инвазии цитотрофобласта и, следовательно, незавершенным ремоделированием спиральных артерий. Последующие механизмы ПОНРП включают нарушение целостности СЦТБ ворсин с локальным снижением активности антикоагуляционных механизмов, а также приобретенные и врожденные тромбофилии. Указанные механизмы приводят к морфологическим нарушениям в последе и нарушениям кровообращения в межворсинчатом пространстве [22].
В ранние сроки беременности при отслойке амниотических оболочек прогноз более благоприятный, чем при отслойке ворсистого хориона. Если площадь отслойки плодного яйца занимает менее ¼ площади — прогноз благоприятный; при гематомах, отслаивающих 1/3 площади хориона и более, может наступить внутриутробная гибель эмбриона [23].
Типы отслойки плаценты. По отношению к амниотическим оболочкам:
— ретроплацентарный — между плацентой и миометрием;
— субхориальный — между плацентой и амниотической оболочкой (не имеет клинической симптоматики).
По месту формирования гематомы:
— центральная отслойка плаценты;
— краевая отслойка, чаще встречается при низком расположении, предлежании плаценты;
— субамниотические гематомы, которые формируются вследствие разрыва хориальных сосудов около корня пуповины.
Утолщение плаценты чаще всего происходит при иммунных конфликтах, инфекционных процессах, сахарном диабете, тромбофилических состояниях.
Расширение межворсинчатого пространства — один из самых частых ультразвуковых симптомов при структурных изменениях плаценты. При УЗИ выявляются множественные гипоэхогенные включения в плаценте различной локализации, неправильной формы, с ламинарным током крови в них. Расширение межворсинчатого пространства может быть проявлением патологии свертывающей системы крови, плацентарной недостаточности [22].
Добавочная доля плаценты (placenta bilobata). Диагностируется на основании выявления участков плацентарной ткани, между которыми имеется свободная зона. В послеродовом периоде может осложниться отрывом добавочной дольки, ее задержкой в полости матки и послеродовым кровотечением [23].
Кольцевидная плацента (placenta membranacea). Развивается вследствие нарушения дифференциации на ворсинчатый и гладкий хорион. Характеризуется большой площадью прикрепления, в том числе в области внутреннего зева, притом ее толщина даже в конце беременности не превышает 10 мм. Может сочетаться с патологическим прикреплением, задержкой роста плода (ЗРП), преждевременными родами, антенатальной гибелью плода [24].
Плацента, окруженная валиком (placenta circumvallata). Относится к экстрахориальному типу плацентации, при котором плодовый край плаценты поднят, завернут, а амниальные оболочки отходят не от края плаценты, а от ее внутренней (материнской) поверхности. При эхографии чаще всего визуализируется перетяжка между полюсами плаценты, так называемая плацентарная полка, состоящая из амниальных оболочек. Данный ультразвуковой признак визуализируется во II триместре и не визуализируется в III триместре беременности. Оптимальный срок для выявления — 13—14 нед, первое скрининговое УЗИ. При данной патологии несколько чаще встречаются ЗРП, гипоксия плода, дородовое излитие околоплодных вод, преждевременные роды, кровотечение в родах [25].
Субамниотические кисты плаценты. Анэхогенные однокамерные образования над плодовой поверхностью плаценты. Размеры от 5 до 7—8 см, чаще всего являются следствием субамниотических гематом, возникающих в конце I или начале II триместра.
Хорионангиома плаценты. Доброкачественная опухоль плаценты, размеры которой могут варьировать от нескольких миллиметров до 7—8 см, как правило, одиночная, но может быть представлена несколькими мелкими узлами. Обычно она располагается на плодовой поверхности плаценты.
При УЗИ представляет собой образование с четкими контурами, неоднородной эхоструктурой с кистозным и солидным компонентом. Иногда хорионангиомы бывают гомогенными с множественными перегородками или пониженной эхогенности с неоднородной структурой. В ряде случаев хорионангиома имеет эхографическое сходство с миоматозными узлами, гематомами в стадии организации, липомой плаценты. При цветовом допплеровском картировании (ЦДК) внутри опухоли визуализируются сосуды разного калибра. Осложнения хорионангиомы зависят от ее размеров [26].
Пузырный занос — это перерождение ворсин хориона в пузырьки с жидкостью, разрастание эпителия ворсин, особенно синцития.
Полный пузырный занос (ППЗ) — генетически обусловленное тотальное поражение трофобласта, хромосомный набор чаще диплоидный, 46ХХ, обе хромосомы — отцовские. В 3—13% встречается комбинация 46ХУ, где все хромосомы — отцовские. ППЗ характеризуется отсутствием признаков зародышевого и эмбрионального развития. Злокачественная трансформация возникает в 20% наблюдений, при 46ХУ чаще развивается метастатическая опухоль.
Неполный пузырный занос — частичное перерождение плаценты, при котором эмбрион продолжает развиваться, всегда триплоидный, с 1 материнской хромосомой (чаще — 69ХХУ, 69ХХХ, реже — 69ХУУ), имеются фрагменты нормальной плаценты и плода [27]. Эхографические критерии полного пузырного заноса: увеличение размеров матки, несоответствие сроку беременности, эмбриона и его частей в полости матки нет, содержимое полости — бесформенные гиперэхогенные структуры с множеством кистозных образований, граница опухоли и миометрия отчетливая, ровная, возможна визуализация расширенных сосудов миометрия.
Мезенхимальная дисплазия плаценты (МДП) — редкое нарушение, связанное с необычной аномалией стволовых ворсинок плаценты, характеризуется плацентомегалией, кистозной дилатацией и образованием везикул, сосудистыми аномалиями [28].
Ультразвуковая картина МДП достаточно характерна и заключается в диффузном утолщении плаценты, множественных кистозных полостях, занимающих часть плаценты или всю ее площадь. Кистозные полости при МДП имеют существенные отличия от частичного пузырного заноса: размеры кист позволяют дифференцировать их в виде отдельных округлых анэхогенных структур с ровными четкими контурами, гладкой внутренней поверхностью. Архитектоника сосудистой сети не нарушена, топография плацентарных сосудов соответствует строению нормальной сосудистой сети плаценты. Извитые, расширенные сосуды стволовых ворсин могут четко определяться при ЦДК.
Вирусные инфекции. Изучение плаценты при вирусной инфекции проводится уже несколько десятилетий. Впервые еще в 1965 г. [29] отмечен ряд изменений морфологической картины плаценты при ее инфицировании вирусами простого герпеса: неровные контуры ядра с неравномерно распределенным хроматином; крупные, гиперхромные, бесструктурные ядра, цитоплазма амниоцитов оксифильная либо слегка базофильная, ацидофильный некроз значительных участков амниона, отечность стромы [30, 31]. В хориальной пластинке и ворсинчатой строме обнаруживаются группы клеток с гиперхромными ядрами, скопления лимфоидных клеток [31]. Поражение сосудов ворсинчатого хориона разного калибра проявляется отеком, утолщением стенок, очаговыми или диффузными инфильтратами стенок, сужением или даже облитерацией сосудов. В межворсинчатом пространстве — небольшие скопления лимфоидных клеток и плазмоцитов, отложения фибрина и реже кровоизлияния. В части ворсин обнаруживались мелкие пылевидные или более крупные глыбки кальция. Характерно также наличие кальциноза, фиброза, образования кист. В оболочках плаценты изменения были такого же рода. Они характеризовались прогрессирующим поражением плаценты с наличием в инфильтратах плазмоцитов, периваскулярным или диффузным фиброзом стромы ворсин. В сосудах отмечался тромбоз с облитерацией просветов и кальцинозом. Число капилляров в ворсинах резко снижено. При герпесе в ткани плаценты возникают характерные структурные изменения всех слоев с поражением как эпителиальных структур, так и сосудистого русла [31, 32].
При УЗИ плаценты при инфекционных заболеваниях картина неспецифична: в структуре плаценты определяются мелкие расширения межворсинчатых пространств, утолщение плаценты, преждевременное старение и кальциноз [32].
Вирусный гепатит. Среди всех известных нозологических форм наиболее актуальными являются гепатиты В и С [33]. В литературе описаны следующие морфологические изменения в плаценте: гипоплазия плаценты — в 24% наблюдений, нарушение созревания ворсин — в 32%, диссоциированное созревание, инфаркты, псевдоинфаркты — в 30%, аномалии развития сосудов пуповины — в 8%, плацентит — в 17%, хориоамнионит — в 52% [28]. Ультразвуковые признаки также неспецифичны и характерны для плацентарной недостаточности: увеличение или уменьшение толщины плаценты (диффузное или локальное утолщение плаценты, «тощая» плацента); изменение индекса амниотической жидкости (многоводие или маловодие); преждевременное старение и кальциноз плаценты [34].
Такие же изменения характерны и для других инфекционных заболеваний, таких как цитомегаловирусная инфекция [32].
Сахарный диабет. Для последов родильниц с сахарным диабетом (СД) характерной морфологической картиной является незрелость ворсинчатого дерева с отложением фибpинoидa мeжду вopcинками. При этом частота диссоциированного и преждевременного созревания ворсин (6,5% против 6,4%) одинакова при наличии или в отсутствие диабетической фетопатии. Состояние сосудистого дерева плацент у беременных с СД характеризуется наличием облитерационной ангиопатии, которая чаще встречается при СД 1-го типа (52,4%), реже при гестационном СД (38,1%) и СД 2-го типа (9,5%). При эхографии отмечаются утолщение плаценты и расширение межворсинчатых пространств без специфических структурных изменений [35—37].
Тромбофилии. Беременность всегда сопровождается состоянием гиперкоагуляции, что связано с повышением уровня фибриногена, протромбина, развивается так называемая гравидарная тромбинемия, значительно — на 50—80% — возрастает уровень FVIII, FIX, FX факторов свертывания крови. Одновременно снижается активность системы фибринолиза и физиологических антикоагулянтов: повышается активность ингибитора активатора плазминогена с одновременным повышением уровня активаторов плазминогена — t-PA, u-PA, FXII [38—41]. На фоне тромбофилии происходят также изменения в плаценте: нестойкость баланса гемостаза в системе мать—плацента возникает в течение осложненной беременности, когда под влиянием ряда факторов появляются многочисленные повреждения эпителиального покрова ворсин плаценты, приводящие к нарушению щеточной каймы, оголению базального слоя и даже стромы ворсин и высвобождению дополнительных плацентарных коагулирующих агентов. Последнее сопровождается активацией внешней системы свертывания, а в дальнейшем запускает внутренний путь коагуляции материнской крови в межворсинчатом пространстве.
Морфологические исследования последа при тромбофилии у матери выявили многочисленные структурные изменения, связанные с гиперкоагуляцией: в интервиллезном пространстве — очаги отложения фибриноида с замуровыванием ворсин; псевдоинфаркты, тромбы, кровоизлияния в децидуальной базальной пластине; увеличение объемной плотности межворсинчатого фибриноида в 5—10 раз; уменьшение объемной плотности терминальных ворсин в 2—3 раза; уменьшение объемной плотности базальной пластины в 1,4—1,2 раза, что может способствовать развитию преждевременной отслойки плаценты.
При наследственной тромбофилии в плаценте была выявлена незрелость ворсин (варианты промежуточных дифференцированных ворсин и диссоциированного созревания котиледонов) [42—44].
В настоящее время ультразвуковая картина плаценты при тромбофилии не описана, хотя логично предполагать, что эти патологические процессы будут отражаться в структурных особенностях плаценты при эхографии. Клиническую целесообразность данных исследований подтверждают слова А.Н. Дробинской и соавт. [44]: «Возможность клинико-морфологической диагностики наследственной тромбофилии позволяет определить причину осложнений и прогноз беременности, а при своевременной коррекции гемореологических нарушений у беременных с тромбофилией они имеют шанс выносить беременность. Знание морфологических основ плацентарной недостаточности при наследственной тромбофилии необходимо для совершенствования методов своевременной коррекции гемореологических нарушений».
Заключение
Таким образом, структурные изменения в плаценте при УЗИ во многих ситуациях играют важную роль в оценке и прогнозировании течения беременности, например при аномалиях локализации и прикрепления, гематомах, отслойках и кистах плаценты, трофобластических заболеваниях. Однако большинство эхографических критериев встречаются при самых различных патологических состояниях и могут быть интерпретированы только при анализе совокупности данных, полученных при УЗИ. Кроме того, представляет научный интерес и имеет большое практическое значение изучение особенностей изменений в плаценте при наследственной тромбофилии, которые могут быть выявлены при ультразвуковом (допплерометрическом) исследовании.