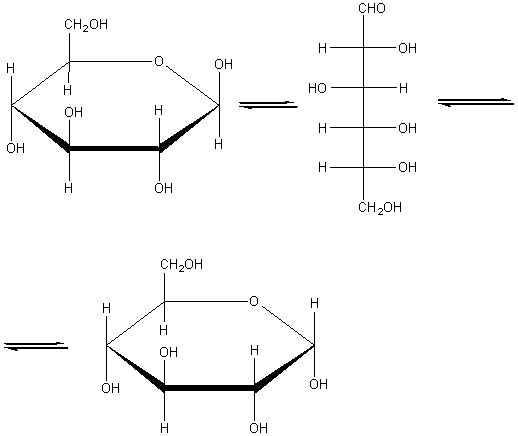
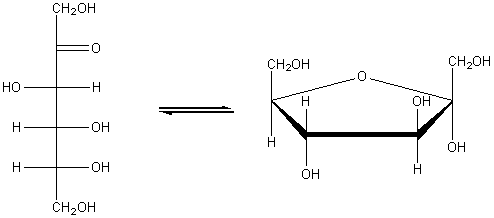
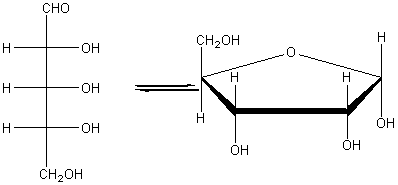
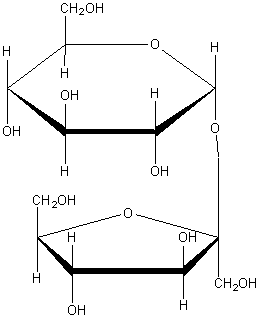
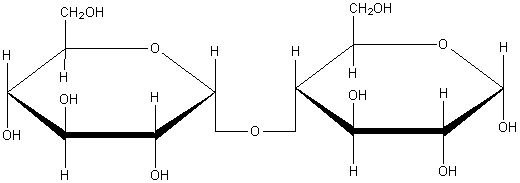
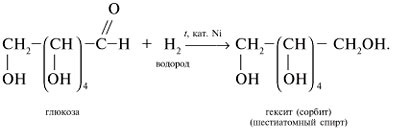доказать что глюкоза альдегидоспирт
Глюкоза C6H12O6 (альдегидоспирт).
Глюкозу называют также виноградным сахаром, так как она содержится в большом количестве в виноградном соке. Кроме винограда глюкоза находится и в других сладких плодах и даже в разных частях растений. Распространена глюкоза и в животном мире: 0,1% ее находится в крови. Глюкоза разносится по всему телу и служит источником энергии для организма. Она также входит в состав сахарозы, лактозы, целлюлозы, крахмала.
В организме человека глюкоза содержится а мышцах, крови, и в небольших количествах во всех клетках.
В природе глюкоза на ряду с другими углеводами образуется в результате реакции фотосинтеза:
6СО2+6Н2О хролофил С6Н12О6+6О2-Q.
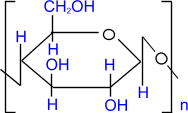
Глюкоза может существовать в линейной и циклической формах:
Получение.
Первый синтез простейших углеводов из формальдегида в присутствии гидроксида кальция был произведен А. М. Бутлеровым в 1861 г. На производстве глюкозу чаще всего получают гидролизом крахмала в присутствии серной кислоты:
(С6Н10О5)n + nН2О Н2SO4, t nС6Н12О6
Химические свойства:
Глюкоза обладает химическими свойствами, характерными для спиртов и альдегидов. Кроме того, она обладает и некоторыми специфическими свойствами.
1) Реакции альдегидной группы:
а) реакция «серебряного зеркала»:
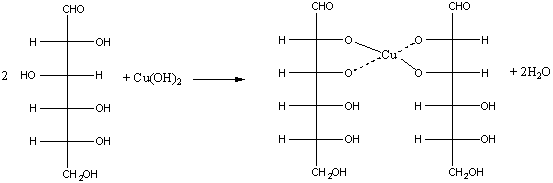
б) реакция с гидроксидом меди (II):
2) Реакции гидроксильной группы:
а) взаимодействие с гидроксидом меди (II): Как и все многоатомные спирты, глюкоза с гидроксидом меди (II) дает интенсивное синее окрашивание (качественная реакция). Осадок гидроксида меди(II) сначала растворяется, затем при нагревании становится желто-оранжевым, что говорит о наличии альдегидной группы.
При действии бромной водой глюкоза также окисляется в глюконовую кислоту.
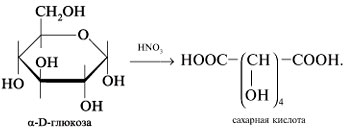
-Окисление глюкозы азотной кислотой приводит к двухосновной сахарной кислоте:
Восстановление глюкозы в шестиатомный спирт сорбит:
Cорбит содержится во многих ягодах и фруктах.
б) брожение – расщепление глюкозы под действием ферментов (специфические реакции)
Существуют специфические свойства глюкозы, подобно алифатическим альдегидам она присоединяет молекулу синильной кислоты. Что позволяет увеличить длину цепи углевода:
Фруктоза C6H12O6 (кетоноспирт). В растительном мире широко распространена фруктоза или фруктовый (плодовый) сахар. Фруктоза содержится в сладких плодах, меде. Извлекая из цветов сладких плодов соки, пчелы приготавливают мед, который по химическому составу представляет собой в основном смесь глюкозы и фруктозы. Также фруктоза входит в состав сложных сахаров, например тростникового и свекловичного.
Химические свойства:Фруктоза вступает во все реакции, характерные для многоатомных спиртов, однако реакции карбонильной (альдегидной) группы, в отличие от глюкозы, для нее не характерны.
Рибоза C5H10O5 – пентоза (альдегидоспирт)
Химические свойства аналогичны глюкозе.
Дисахариды.
Сахароза C12H22O11 – дисахарид. Сахароза образована остатками a-глюкозы и b-фруктозы:
Химические свойства:
Сахароза глюкоза фруктоза
2) Взаимодействие с гидроксидом кальция с образованием сахарата кальция.
3) Сахароза не реагирует с аммиачным раствором оксида серебра, поэтому ее называют невосстанавливающим дисахаридом.
Индусы еще за 300 лет до нашей эры умели получать тростниковый сахар из тростника. В наше время получают сахарозу из тростника, произрастающего в тропиках (на о.Куба и в других странах Центральной Америки).
В середине 18 века дисахарид был обнаружен и в сахарной свекле, а в середине 19 века был получен в производственных условиях.
В сахарной свекле содержится 12-15% сахарозы, по другим источникам 16-20% (сахарный тростник содержит 14-26% сахарозы).
Тростниковый сахар применяется в медицине для изготовления порошков, сиропов, микстур и т.д.
Свекловичный сахар широко применяется в пищевой промышленности, кулинарии, приготовлении вин, пива и т.д.
Значение лактозы очень велико, т.к. она является важным питательным веществом, особенно для растущих организмов человека и млекопитающихся животных.
Солодовый сахар широко распространен как в растительных, так и в животных организмах. Например, он образуется под влиянием ферментов пищеварительного канала, а также при многих технологических процессах бродильной промышленности: винокурения, пивоварении и т.д.
Мальтоза С12H22O11 – дисахарид, образованный двумя остатками a-глюкозы.
Лактоза состоит из остатков (3-галактозы и а-глюкозы в пиранозной форме, соединенных через 1-й и 4-й атомы углерода. Все эти вещества представляют собой бесцветные кристаллы сладкого вкуса, хорошо растворимые в воде. Химические свойства дисахаридов определяются их строением. При гидролизе дисахаридов в кислой среде или под действием ферментов связь между двумя циклами разрывается и образуются соответствующие моносахариды, например:
По отношению к окислителям дисахариды делят на два типа: восстанавливающие и невосстанавливающие. К первым относятся мальтоза и лактоза, которые реагируют с аммиачным раствором оксида серебра по упрощенному уравнению:
Эти дисахариды могут также восстанавливать гидроксид меди (II) до оксида меди (I):
человека. Лактоза содержится в молоке (от 2 до 8%) и получается из молочной сыворотки. Мальтоза содержится в проросших семенах хлебных злаков. Мальтоза также образуется при неполном гидролизе крахмала.
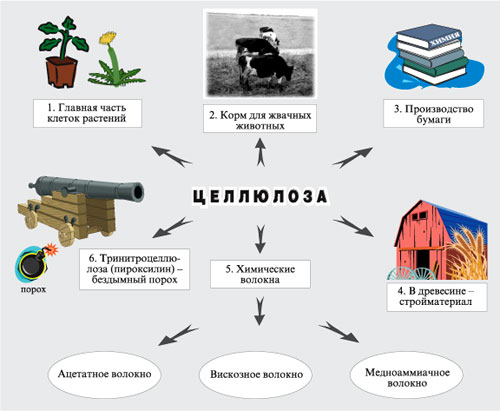
Полисахариды: Молекулы полисахаридов можно рассматривать как продукт поликонденсации моносахаридов. Важнейшие из полисахаридов – это крахмал и целлюлоза (клетчатка). Они построены из остатков глюкозы. Общая формула этих полисахаридов (C6H10O5)n
Физические свойства: Внешний вид крахмала хорошо всем известен: это белое вещество, состоящее из мельчайших зерен, напоминающих муку, поэтому его второе название «картофельная мука». Крахмал не растворим в холодной воде, в горячей набухает и постепенно растворяется, образуя вязкий раствор (клейстер).При быстром нагревании крахмала происходит расщепление гигантской молекулы крахмала на мелкие молекулы полисахаридов, называемых декстринами. Декстрины имеют общую молекулярную формулу с крахмалом (С6Н12О5)х, разница лишь в том, «х» в декстринах меньше «n» в крахмале. Пищеварительные соки содержат несколько разных ферментов, которые при низкой температуре доводят гидролиз крахмала до глюкозы:
Крахмал легко подвергается гидролизу: при нагревании в присутствии серной кислоты образуется глюкоза. (C6H10O5)n(крахмал) + nH2O –– H 2SO 4,t ° ® nC6H12O6(глюкоза)
Химические свойства:
2) Крахмал дает интенсивно синее окрашивание с йодом за счет образования внутрикомплексного соединения(качественная реакция).
3) Крахмал не вступает в реакцию «серебряного зеркала».
Получение: Образцом почти чистой целлюлозы является вата, полученная из очищенного хлопка. Основную массу целлюлозы выделяют из древесины, в которой она содержится вместе с другими веществами. Наиболее распространенным методом получения целлюлозы в нашей стране является так называемый сульфитный. По этому методу измельченную древесину в присутствии раствора гидросульфита кальция Ca(HSO3)2 или «гидросульфита натрия NaHSO3 нагревают в автоклавах при давлении 0,5— 0,6 МПа и температуре 150 «С. При этом все другие вещества разрушаются, а целлюлоза выделяется в сравнительно чистом виде. Ее промывают водой, сушат и направляют на дальнейшую переработку, большей частью на производство бумаги.
Химические свойства:
2) Образование сложных эфиров с азотной и уксусной кислотами:
 целлюлоза целлюлоза | + 3n HNO3 | H2SO4 ––––® | 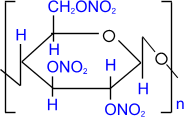 тринитрат целлюлозы тринитрат целлюлозы | + 3n H2О |
Целлюлоза представляет собой твердое волокнистое вещество, нерастворимое в воде, но растворимое в аммиачном растворе гидроксида меди (II) (реактиве Швейцера).
Контроль знаний:
1.Какой дисахарид лежит в нашей сахарнице?
2.Почему жизнь на Земле основана на углероде?
3. Какие вещества относятся к углеводам? Как классифицируют углеводы и почему?
4. Какие характерные химические свойства глюкозы и крахмала.
5. Приведите примеры значения углеводов.
6.Составьте уравнение реакций, при которых сахарозу можно превратить в этанол?
7. Изобразите известные вам процессы брожения глюкозы и укажите их практическое значение.
8.Вычислите, какой объём (в л.) оксида углерода (IV) образуется при окислении 0,25 моль сахарозы.
ДОМАШНЕЕ ЗАДАНИЕ:
Проработать: Л1. Стр.146-152,153-156,157-161,162-165,пересказ конспекта лекции №13.
Лекция № 14.
Тема: Амины. Понятие об аминах. Анилин как ароматический амин, органическое основание. Взаимное влияние атомов в молекуле анилина: ослабление основных свойств и взаимодействие с бромной водой. Применение анилина на основе свойств.
Аминокислоты. Получение аминокислот из карбоновых кислот и гидролизом белков. Химические свойства аминокислот как амфотерных органических соединений: взаимодействие со щелочами, кислотами и друг с другом (реакция поликонденсации). Пептидная связь и полипептиды. Применение аминокислот на основе свойств.
Белки. Получение белков реакцией поликонденсации аминокислот. Первичная, вторичная и третичная структуры белков. Химические свойства белков: горение, денатурация, гидролиз и цветные реакции. Биохимические функции белков. Генетическая связь между классами органических соединений.
Основные понятия и термины по теме: классификация аминокислот и структуры белков, изомерия. характеристика представителей, химические свойства, качественные реакции.
План изучения темы
(перечень вопросов, обязательных к изучению):
1.Понятие об аминах. Анилин как ароматический амин, органическое основание.
2.Способы получения аминокислот.
3.Химические свойства аминокислот как амфотерных органических соединений.
5.Получение белков реакцией поликонденсации аминокислот
6.Первичная, вторичная и третичная структуры белков.
7.Качественные реакции на белки.
8.Биохимические функции белков.
9.Генетическая связь между классами органических соединений.