Электрофорез белков проводят на чем
Электрофорез белков проводят на чем
Разделение растворенных белков под действием постоянного электрического поля носит название белкового электрофореза (ЭФ). В качестве носителя для проведения электрофореза могут быть использованы различные материалы, выбор которых зависит от поставленной задачи.
В настоящее время в диагностической практике в качестве поддерживающей среды используют ацетатцеллюлозную мембрану или гель агарозы (агароза отличается большей чувствительностью и лучшим разрешением, поэтому предпочтительна). Величина пор обоих этих носителей намного больше величины исследуемых молекул, в связи с чем даже высокомолекулярные белки мигрируют в них беспрепятственно.
В щелочной среде (именно в щелочном буфере проводят диагностический электрофорез) белки биологических жидкостей имеют суммарный отрицательный заряд. Под действием электрического поля они перемещаются к аноду со скоростью, зависящей главным образом от величины заряда. После окончания фореза пластину с разделенными образцами окрашивают специальными красителями, а затем полученные электрофореграм-мы оценивают визуально и с помощью приборов.
При использовании современного оборудования и готовых диагностических наборов получение электрофореграмм занимает обычно не больше 1 ч.
Электрофоретическое разделение нормальной сыворотки человека в геле агарозы позволяет выявить следующие фракции: преальбумин, альбумин и пять глобулиновых зон: а, (формируется в основном за счет а1-антитрипсина), а2 (ее образуют гаптоглобин и а2-макроглобулин), b1 (трансферрин), b2 (С3-компонент комплемента) и у (ее формирует в основном IgG). Если исследуют плазму, в быстрой у-зоне имеется дополнительно полоса фибриногена. Другие белки в норме содержатся в количествах, не позволяющих выявить их в виде отдельных зон, но при повышении их уровня могут давать дополнительные полосы в зоне своей миграции или приводить к усилению окраски уже существующих фракций. Это прежде всего орозомукоид и а-липопротеины (а,-зона), антихимотрипсин и церулоплазмин (а2-зона), фибронектин (граница а2- и b-зон), четвертый компонент комплемента — С4 (b-зона), С-реактивный белок и лизоцим (у-зона), поликлональные IgA (b2у1-зона) и IgM (у1-зона).
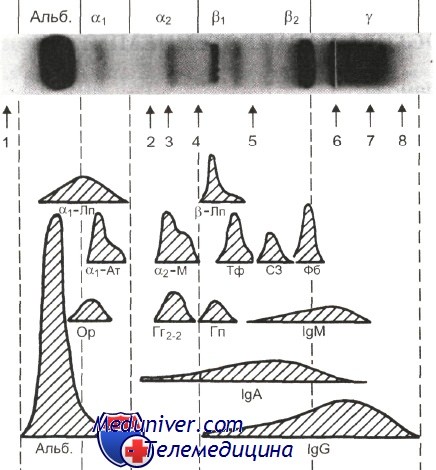
1 — преальбумин; 2 — антихимотрипсин; 3 — церулоплазмин; 4 — фибронектин; 5 — С4 (4-й компонент комплемента); 6 — старт; 7 — С-реактивный белок; 8 — лизоцим; Альб. — альбумин; a1-Лп — а1-липопротеин; а1-Ат — а1,-антитрипсин; Ор— орозомукоид; a2-М — а2-макроглобулин; Гг2„, — гаптоглобин 2—2; р-Лп — р-липопротеин; Тф — трансферрин; Гп — гемо-пексин; C3 — 3-й компонент комплемента; Фб — фибриноген. Анод слева.
Поликлональные иммуноглобулины, характерной особенностью которых является гетерогенность структуры и, следовательно, заряда молекул, отличаются разной подвижностью в электрическом поле, поэтому область их миграции (у-зона) представляет собой широкое диффузное пятно без четких границ. Структурная гомогенность моноклональных иммуноглобулинов обусловливает гомогенность изоэлектрических точек молекул внутри пула. На электрофореграмме моноклональные иммуноглобулины образуют, как правило, узкую, четко ограниченную полосу, называемую М-градиентом.
Интенсивность окрашивания каждой из электрофоретических фракций пропорциональна количеству образовавшего ее белка: чем больше белковых молекул мигрирует в определенной зоне, тем больше красителя они связывают. Плотность окрашивания в каждой точке электрофореграммы оценивают с помощью специального прибора — денситометра, детектор которого регистрирует степень ослабления светового луча, перемещающегося вдоль трека перпендикулярно к поверхности последнего. Данные сканирования представляют в виде графика, на котором каждая белковая зона образует пик.
Высота пика отражает интенсивность окраски зоны, а ширина—степень ее гетерогенности. По площади пиков автоматически рассчитывают относительное (в процентах) и абсолютное (в весовых единицах) содержание белка в электрофоретических фракциях. Для расчета в весовых единицах необходимо предварительно ввести в прибор данные о концентрации общего белка в образце.
Качественно выполненный электрофорез является высокоинформативным методом. Он позволяет без больших затрат времени, сил и средств дать предварительную характеристику белков сыворотки и других биологических жидкостей.
Один из основных недостатков метода — неспецифичность, т. е. невозможность во многих случаях сделать вывод о природе белковой полосы, выявленной на электрофореграмме. Это относится прежде всего к дополнительным зонам и фракциям, отсутствующим в нормальной сыворотке. Кроме того, если электрофоретическая подвижность двух разных белков совпадает, то на электрофореграмме они образуют одну полосу. Поэтому в случаях, когда на основании клинико-лабораторного симптомокомплекса можно предполагать заболевание, характеризующееся белковой патологией, электрофоретическое исследование сыворотки недостаточно: необходимо использовать дополнительно иммунохимические методы.
Например, при дефиците IgA и IgM уровень электрофоретической у-фракции остается в пределах нормы, поскольку эта зона формируется в основном за счет IgG. Только иммунохимическое определение уровня иммуноглобулинов позволяет выявить иммунодефицитное состояние.
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
Электрофорез белков проводят на чем
Электрофорез сывороточных белков: современные возможности анализа
Гильманов А.Ж., д.м.н., профессор
Саляхова Р.М., к.м.н., доцент
Кафедра лабораторной диагностики ИПО Башкирского медуниверситета, г. Уфа
Информативность и экономичность – важнейшие требования к лабораторным исследованиям, которые приходится учитывать как в отечественной, так и в зарубежной практике. Одним из достаточно информативных лабораторных тестов, используемых в настоящее время, является электрофорез белков биологических жидкостей (сыворотка крови, моча, спинномозговая жидкость и др.), который позволяет получить значительную диагностическую информацию. К сожалению, в большинстве лабораторий нет необходимых приборов. В то же время часть лабораторий, имеющих оборудование для электрофореза, им зачастую не пользуется из-за поломок, отсутствия расходных материалов или, как нередко бывает, невостребованности этого типа анализов лечащими врачами вследствие их недостаточной осведомленности о современных возможностях и клинической значимости этого метода. Исследование белкового и липопротеинового спектра сыворотки крови особенно значимо для диагностики патологических состояний, сопровождающихся нарушениями обмена белков и дислипопротеидемиями. При многих заболеваниях в сыворотке крови изменяется соотношение отдельных белков (диспротеинемия), хотя общее содержание белка может остаться нормальным.
В настоящее время известно более 150 индивидуальных сывороточных белков; значительную часть из них можно количественно определить современными иммуноферментными, иммунохемилюминесцентными и иммунотурбидиметрическими методами. Но при всей информативности и доказательности таких анализов пока они в основном малодоступны из-за сравнительной дороговизны: себестоимость одного количественного определения апопротеинов, антитрипсина или иммуноглобулинов составляет от 2 до 8 долларов США. Вместе с тем типовые сдвиги белкового состава сыворотки крови можно определить гораздо более доступным электрофоретическим методом, который к тому же позволяет «одним взглядом» оценить общую картину белкового спектра и получить значимую диагностическую информацию.
С учетом приведенного выше, при интерпретации результатов клиницистам нет смысла придавать диагностическое значение, например, снижению содержания альбумина у пациента на 2-3% от справочных данных. Само понятие нормы в лабораторной практике весьма условно; нормальные значения параметров зависят от местных факторов и должны формироваться в первую очередь «на местной базе», т.е. в конкретной лаборатории при обследовании здорового контингента. Вместе с тем для общего контроля качества разделения белков выпускаются специальные контрольные сыворотки, которые желательно иметь в каждой лаборатории, работающей этим методом.
Для электрофореза белков используются различные аппараты, как ручные, так и полуавтоматические. Современные комплексы оснащены микропроцессорными блоками питания и управляются компьютером; в большинстве систем на последней стадии исследования окрашенных мембран или гелевых пластинок (определения относительного количества белков в каждой фракции) используется электронный цветной сканер или миниатюрная фотокамера, что существенно повышает точность и воспроизводимость результатов. Программное обеспечение дает возможность усредненного расчета оптической плотности отдельных фракций путем автоматического определения границ «дорожек» и многократного сканирования каждой из них в нескольких «разрезах», что позволяет исключить ошибки из-за локальных микродефектов и неровного положения носителя, а также до определенной степени нивелировать искривление дорожки и влияние окрашенного фона при неполной отмывке. На экран дисплея и на принтер выводится график-денситограмма с рассчитанным содержанием отдельных белковых фракций. При необходимости маркеры границ фракций на графике можно скорректировать, при этом будет произведен автоматический пересчет их показателей. В компьютере, как правило, создается архив электрофореграмм; их можно в любое время извлечь и просмотреть.
Электрофорез белков, позволяющий определить их количественные сдвиги и физико-химические характеристики, помогает выявить заболевания печени и почек, иммунной системы, некоторые злокачественные новообразования (лейкозы), острые и хронические инфекции, генетические поломки и др. Известен ряд своеобразных электрофоретических «синдромов» – типичных картин электрофореграмм, характерных для некоторых патологических состояний. Среди них можно отметить:
Ниже представлены примеры интерпретации данных исследования сыворотки крови нескольких пациентов, проведенного с помощью устройства электрофореза с анализатором электрофореграмм УЭФ-01-«Астра» производства НПЦ «Астра» (г. Уфа).
Электрофоретические методы в клинической лабораторной диагностике имеют хорошую перспективу. Так, среди новинок можно отметить автоматические системы капиллярного электрофореза, которые выполняют быстрое разделение биомолекул внутри капилляра под действием высокого напряжения; для таких приборов требуются уже не микролитры, а нанолитры образца. В целом использование современных электрофоретических анализаторов позволяет с высокой точностью и минимальными затратами исследовать широчайший спектр биохимических параметров с целью уточнения диагноза, мониторинга патологического процесса и обоснования методов терапии заболеваний.
Привет студент
Определение белков с помощью электрофореза
МИНИСТЕРСТВО ОБРАЗОВАНИЯ И НАУКИ УКРАИНЫ
НАЦИОНАЛЬНЫЙ ТЕХНИЧЕСКИЙ УНИВЕРСИТЕТ
«Харьковский политехнический институт»
Кафедра биотехнологии, биофизики и аналитической химии
на тему: «Определение белков с помощью электрофореза»
Выполнил: студент группы ХТ-57б
Нобатова Огулсенем Аганиязовна
Доцент Самойленко С. И.
ОГЛАВЛЕНИЕ
1.2. Варианты метода электрофореза белков…………………………………. 5
1.3. Оборудования для электрофореза. Форезная камера……………….……..6
2.3. Процесс полимеризации ПААГ…………………………………………..12
2.4. Выбор концентраций мономеров…………………………………………14
2.5. Миграция белков в геле…………………………………………………. 17
3. Красители используемые для проявления белков …………. 19 Заключение………………………………………………………………………. 20 Список использованных источников……………………………………………. 21
Введение
Электрофорез применяют в физиотерапии, для окраски автомобилей, в химической промышленности, для осаждения дымов и туманов, для изучения состава растворов и др. Электрофорез является одним из наиболее важных методов для разделения и анализа компонентов веществ в химии, биохимии и молекулярной биологии.
Электрофорез – это перемещение заряженных частиц в растворе (в зависимости от знака их суммарного электрического заряда) к аноду или катоду под действием электрического поля. Поскольку скорость движения молекул в электрическом поле зависит от их заряда, формы и размера, то электрофорез может быть использован для их разделения. Находящиеся в буферном растворе макромолекулы обладают некоторым суммарным электрическим зарядом, величина и знак которого зависят в основном от рН среды. Если через этот раствор начать пропускать электрический ток, то под действием электрического поля макромолекулы в соответствии со своим суммарным зарядом мигрируют в направлении катода или анода, причем их трение об окружающую среду ограничивает скорость миграции. В зависимости от величины заряда и размеров макромолекулы приобретают разные скорости, и в этом – сущность процесса электрофореза. Постепенно исходный препарат, состоявший из различных молекул, разделяется на зоны одинаковых молекул мигрирующих с одной и той же скоростью. Однако в жидкости нельзя избежать конвекции, которая деформирует и смешивает разделяющиеся зоны, поэтому обычно электрофорез проводят в гелеобразной среде. Наличие сетки геля приводит к тому, что теперь фракционируемые макромолекулы сталкиваются с нитями полимера, образующего сетку геля, что увеличивает эффективное трение о среду, а следовательно, снижает скорость движения молекул. Очевидно, что препятствия для миграции становятся особенно серьезными, если средний диаметр пространственных ячеек геля оказывается соизмерим с размерами макромолекул. В этом случае решающее влияние на электрофоретическую подвижность различных молекул и степень разделения оказывает соотношение их линейных размеров. Электрофорез позволяет разделять макромолекулы, различающиеся по таким важнейшим параметрам, как размеры (или молекулярная масса), пространственная конфигурация, вторичная структура и электрический заряд, причем эти параметры могут выступать как порознь, так и в совокупности. Биологические макромолекулы – белки, нуклеиновые кислоты, полисахариды и др. – находятся в водном растворе в виде частиц, несущих определённый электрический заряд. Заряд макромолекулы определяется входящими в ее состав группами, способными к электролитической диссоциации. Степень диссоциации групп зависит от многих факторов, в частности, от рН среды. Общий заряд биологической макромолекулы также может изменяться при её взаимодействии с ионами или другими молекулами. Наиболее широкое применение электрофорез получил для анализа и очистки белков и нуклеиновых кислот, хотя этот метод может быть использован и для других заряженных биологических молекул, таких как сахара, аминокислоты, пептиды, нуклеотиды и др. Для фракционирования белков, нуклеиновых кислот и их фрагментов в настоящее время используют почти исключительно гель-электрофорез. Наиболее широко используются полиакриламидные (ПААГ) гели и гели агарозы. Варьируя концентрацию полимера, можно получать гели с очень широким диапазоном размеров пор. Кроме того, можно изменять электрические заряды макромолекул путем вариации рН буфера, а их конфигурацию путем введения в буфер денатурирующих агентов или детергентов. В качестве других «носителей» жидкой фазы широко используют пленки из ацетата целлюлозы, фильтровальную бумагу, тонкие слои силикагеля, целлюлозы, сефадекса и др. В некоторых случаях, например для разделения низкомолекулярных веществ, эти системы имеют свои преимущества.
1.2. Варианты метода электрофореза белков.
Существует множество разновидностей и модификаций данного метода, которые используются (или использовались в определённые периоды развития биохимии) в различных областях: 1) электрофорез в свободных средах (без поддерживающей среды) 2) электрофорез с подвижной границей 3) зональный электрофорез без поддерживающей среды 4) капиллярный электрофорез 5) зональный электрофорез в поддерживающей среде с капиллярной структурой 6) электрофорез на фильтровальной бумаге 7) электрофорез белков на ацетат-целлюлозной мембране 8) электрофорез в колонках и блоках гранулированной поддерживающей среды 9) электрофорез белков в ПААГ 10) электрофорез белков в крахмальном геле 11) электрофорез белков в агарозном геле 12) электрофорез в полиакриламидном геле.
1.3. Оборудования для электрофореза. Форезная камера.
Рисунок – 1.3. Оборудование для электрофореза.
платиновый электрод; * если при споласкивании или переносе держать камеру за один бортик, то в этом бортике появится трещина. Рисунок – 1.3. Вертикальная форезная камера.
Прибор для электрофореза в вертикальных трубках (в разрезе)
1 — верхний электродный резервуар; 2 — центральный цилиндр; 3 — верхний платиновый электрод; 4 — резиновая прокладка; 5 — трубочка с гелем; 6 — нижний электродный резервуар; 7 —нижний платиновый электрод. Для электрофореза белков обычно используют пластины шириной 8 — 14 см и длиной (в направлении электрофореза) 8 —28 см. Электрофорез нуклеиновых кислот и их фрагментов, например при секвенировании, нередко ведут в больших пластинах размером 33 43 см, что диктуется максимальным размером рентгеновской пленки для авторадиографии. Для разделения гидролизатов тРНК Пиртл и др. недавно использовали пластины ПААГ длиной 90 см.
Стандартно используют следующие обозначения: Т – процентное отношение суммарной массы обоих мономеров к объему раствора, С – процентное отношение массы бисакриламида к общей массе обоих мономеров. (Т = акриламид + мономер, образующий сшивки) и количество сшивающего агента в процентах от общего количества мономеров (С): Т = (a + b)/m x 100 % C = b/(a + b) x 100 %
2.2. Полиакриламидныи гель (ПААГ).
Исходные материалы: Акриламид (СН2 = СН — CONH2) представляет собой белый кристаллический порошок. Хорошо очищенный продажный препарат содержит не более 0,05% акриловой кислоты. Его 5%-ный водный раствор должен иметь рН не ниже 5, а оптическая плотность 1%-ного раствора при 290 нм (А290) не должна превышать 0,15. Такой препарат можно использовать без дополнительной очистки или перекристаллизации. Акриламид следует хранить сухим, в темной посуде, предпочтительно на холоду. В этих условиях он может храниться до года. Акриламид токсичен (воздействует на кожу и нервную систему), поэтому отвеши-вать и растворять его следует в перчатках и под тягой. Недостаточно чистый пре-парат можно перекристаллизовать. Для этого 70 г акриламида растворяют в 1 л хлороформа при 50°, фильтруют при этой же температуре, затем охлаждают до — 20°, быстро промывают кристаллы холодным хлороформом и высушивают в вакуум-эксикаторе. Для освобождения от УФ-поглощающих примесей акриламид можно обработать активированным углем. Для этого в маточный 30 — 40%-ный водный раствор акриламида в смеси с метиленбисакриламидом добавляют акти-вированный уголь (примерно 50 г/л), суспензию перемешивают в течение 30 мин и фильтруют сначала через бумажный, а затем через стекловолокнистый фильтр. NN’-Метиленбисакриламид («Бис») — используют в качестве «сшивки» линейных полимеров акриламида. Продажные препараты, содержащие не более 0,02% акриловой кислоты, не нуждаются в дополнительной очистке. В случае необходимости Бис можно перекристаллизовать из ацетона (12 г/л) в тех же усло-виях, что и акриламид. Условия хранения и токсичность — такие же, как у акриламида. В качестве «сшивки» иногда используют этилендиакрилат — СН2 = СН — СО — O — СН2 — СН2 — О — СО — СН = СН2, а также NN’-диаллилтартардиамид (ДАТД) —
CH2 = CH — CH2 — NH —CO — CH(OH) — CH(OH) — CO — NH — CH2 — CH = CH2. С их помощью получают «растворимые» гели. В первом случае эфирную связь можно разорвать обработкой геля щелочью или водным раствором пипери-дина. Гели, сшитые ДАТД, растворяются за 20 — 30 мин при комнатной темпера-туре в 2%-ной йодной кислоте.
2.3. Процесс полимеризации ПААГ.
При подготовке определенной серии опытов удобно заранее приготовить концентрированный (30 — 40%) водный раствор акриламида и метиленбисакрил-амида с определенным соотношением обоих мономеров. Такой раствор можно хранить в холодильнике в течение нескольких недель. Так же хранят и маточный раствор буфера, например 10-кратной концентрации. ТЕМЕД хранится хорошо, а персульфат аммония растворяют в воде непо-средственно перед началом опыта. Для приготовления геля маточные растворы мономеров и буфера смешивают в такой пропорции, чтобы получить нужную конечную концентрацию акриламида и буфера, дополняют до расчетного объема водой и вносят ТЕМЕД. После этого раствор деаэрируют в колбе Бунзена, присоединенной к водоструйному насосу, добавляют расчетный объем раствора персульфата и заливают в трубку или между стеклами для формирования пластин. При правильном выборе концентраций персульфата и ТЕМЕД полимеризация занимает 30 — 40 мин.Ее следует вести вдали от яркого источника света. Рассмотрим некоторые факторы, влияющие на этот процесс. Наибольшую опасность для нормального протекания полимеризации акриламида представляет растворенный в воде кислород, молекула которого является опреде-ленного рода бирадикалом и потому способна оборвать цепную реакцию свободно-радикальной полимеризации акриламида. Деаэрация смеси растворов необходима именно для удаления из нее растворенного кислорода. Ее можно вести достаточно энергично и с перемешиванием — так, чтобы жидкость при пониженном давлении закипела, но как только интенсивное выделение пузырей газа закончится, деа- эрацию следует прекратить, не допуская заметного испарения воды. Обычно эта процедура занимает несколько минут при комнатной температуре. Кислород воздуха в контакте с раствором мономеров может помешать полимеризации, поэто-му на поверхность раствора осторожно наслаивают до высоты 3 — 5 мм деаэри-рованную кипячением воду или изобутанол. Наслаивать следует по стенке формы через иглу от шприца с помощью перистальтического насоса. Им же удобно отсо-сать воду после окончания полимеризации геля. Вначале граница между гелем и водой исчезает, но затем вновь появляется, что указывает на окончание процесса полимеризации. Если в качестве инициатора используют рибофлавин, то форму с раствором мономеров освещают люминесцентной лампой «дневного света» с расстояния около 5см в течение30 — 45мин. Уже указывалось, что рибофлавин является более эффективным инициатором, чем персульфат. Кроме того, продукты его распада не опасны для белков и нуклеиновых кислот, в то время как ион пер-сульфата может вступать в реакцию с белками, создавая артефакты при их фракци-онировании. В тех случаях, когдаэто существенно, персульфат удаляют путем предварительного электрофореза («преэлектрофореза») геля до внесения в него препарата, однако полностью это сделать не удается. Тем не менее в последние годы в качестве инициатора предпочтение отдают персульфату, поскольку при работе с рибофлавином довольно трудно подобрать оптимальную степень деаэри-рования растворов. С одной стороны, растворенный кислород препятствует полимеризации, а с другой — он необходим, хотя и в небольшом количестве, для самого процесса инициации с участием рибофлавина. Полимеризация — экзотер-мический процесс, поэтому в случае высокой концентрации акриламида во избежа-ние образования пузырей газа и нарушения однородности геля необходимо обес-печить отвод тепла. Вместе с тем скорость полимеризации увеличивается с ростом температуры за счет ускорения образования свободных радикалов. Этим можно воспользоваться для замедления полимеризации: при охлаждении геля на 1° ее продолжительность увеличивается примерно на 2 мин. Полимеризацию гелей, содержащих более 15% акриламида, лучше вести на холоду. Гель получается наи-более однородным, если время полимеризации составляет 30 — 40 мин. Обычно этого добиваются эмпирически, подбирая оптимальную концентрацию персуль-фата. Она может варьировать в пределах от 0,02 до 0,2% в зависимости от концен-трации акриламида и качества самого персульфата. С увеличением содержания акриламида концентрацию персульфата приходится уменьшать. Имеет смысл предварительно внести различные количества данного препарата персульфата в ряд пробирок с рабочим раствором мономеров акриламида, наблюдая продолжи-тельность полимеризации в них.
2.4. Выбор концентраций мономеров.
Недавно описано успешное использование для электрофореза белков еще сильнее сшитого геля этого типа. В нем величина С достигала 27,т.е. отношение акриламид/ДАТД не превышало 4 : 1. Рассмотрим теперь подробнее влияние выбора значений Т и С для обыч-ного ПААГ на скорость миграции в нем биополимеров. Тормозящий эффект тре-ния о гель проявляется в снижении электрофоретической подвижности заряженных макромолекул вгеле (и’) по сравнению с их подвижностью в свободной жидкости с такими же, как у буфера геля, значениями рН и ионной силы раствора (u0). Электрофоретическую подвижность определяют как величину скорости миграции заряженных молекул(см/ч)при напряженности поля 1 В/см. Величина и0 зависит от соотношения суммарного электрического заряда макромолекулы(при данном рН) и ее массы. Сила, действующая на молекулу в электрическом поле, пропорциональна заряду, а противодействующая миграции вдоль силовых линий поля сила трения о жидкость пропорциональна линейному размеру молекулы, а следовательно, кубическому корню из ее массы. Для ориентировки заметим, что электрофоретическая подвижность большинства кислых белков в свободной жид-кости при рН 8,8 лежит в пределах 0,1 — 0,5 см/ч на 1 В/см. Прямой корреляции между массой молекулы и величиной и0, очевидно, быть не должно. В геле трение существенно возрастает, причем тем сильнее, чем больше масса молекул и меньше средний размер пор, т. е. чем больше величина Т (для малых значений С).
Показано, что имеет место соотношение: ln(и’/и0) = — kRT. Величина коэффициента торможения kR (порядка 0,1— 0,4) зависит от среднего радиуса молекулы R и степени сшивки геля С, слабо увеличиваясь с ростом последней в пределах от 1 до 7. Для глобулярных белков R лежит в диапазоне от 1,57 нм для лактальбумина(M = 12400) до 3,61 нм для церулоплазмина (M = 151 000). Для эффективного разделения белков при электрофорезе в ПААГ соотношение u’/u0 должно составлять 0,1 — 0,2. Отсюда следует, что оптимальная электрофорети-ческая подвижность белков в ПААГ лежит в пределах 0,01— 0,1 см/ч на 1 В/см. При напряженности поля 10 — 20 В/см этому соответствуют скорости миграции белков в диапазоне 0,1 — 2 см/ч. Таким образом, прирабочей длине геля 10см за 5ч электрофореза наиболее быстрые белки могут достигнуть конца геля, в то время как наименее подвижные продвинутся лишь на 0,5 см. Цифры эти — сугубо приближенные и приведены здесь лишь для общей ориентировки. В конкретных случаях возможны существенные отклонения от них. Например, если заранее известно, что разделяемые белки сильно различаются между собой по заряду или размерам, то можно вести электрофорез в условиях более высоких подвижностей (и’), т. е. в более крупно пористых гелях, и тем сократить время фракционирования в 2 — 3 раза. Выбор значения Т зависит от природы различия электрофоретических подвижностей белков в геле. Если сильно различаются размеры молекул, а отноше-ние заряда к массе у них более или менее одинаково, то имеет смысл выбрать Т максимальным. Разделение в этом случае будет происходить только за счет трения о гель, причем тем эффективнее, чем больше Т, хотя при этом в связи с увеличени-ем продолжительности электрофореза усилится диффузия белков. Если же компо-ненты анализируемой смеси имеют различные отношения заряда к массе, то может оказаться выгодным вести разделение в крупнопористом геле при малых значениях Т), т.е. как бы в свободной жидкости, почти не используя эффект трения молекул о гель. По крайней мере, это обеспечит выигрыш во времени фракционирования.
2.5. Миграция белков в геле.
Отличие и’ от uо является сила трения о гель, которая зависит от соотно-шения линейных размеров макромолекул и пор геля, а следовательно, от молеку-лярных масс белков и концентрации ПААГ. Молекулярные массы подавляющего большинства индивидуальных белков не превышают 500 000. Поэтому исполь-зование гелей агарозы оказывается нецелесообразным, кроме тех случаев, когда разделение белков хотят вести только по величине отношения заряда к массе. Как правило, электрофорез белков проводят в ПААГ, содержащем 5 — 20% акриламида. Белки являются, цвиттерионами. Их суммарным зарядом, а следовательно и отношением заряда к массе, можно управлять путем изменения рН буфера, в котором полимеризуют ПААГ и ведут электрофорез и который далее будем именовать рабочим. Очевидно, что оптимальное значение рН рабочего буфера обусловливает не максимальный заряд, а максимальное различие зарядов разных белков, состав-ляющих исходную смесь. Поэтому в большинстве случаев нецелесообразно ис-пользовать экстремальные величины рН рабочего буфера, слишком удаленны не от изоэлектрических точек всех белков смеси. Для обычных кислых белков оптималь-ные значения рН буфера оказываются в нейтральной или слабощелочной области; миграция белков идет в направлении от катода к аноду. Для щелочных белков (гистонов, белков рибосом и др.) целесообразно использовать слабокислые буферы (рН 4 — 5). Эти белки различаются по величине суммарного положительного заряда и мигрируют в направлении от анода к катоду. Отметим, что эффект трения о гель зависит не только от молекулярной массы, но и от конфигурации и жесткости белковой макромолекулы. Глобулярные белки, неспособные к агрегации или диссоциации на субъединицы, ведут себя более или менее одинаково, хотя их размеры зависят от плотности упаковки глобу-лы. Рыхлые глобулярные и, особенно, фибриллярные белки могут деформировать-ся при взаимодействии с гелем и тем самым облегчать себе миграцию между его нитями. Этот эффект особенно сильно выражен у высокомолекулярных нуклеино-вых кислот. Для однозначного определения молекулярной массы белка по скорости его миграции при электрофорезе бывает целесообразно распрямить полипептидную цепочку белка и придать ей жесткость. Именно такой прием используется при электрофорезе белков, обработанных додецилсульфатом натрия.
Заключение
В ходе работы был изучен метод электрофореза белков. Использование метода электрофореза в полиакриламидном геле для анализа и разделения сложных смесей белков и нуклеиновых кислот значительно расширило наши знания о белках. Электрофорез в полиакриламидном геле имеет ряд преимуществ перед другими аналитическими методами: он отличается простотой в исполнении, хорошей воспроизводимостью результатов и не требует сложного оборудования.
Все цели и задачи которые были поставлены – изучены.
Список использованных источников.









