Энтальпия холодной воды что это
Энтальпия — что это такое простыми словами
Про энтальпию на простом языке
При работе с какими-либо расчётами, вычислениями и выполнении прогноза разнообразных явлений, связанных с теплотехникой, каждый сталкивается с понятием энтальпия. Но для людей, специальность которых не касается теплоэнергетики или которые лишь поверхностно сталкиваются с подобными терминами, слово «энтальпия» будет наводить страх и ужас. Итак, давайте разберёмся, действительно ли всё так страшно и непонятно?
Если попытаться сказать совсем просто, под термином энтальпия понимается энергия, которая доступна для преобразования в теплоту при некотором постоянном давлении. Понятие энтальпия в переводе с греческого значит «нагреваю». То есть формулу, содержащую элементарную сумму внутренней энергии и произведенную работу, называют энтальпией. Эта величина обозначается буквой i.
Если записать вышесказанное физическими величинами, преобразовать и вывести формулу, то получится i = u + pv (где u – внутренняя энергия; p, u – давление и удельный объем рабочего тела в том же состоянии, для которого взято значение внутренней энергии). Энтальпия — аддитивная функция, т. е. энтальпия всей системы равна сумме всех составляющих её частей.
Термин «энтальпия» сложен и многогранен.
Но если постараться в нём разобраться, то всё пойдёт очень просто и понятно.
Ну, что же, механизм работы понятен. Вам лишь нужно внимательно читать и вникать. С термином «Энтальпии» мы уже разобрались, также привели и его формулу. Но тут же возникает ещё один вопрос: откуда взялась эта формула и почему энтропия связана, к примеру, с внутренней энергией и давлением?
Суть и смысл
Для того, чтобы попытаться выяснить физический смысл понятия «энтальпия» нужно знать первый закон термодинамики:
энергия не исчезает в никуда и не возникает из ничего, а лишь переходит из одного вида в другой в одинаковых количествах. Таким примером может служить переход теплоты (тепловой энергии) в механическую энергию, и наоборот.
Уравнение первого закона термодинамики нам нужно преобразить в вид dq = du + pdv = du + pdv + vdp – vdp = d(u + pv) – vdp. Отсюда мы видим выражение (u + pv). Именно это выражение и называется энтальпией (полная формула приводилась выше).
Энтальпия также является величиной состояния, потому что составляющие u (напряжение) и p (давление), v (удельный объём) имеют для каждой величины определенные значения. Зная это, первый закон термодинамики возможно переписать в виде: dq = di – vdp.
В технической термодинамике используются значения энтальпии, которые высчитываются от условно принятого нуля. Все абсолютные значения этих величин весьма трудно определить, так как для этого необходимо учесть все составляющие внутренней энергии вещества при изменении его состояния от О к К.
Формулу и значения энтальпии привёл в 1909 г. учёный Г.Камерлинг-Оннесом.
В выражении i — удельная энтальпия, для всей массы тела полная энтальпия обозначается буквой I, по всемирной системе единиц энтальпия измеряется в Джоулях на килограмм и рассчитывается как:
Функции
Энтальпия («Э») является одной из вспомогательных функций, благодаря использованию которой можно значительно упростить термодинамический расчёт. Так например, огромное количество процессов подвода теплоты в теплоэнергетике (в паровых котлах или камере сгорания газовых турбин и реактивных двигателей, а также в теплообменных аппаратах) осуществляют при постоянном давлении. По этой причине в таблицах термодинамических свойств обычно приводят значения энтальпии.
Условие сохранения энтальпии лежит, в частности, в основе теории Джоуля — Томсона. Или эффекта, нашедшего важное практическое применение при сжижении газов. Таким образом, энтальпия есть полная энергия расширенной системы, представляющая сумму внутренней энергии и внешней – потенциальной энергии давления. Как любой параметр состояния, энтальпия может быть определена любой парой независимых параметров состояния.
Также, исходя из приведённых выше формул, можно сказать: «Э» химической реакции равна сумме энтальпий сгорания исходных веществ за вычетом суммы энтальпий сгорания продуктов реакции.
В общем случае изменение энергии термодинамической системы не является необходимым условием для изменения энтропии этой системы.
Итак, вот мы и разобрали понятие «энтальпии». Стоит отметить, что «Э» неразрывно связана с энтропией, о которой вы также можете прочесть позже.
Об учете энергии холодной воды
А. Г. Лупей, заместитель главного метролога ОАО «Ленэнерго»
При реализации тепловой энергии возникает вопрос о наиболее рациональных механизмах учета теплоэнергии, содержащейся в исходной воде, забираемой источниками теплоты из естественных водоемов или городских водопроводов для подпитки тепловых сетей.
В связи с тем, что в узлах учета потребителей измерение давления (Рхв) и температуры холодной воды (tхв) технически неосуществимо и экономически неоправданно из-за значительной удаленности потребителей от источников теплоты, в некоторых теплоснабжающих организациях (ТСО) принят следующий порядок расчета платежей потребителей за используемую теплоэнергию:
2. По окончанию расчетного месяца результаты измерений Wс потребители представляют в ТСО, куда все источники теплоты 1-го числа каждого месяца, следующего за расчетным, передают сведения о среднемесячных значениях tхв и Рхв, фактически измеренных на источниках теплоты в узлах учета холодной воды.
При таком подходе помимо учета энергии холодной воды появляются достоверные сведения о платежах потребителей за фактически использованную ими энергию, т. к. отпадает необходимость применения в узлах учета потребителей каких-либо специальных резисторов (имитаторов tхв), задания договорных констант tхв и т. д.
Сегодня можно встретить и другие предложения по способам учета энергии холодной воды. Например, предлагается не корректировать показания теплосчетчиков указанным выше способом, а продавать потребителям «абсолютную» энергию, измеренную в узле учета потребителя по формуле Wс = М1h1-M2h2, которая содержит в себе и энергию холодной воды (М1-М2)hхв.
Поскольку при таком подходе объемы реализации теплоэнергии возрастут на величину (М1-М2)hхв, то одновременно предлагается скомпенсировать это увеличение объема продаж соответствующим снижением тарифа на отпускаемую энергию.
Нет сомнений в том, что при таком подходе финансовые интересы ТСО будут полностью учтены: при росте объема реализации теплоэнергии по пропорционально сниженным тарифам объем финансовых поступлений в ТСО сохранится на прежнем уровне, ТСО при этом ничего не потеряет и не приобретет. Но такой способ решения проблемы холодной воды в открытых системах теплоснабжения принципиально неприемлем для потребителей с относительно высокой долей использования теплоносителя на нужды горячего водоснабжения (ГВС) или технологические нужды.
Иными словами, введение в практику реализации тепловой энергии предложение продавать «абсолютную» энергию, но по сниженным тарифам, неизбежно приведет к заметному финансовому неравенству потребителей: при прежних объемах потребления энергии возрастут денежные платежи потребителей с относительно высокой долей нагрузки ГВС (жилые дома, бани, спортивные объекты и т. д.) за счет снижения платежей тех потребителей, у которых нагрузка ГВС сравнительно мала или вообще отсутствует.
Рассмотрим на простом примере суть возникающего финансового неравенства потребителей.
Пусть имеется некий источник теплоты (например, котельная) с одной отходящей открытой тепломагистралью. К ней подключено только два потребителя: промышленный склад и городская баня.
Склад использует тепловую энергию только на нужды отопления и вентиляцию, отбор теплоносителя (ГВС, утечки) у этого потребителя отсутствует (технологически М1 = М2).
Баня, наоборот, всю потребляемую энергию расходует только на нужды своих клиентов и (для упрощения расчетов) ничего на отопление и вентиляцию, т. е. в ней применяется однотрубная (тупиковая) система горячего водоснабжения (М1 = Мгвс,М2 = 0).
Пусть по показаниям теплосчетчиков на каком-то отрезке времени имеем:
— в бане:
Мгвс = 46,875 т, h1 = = 70 ккал/кг,
Wб = 0,001 • 46,875 • 70 = 3,28125 Гкал.
Пусть на этом же отрезке времени средняя удельная энтальпия холодной воды в котельной hхв = 6 ккал/кг, а действующий тариф на тепловую энергию Т = 500 руб./Гкал.
Показания теплосчетчиков и склад, и баня представили в ТСО на оплату.
Результаты учета тепловой энергии на складе ТСО не подвергает корректировке на холодную воду, т. к. на складе отбора теплоносителя нет. В этой связи ТСО предъявляет складу счет на оплату потребленной энергии в размере
Цск = WскТ = 3 • 500 = 1 500 руб.
Таким образом, поскольку фактическое потребление тепловой энергии складом и баней одинаково, то и размер платежей этих двух потребителей тоже совершенно одинаков (каждый из них за израсходованные 3 Гкал заплатил ТСО по 1 500 руб.).
Теперь мы предложили данной ТСО для решения проблемы холодной воды продавать «абсолютную» энергию (т. е. энергию, выработанную источником и привнесенную холодной водой при подпитке тепломагистрали), но по соответственно сниженному тарифу.
Каким должен быть новый (сниженный) тариф, если ТСО будет продавать потребителям теплоэнергию, содержащуюся в холодной воде, расходуемой котельной на подпитку этой тепломагистрали?
Относительный водозабор на нужды ГВС потребителями Ленэнерго
Выше было показано, что «абсолютный» теплоотпуск котельной (с учетом энергии холодной воды) равен
Wа = Wск + Wб = 3 + 3,28125 = 6,28125 Гкал,
при этом энергия, выработанная котельной, равна
Wв = 3 + 3 = 6 Гкал.
Следовательно, при отсутствии коррекции показаний теплосчетчика бани на холодную воду коэффициент снижения тарифа равен
Кт = Wа/Wв = 6,28125/6 = 1,046875.
Таким образом, новый тариф Тн на отпускаемую складу и бане «абсолютную» тепловую энергию будет следующим:
Тн = Т/Кт= 500/1,046875 = 477,612 руб./Гкал.
ТСО начинает продавать теплоэнергию по сниженному тарифу, но уже без коррекции результатов учета теплопотребления на холодную воду.
Пусть показания теплосчетчиков на складе и в бане за тот же период времени остались без изменений, т. е.
Wск= 0,001 • 100 • (70-40) = 3 Гкал,
Wб = 0,001 • 46,875 • 70 = 3,28125 Гкал.
По новому (уменьшенному) тарифу склад заплатит ТСО
3 • 477,612 = 1432,84 руб., а баня –
• 3,28125 • 477,612 = 1567,16 руб.
Видно, что интересы ТСО никак не пострадали, поскольку ТСО, как и в первом случае, получила с двух потребителей 3 000 руб. (1432,84 + 1567,16).
Но, несмотря на то что объем потребления тепла, выработанного источником, у обоих потребителей остался неизменным (каждый из них по-прежнему израсходовал по 3 Гкал), платежи этих потребителей заметно перераспределились: склад заплатил за свое теплопотребление в 3 Гкал на 67,16 руб. меньше, а баня на 67,16 руб. больше, чем в первом случае (т. е. когда осуществлялась коррекция показаний теплосчетчика бани на фактическую hхв).
Таким образом, предложение продавать всю энергию, в том числе и энергию холодной воды (но по сниженному тарифу), не затрагивает финансовые интересы ТСО, однако явно противоречит Гражданскому кодексу, в котором прямо указано, что каждый потребитель оплачивает только фактически отпущенную ему энергию.
Очевидно, что при реализации предложения предъявлять потребителям к оплате «абсолютную» энергию при одновременном снижении тарифа станет неизбежной ситуация, когда потребители с относительным потреблением горячей воды ниже среднего уровня (например, менее 4,6 % от М1 – см. рисунок) будут оплачивать не всю потребляемую энергию, выработанную источником теплоты.
А вот потребители, у которых относительный водоразбор на нужды горячего водоснабжения превышает средний уровень (например, жилые дома), будут вынуждены систематически переплачивать за фактически потребленную энергию, при этом степень переплаты будет тем выше, чем больше фактический относительный водоразбор у конкретного потребителя отличается от среднего уровня, принятого при расчете скорректированного тарифа.
Итак, несмотря на то что тарифная компенсация энергии холодной воды не затронет экономических интересов теплоснабжающих организаций и в некотором смысле упростит процедуру измерений тепловой энергии и расчетов платежей потребителей, предложение продавать потребителям тепловую энергию холодной воды вряд ли может быть поддержано из-за возникающей финансовой несправедливости по отношению к потребителям с различным соотношением объемов теплопотребления на нужды отопления и горячего водоснабжения.
1 В эту случайную выборку из 29 потребителей не входят жилые дома. Однако по имеющейся статистике в петербургских ЖСК и ТСЖ относительный водоразбор на нужды горячего водоснабжения сегодня в основном изменяется в пределах 15–25 % от М1. Иными словами, в открытых системах теплоснабжения из каждых 100 т сетевой воды, поступивших в теплоцентр потребителя по подающему трубопроводу, в жилых домах на нужды ГВС расходуется 15–25 т теплоносителя.
Поделиться статьей в социальных сетях:
Что такое энтальпия? (и его 11 видов)
Содержание:
И из всех физических величин, с которыми справляется эта дисциплина, одним из самых важных, несомненно, является энтальпия. Изменение этого термодинамического свойства определяет, что химические реакции в системе являются экзотермическими (они выделяют тепло) или эндотермическими (они поглощают тепло), что очень важно во многих областях науки.
Но что такое энтальпия? Как рассчитывается? Какие бывают типы? Как это связано с энтропией? В сегодняшней статье мы ответим на эти и многие другие вопросы об этой энергии, которая, хотя мы ее и не видим, определяет природу всего, что нас окружает.
Что такое энтальпия?
Энтальпия, представленная как H, это количество энергии, которым термодинамическая система в условиях постоянного давления обменивается с окружающей средой.. Другими словами, это термодинамическое свойство, изменение которого определяет, выделяет ли рассматриваемая химическая реакция энергию в виде тепла или необходимо поглощать эту тепловую энергию.
Следовательно, энтальпию можно понимать как количество тепловой энергии, которую термодинамическая система (регулируемая потоками температуры и энергии) излучает или поглощает, когда она находится под постоянным давлением. А под термодинамической системой мы можем понимать, в основном, любой физический объект.
Это одно из самых фундаментальных термохимических свойств, поскольку мы анализируем, как реакционная среда обменивается теплом (поглощая или выделяя его) с окружающей средой. А поглотит он его или высвободит, будет определяться не самой энтальпией (H), а ее изменением (ΔH).. И исходя из этого химическая реакция может быть двух типов:
Экзотермический: Когда ΔH 0 (изменение энтальпии отрицательное), реакция выделяет энергию в виде тепла. Они не потребляют тепло, а излучают его. Все реакции, в которых конечный продукт молекулярно проще, чем исходный, будут экзотермическими.
Эндотермический: Когда ΔH> 0 (изменение энтальпии положительное), реакция потребляет энергию в виде тепла. Они не выделяют энергию, а должны ее поглощать и расходовать. Все реакции, в которых конечный продукт молекулярно более сложен, чем исходный, будут эндотермическими.
Как рассчитывается энтальпия?
Как мы видели, основа энтальпии очень проста. Если его изменение отрицательное, рассматриваемая химическая реакция будет выделять тепловую энергию в среду. И если его изменение положительное, он будет поглощать энергию в виде тепла. Как мы можем это вычислить? Тоже очень просто.
Формула для расчета энтальпии выглядит следующим образом:
H = E + PV
Тем не менее, как мы уже сказали, что действительно интересует нас для определения термического поведения реакции, так это изменение энтальпии. Таким образом, мы находим эту новую формулу:
ΔH = ΔE + PΔV
Таким образом, если результат добавления изменения энергии к произведению давления и изменения объема положительный, это означает, что энтальпия увеличивается и, следовательно, тепловая энергия поступает в систему (это эндотермический эффект). Если, наоборот, результат этой суммы отрицательный, это означает, что энтальпия уменьшается на протяжении реакции и, следовательно, тепловая энергия покидает систему (она экзотермична).
Какие бывают типы энтальпии?
Мы уже точно видели, что такое энтальпия и как она рассчитывается. Теперь пришло время посмотреть, как он классифицируется в соответствии с природой химических реакций, которые он определяет, и как он влияет на тепловую энергию в них.
1. Энтальпия образования
Энтальпия образования определяется как количество энергии, необходимое для образования одного моля соединения (единица, с помощью которой измеряется количество вещества и которая эквивалентна 6,023 x 10 ^ 23 атомов или молекул соединения) от элементов, которые составляют его при стандартных условиях температуры и давления, то есть 25 ° C и 1 атмосфера соответственно.
2. Энтальпия разложения
Энтальпия разложения определяется как количество тепловой энергии, поглощаемой или выделяемой при один моль вещества распадается в его составных элементах.
3. Энтальпия горения
Энтальпия горения связана с горением веществ в присутствии кислорода. В этом смысле речь идет о энергия, выделяемая при сгорании одного моля вещества. Рассматриваемое вещество горит, когда вступает в реакцию с кислородом, и это экзотермические реакции, поскольку всегда выделяются тепло и свет.
4. Энтальпия гидрирования.
Энтальпия гидрирования определяется как энергия, выделяемая или поглощаемая, когда вещество мы добавляем молекулу водорода, чтобы обычно образовывать углеводород.
5. Энтальпия нейтрализации.
Энтальпия нейтрализации определяется как энергия, выделяемая или поглощаемая при смешивании кислоты (pH ниже 7) и основания (pH выше 7), которые в конечном итоге нейтрализуются. Отсюда и его название. Так долго как смесь кислотных и основных веществ, будет энтальпия нейтрализации, связанная с реакцией.
6. Энтальпия фазового перехода
Под энтальпией фазового перехода мы подразумеваем любое выделение или поглощение энергии, когда один моль определенного вещества изменить его агрегатное состояние. Другими словами, это энергия, связанная с изменением состояния между жидкостью, твердым телом и газом.
7. Энтальпия растворения
Энтальпия раствора определяется как энергия, поглощаемая или выделяемая при химическое вещество растворяется в водном растворе. То есть это энергия, связанная со смесью растворенного вещества и растворителя, имеющая ретикулярную фазу (поглощает энергию) и фазу гидратации (выделяет энергию).
8. Энтальпия плавления.
9. Энтальпия испарения.
10. Энтальпия сублимации.
11. Энтальпия затвердевания.
Как энтальпия связана с энтропией?
С другой стороны, энтропия прямо противоположна. И хотя неправильно определять его как величину, которая измеряет степень беспорядка в системе, верно, что это связано с энергией, недоступной в реакции. Таким образом, это определенным образом связано с молекулярным хаосом.
В любом случае энтальпия и энтропия связаны. Но каким образом? Что ж, правда в том, что это довольно сложно, но мы могли бы резюмировать это в следовать обратно пропорциональной зависимости: чем выше энтальпия (больше энергообмена), тем ниже энтропия (меньше беспорядка); при этом чем ниже энтальпия (меньше энергообмена), тем выше энтропия (больше беспорядка).
Культура Панамы: традиции, обычаи, гастрономия, религия
Энтальпия
Энтальпия — это термодинамическое свойство вещества, которое указывает уровень энергии, сохраненной в его молекулярной структуре. Это значит, что, хотя вещество может обладать энергией на основании температуры и давления, не всю ее можно преобразовать в теплоту. Часть внутренней энергии всегда остается в веществе и поддерживает его молекулярную структуру. Часть кинетической энергии вещества недоступна, когда его температура приближается к температуре окружающей среды. Следовательно, энтальпия — это количество энергии, которая доступна для преобразования в теплоту при определенной температуре и давлении. Единицы энтальпии — британская тепловая единица или джоуль для энергии и Btu/lbm или Дж/кг для удельной энергии.
Количество энтальпии
Если температура вещества выше его данной температуры или изменяет состояние на газообразное при данной температуре, энтальпия выражается положительным числом. И наоборот при температуре ниже данной энтальпия вещества выражается отрицательным числом. Энтальпия используется в вычислениях для определения разницы уровней энергии между двумя состояниями. Это необходимо для настройки оборудования и определения коэффициента полезного действия процесса.
Энтальпию часто определяют как полную энергию вещества, так как она равна сумме его внутренней энергии (и) в данном состоянии наряду с его способностью проделать работу (pv). Но в действительности энтальпия не указывает полную энергию вещества при данной температуре выше абсолютного нуля (-273°С). Следовательно, вместо того, чтобы определять энтальпию как полную теплоту вещества, более точно определять ее как общее количество доступной энергии вещества, которое можно преобразовать в теплоту.
H = U + pV
1. Общие положения
1.1. Рекомендация охватывает измерения (определения) величин, которые явля ю тся исходными для осуществления учета тепловой энергии и теплоносителя при взаиморасчетах энергоснабжающей организации с потребителем.
1.2. При измерении тепловой энергии применяют косвенные измерения, при которых тепловую энергию определяют на основании измерений расхода (массового или объемного) или количества (массы или объема) теплоносителя, температуры и давления теплоносителя.
Давление теплоносителя допускается не измерять при условии оценки возникающей из-за этого погрешности. В этом случае тепловую энергию определяют с учетом принятого в установленном порядке для измерений значения давления теплоносителя.
Измерение тепловой энергии может осуществляться с у четом или без учета тепловой энергии холодной воды.
1.3. При измерен и и тепловой энергии и коли ч ества теплоносителя применяют регламентированные в нормативно-технич е ских документах ( НТ Д) методы измер е ний расхода, количества, температуры и давления теплоносителя.
1.4. Те пл офиз и чес ки е свойства теплоносителей принимают соответствующими НТД ГСССД или другим утвержденным в установленном порядке нормативным документам, регламентирующим эти свойства.
2. Уравнения измерений
тепловая энергия, отпущенная источником тепловой энергии, при неравенстве расходов теплоносителя в подающем и обрат н ом трубопроводах, Q (по одной из формул ).
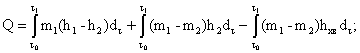
2.4. Тепловую энергию у потребителя по каждому вводу определяют по следующим формулам:
тепловая энергия, полученная потребителем на все виды тепловых нагрузок при неравенст в е расходов теплоносителя в подающем и обратном трубопроводах, включая утечки теплоносителя, Q
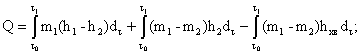
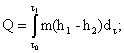
В последнем случае уменьшается погрешность измерений тепловой энергии за счет исключения погрешности измерений тепловой энергии холодной воды и такие измерения являются предпочтительными. В этом случае, пр и необходимости учета тепловой энергии холодной воды она может быть определена отдельн о, например, как произведение принятого в установленном порядке среднего значения энтальпии холодной воды на и с точнике тепловой энергии, на массу отобранной из системы воды. При этом должна быть оценена погрешность определения тепловой энергии холодно й воды.
2.7. Количество теплоносителя (на источнике тепловой энергии и у потребителя) определяют по следующим формулам:
масса воды, прошедшей по любому единичному трубопроводу, Мед.
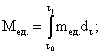
2.9. В случае измерения объем н ого расхода q массовый расход m определяют по формуле
Интегралы заменяют на соответствующие суммы, например
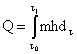
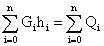
В этих случаях оценивают погрешность от замены интеграла на соответствующую сумму, и если она существенна, то она указывается в технической документации на средства измерений и (или) методике выполнения измерений.
Вопрос о существенности указанной погрешности рассма т ривае т ся при утверждении типа средства измерений и (или) аттестации (утверждения) методики выполнения измерений.
Приложение
УРАВНЕНИЯ ОПРЕДЕЛЕНИЯ ПЛОТНОСТИ И ЭНТАЛЬПИИ ВОДЫ
1. Общие положен и я.
1.3. Уравнения справедливы в диапазонах температуры от 0 до 300 °С и абсолютного давления от 0,05 до 30,0 МП а.
Средне к ва д ра ти чес к ая оценка относитель н о й погрешности уравнения σ не выходит за пределы: ±0,025 %.
Максимальное значение относительной погрешности уравнения δ не выходит за пределы: ±0,10 %.
2. Энтальпию h воды определяют по форму л е:
Остальные обоз н ачения те же, что в формул е (П.1).
Средне кв а д ра ти чес к ая оценка относительной погреш н ости уравнения σ не выходит за пределы: ±0,07 %.
Максимальное значение относительной погрешности уравнения δ не выходит за пределы ±0,20 %.
3. Примеры сравнения результатов расчета по формулам и данных ГСССД.
Значения температуры t и абсолютного давления Р