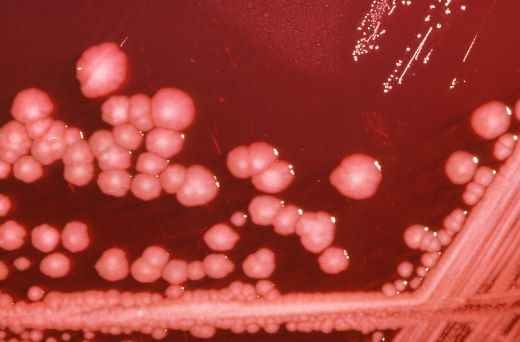
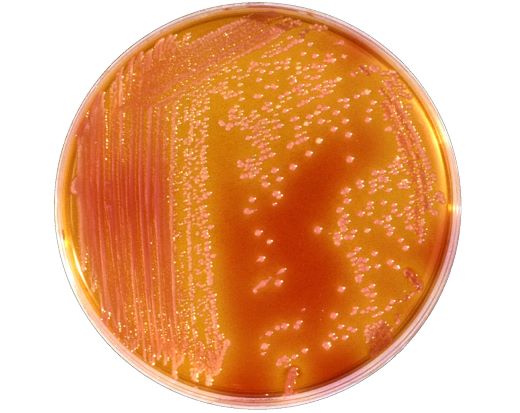
Энтеробактерии в мокроте что это
Энтеробактерии в мокроте что это
Выделяют два вида сальмонелл: Salmonella enterica и Salmonella bongori. Вид Salmonella enterica включает подвиды: enterica, salamae, arizonae, diarizonae, houtenae. Наиболее патогенны для человека и других теплокровных животных серовары подвида enterica.
Сальмонеллёз. Сальмонеллы хорошо приспособлены к обитанию в организме различных животных. У человека инфекция обычно не выходит за пределы кишечника. Заболевание характеризуется саморазрешающейся диареей. В некоторых случаях микроорганизмы могут вызывать инвазивные, угрожающие жизни человека заболевания, сопровождающиеся бактериемией, септицемией и остеомиелитом.
Сальмонелл обнаруживают в организме большинства домашних животных. Важными источниками инфекции считают больных людей и реконвалесцентных носителей. Механизм передачи заболевания — фекально-оральный (при употреблении контаминированных продуктов питания). Самые тяжёлые случаи сальмонеллёза наблюдают у пациентов со сниженным иммунитетом и сниженной секрецией желудочного сока, а также у лиц, перенёсших спленэктомию. В некоторых случаях заболевание осложняется реактивным артритом или развивается хроническое носительство.
Брюшной тиф. Возбудители брюшного тифа — серовары typhi и paratyphi подвида Salmonella enterica. Заболевание характеризуется поражением стенки кишечника, затем регионарных лимфатических узлов, сопровождается первичной бактериемией и инфекцией ретикулоэндотелиальной системы. В последующем бактерии попадают в кишечник из жёлчного пузыря, размножаются в пейеровых бляшках (развивается вторичная бактериемия), вызывают изъязвление стенки кишечника, которое может привести к кровотечению или перфорации. Пациенты предъявляют жалобы на высокую температуру, нарушение функций кишечника (диарею или запор) и сыпь (розеолёзные элементы на передней брюшной стенке). Наблюдают гепатоспленомегалию. Иногда брюшной тиф осложняется остеомиелитом и реже менингитом.
Инфекции мочевыводящих путей и пиелонефрит. Большинство инфекций мочевыводящих путей вызвают определённые серотипы Escherichia coli. Они способны к повышенному образованию К-антигена и гемолизина и прикреплению к эпителию мочевыводящих путей посредством пилей (последнее свойство характерно и для некоторых видов протея). При наличии у возбудителя маннозоустойчивых пилей развивается пиелонефрит. Важный фактор вирулентности бактерий рода Proteus — уреаза, снижающая рН и стимулирующая процесс образования камней.
Менингит и абсцессы мозга. Важной причиной менингита у новорождённых (характеризуется высокой смертностью) является Escherichia coli, штаммы которой в большом количестве продуцируют капсульный Kl-антиген. Кроме того, заболевание может быть следствием нейрохирургических вмешательств, операций по протезированию. Следует отметить, что энтеробактерии очень часто присутствуют в патогенной микрофлоре, сопровождающей абсцессы головного мозга.
Остеомиелит и септический артрит. Тяжелейшее осложнение у пациентов с серповидно-клеточной анемией и ВИЧ-инфекцией — остеомиелит или септический артрит, вызванные сальмонеллами. Кроме того, сальмонеллы и другие энтеробактерии часто вызывают инфекции костей и суставов у пожилых пациентов. Иногда эти заболевания возникают вследствие проникающего ранения. Для лечения обычно применяют фторхинолоны, так как они обладают способностью проникать в костную ткань (например, ципрофлоксацин).
Инфекции, вызванные представителями рода Klebsiella. Микроорганизмы рода Klebsiella обычно вызывают внутрибольничные инфекции. Кроме того, они могут быть причиной развития пневмонии (особенно у пациентов, находящихся на искусственной вентиляции лёгких), инфекций мочевыводящих путей, раневых инфекций и бактериемии. У высоковосприимчивых пациентов известны случаи заболеваний, сопровождающихся септицемией и заканчивающихся летальным исходом. Первичная пневмония, вызванная подвидом Pneumoniae вида К. pneumoniae, — редкое и крайне тяжёлое внебольничное заболевание, характеризующееся неблагоприятным исходом. Возбудитель прогрессирующей гранулематозной инфекции слизистой оболочки полости носа — Klebsiella rhinoscleromatis. Большинство случаев заболевания регистрируют в тропических регионах мира. Другой вид — Klebsiella ozanae — возбудитель хронической бронхо-эктатической болезни.
Инфекции, вызванные бактериями родов Enterobacter, Serratia и Citrobacter. Представители этих родов обитают в окружающей среде и могут поражать пациентов лечебных учреждений, вызывая раневые инфекции, бактериемию и внутрибольничную пневмонию. Выбор антибактериального препарата осложняется тем, что большинство возбудителей устойчиво к действию антибиотиков.
Диагностика энтеробактерий:
• Бактериологическое исследование крови или костного мозга (особенно в диагностике брюшного тифа).
• Изучение биохимических свойств возбудителя (например, способности расщеплять углеводы).
• Серотипирование (серотипы различают по липополисахаридному (О) и жгутиковому (Н) антигену) и фаготипирование применяют при эпидемиологических исследованиях.
• Колицинотипирование.
• Современные молекулярно-генетические исследования.
Лечение и профилактика инфекции вызванной энтеробактериями
Большинство грамотрицательных энтеробактерии чувствительны к действию аминогликозидов, цефалоспоринов широкого спектра действия, фторхинолонов, бета-лактамов и карбапенемов (например, меропенем). Лечение назначают только после определения чувствительности возбудителя к антимикробным средствам, так как некоторые микроорганизмы способны вырабатывать бета-лактамазу и ферменты, разрушающие аминогликозидные препараты. Возросшая в последнее время устойчивость энтеробактерии к антибиотикам широкого спектра действия обусловлена появлением штаммов, обладающих бета-лактамазами широкого спектра действия.
Препараты выбора при инфекциях мочевыводящих путей — цефалексин, ампициллин, нитрофурантоин или триметоприм.
Для профилактики заболеваний, сопровождающихся диареей, необходимо соблюдать правила личной гигиены, приготовления пищи, а также использовать безопасные источники водоснабжения. Основной метод лечения — пероральная регидратация организма.
Препарат выбора при брюшном тифе — ципрофлоксацин, альтернативные средства — триметоприм или цефалоспорины третьего поколения. В некоторых странах инфекционисты сталкиваются с заболеваниями, вызванными мультирезистентными штаммами возбудителя. Для профилактики заболевания людям, посещающим эти регионы, рекомендуют использовать живую аттенуированную (Ту21А) или бесклеточную (содержит Vi-антиген) вакцины, но вакцинация лишь частично защищает от инфекции.
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
Enterobacter cloacae (энтеробактер клоаки)

Уреазо-продуцирующий. Поэтому присутствие его в желудке может увеличивать число ложноположительных результатов при уреазных тестах на Helicobacter pylori (Старостин Б.Д.). Является оксидаза-отрицательной и каталаза-положительной бактерией.
Enterobacter cloacae — причина заболеваний человека
Enterobacter cloacae в систематике бактерий
Антибиотики, активные и неактивные в отношении Enterobacter cloacae
Антибактериальные средства (из имеющих описание в данном справочнике), активные в отношении Enterobacter cloacae: левофлоксацин, рифаксимин, норфлоксацин, офлаксацин, ципрофлоксацин, моксифлоксацин. Enterobacter cloacae слабо чувствителен к нифуроксазиду.
Enterobacter cloacae имеет высокую природную чувствительность к меропенему.
Enterobacter cloacae резистентны к цефалоспоринам III поколения и умеренно чувствительны к цефалоспоринам IV поколения (цефепим, цефпиром).
Семейство Enterobacteriaceae. Часть 1
Автор: врач – клинический фармаколог Трубачева Е.С.
.jpg)
Автор: врач – клинический фармаколог Трубачева Е.С.
Morganella spp. и Proteus spp.
Особо выдающихся представителей семейства Enterobacteriaceae мы уже разбирали в отдельных статьях, а именно представительницу рода Esherichia — кишечную палочку E.coli, а также одну из представительниц клебсиелл — Klebsiella pneumonia. В ближайших статьях мы постараемся осветить все оставшееся семейство, как, во-первых, одно из самых проблемных в плане развития резистентности к антимикробным препаратам, а во-вторых — как возбудителей, наиболее часто являющихся причиной внутрибольничных инфекций.
Микробиологические аспекты
Основными клинически значимыми представителями родов семейства Enterobacteriaceae, вызывающими заболевания у человека, являются:
Естественно совсем уж экзотику мы рассматривать не станем, но по наиболее часто встречающимся представителям обязательно пробежимся.
Клинические аспекты
Почему данное семейство так актуально? Наверное, потому, что почти ни одна нозология не обходится без его представителей. В самом широком смысле семейство Enterobacteriaceae является причиной следующих заболеваний:
Как мы видим, наши знакомые отметились практически везде. Но надо обязательно помнить, что выявление вышеуказанных представителей у здоровых людей из респираторного тракта, урогенитального и уж тем более желудочно-кишечного ни в коем случае не говорит о том, что человек чем-то болен, так как в большинстве своем эти микробы являются представителями нормальной микрофлоры, а не все люди умеют мыть руки, особенно летом.
Когда можно думать о наличии бактериальной патологии? Во-первых, когда имеется четкая клиника, во-вторых, когда микробы выделены из стерильных в норме сред, таких как кровь и ликвор, брюшная или плевральная полость, точнее, экссудат оттуда и, в-третьих, когда микроорганизмы выделены в клинически значимых концентрациях (тут в помощь будет ваша бак. лаборатория).
Стоит отметить еще один немаловажный момент — не все представители семейства Enterobacteriaceae умеют жить вне организма человека, и поэтому не размножаются во внешней среде, а потому обнаружение оных на пищевых продуктах и всевозможных поверхностях в лечебных учреждениях говорит о фекальном загрязнении, проще говоря, о неумении обрабатывать руки после посещения туалетной комнаты. Одним из таких микробов-детекторов является кишечная палочка, и стоит ее поймать даже не на руках персонала, а, например, на компьютерной мышке, как дальше можно уже ничего не искать, а начинать очередной этап избиения младенцев, пардон, обучения правилам асептики и антисептики, в частности, обработки рук.
Но давайте перейдем к частностям — и первым микроорганизмом, который будем сегодня рассматривать, станет:
Morganella spp.
Зверюшка названа так в честь своего первооткрывателя Гарри Р. Моргана.
Начнем традиционно с микробиологических аспектов
Семейство морганелл включает единственный вид M. morganii, включающий два подвида M. morganii и M. sibonii, которые различаются только ферментацией трегалозы.
Морганеллы являются представителями нормальной микрофлоры как человека, так и животных, а потому могут присутствовать в качестве сапрофитов в окружающей (внебольничной!) среде.
Морганеллы имеют довольно сложные отношения с антибактериальными препаратами и обладают природной резистентностью к:
Проявляют высокую чувствительность к:
Клинические аспекты
Как говорилось выше, морганеллы являются частью нормальной микрофлоры человека, крайне редко вызывая инфекционные заболевания. Чаще всего они являются возбудителями осложненных инфекций мочевыводящих путей.
Факторами риска развития инфекции являются:
В качестве механизмов резистентности морганеллы способны продуцировать бета-лактамазы, чем и объясняется их природная устойчивость к пенициллинам и цефалоспоринам 1-2 поколений. При нерациональном использовании антибиотиков они начинают вырабатывать бета-лактамазы расширенного спектра и факторы устойчивости к фторхинолонам, которыми довольно бодро делятся с соседями по семейству Enterobacteriaceae. Отдельно стоит отметить способность отдельных штаммов морганелл к резистентности к имипенему.
Какие заболевания вызывают чаще всего:
Терапевтические аспекты
Антибактериальная терапия будет полностью зависеть от результата из микробиологической лаборатории. Повторимся еще раз, микроб изначально умеет вырабатывать бета-лактамазы, а потому в случае развития осложненных инфекции мочевыводящих путей, которые чаще всего уже не связанны с кишечной палочкой, препаратами выбора становятся карбопенемы (имипенем, если штамм к нему чувствителен, или меропенем), дозирование которых проводится с учетом клиренса креатинина. Длительность лечения должна быть не менее 7 дней. В качестве альтернативы можно использовать цефалоспорин 4-го поколения Цефипим каждые 8 часов или фторхинолоны.
Аминогликозиды, несмотря на чувствительность к оным, при лечении заболеваний мочевыводящих путей лучше не применять в виду их нефро- и отоксичности, и по этой же причине их невозможно будет использовать около трех месяцев после проведенной терапии, например, в лечении синегнойной инфекции. Цефалоспорины третьего поколения тоже применять не стоит, так как морганеллы довольно быстро обзаводятся бета-лактамазами расширенного спектра, которые, как мы помним, эту генерацию препаратов быстро инактивируют.
Proteus spp.
Микробиологические аспекты
Протей долгое время был практически родным отцом морганеллы, так как последняя рассматривалась как один из видов рода протей. Этот род примечателен тем, что занимает почетное второе место по выявляемости после кишечной палочки в семействе Enterobacteriaceae.
В данный момент представителями рода протей являются P. mirabilis, вызывающий порядка 90% инфекционных заболеваний, а также P. vulgaris и P. penneri.
Клинические аспекты
Протеи выступают возбудителями порядка 10% неосложненных инфекций мочевыводящих путей, с чем могут быть связаны неудачи в лечении последних с использованием аминопенициллинов.
Как и все клинически значимые возбудители семейства Enterobacteriaceae, протей является возбудителем нозокомиальных инфекций, таких как пневмония, вплоть до сепсиса. Кроме того выступает возбудителем интраабдоминальных, а также хирургических инфекций кожи и мягких тканей, сепсиса, связанного с медицинскими вмешательствами как последствий нозокомиальной пневмонии в результате недостаточной дезинфекции, например, бронхоскопов.
Таким образом, мы видим, что, как и в предыдущем случае, проще правильно помыть руки и обработать инструменты, чем лечить это все с учетом природной и приобретенной резистентности.
Терапевтические аспекты
Как и в случае с морганеллой, нам просто необходим результат микробиологического исследования с определением чувствительности по МПК возбудителя либо результаты микробиологического мониторинга, которые помогут предположить зверей в случае неудачи ранее проводимого лечения.
В случае ампициллин-чувствительного P.mirabilis именно ампициллин может выступать препаратом первой линии. Кроме того, возможно использование цефуроксима и фторхинолонов. Обязательным аспектом лечения является его длительность. В случае неосложненных инфекций мочевыводящих путей (цистита) — не менее 3 дней, пиелонефрита — 10–14 дней, осложненных инфекций — 10–21 день. Сепсис является состоянием, требующим индивидуального подхода, но лечим не менее 14 дней.
На этом на сегодня мы закончим, но повторим одну базовую и, чего уж, наиважнейшую истину: в лечении инфекций, связанных с любым представителем семейства Enterobacteriaceae, самым главным будет являться профилактика. А именно правильное и тщательное мытье рук. Обеспечим мытье рук, не будет большинства проблем с инфекциями, вызванными указанным семейством.
Семейство Enterobacteriaceae. Часть 2
Автор: врач – клинический фармаколог Трубачева Е.С.

Автор: врач – клинический фармаколог Трубачева Е.С.
Сегодня мы закончим разговор о микроорганизмах из семейства Enterobacteriaceae, которое, как мы помним, является одним из самых проблематичных источников внутрибольничных инфекций, потому что возбудители умеют делиться и передавать в рамках почти всего семейства свои механизмы резистентности, и это при том, что изначально почти каждый представитель имеет природную устойчивость к целым классам антибиотиков.
Героями сегодняшнего разговора станут энтеробактеры, серрации, морганеллы. Конечно, есть и другие представители и, возможно, в постковид они начнут встречаться намного чаще, но пока нам в рамках Азбуки достаточно вышеперечисленных плюс кишечные палки и клебсиеллы, о которых мы говорили ранее.
Enterobacter spp.
Микробиологические аспекты
Род энтеробактера включает несколько видов, но наиболее клинически значимыми из них являются:
Очень важно помнить, что энтеробактеры проявляют природную устойчивость к большому спектру антибиотиков, таким как бета-лактамы, к которым они продуцируют хромосомные AmpC бета-лактамазы, плазмидные бета-лактамазы расширенного спектра, а также карбапенемазы. Так как клинически значимые представители Enterobacter spp. обитают в желудочно-кишечном тракте человека, то основным источником инфицирования для пациента становится медицинский персонал, который просто по факту своей ежедневной работы в больнице с антибиотиками является резервуаром всевозможных антибиотикорезистентностей.
Клинически значимые аспекты
Enterobacter spp. является причиной:
Инфекций мочевыводящих путей: катетер— или инструментально-ассоциированных (как результат эндоскопических манипуляций контаминированным инструментарием).
Внутрибольничных пневмоний, в том числе вентилятор-ассоциированных.
Инфекций кожи и мягких тканей, таких как раневые инфекции, инфицирование пролежней, ожоговые инфекции и послеоперационные инфекции. Кроме того в случае полимикробного характера инфицирования пролежней возможно развитие сепсиса как исхода раневой инфекции.
Инфекций кровотока — катетер— и инструмент-ассоциированные.
Инфекций центральной нервной системы — менингиты, чаще всего внутрибольничные, как следствие нейрохирургических вмешательств.
Неонатальных инфекций, таких как некротический энтероколит, сепсис и менингит.
Чем лечить?
Ответ будет традиционным — лучше вообще не инфицировать, тогда не придется ломать голову, чем все это лечить. В основе терапии лежит обязательное микробиологическое исследование с определением антибиотикочувствительности.
В случае выявления представителей Enterobacter spp. при лечении тяжелых инфекций предпочтение следует отдавать комбинированной терапии, и самыми подходящими будут пиперациллин-тазобактам в комбинации с аминогликозидами или фторхинолонами. А для преодоления резистентности, вызванной бета-лактамазами расширенного спектра, можно использовать карбопенемы.
Для лечения инфекций мочевыводящих путей самым первым и наиважнейшим является удаление мочевого катетера до момента прекращения пиурии. Далее лечим либо исходя из профиля антибиотикограммы, либо ципрофлоксацином в правильно подобранной дозе, либо, как было указано выше, рассматриваем назначение нитрофуранов и фосфомицина.
Serratia spp.
Серрации по своей сути являются родными сестрами клебсиелл, но в отличие от последних только S.marcescens вызывает клинически значимые заболевания у людей, а остальные виды — S.liquefaciens и S.rubidaea — делают это значительно реже, и в обычной, доковидной жизни, ими можно было пренебречь.
Клинические аспекты
Что вызывает?
Катетер-ассоциированные инфекции и как их исход — сепсис.
Инфекции мочевыводящих путей как следствие медицинских манипуляций необработанным инструментом.
Раневые инфекции в послеоперационном периоде.
Нозокомиальные пневмонии как следствие интубации.
Конъюнктивиты и кератиты.
И редко вызывали остеомиелиты и эндокардиты
Терапевтические аспекты
В первую очередь про серрацию надо узнать, а значит, необходимо микробиологическое исследование. Во-вторую, вспомнить о природной устойчивости. В-третью, держать в уме то, что очень часто цефалоспорины третьего и четвертого поколения тоже не будут работать, так как посредством плазмид получают устойчивость от родственников по семейству Enterobacteriaceae, например, от родной сестры — клебсиеллы. Точно таким же образом серрация может оказаться устойчивой и к карбопенемам. К фторхинолонам резистентность так же уже давно описана.
Так чем лечить?
Лучше вообще не заражать — потому что если бак. лаборатория дает серрацию, то ниоткуда кроме как с наших рук она появиться не может, так как ни ходить, ни летать сия зверюшка до сих пор не научилась.
В случае развития тяжелых инфекций — сепсиса, вентилятор-ассоциированной пневмонии и т. п., и только при документированной чувствительности, препаратами выбора могут быть цефепим или меропенем, или ципрофлоксацин в вену в стандартных дозировках. Если чувствительность утеряна, то зовем клинического фармаколога, а если такового нет, то смотрим в сторону амикацина, пиперациллина-тазобактама и азтреонама, только помним об их побочных эффектах. Курс лечения соблюдать жизненно необходимо, чтобы зверюшка еще куда-нибудь не мутировала и новыми механизмами защиты не обзавелась. Обычно речь идет о 10–14 днях (но так как польза превышает вред, то нефротоксичность аминогликозидов со временем отступит, а ототоксичность — тут уж как повезет).
Инфекции мочеполового тракта лечим так же с учетом чувствительности, и если таковая располагает, то препаратом выбора становятся фторхинолоны, либо комбинация двух антибиотиков, например фторхинолон с карбапенемом или бета-лактам с аминогликозидом.
Эндокардиты с остеомиелитами бывают хоть и редко, но крайне метко, а потому снова сначала исследуем чувствительность, потом индивидуально в каждом случае подбираем антибиотики (а лучше зовем клинического фармаколога, пусть он мучается). И снова крайне важно соблюдение сроков лечения, для эндокардита это порядка четырех, а то и шести недель внутривенной антибактериальной терапии, а для остеомиелита не менее двух недель. Почему нельзя меньше? Потому что последует мутация и новый рецидив, а антибиотиков просто может не хватить, ибо, как и сестра-клебсиелла, серрация тоже умеет в панрезистентность.
В заключении хочется повторить, что и в этом случае проще помыть руки, чем разгребать последствия инфицирования серрацией. Мытье рук и проще, и дешевле, и, что самое главное, спокойнее.
Morganella spp.
Морганеллы будут последними представителями семейства Enterobacteriaceae, которых мы обсуждаем в рамках нашей Азбуки. Если кому-то станет интересно покопаться дальше, то к их услугам всегда будет четырехтомник по медицинской микробиологии под редакцией Лабинской, конкретно второй и третий том, в которых все очень подробно расписано, правда, чтение это для неподготовленного человека будет довольно сложным. Но вернемся к нашей морганелле.
Микробиологические аспекты
Морганелла существует только одна — M.morganii, но имеет два подвида — M.morganii и M.sibonii, которые отличаются только по ферментации треалозы, и никакого клинического значения данное отличие не имеет.
Конечно, и морганелла умеет в природную устойчивость к антибиотикам, а именно к пенициллинам, цефалоспоринам первого и второго поколения, макролидам и ко-тримоксазолу. При этом сохраняет высочайшую чувствительность к аминогликозидам, пиперациллину, цефалоспоринам третьего и четвертого поколения, фторхинолонам и карбопенемам. То есть данную зверюшку есть чем победить.
Клинические аспекты
Морганелла является представителем нормальной микрофлоры человека и самостоятельно крайне редко что-то вызывает. Этим крайне редким являются инфекции мочевыводящих путей, чему способствуют крайне пожилой возраст, длительная госпитализация, мочевой катетер и иммунодефицит любой этиологии.
В плане приобретенной антибиотикорезистентности морганелла обзавелась факторами устойчивости к фторхинолонам, что и понятно, учитывая какие именно заболевания она вызывает и чем их чаще всего лечат.
Что еще может вызывать?
Крайне редко — сепсис, как исход инфекции мочевыводящих путей.
Раневую хирургическую инфекцию.
Неонатальный сепсис и хореоамнионит.
Но стоит иметь в виду, что данные ситуации крайне редки, и стоит изначально подумать не об этом возбудителе, а о том, какой за ним может прятаться в виду контаминации материала, и лучше бы все еще раз пересеять и перепроверить.
Терапевтические аспекты
Если результат микробиологического исследования сомнений не вызывает и вы убеждены, что имеете дело с морганеллами, то препаратами выбора становятся карбопенемы, и только в случае их недоступности и документированной бактериологом чувствительности, можно посмотреть в сторону цефалоспоринов, например, цефтазидима (для которого нужна отдельная цефалоспориназа, чтобы он был инактивирован), а лучше цефтазидим-авибактама. Хотя если недоступны карбопенемы, то и Завицефте, скорее всего, взяться будет неоткуда.
Какие препараты могут быть использованы в качестве резервных? Решать этот вопрос также необходимо только после получения результата микробиологии и чувствительности в идеале по МПК, и только после этого рассматривать назначение цефепима или ципрофлоксацина, или аминогликозидов (они, к слову, в случае морганеллы могут обоснованно выступать в качестве монотерапии инфекций мочевыводящих путей).
На этом автор заканчивает обзор семейства Enterobacteriaceae и в сотый раз призывает: «Коллеги, мойте руки! Это намного проще, дешевле и быстрее, чем лечить то, что с немытых рук может упасть в пациента».