Энзимодефицитные энтеропатии что это
Энзимодефицитные энтеропатии что это
ГБУЗ «Московский клинический научно-практический центр» Департамента здравоохранения Москвы
Современные подходы к диагностике и лечению энтеропатий
Журнал: Терапевтический архив. 2014;86(2): 4-12
Парфенов А. И. Современные подходы к диагностике и лечению энтеропатий. Терапевтический архив. 2014;86(2):4-12.
Parfenov A I. Current approaches to the diagnosis and treatment for enteropathies. Terapevticheskii Arkhiv. 2014;86(2):4-12.
ГБУЗ «Московский клинический научно-практический центр» Департамента здравоохранения Москвы
ГБУЗ «Московский клинический научно-практический центр» Департамента здравоохранения Москвы
Цель настоящей статьи заключается в нозологической систематизации ЭП, изложении принципов дифференциальной диагностики и лечения.
Наиболее известные ЭП и вызывающие их этиологические факторы представлены в табл. 1.
Таким образом, ЭП могут быть: 1) известной и неизвестной этиологии; 2) первичными и вторичными, т.е. связанными с патологией других органов и систем; 3) острыми (инфекционные, токсические, аллергические) и хроническими.
Этиология. К ЭП известной этиологии (специфическим) относятся глютенчувствительная целиакия (ГЦ), ЭП, вызываемые бактериями, вирусами, грибами и паразитами, лекарствами (НПВП, антибиотики и др.), пищевыми аллергенами. ЭП могут вызывать физические факторы (радиация), аномалии развития и приобретенные нарушения проходимости артериовенозных и лимфатических сосудов (МФ), васкулиты, болезни печени, почек, крови, соединительной ткани, эндокринной и иммунной систем. Правильно установленный нозологический диагноз при ЭП известной этиологии дает возможность добиться выздоровления с восстановлением структуры слизистой оболочки тонкой кишки (СОТК) или глубокой клинико-морфологической ремиссии при исключении влияния этиологического фактора и выполнении оптимальной программы лечения [1].
Наиболее тяжелыми и прогностически сомнительными являются ЭП неизвестной этиологии, т.е. неспецифические. К ним относятся целиакия, не чувствительная к глютену (рефрактерная), гипогаммаглобулинемическая спру (ГГГС), коллагеновая спру, аутоиммунная ЭП с образованием антител к энтероцитам, гранулематозный энтерит (БК), идиопатический негранулематозный еюноилеит, эозинофильный гастроэнтерит, ЭП, развивающаяся при РТПХ. Хотя причины этих ЭП остаются неизвестными, но механизмы понимания патологического процесса находятся на молекулярном уровне, а биологическая терапия оказалась настолько эффективной в подавлении воспаления, что конечной точкой ремиссии может быть достижение полного восстановления структуры и функции тонкой кишки.
Патоморфологическая картина ЭП не имеет патогномоничных нозологических критериев. Тем не менее патогистологическая картина ГЦ, болезни Уиппла, ГГГС, коллагеновой спру, гранулематозного илеита Крона и некоторых других позволяет установить нозологический диагноз.
К редким формам относится аутоиммунная ЭП. Для нее характерны хроническая диарея, тяжелый синдром нарушенного всасывания, сходная с целиакией атрофия ворсинок и гиперплазия крипт, лимфоплазмоцитарная инфильтрация собственной пластинки СОТК с повышенным количеством МЭЛ. У некоторых больных снижено содержание ИГ А. Патогенез аутоиммунной ЭП связан с появлением антител к собственным энтероцитам. Больные не отвечают на АГД, течение болезни отличается неблагоприятным прогнозом.
При болезни Уиппла в макрофагах собственной пластинки СОТК поселяются бактерии Уиппла (Tr. whippelii), маркерами которых служат PAS-положительные включения (рис. 3). Рисунок 3. Болезнь Уиппла. Отечная ворсинка слизистой оболочки тонкой кишки с PAS-включениями. Микрофото. PAS-реакция. Их находят также в лимфатических сосудах тонкой кишки и других органов у пациентов с нарушенной функцией макрофагов, не отвечающих на присутствие бактерий выработкой специфических антител. В результате развиваются синдром экссудативной ЭП, поражение суставов, нервной системы и других органов.
Экссудативная ЭП может быть первичной (вследствие аномалии развития) и вторичной. Вторичный синдром экссудативной ЭП развивается в результате механической или функциональной блокады лимфатических сосудов тонкой кишки воспалительной или опухолевой природы. Он может сопутствовать болезни Уиппла, васкулитам, правожелудочковой сердечной недостаточности. Гистологическими признаками экссудативной ЭП служат ворсинки, заполненные лимфой. В собственной пластинке СОТК видны расширенные лимфатические сосуды, приобретающие вид лимфатических «озер» (рис. 5). Рисунок 5. Лимфангиэктазия. Объяснение в тексте. Микрофото. Окраска гематоксилином и эозином.
Клиническая картина ЭП характеризуется хронической диареей, симптомами мальабсорбции (МА) и аутоиммунными нарушениями. Болевой синдром отсутствует или выражен незначительно, но при нарушении проходимости тонкой кишки может быть ведущим в клинической картине.
В табл. 2 приведены основные типы диареи при ЭП и механизмы, лежащие в их основе.
При инфекционной ЭП отмечается водянистая диарея, которая является следствием избыточной секреции воды и электролитов в просвет кишки. Основными активаторами секреции служат бактериальные токсины, вирусы, лекарственные и биологически активные вещества.
В патогенезе диареи при БК, инфекционных и других ЭП с повреждением СОТК преобладает экссудация воды, электролитов и белка в просвет кишки. Стул жидкий, часто с кровью и гноем. Характерны боли в животе, лихорадка, анорексия, похудение и отеки. В анализах крови наблюдаются лейкоцитоз, повышение СОЭ, уровня С-реактивного белка, фекального кальпротектина, гипоальбуминемия и гипопротеинемия.
БК характеризуется прогрессирующим течением. Различают 3 ее фенотипа, или формы: воспалительную (люминальную), cтенозирующую и пенетрирующую (экстралюминальную), осложняющуюся межкишечными и иными свищами, абсцессами и инфильтратами в брюшной полости. В отличие от БК негранулематозный неспецифический еюноилеит не имеет склонности к стенозам и экстралюминальным осложнениям.
При лимфангиоэктазиях возникает избыточная потеря белка в просвет кишки.
Основное значение для установления нозологического диагноза целиакии, коллагеновой и тропической спру, болезни Уиппла, ГГГС, эозинофильного гастроэнтерита имеет гистологическое исследование биоптатов СОТК, полученных из дистального отдела двенадцатиперстной кишки. Тем не менее надо иметь в виду, что сходная с целиакией атрофия ворсинок слизистой оболочки вблизи луковицы двенадцатиперстной кишки развивается у некоторых больных с кислотозависимыми заболеваниями вследствие влияния на нее пептического фактора. Диагностике ГЦ в этих случаях помогают иммунологические исследования на антитела к тканевой трансглутаминазе (АТтТГ), и антитела к диамидированному пептиду глиадина (АТДПГ), которые отсутствуют при пептических дуоденитах [3].
Сложности диагностики ГЦ объясняются следующими факторами: 1) атрофия ворсинок распределяется неравномерно, поэтому требуется исследовать не менее 3-5 биоптатов, полученных из дуоденальной слизистой оболочки; 2) АТтТГ, характерные для ГЦ, на момент постановки диагноза могут отсутствовать [4]; 3) СОТК восстанавливается под влиянием АГД иногда очень медленно; 4) у некоторых больных рефрактерной целиакией 2-го типа с клональной экспансией МЭЛ с аберрантным фенотипом, не отвечающих на лечение АГД, развивается Т-клеточная лимфома, ассоциированная с ЭП. Правильный диагноз в этих случаях устанавливают при гистохимическом исследовании биоптатов, полученных из патологически-измененной СОТК, а также с помощью УЗИ, КТ, МРТ или позитронно-эмиссионной томографии (ПЭТ).
К ЭП, не связанной с глютеном, относится ее аутоиммунная форма. Диагноз аутоиммунной ЭП является правомочным, если пациент с клинической картиной целиакии и аутоиммунными манифестациями не отвечает на АГД. Диагностике помогают первоначальные результаты серологических тестов на ГЦ, определение антител к энтероцитам или бокаловидным клеткам, тестирование на HLA DQ2/DQ8, повторная биопсия и сравнение гистологической картины с ранее выполненной биопсией СОТК.
Современные методы, хотя и расширили возможности распознавания ЭП, не решили многих проблем дифференциальной диагностики. Это связано с тем, что патоморфологические признаки ЭП (изменения слизистой оболочки, формы и высоты складок, просвета кишки, ее тонуса) не являются специфическими для конкретной нозологической формы. Так, афты СОТК, подобные обнаруженным у больного гранулематозным илеитом Крона (см. рис. 4), можно увидеть у больных с энтеропатией, ассоциированной с НПВП, и другими заболеваниями тонкой кишки.
Результаты исследования пораженного участка кишки, осуществляемого с помощью эндоскопического, рентгенологического и ультразвукового методов, дополняют друг друга. Глубокая эндоскопия тонкой кишки и капсульная эндоскопия высоко чувствительны и специфичны в обнаружении воспалительных проявлений СОТК. Более глубокие слои кишечной стенки доступны оценке при изображении кишки в поперечном сечении, позволяющем обнаружить стриктуры, свищи и абсцессы. Поэтому при БК одинаково большое значение имеют как осмотр поверхности кишки, позволяющий увидеть афты, изменение рельефа и диаметра просвета кишки, доступные эндоскопическому методу, так и оценка толщины всей стенки кишки с помощью УЗИ, КТ и МРТ, особенно с использованием контрастных растворов, введенных внутривенно.
ПЭТ с использованием меченной фтором-18 фтор-2-дезокси-D-глюкозы (ФДГ) является функциональным методом визуализации, который чувствителен к метаболизму глюкозы. ФДГ накапливается в местах активного воспалительного процесса в связи с гиперэкспрессией лейкоцитов в зоне переносчиков глюкозы и увеличением метаболической активности. С помощью ПЭТ можно определить воспаленные участки кишки и, что особенно важно, объективно оценить степень активности энтеропатии и определить конечную точку ремиссии, необходимую для оценки качества лечения. ПЭТ позволяет различить воспалительные и фиброзные стриктуры, т.е. связать результаты с адекватностью лечения, а также осуществить скрининг рака [6].
Особенные трудности представляет распознавание ЭП, причиной которой служит випома, гастринома, карциноид и другие НЭО. Основным клиническим проявлением ЭП при НЭО служит хроническая диарея, преимущественно водянистая, резистентная к терапии. При диффузном типе распределения нейроэндокринных опухолевых клеток в СОТК диагноз особенно труден и основан на выявлении в крови повышенной концентрации хромогранина А, соответствующего гастроинтестинального гормона (гастрина, вазоактивного интестинального пептида, серотонина и др.) и последующей верификации самой опухоли в кишечнике или поджелудочной железе.
При выявлении у больного с атрофией ворсинок СОТК общего вариабельного иммунодефицита с нормальным уровнем альбуминов правомерным является диагноз ГГГС.
Дифференциальную диагностику со специфическими ЭП инфекционной этиологии осуществляют с применением бактериологических исследований. ЭП, связанную с дефицитом лактазы или других ферментов тонкой кишки, верифицируют с помощью биохимических тестов с определением их в биоптатах СОТК.
Лечение больных ЭП может быть этиотропным, патогенетическим и симптоматическим. Ниже приведены принципы такой терапии.
1. Этиотропная терапия:
— элиминационные диеты: АГД, алактозная, гипоаллергенная;
2. Патогенетическая терапия:
— глюкокортикостероиды (системные и топические);
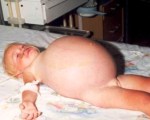
Экссудативная энтеропатия у детей
Экссудативная энтеропатия у детей — это клинический синдром, при котором происходит избыточное выделение белков сыворотки крови через желудочно-кишечный тракт. Патология возникает при нарушении лимфооттока, воспалительных и деструктивных поражениях ЖКТ, некоторых кардиологических болезнях. Энтеропатия проявляется расстройствами стула, подкожными отеками, похудением и признаками авитаминозов. Диагностика включает МРТ органов живота, эндоскопию с биопсией энтероцитов, анализ кала на белки (метод ядерной сцинтиграфии, исследование А1-антитрипсина). Лечение состоит из диетической коррекции белкового дефицита и терапии первопричины заболевания.
МКБ-10
Общие сведения
Экссудативная энтеропатия (ЭЭ) — редко встречающееся в педиатрической практике заболевание, частота которого точно не установлена. Впервые об этом нарушении заговорили в 1949 г. Ф. Олбрайт и соавторы, а точная диагностика состояния стала возможна после 1977 г., когда Дж.Р. Кроссли и Р.Б. Эллиот разработали метод определения потерь белка. Патология не имеет патогномоничных симптомов и зачастую протекает под маской других болезней, поэтому для ее выявления врачу требуется большой опыт, хорошо развитое клиническое мышление и проведение комплекса диагностических мер.
Причины
У детей данный вид энтеропатии встречается при врожденной аномалии лимфатических сосудов — первичной кишечной лимфангиэктазии. Этиологическим фактором также служат генетические синдромы: ювенильный полипоз, нарушения гликозилирования и образования гепарансульфат-содержащих протеогликанов. Приобретенные причины экссудативных энтеропатий можно систематизировать в несколько групп:
Патогенез
Механизм развития патологии зависит от ее первопричины. При нарушениях лимфооттока наблюдается застой лимфы в сосудах ЖКТ, в результате чего происходит экссудация белков в просвет кишечника. При лимфангиэктазии в тонкую кишку секретируются не только альбумины, но и другие компоненты: иммуноглобулины, лимфоциты, холестерин и жирорастворимые витамины. При этом вначале иммунитет не страдает, поскольку образование новых иммунных молекул восполняет эти потери.
Любые воспалительные и язвенные повреждения стенки кишечника сопровождаются экссудативной диареей. В патогенезе имеет значение уменьшение числа специфических протеогликанов на базолатеральной поверхности кишечных клеток, накопление провоспалительных цитокинов, повреждающее действие инфекционных агентов. Повышение проницаемости стенки ЖКТ возможно даже при отсутствии воспаления, если между эпителиальными клетками возникают дефекты контактов.
Симптомы
Клиническая картина экссудативной энтеропатии включает диспепсические симптомы и признаки протеинового дефицита. Нарушения всасывания в желудочно-кишечном тракте проявляются в виде стеатореи — у детей появляется обильный зловонный стул с бледно-серым оттенком и маслянистой поверхностью. В кале присутствует большое количество слизи, частицы непереваренной пищи. Типичный признак стеатореи — трудно смываемые следы кала на стенках унитаза.
Частота испражнений повышается до 4-5 раз в сутки у детей старше 1 года и до 10-15 раз у грудничков. Если экссудация протеинов вызвана кишечными заболеваниями, возможно наличие крови в каловых массах. Кроме расстройств стула, ребенок жалуется на боли в животе, тошноту, снижение аппетита. Периодически беспокоят сильное вздутие и урчание в кишечнике, сопровождающееся мучительными коликами.
Недостаток сывороточных белков проявляется отеками подкожной клетчатки, которые особенно хорошо видны у детей худощавого телосложения. При сильном белковом дефиците вследствие асцита увеличивается живот. Несмотря на отечный синдром, ребенок начинает терять в весе, поскольку у него нарастает нутритивная недостаточность. Болезненность в костях и суставах, сухость и шелушения кожи, общая слабость и вялость являются симптомами авитаминозов.
Осложнения
Основную опасность для ребенка представляет снижение нутритивного статуса. Вследствие этого возникают задержки роста и физического развития, которые без своевременной коррекции принимают необратимый характер. Дефицит витамина D манифестирует нарушениями минерализации костей и их деформацией, что усугубляет проблему отставания в росте. Нехватка витамина А проявляется нарушениями зрения, а гиповитаминоз Е особо опасен в периоде пубертата.
В начале болезни иммунитет сохраняется на должном уровне, но при длительной нехватке протеинов снижается синтез противоинфекционных факторов. У ребенка формируется вторичный иммунодефицит, возрастает частота ОРВИ и инфекций другой локализации. Снижение иммунитета на фоне мальабсорбции и СИБР чревато попаданием бактерий в полость брюшины и началом гнойного перитонита. Тяжелая гипопротеинемия опасна отеком мозга и отеком легких.
Диагностика
При обследовании ребенка педиатр обращает внимание на особенности питания, узнает о перенесенных заболеваниях и наличии хронических патологий, измеряет антропометрические показатели. Физикальный осмотр включает пальпацию живота, оценку состояния сердечно-сосудистой системы. Диагностика экссудативной энтеропатии сложна и требует использования следующих методов исследования:
Лечение экссудативной энтеропатии у детей
Чтобы корригировать нутритивный статус при экссудативной энтеропатии, ребенку назначается диетическое питание. Из рациона исключают продукты с длинноцепочечными жирными кислотами для уменьшения давления в лимфатических сосудах и воздействия на патогенетические механизмы. Для восстановления уровня белка в крови рекомендовано повышение содержания протеинов в диете до 4 г на кг массы тела. Гиповитаминоз устраняется питанием или витаминными добавками.
Из медикаментозных препаратов применяются кортикостероиды, которые уменьшают воспалительные процессы в кишечной стенке и снижают экссудацию. Для улучшения переваривания и всасывания пищи эффективны ферменты, пробиотики и пребиотики. Если гипопротеинемию не удается корректировать диетой, ребенку проводят инфузии растворов альбумина.
Поскольку ЭЭ всегда развивается вторично, главный пункт в лечении — своевременная диагностика и устранение основного заболевания. С ребенком работает бригада специалистов: детский гастроэнтеролог, аллерголог-иммунолог, ревматолог, другие врачи, которые подбирают комплексную этиопатогенетическую терапию причин экссудативной энтеропатии.
Прогноз и профилактика
Основной прогностический фактор — причина экссудативных потерь протеинов. Если первичное заболевание возможно вылечить, то состояние ребенка быстро нормализуется и уровень белков крови восстанавливается. При хронических рецидивирующих патологиях и врожденных аномалиях прогноз сомнительный. Учитывая разнообразие этиологических факторов и неясный патогенез, меры профилактики болезни не разработаны.
Энтеропатии: новый взгляд на диагностику и лечение болезней тонкой кишки
Энтеропатии (ЭП) – общее название болезней, объединяемых патологическими (воспалительными, геморрагическими эрозивно-язвенными и атрофическими) изменениями тонкой кишки. Современные методы исследования позволяют получить информацию о патоморфологических и функциональных изменениях кишки, однако из-за их сходства при многих нозологических формах дифференциальная диагностика ЭП остается одной из сложных в клинике внутренних болезней.
В таблице 1 представлены наиболее известные ЭП и вызывающие их этиологические факторы. Из таблицы 1 видно, что ЭП могут быть известной и неизвестной этиологии, первичными и вторичными, связанными с патологией других органов и систем, острыми (инфекционными, токсическими, аллергическими) и хроническими.
К ЭП известной этиологии (специфические) относятся глютенчувствительная целиакия (ГЦ), ЭП, вызываемые бактериями, вирусами, грибами и паразитами, лекарствами (нестероидные противовоспалительные препараты – НПВП, антибиотики и др.), пищевыми аллергенами. ЭП могут вызывать физические факторы (радиация, токсины), аномалии развития и приобретенные нарушения проходимости артериовенозных и лимфатических сосудов (мальформации), васкулиты, болезни печени, почек, крови, соединительной ткани, эндокринной и иммунной системы. Правильно установленный нозологический диагноз при ЭП известной этиологии позволяет добиться выздоровления с восстановлением структуры слизистой оболочки тонкой кишки (СОТК) или глубокой клинико-морфологической ремиссии при условии исключения влияния этиологического фактора и выполнения оптимальной программы лечения [1].
Наиболее тяжелыми и прогностически сомнительными являются ЭП неизвестной этиологии, то есть неспецифические. К ним относятся целиакия, нечувствительная к глютену (рефрактерная), гипогаммаглобулинемическая спру (ГГГС), коллагеновая спру, аутоиммунная ЭП с образованием антител к энтероцитам, гранулематозный энтерит (болезнь Крона), идиопатический негранулематозный еюноилеит, эозинофильный гастроэнтерит, ЭП, развивающаяся при реакции «трансплантат против хозяина». Хотя причины этих ЭП остаются неизвестными, механизмы понимания патологического процесса находятся на молекулярном уровне, а биологическая терапия настолько эффективна в подавлении воспаления, что конечной точкой ремиссии может быть достижение полного восстановления структуры и функции тонкой кишки.
Патоморфология ЭП не имеет строго патогномоничных нозологических критериев. Тем не менее патогистологическая картина ГЦ, болезни Уиппла, ГГГС, коллагеновой спру, гранулематозного илеита Крона и некоторых других позволяет установить точный нозологический диагноз.
Для ГЦ характерно снижение высоты ворсинок (атрофия), углубление (гиперплазия) крипт, инфильтрация лимфоцитами и плазмоцитами собственной пластинки и эпителиоцитов (межэпителиальные лимфоциты – МЭЛ). Исключение из пищевого рациона растительного белка глютена, содержащегося в пшенице, ржи и ячмене, приводит к постепенному восстановлению СОТК. Если лечение не оказывает заметного влияния на СОТК, то речь должна идти о рефрактерной форме целиакии. Различают 2 типа рефрактерной целиакии. При 1-м типе СОТК инфильтрирована нормальным лимфоплазмоцитарным фенотипом. При 2-м типе МЭЛ представлены аберрантным клоном лимфоцитов, предрасположенных к развитию Т-клеточной лимфомы.
При ГГГС структура СОТК сходна с таковой при ГЦ, но отличается почти полным отсутствием в инфильтрате плазматических клеток, продуцирующих основные классы иммуноглобулинов (Ig). При коллагеновой спру СОТК также атрофирована, а под базальной мембраной энтероцитов образуется слой коллагена, существенно нарушающий пищеварительно-транспортную функцию тонкой кишки (рис. 1). Лечение больных ГГГС и коллагеновой спру аглютеновой диетой (АГД) не оказывает влияния на СОТК.
К редким формам относится аутоиммунная ЭП. Для нее характерны хроническая диарея, тяжелый синдром нарушенного всасывания, сходная с целиакией атрофия ворсинок и гиперплазия крипт, лимфоплазмоцитарная инфильтрация собственной пластинки СОТК с повышенным количеством МЭЛ. У некоторых снижен IgА. Патогенез аутоиммунной ЭП связан с появлением антител к собственным энтероцитам. Больные не отвечают на лечение АГД, течение болезни отличается плохим прогнозом.
При болезни Уиппла в макрофагах собственной пластинки СОТК поселяются бактерии Уиппла (Tropheryma whippelii). Скопления макрофагов, заполненных PAS-положительными гранулами бактериального происхождения, служат диагностическими маркерами болезни Уиппла (рис. 2). Их находят также в лимфатических сосудах тонкой кишки и других органов у пациентов с нарушенной функцией макрофагов, не отвечающих на присутствие бактерий выработкой специфических антител. В результате развивается синдром экссудативной ЭП, поражение суставов, нервной системы и других органов.
Болезнь Крона (БК) характеризуется развитием воспаления стенки кишки с формированием гранулем в подслизистом слое, содержащих гигантские эпителиоидные клетки Пирогова – Лангханса. Уже на ранней стадии появляются поверхностные язвы (афты) (рис. 3), которые не являются специфическими и отражают лишь тяжесть воспалительной реакции и ее длительность. В редких случаях язвенный еюнит (илеит) развивается без гранулематозного воспаления и классифицируется как негранулематозный еюноилеит неизвестной этиологии.
Экссудативная ЭП может быть первичной (вследствие аномалии развития) и вторичной. Вторичный синдром экссудативной ЭП развивается в результате механической или функциональной блокады лимфатического аппарата кишечника воспалительной или опухолевой природы. Он может сопутствовать болезни Уиппла, васкулитам, правожелудочковой сердечной недостаточности. Гистологическими признаками экссудативной ЭП служат ворсинки, заполненные лимфой. В собственной пластинке СОТК видны расширенные лимфатические сосуды, приобретающие вид лимфатических «озер» (рис. 4).
Клиническая картина ЭП характеризуется хронической диареей, симптомами мальабсорбции и аутоиммунными нарушениями. Болевой синдром отсутствует или незначителен, но при нарушении проходимости тонкой кишки может стать ведущим в клинической картине.
При инфекционной ЭП диарея водянистая, является следствием избыточной секреции воды и электролитов в просвет кишки. Основные активаторы секреции – бактериальные токсины, вирусы, лекарства и биологически активные вещества.
В механизме диареи при мальабсорбции ведущую роль играет повышение осмотического давления неабсорбированного химуса, вызывающего задержку воды в просвете кишки. Стул становится обильным с большим количеством продуктов гидролитического расщепления нутриентов. При исследовании крови часто выявляется микроцитарная, или В12-дефицитная, анемия, вызванная снижением всасывания железа, витамина В12 и фолиевой кислоты. Уменьшение в сыворотке крови ионов калия, кальция, магния и хлора, белка и холестерина указывает на их плохое всасывание в тонкой кишке.
В патогенезе диареи при БК, инфекционных и других энтеропатий с повреждением СОТК, а также вследствие гамартий (синдромы Пейтца – Егерса и Кронкайта – Канада) преобладает экссудация воды, электролитов и белка в просвет кишки. Стул жидкий, часто с кровью и гноем. Характерны боли в животе, лихорадка, анорексия, похудение и отеки. В анализах крови наблюдается лейкоцитоз, повышенная скорость оседания эритроцитов, повышение С-реактивного белка, фекального кальпротектина, гипоальбуминемия и гипопротеинемия.
БК характеризуется прогрессирующим течением. Различают три фенотипа или формы БК – воспалительную (люминальную), cтенозирующую и пенетрирующую (экстралюминальную), осложняющуюся межкишечными и иными свищами, абсцессами и инфильтратами в брюшной полости. В отличие от БК негранулематозный неспецифический еюноилеит не имеет склонности к стенозам и экстралюминальным осложнениям.
Основным проявлением ЭП, ассоциированной с артериовенозными мальформациями кровеносных и лимфатических сосудов, могут быть рецидивирующие кровотечения, источником которых служат повреждения (изъязвления) артериовенозных ангиэктазий. При лимфангиэктазиях возникает избыточная потеря белка в просвет кишки.
Диагноз и дифференциальная диагностика
Нозологическая диагностика болезней тонкой кишки улучшается по мере усовершенствования иммунологических, рентгенологических и особенно эндоскопических методов [2]. На рисунке 5 показаны возможности каждого из них в распознавании ЭП.
Основное значение для установления нозологического диагноза целиакии, коллагеновой и тропической спру, болезни Уиппла, ГГГС, эозинофильного гастроэнтерита имеет гистологическое исследование биоптатов СОТК, полученных из дистального отдела двенадцатиперстной кишки. Тем не менее надо иметь в виду, что сходная с целиакией атрофия ворсинок слизистой оболочки вблизи луковицы двенадцатиперстной кишки развивается у ряда больных кислотозависимыми заболеваниями вследствие влияния на нее пептического фактора. Диагностике ГЦ в этих случаях помогают иммунологические исследования на антитела к тканевой трансглутаминазе (АТтТГ) и антитела к диамидированному пептиду глиадина (АТДПГ), которые отсутствуют при пептических дуоденитах [3].
Атрофию ворсинок, напоминающую таковую при ГЦ, можно наблюдать и у пациентов с общим вариабельным иммунодефицитом, особенно при наличии симптомов мальабсорбции. В этом случае речь идет о ГГГС [1]. Для эозинофильного гастроэнтерита характерна эозинофильная инфильтрация стенки кишки, не имеющая отношения к аллергии пищевого или паразитарного происхождения.
Правильный диагноз в этих случаях устанавливают при гистохимическом исследовании биоптатов, полученных из патологически измененной СОТК, а также с помощью ультразвукового исследования (УЗИ), компьютерной (КТ) или магнитно-резонансной томографии (МРТ).
Ответ на АГД является тестом на целиакию, хотя некоторое клиническое улучшение может наблюдаться и при ЭП, не связанной с глютеном [5]. Поэтому данный симптом следует оценивать с осторожностью как диагностический признак. У больных с незначительным повышением АТтТГ IgА и АТДПГ рекомендуется проводить тест на HLA-DQ2/DQ8. Диагностика целиакии с использованием генотипов HLA-DQ2 и HLA-DQ8 основана на тесной связи между ГЦ и определенными типами HLA: более чем у 95% больных определяются DQ2, а почти у всех остальных – DQ8.
К ЭП, не связанной с глютеном, относится аутоиммунная форма. Диагноз аутоиммунной ЭП правомочен, если пациент с клинической картиной целиакии и аутоиммунными манифестациями не отвечает на АГД. Диагностике помогают первоначальные результаты серологических тестов на ГЦ, определение антител к энтероцитам или бокаловидным клеткам, HLA-DQ2/DQ8-тестирование, повторная биопсия и сравнение гистологической картины с ранее выполненной биопсией СОТК.
Современные методы хотя и расширили возможности распознавания ЭП, но не решили многих проблем дифференциальной диагностики. Это связано с тем, что патоморфологические признаки ЭП (изменения слизистой оболочки, формы и высоты складок, просвета кишки, ее тонуса) не являются специфическими при ЭП у больных с НПВП-ассоциированной энтеропатией и другими заболеваниями тонкой кишки.
Эндоскопический, рентгенологический и ультразвуковой методы при визуализации пораженного участка кишки дополняют друг друга. Глубокая эндоскопия тонкой кишки и капсульная эндоскопия обладают высокой чувствительностью и специфичностью к обнаружению воспалительных проявлений СОТК. Более глубокие слои кишечной стенки доступны оценке при изображении кишки в поперечном сечении, позволяющем обнаружить стриктуры, свищи и абсцессы. Поэтому при БК одинаково важное значение имеет как осмотр поверхности кишки, позволяющий увидеть афты, изменение рельефа и диаметра просвета кишки, доступные эндоскопическому методу, так и оценка толщины всей стенки кишки с помощью УЗИ, КТ и МРТ, особенно с использованием контрастных растворов, введенных внутривенно.
Особые трудности представляет распознавание ЭП, причиной которой служит випома, гастринома, карциноид и другие нейроэндокринные опухоли (НЭО). Основным клиническим проявлением ЭП при НЭО является хроническая диарея, преимущественно водянистая, резистентная к терапии. При диффузном типе распределения нейроэндокринных опухолевых клеток в СОТК постановка диагноза особенно трудна и основана на выявлении в крови повышенной концентрации соответствующего гастроинтестинального гормона (гастрина, вазоактивного интестинального пептида, серотонина и др.), а также хромогранина А – высокочувствительного и специфичного маркера НЭО [6] с последующей верификацией самой опухоли в кишечнике или поджелудочной железе.
На рисунке 6 показан алгоритм дифференциальной диагностики ЭП, созданный нами, на основе предложенного K. Pallav и соавт. алгоритма диагностики нецелиакальной ЭП [7]. Больному с патогистологическими признаками ЭП проводят серологические тесты на целиакию. Повышенный уровень АТтТГ и/или АТДПГ позволяет установить ГЦ и назначить лечение с обязательным соблюдением АГД. Положительный ответ на лечение, наступающий обычно уже через 10–15 дней, подтверждает диагноз ГЦ, и больному пожизненно назначается АГД. При отсутствии улучшения необходимо провести генетическое исследование на HLA-DQ2 и HLA-DQ8. Положительные результаты типирования у пациента с атрофией ворсинок и гиперплазией крипт дают основание для диагностики целиакии, не связанной с глютеном, то есть рефрактерной спру. У больного, не имеющего гаплотипов DQ2 или DQ8, необходимо оценить иммунный статус. При снижении IgA нужно провести тест на антитела к ДПГ и при положительных значениях антител можно подтвердить у больного ГЦ, а при их отсутствии – ЭП, не связанную с глютеном. Окончательный диагноз устанавливают после повторной оценки гистологических препаратов с целью исключения коллагеновой спру, тропической спру, болезни Уиппла, эозинофильного гастроэнтерита и аутоиммунной ЭП. Обследование больных рефрактерной целиакией следует проводить, памятуя о высоком риске развития у них Т-клеточной лимфомы, ассоциированной с ЭП.
При выявлении у больного с атрофией ворсинок СОТК общего вариабельного иммунодефицита и нормальном уровне альбуминов правомерен диагноз ГГГС.
Дифференциальную диагностику со специфическими ЭП инфекционной этиологии осуществляют с применением бактериологических исследований. ЭП, связанную с дефицитом лактазы или других ферментов тонкой кишки, верифицируют с помощью биохимических тестов с определением их в биоптатах СОТК.
Терапия больных ЭП может быть этиотропной, патогенетической и симптоматической. В таблице 2 приведены принципы терапии.
Этиотропная терапия. В основе этиотропной терапии ГЦ лежит строгая пожизненная приверженность АГД. Соблюдение этого принципа наряду с безусловно положительными влияниями несет в себе много проблем. Они связаны с ограничениями социальных и бытовых условий жизни больного. Исключение из рациона пшеницы, ржи и ячменя существенно сужает качественный состав пищевого рациона, затрудняет его обеспечение, тем более что многие из продуктов (мясные, кисломолочные и др.) содержат глютен, делает его более дорогим. В большинстве развитых стран налажена маркировка продуктов на содержание глютена. Больные получают денежные дотации. Специалисты в области пищевой промышленности работают над созданием генетически модифицированных сортов пшеницы, лишенных иммуногенных антигенных детерминант. Фармацевтическая промышленность приступила к созданию ферментных препаратов, способных расщеплять глиадин: проходит клинические испытания пролилэндопептидаза. Исследуются агенты типа октапептида АТ-1001, которые блокируют рецепторы зонулина и тем самым уменьшают проницаемость межэпителиальных соединений и приток глютена в собственную пластинку СОТК.
Больным аллергическим гастроэнтеритом из рациона исключают пищевые аллергены. При болезни Уиппла применяют диету, бедную длинноцепочечными и обогащенную среднецепочечными триглицеридами, которые содержатся в продуктах энтерального питания (нутризон, портаген, энтритион, изокал и др.). Пациентам с нарушением всасывания назначают диету с повышенным количеством белка (до 130 г/сут). Основным методом устранения гипопротеинемии является длительное внутривенное введение белоксодержащих растворов, в первую очередь альбумина и гамма-глобулина. Всем больным показаны препараты калия, кальция, железа. Дважды в год назначают курсы лечения витаминами.
Пациентам с ЭП инфекционной этиологии назначают антибиотики.
При болезни Уиппла и ЭП, ассоциированной с лимфангиэктазиями, лечение начинают с введения цефтриаксона по 1 г в/в или в/м каждые 24 часа в течение 2 недель. Затем назначают антибиотики, которые способны проникать через гематоэнцефалический барьер. К таким препаратам относится сочетание триметоприма по 160 мг/сут с сульфаметоксазолом по 1,6 г/сут внутрь. Лечение обычно продолжается от 1 до 2 лет и прекращается только после исчезновения РАS-положительных макрофагов в СОТК.
Пациентам с тропической спру и инфекционными гастроэнтеритами обычно назначают антибиотики из группы хинолонов II поколения (ципрофлоксацин) и нитрофураны (фуразолидон и др.).
К препаратам с этиотропным механизмом также относятся антибиотики местного действия и кишечные антисептики, предотвращающие избыточный рост микрофлоры в тонкой кишке. В последние годы предпочтение отдается более современному и безопасному рифаксимину.
Рифаксимин-альфа (Альфа Нормикс, Alfa Wassermann (Италия)) имеет широкий спектр антибактериальной активности, воздействуя на большинство грамположительных и грамотрицательных как аэробных, так и анаэробных бактерий.
Рифаксимин-альфа демонстрирует практически полное отсутствие всасывания в желудочно-кишечном тракте. Это было убедительно доказано в экспериментальных исследованиях у животных, а затем в клинических исследованиях у здоровых добровольцев и пациентов с заболеваниями кишечника. Всасыванию рифаксимина-альфа препятствует наличие в его молекуле пиридоимидазо-группы, электрический заряд и ароматическое кольцо которой препятствуют прохождению через эпителий кишечника. Установлено, что при пероральном приеме рифаксимина-альфа натощак в крови обнаруживается не более 0,4% от принятой дозы.
Минимальное всасывание действующего вещества в плазму крови снижает риск возникновения системных побочных эффектов, внекишечных лекарственных взаимодействий с другими препаратами, а у пациентов с заболеваниями печени и почек нет необходимости в коррекции дозы.
В последние десятилетия эффективность рифаксимина-альфа активно изучалась в зарубежных и российских плацебоконтролируемых исследованиях.
Рекомендуется следующая схема приема препарата: 800–1200 мг/сут (2 таблетки по 200 мг 2–3 раза в день) в течение 7 дней, ежемесячно с проведением повторных курсов через 20–40 дней по мере необходимости.
Патогенетическая терапия. В лечении ЭП неизвестной этиологии (БК, аутоиммунная ЭП, коллагеновая спру, рефрактерная спру, ГГГС ) применяют системные и топические глюкокортикостероиды (будесонид), препараты 5-аминосалициловой кислоты (Пентаса), иммунодепрессанты (азатиоприн и др.), ингибиторы ФНО-альфа (инфликсимаб, адалимумаб). В ЦНИИГ нами успешно применяется трансплантация аллогенных мезенхимальных стволовых стромальных клеток [8]. В случае осложнения рефрактерной целиакии развитием Т-клеточной лимфомы можно добиться полной ремиссии заболевания с помощью высокодозной полихимиотерапии и трансплантации аутологичных стволовых клеток [9].
В механизмах развития любой ЭП одно из ведущих мест занимает нарушение кишечного пищеварения и всасывания и, как следствие, предрасположенность к избыточному росту микробной флоры в тонкой кишке. Поэтому при обострениях любой ЭП показана антибактериальная терапия (рифаксимин-альфа или кишечные антисептики).
С целью восстановления структуры и пищеварительно-транспортной функции СОТК применяются энтеропротекторы.
Энтеропротектор Энтеросан зарегистрирован в России в 1998 г. как оригинальное лекарственное средство, содержащее природную смесь полимеризированного секрета мышечного отдела желудка птиц. Он содержит гликопротеины, полисахариды, гликозаминогликаны, сиаломуцины, регуляторные пептиды, желчные и нуклеиновые кислоты, протеолитические ферменты. Каждый из компонентов влияет на морфологию и функцию эпителиоцитов СОТК. Энтеросан способен повышать барьерную функцию кишечника, улучшать активность и синтез пищеварительных ферментов тонкой кишки. Препарат способствует улучшению всасывания, восстановлению нормальной кишечной микрофлоры, устранению избыточного роста микробной флоры в тонкой кишке. Энтеросан назначают по 1-й капсуле (0,3 г) 3 раза в день за 15 минут до еды. Курс лечения – 3 недели [10].
К препаратам с патогенетическим механизмом, направленным на улучшение структуры и функции кишечника, относятся также пробиотики. Вырабатываемые симбионтной микрофлорой короткоцепочечные жирные кислоты оказывают разностороннее действие на клеточную дифференциацию, пролиферацию и апоптоз эпителиоцитов кишечника, индукцию продукции антимикробных пептидов, нейротрансмиттеров, гормонов, подвижность кишечника, иммунитет, межклеточные взаимоотношения и т.д. [11]. Поэтому пробиотики (Бифиформ, Пробифор и др.), пребиотики (Инулин, лактулоза, Лизоцим и др.) или их комбинации (Бактистатин) находят все большее распространение в терапии болезней кишечника. Длительность приема 2–3 недели.
Симптоматическая терапия. Симптоматические средства используются при лечении всех ЭП. Для улучшения кишечного пищеварения показаны ферментные препараты, улучшающие кишечное пищеварение (Креон, Лактаза), энтеросорбенты (Смекта, лигнин гидролизный), регуляторы моторики кишечника (тримебутин, лоперамид), регуляторы кишечной секреции (соматостатин).