если азитромицин не помогает при ангине что делать
Возможности клинического применения левофлоксацина
Антибактериальные препараты из группы фторхинолонов занимают одно из ведущих мест в лечении различных бактериальных инфекций, в том числе в амбулаторных условиях. Однако столь популярные в настоящее время ципрофлоксацин, офлоксацин, ломефлоксацин
Антибактериальные препараты из группы фторхинолонов занимают одно из ведущих мест в лечении различных бактериальных инфекций, в том числе в амбулаторных условиях. Однако столь популярные в настоящее время ципрофлоксацин, офлоксацин, ломефлоксацин, пефлоксацин обладают высокой активностью в отношении грамотрицательных возбудителей, умеренной активностью против атипичных возбудителей и малоактивны в отношении пневмококков и стрептококков, что значительно ограничивает их применение, особенно при респираторных инфекциях.
В последнее десятилетие в клиническую практику стали входить новые препараты из этой группы — т. наз. новые фторхинолоны, которые сохраняют высокую активность против грамотрицательных возбудителей, свойственную их предшественникам, и при этом значительно более активны против грамположительных и атипичных микроорганизмов. Одним из таких препаратов является левофлоксацин (таваник). По химической структуре он представляет собой левовращающий изомер офлоксацина. Широкий спектр антибактериальной активности, высокая безопасность, удобные фармакокинетические свойства обусловливают возможность его широкого применения при различных инфекциях.
Механизм действия
Левофлоксацин обладает быстрым бактерицидным действием, поскольку проникает внутрь микробной клетки и подавляет, так же как и фторхинолоны первого поколения, ДНК-гиразу (топоизомеразу II) бактерий, что нарушает процесс образования бактериальной ДНК. Ферменты клеток человека не чувствительны к фторхинолонам, и последние не оказывают токсического действия на клетки макроорганизма. В отличие от препаратов прежнего поколения новые фторхинолоны ингибируют не только ДНК-гиразу, но и второй фермент, ответственный за синтез ДНК, — топоизомеразу IV, выделенную у некоторых микроорганизмов, прежде всего грамположительных. Считается, что именно воздействием на этот фермент объясняется высокая антипневмококковая и антистафилококковая активность новых фторхинолонов.
Левофлоксацин обладает клинически значимым дозозависимым постантибиотическим эффектом, достоверно более длительным по сравнению с ципрофлоксацином, а также длительным (2-3 часа) субингибирующим действием.
Под действием левофлоксацина отмечено повышение функции полиморфноядерных лимфоцитов у здоровых добровольцев и ВИЧ-инфицированных пациентов. Показано его иммуномодулирующее воздействие на тонзиллярные лимфоциты у больных хроническим тонзиллитом. Полученные данные позволяют говорить не только об антибактериальной активности, но и о синергическом противовоспалительном и антиаллергическом действии левофлоксацина.
Спектр антимикробной активности
Левофлоксацин характеризуется широким антимикробным спектром, включающим грамположительные и грамотрицательные микроорганизмы, в том числе внутриклеточные возбудители (табл. 1).
При сравнении эффективности различных антибактериальных препаратов в отношении возбудителей респираторных инфекций было выявлено, что левофлоксацин в отношении противомикробной активности превосходит остальные препараты. К нему оказались чувствительны все штаммы пневмококка, в том числе пенициллинрезистентные, при сравнительно более низкой чувствительности пневмококков к препаратам сравнения: офлоксацин — 92%, ципрофлоксацин — 82%, кларитромицин — 96%, азитромицин — 94%, амоксициллин/клавуланат — 96%, цефуроксим — 80%. К левофлоксацину оказались также чувствительны все штаммы моракселлы катаралис, гемофильной палочки и метициллин чувствительного золотистого стафилококка, 95% штаммов клебсиеллы пневмонии.
Резистентность
Возможность широкого клинического использования левофлоксацина и других новых фторхинолонов заставляет задуматься об опасности развития резистентности к ним. Хромосомные мутации являются основным механизмом, обеспечивающим устойчивость микробов к фторхинолонам. При этом происходит постепенное накопление мутаций в одном или двух генах и ступенчатое снижение чувствительности. Развитие клинически значимой резистентности пневмококков к левофлоксацину наблюдается после трех мутаций, а следовательно, представляется маловероятным. Это подтверждается и экспериментальными данными: левофлоксацин вызывал спонтанные мутации в 100 раз реже, чем ципрофлоксацин, независимо от чувствительности тестируемых штаммов пневмококка к пенициллину и макролидам. Широкое использование препарата в последние годы в США и Японии не привело к росту резистентности к нему. По данным K. Yamaguchi et al., 1999, чувствительность бактерий к левофлоксацину за пять лет, т. е. с момента начала его широкого применения, не изменилась и превышает 90% как для грамотрицательных, так и для грамположительных возбудителей.
Больший риск развития антибиотикорезистентности связан не с пневмококками, а с грамотрицательными бактериями. В то же время, по некоторым данным, применение левофлоксацина в отделениях интенсивной терапии не сопровождается значимым ростом резистентности грамотрицательной кишечной флоры.
Фармакокинетика
Левофлоксацин хорошо всасывается в желудочно-кишечном тракте. Его биодоступность составляет 99% и более. Так как левофлоксацин почти не подвергается метаболизму в печени, это способствует быстрому достижению максимальной его концентрации в крови (значительно более высокой, чем у ципрофлоксацина). Так, при назначении добровольцам стандартной дозы фторхинолона значения его максимальной концентрации в крови при приеме левофлоксацина составляли 2,48 мкг/мл/70 кг, ципрофлоксацина — 1,2 мкг/мл/70 кг.
После приема разовой дозы левофлоксацина (500 мг) его максимальная концентрация в крови, равная 5,1 ± 0,8 мкг/мл, достигается через 1,3-1,6 часа, при этом бактерицидная активность крови против пневмококков сохраняется до 6,3 часа независимо от их чувствительности к пенициллинам и цефалоспоринам. Более длительное время, до 24 часов, сохраняется бактерицидное действие крови на грамотрицательные бактерии семейства Enterobacteriacae.
Период полувыведения левофлоксацина составляет 6-7,3 часа. Около 87% принятой дозы препарата выделяется с мочой в неизмененном виде в течение последующих 48 часов.
Левофлоксацин быстро проникает в ткани, при этом уровни тканевых концентраций препарата выше, чем в крови. Особенно высокие концентрации устанавливаются в тканях и жидкостях респираторного тракта: альвеолярных макрофагах, слизистой бронхов, бронхиальном секрете. Левофлоксацин также достигает высоких концентраций внутри клеток.
Длительный период полувыведения, достижение высоких тканевых и внутриклеточных концентраций, а также наличие постантибиотического действия — все это позволяет назначать левофлоксацин один раз в сутки.
Лекарственные взаимодействия
Биодоступность левофлоксацина снижается при одновременном приеме с антацидами, сукральфатом, препаратами, содержащими соли железа. Интервал между приемом этих лекарственных средств и левофлоксацина должен составлять не менее 2 часов. Других клинически значимых взаимодействий левофлоксацина выявлено не было.
Клиническая эффективность
Существует много публикаций, посвященных результатам клинических исследований эффективности применения левофлоксацина. Ниже представлены наиболее значимых из них.
В многоцентровом рандомизированном исследовании, включившем 590 пациентов, сравнивалась эффективность и безопасность двух режимов лечения: левофлоксацина в/в и/или перорально в дозе 500 мг в сутки и цефтриаксона в/в 2,0 г в сутки; и/или цефуроксима перорально 500 мг два раза в сутки в комбинации с эритромицином или доксициклином у больных с внебольничной пневмонией. Длительность терапии 7–14 дней. Клиническая эффективность составила 96% в группе левофлоксацина и 90% в группе, получавшей цефалоспорины. Эрадикация возбудителей была достигнута соответственно у 98 и 85% больных. Частота нежелательных действий в группе левофлоксацина составляла 5,8%, а в группе сравнения 8,5%.
В другом большом рандомизированном исследовании сравнивалась эффективность лечения больных с тяжелой пневмонией левофлоксацином 1000 мг в сутки и цефтриаксоном — 4 г в сутки. Первые дни левофлоксацин назначили в/в, затем перорально. Результаты лечения в обеих группах оказались сопоставимы, но в группе цефтриаксона наблюдалась достоверно более частая смена антибиотика в первые дни лечения — из-за недостаточного клинического эффекта.
Сопоставимые результаты были получены и при сравнении групп пациентов, получавших лечение левофлоксацином и коамоксиклавом.
Эффективность монотерапии левофлоксацином изучалась у более чем 1000 пациентов с внебольничной пневмонией. Клиническая и бактериологическая эффективность составляли здесь 94 и 96% соответственно.
Фармакоэкономические исследования показали, что общие затраты на лечение пациентов левофлоксацином и комбинацией цефалоспорина и макролида сопоставимы или даже несколько ниже в группе левофлоксацина.
У пациентов с обострением хронического бронхита сравнивалась эффективность лечения левофлоксацином в дозе 500 мг в сутки перорально и цефуроксимом аксетила внутрь 500 мг два раза в сутки. При этом клиническая и бактериологическая эффективность не различалась в зависимости от групп и составляла 77–97%.
Таким образом, в настоящее время можно считать доказанной высокую эффективность левофлоксацина при респираторных инфекциях нижних дыхательных путей. Результаты проведенных исследований позволили включить левофлоксацин как препарат первого ряда или альтернативный в схему лечения пациентов с внебольничной пневмонией и обострениями хронического бронхита (табл. 2).
В последние годы левофлоксацин стал более широко использоваться и при других инфекционных заболеваниях. Так, появились сообщения, касающиеся его успешного применения у больных с острыми синуситами. Левофлоксацин в 100% случаев активен против наиболее часто встречающихся бактериальных возбудителей этого заболевания; по эффективности он сопоставим с амоксициллином/клавуланатом в больших дозах и значительно превосходит цефалоспорины, котримоксазол, макролиды и доксициклин.
Среди возбудителей урологических инфекций наблюдается рост резистентности к широко используемым антибактериальным препаратам. Так, за период с 1992 по 1996 год отмечено увеличение устойчивости E. Coli и S. saprophyticus к котримоксазолу — на 8–16% и к ампициллину — на 20%. Устойчивость к ципрофлоксацину, нитрофуранам и гентамицину возрасла за этот же период на 2%. Применение левофлоксацина у пациентов с осложненными мочевыми инфекциями в дозе 250 мг в сутки оказалось эффективным у 86,7% пациентов.
Выше приводились фармакокинетические показатели высокого содержания левофлоксацина в тканях. Это наряду с антимикробным спектром препарата послужило основанием для его использования с целью профилактики инфекционных осложнений при эндоскопических методах лечения и диагностики, например при ретроградной холангиопанкреатографии и для периоперационной профилактики в ортопедии.
Применение левофлоксацина в этих ситуациях представляется перспективным и требует дальнейшего изучения.
Безопасность
Левофлоксацин считается одним из самых безопасных антибактериальных препаратов. Однако при его назначении существует ряд ограничений.
У пациентов с нарушением функции печени корригировать дозу препарата не нужно, но нарушение функции почек при снижении клиренса креатинина (менее 50 мл/мин) требует уменьшения дозы препарата. Дополнительный прием левофлоксацина после проведения гемодиализа или амбулаторного перитониального диализа не требуется.
Левофлоксацин не применяется у беременных и кормящих женщин, у детей и подростков. Препарат противопоказан пациентам, у которых в анамнезе имеются нежелательные реакции на лечение фторхинолонами.
У больных пожилого и старческого возраста при приеме левофлоксацина не выявлено повышенного риска развития нежелательных побочных реакций и не требуется коррекции доз.
Контролируемые клинические исследования показали, что побочные реакции при применении левофлоксацина возникают редко и большей частью не являются серьезными. Существует зависимость между дозой препарата и частотой развития НД: при суточной дозе 250 мг их частота не превышает 4,0–4,3%, при дозе 500 мг/ сут. — 5,3–26,9%, при дозе 1000 мг/сут. — 22–28,8%. Наиболее часто наблюдались симптомы желудочно-кишечной диспепсии — тошнота и диарея (1,1–2,8%). При внутривенном введении возможно покраснение места инъекции, иногда наблюдается развитие флебитов (1%).
Дозирование
Левофлоксацин выпускается в двух формах: для внутривенного введения и приема внутрь. Применяется по 250-500 мг один раз в сутки, при тяжелых инфекциях возможно назначение по 500 мг два раза в сутки. При внебольничной пневмонии длительность лечения составляет 10-14 дней, при обострении хронического бронхита — 5-7 дней.
Таблица 1. Спектр противомикробной активности левофлоксацина
Гайморит: симптомы, особенности лечения и правила профилактики
Гайморит – это воспалительный процесс в области гайморовой пазухи, расположенной в толще черепной кости над верхней челюстью, слева и справа. Этот процесс является одной из разновидностей синуситов (это общее название для воспалительных процессов в области придаточных пазух – лобной, гайморовой, решетчатой или клиновидной). Обычно воспалительный процесс затрагивает слизистые оболочки, выстилающие пазухи изнутри, реже затрагиваются более глубокие слои тканей, вплоть до костных структур. Обычно процесс возникает как осложнение вирусных или бактериальных инфекций в области носоглотки и верхних дыхательных путей.
Исходя из причины развития, механизмов формирования и симптомов, гайморит бывает нескольких типов. Выделение каждого из них важно для определения тактики лечения, прогноза и разработки мер профилактики.
Острый – развивается быстро, как осложнение ОРВИ, насморков, простудных заболеваний, воспаления в области корней зубов на верхней челюсти. Возбудители проникают через каналы, соединяющие пазухи с полостью носа с гайморовыми пазухами, размножаются в полости. Тело начинает активно вырабатывать иммунные клетки и слизь, чтобы обезвредить патогенные организмы. Если слизь закупорит проток пазухи, возникает давление на стенки, усиление воспалительного процесса. По мере очищения пазухи от содержимого воспалительный процесс постепенно затухает.
Хронический – воспалительный процесс, который длится более 4 недель, имеет вялое или волнообразное течение, с периодами обострений. Обычно возникает из-за не долеченной острой формы, наличия аденоидов, тонзиллитов, отитов.
Гнойный – обычно становится осложнением острой формы либо обострения хронического процесса, если процесс не лечится, предпринимаются попытки самолечения или пациент переносит инфекцию на ногах. Патогенные бактерии накапливаются в пазухах, в смеси с лейкоцитами образуют гнойное содержимое. Самое опасное осложнение при этой форме – прорыв гноя в полость черепа, поражение костных тканей, мозга.
Двусторонний – одна из тяжелых форм, поражение локализовано сразу в обеих пазухах – левой и правой. Нередко возникает как осложнение инфекций в полости рта и носоглотки, обычно грибковой или бактериальной. Обычно имеет острое течение, редко переходит в хроническую форму.
Аллергическое поражение возникает у пациентов, страдающих от чрезмерно активной реакции иммунной системы на различные вещества. Особенно часто эта форма синусита бывает при поллинозе, круглогодичном рините, реакции на плесень, пылевых клещей.
Катаральный – преимущественно бывает у детей. Он развивается при проникновении в полость пазух патогенных организмов, что формирует отек и раздражение слизистых. Считается самой легкой формой болезни, проходящей при активном лечении без осложнений и последствий.
Полипозная форма формируется при образовании полипозных разрастаний слизистых из-за чрезмерно быстрого деления клеток. Рост полипов могут провоцировать инфекции, травмы, велика роль наследственности.
Одонтогенный – формируется как результат серьезных проблем зубов, особенно 4-6 зуба на верхней челюсти, корни которых расположены в непосредственной близости от пазухи. Если возникают проблемы в области корней этих зубов, воспаление и нагноение может переходить на пазуху, она заполняется секретом и воспаляется.
Причины
Придаточные пазухи, включая гайморовы, созданы как естественный барьер на пути инфекций, фильтр для различных опасных веществ в воздухе. Они помогают согревать воздух, увлажнять его и очищать от примесей перед попаданием в гортань, и ниже по респираторному тракту. Основная причина воспаления и появления признаков гайморита – это проникновение бактерий, грибков или вирусов, аллергенов. Реже инфекция попадает с током крови из других, отдаленных очагов.
Нарушать работу пазух могут патологии иммунной системы, частые ОРВИ, респираторная форма аллергии, носительство патогенных бактерий в носоглотке (стафило-, стрепто- или менингококк).
Среди ключевых причин, которые могут привести к развитию гайморита, можно выделить:
Осложнения
Не все люди знают, как начинается гайморит, поэтому многие принимают симптомы за тяжелую простуду и лечатся самостоятельно. Это может привести к определенным осложнениям, отдаленным последствиям. Среди ключевых осложнений можно выделить поражения бронхов и распространение инфекции на легкие, развитие отитов (поражение среднего уха), переход болезни в хроническую форму.
Тяжелый и запущенный, своевременно не вылеченный гайморит может привести к воспалению внутренних органов – сердца, глаз, почек, поражению суставов и мозга, его оболочек. Если образуются гнойные полости в гайморовых пазухах, возможен прорыв гноя в кровь (возникает сепсис), проникновение его в соседние пазухи с развитием пансинусита, воспаление мозговых оболочек с явлениями менингита. Всех этих осложнений можно избежать при полноценном лечении гайморита под руководством лор-врача.
Симптомы и диагностика
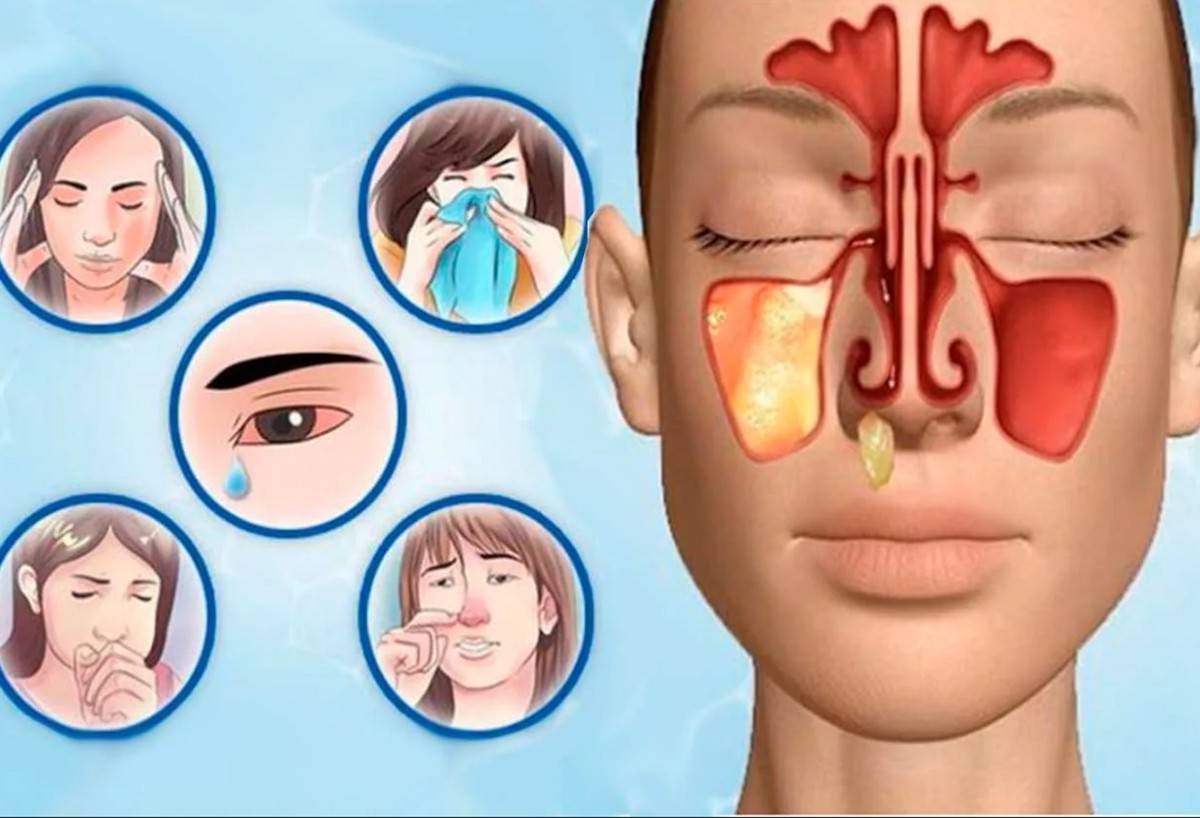
Конечно, при развитии гайморита нужно немедленно обращаться к врачу, но как понять, что гайморит начался? Начальные признаки неспецифичные – это повышение температуры от незначительной до высокой, сильная слабость, заложенность носа или обильные густые выделения, болезненность в проекции пазух или в области лица.
Боль при гайморите может быть различной – от тупой, давящей до сильной, мучительной. Она локализуется в подглазничной области, может отдавать в область переносицы, лобную зону или верхние зубы. При надавливании на область пазух или наклонах головы вперед она усиливается, распространяясь по подглазничной области. Могут краснеть и отекать веки.
Врачи отмечают некоторые особенности того, как проявляется болезнь в определенных возрастных группах. Так, у взрослых самым ключевым признаком могут быть болевые ощущения, головная боль, нарушение восприятия запахов. Может меняться голос, он становится гнусавым, нос сильно заложен, выделяется полупрозрачная или желто-зеленая слизь. Высокая лихорадка типична для острой формы, при хроническом или аллергическом гайморите болезнь может протекать без температуры.
На фоне поражения пазух возможно слезотечение, неприятный привкус во рту, слабость, постоянное утомление, нарушения аппетита, расстройства сна, ознобы и приступы кашля.
Заразен ли гайморит? Само по себе воспаление – это результат влияния патогенных факторов, и это не заразно. Бактерии или вирусы, которые спровоцировали заболевание, могут передаваться от человека к человеку, но не обязательно вызовут поражение пазух.
Диагноз гайморита ставит лор-врач после проведения ряда тестов и осмотра пациента. Важно подробно рассказать, как началось заболевание, какие жалобы были ранее и имеются в данный момент. Врач осмотрит полость носа и глотку, прощупает проекцию пазух, определяя болезненность.
Дополнительно могут понадобиться КТ или МРТ придаточных пазух, рентгенограмма, УЗИ исследование, эндоскопия носоглотки, при необходимости – биопсия полипозных образований. Назначаются анализы крови, посевы отделяемой из носа слизи для определения флоры, чтобы подобрать необходимые препараты.
Как лечить у взрослого
Терапия болезни должна быть комплексной. Она направлена на борьбу с инфекцией, устранение воспаления, налаживание оттока слизи из пазух и улучшение носового дыхания. В неосложненных случаях возможно лечение гайморита дома под постоянным контролем оториноларинголога. В тяжелых случаях и при необходимости хирургического лечения пациент госпитализируется в стационар.
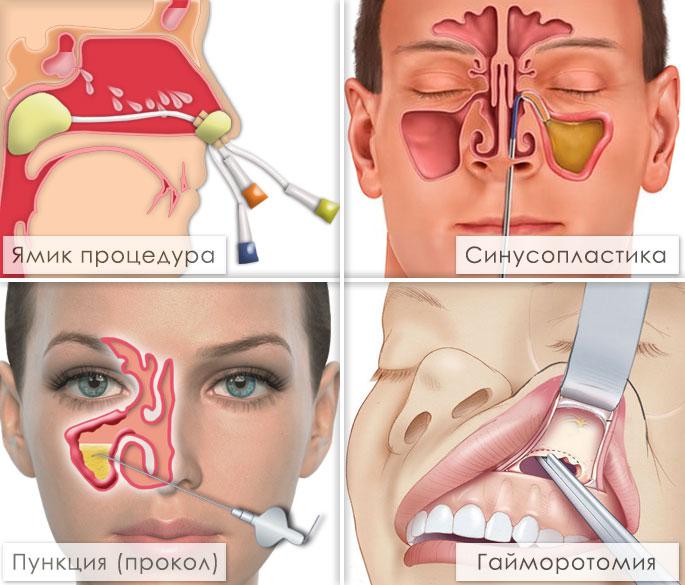
Возможно консервативное лечение с назначением антибактериальных препаратов, противовоспалительных средств, антигистаминных препаратов и различных капель, спреев для носа. Также применяют пункционное лечение или хирургические вмешательства. Выбор зависит от возраста пациента, вида патологии, тяжести состояния и возможных осложнений.
Многим пациентам назначают пункции (с местным обезболиванием) – они помогают удалить гнойное содержимое, помочь в оценке характера воспаления, плюс приносят существенное облегчение. После удаления содержимого пазухи промывают физраствором или фурациллином, вводят растворы антибиотиков и противовоспалительные препараты. Минус подобной тактики – не всегда достаточно одного прокола, поэтому требуется курс процедур в течение нескольких недель. Метод достаточно неприятный, имеет ряд противопоказаний и осложнений, процедура болезненна как во время прокола, так и после него.
Современные тенденции применения азитромицина при остром стрептококковом тонзиллофарингите и остром среднем отите: короткие курсы, высокие дозы
Инфекции дыхательных путей (ИДП) являются одними из наиболее распространенных заболеваний у взрослых и самыми частыми у детей. По данным ВОЗ, частота ИДП у детей младше 5 лет составляет, в среднем, от 4 до 9 эпизодов в год [1].
Инфекции дыхательных путей (ИДП) являются одними из наиболее распространенных заболеваний у взрослых и самыми частыми у детей. По данным ВОЗ, частота ИДП у детей младше 5 лет составляет, в среднем, от 4 до 9 эпизодов в год [1]. В целом, 60% всех обращений к педиатрам связаны с ИДП [2]. Поскольку значимая доля пациентов не обращаются за медицинской помощью, реальный уровень заболеваемости ИДП еще выше. Однако ИДП — это не только медицинская, но и значимая экономическая проблема. Экономический ущерб, причиняемый ИДП, является колоссальным — так, ежегодные экономические затраты на терапию ИДП (исключая грипп) приближаются к 40 млрд долларов США, при этом прямые медицинские затраты (посещение врача, вызовы неотложной помощи, стоимость назначенного лечения) составляют 17 млрд долларов, а непрямые (пропущенные дни учебы и рабочие дни) — 22,5 млрд долларов США [3]. В связи с этим все большее внимание врачей привлекает возможность быстрого излечения пациентов с ИДП с использованием антибактериальных препаратов (АБП), которые можно применять короткими курсами. Кроме того, за последнее десятилетие наметилась тенденция использования более высоких доз АБП при лечении инфекций не только в стационарах, но и в амбулаторной практике. Основанием для этого является необходимость достижения высоких концентраций препарата в очаге инфекции, эффективных не только против высокочувствительных штаммов, но и против штаммов, обладающих определенными механизмами устойчивости к АБП, а главное — стремление предотвратить селекцию резистентных штаммов, происходящую при терапии субоптимальными дозами антибиотиков. Однако использование высоких доз возможно только при назначении безопасных АБП, не имеющих серьезных дозозависимых нежелательных лекарственных реакций (гепатотоксичности, кардиотоксичности и т. д.).
Азитромицин — первый представитель группы полусинтетических 15-членных макролидных антибиотиков (азалидов) — применяется в клинической практике с 1991 г. и является одним из наиболее часто назначаемых препаратов во многих странах мира. В настоящее время азитромицин одобрен Администрацией США по продуктам питания и лекарственным средствам (Food and Drug Administration — FDA) для использования у взрослых и детей старше 6 месяцев для лечения инфекций, вызванных чувствительными к нему возбудителями, в том числе ИДП [4].
Рекомендованные в мире режимы применения азитромицина при ИДП (остром стрептококковом тонзиллофарингите, остром среднем отите, остром бактериальном синусите, внебольничной пневмонии) и у детей, и у взрослых основаны на результатах рандомизированных контролируемых сравнительных клинических исследований. Необходимо подчеркнуть, что все исследования, послужившие основой для определения оптимальных режимов дозирования азитромицина, проводились с использованием оригинального препарата (Сумамед ® в Европе и Зитромакс ® в США), поэтому недопустимо переносить данные о его эффективности и безопасности на дешевые дженерики сомнительного качества, не имеющие доказательств биоэквивалентности и терапевтической эквивалентности с оригинальным препаратом.
В данной публикации предпринята попытка обобщить имеющиеся на настоящий момент сведения, касающиеся возможностей использования коротких курсов азитромицина при остром стрептококковом тонзилофарингите и остром среднем отите, а также выбора оптимального режима дозирования азитромицина при данных нозологических формах.
Острый тонзиллофарингит
Наиболее частыми этиологическими агентами острого тонзиллофарингита являются вирусы (риновирусы, доля которых в этиологической структуре составляет 20%, коронавирусы — более 5%, аденовирусы — около 5%, вирусы парагриппа и др.) и стрептококки, а именно бета-гемолитический стрептококк группы А (БГСА) (Streptococcus pyogenes) — 15–30%, бета-гемолитические стрептококки групп С и G (5–10%), в редких случаях встречается смешанная аэробно-анаэробная флора, другие бактериальные патогены — Neisseria gonorrhoeae, Corynebacterium diphtheriae, Arcanobacterium haemolyticum (ранее Corynebacterium haemolyticum), Yersinia enterocolitica, Treponema pallidum, Chlamydophila pneumoniae, Mycoplasma pneumoniae [5]. В 30% случаев этиологию острого тонзиллофарингита установить не удается.
Известно, что БГСА — единственный распространенный возбудитель тонзиллофарингита, при выделении которого показана антимикробная терапия, причем целью назначения АБП является не только устранение симптомов тонзиллофарингита, а, прежде всего, эрадикация БГСА из ротоглотки и профилактика возникновения поздних иммуноопосредованных осложнений (острой ревматической лихорадки и острого гломерулонефрита) [6]. Учитывая универсальную чувствительность БГСА к бета-лактамам, препаратами выбора в терапии БГСА-тонзиллофарингита являются пенициллины, при наличии в анамнезе аллергических реакций на бета-лактамы — макролиды и линкозамиды [7]. Следует отметить, что по данным исследования ПеГАС-I в 2001–2003 гг. устойчивость БГСА к макролидам в России (в отличие от многих стран Европы Азии и США) составляет не более 8%, т. е. макролиды сохраняют свою активность [9].
В последние годы появился целый ряд сообщений о случаях неэффективности пенициллина для эрадикации S. pyogenes со слизистой миндалин и задней стенки глотки, частота которых может достигать 30–40% [10–12]. В 2001 г. были опубликованы объединенные данные двух рандомизированных простых слепых многоцентровых исследований эффективности применения пенициллина (феноксиметилпенициллина или бензилпенициллина) в рекомендуемых дозах при лечении БГСА-тонзиллофарингита у детей [10]. Оказалось, что, несмотря на 100% чувствительность пиогенного стрептококка к пенициллину, микробиологическая неэффективность (отсутствие эрадикации БГСА из носоглотки на 10–14 или 29–31 день) отмечалась у 35% пациентов, получавших феноксиметипенициллин, и у 37% пациентов, получавших бензилпенициллин [10].
Среди наиболее часто упоминаемых причин неудачной эрадикации БГСА отмечают: 1) низкую комплаентность 10-дневных курсов пенициллина; 2) повторное заражение стрептококками от инфицированных членов семьи; 3) разрушение пенициллина ко-патогенами полости рта; 4) недостаточное проникновение антибиотика в ткань миндалин; 5) использование контаминированных зубных щеток, протезов; 6) передачу БГСА от домашних животных (кошек, собак); 7) явления толерантности стрептококков к пенициллину [12, 13].
Еще одной недавно установленной причиной неэффективности эрадикации S. pyogenes является наличие у пиогенного стрептококка способности проникать в эпителиальные клетки слизистых оболочек. Однако далеко не все антибактериальные препараты способны эффективно воздействовать на внутриклеточно локализованных патогенов. В ходе исследования, выполненного E. L. Kaplan с соавт. на культуре эпителиальных клеток слизистой оболочки глотки человека (HEp-2), проводилось изучение жизнеспособности внутриклеточно локализованных БГСА после воздействия на них антибиотиков, рекомендованных для лечения БГСА-инфекций [14]. Результаты воздействия препаратов (пенициллин, эритромицин, азитромицин, цефалотин и клиндамицин) оценивались с применением трех методик: электронной микроскопии ультратонких срезов внутриклеточно локализованных БГСА, качественного подтверждения присутствия антибиотика в эпителиальных клетках и специальной оценки жизнеспособности внутриклеточно локализованных S. pyogenes после воздействия препаратов. Как оказалось, пиогенные стрептококки, локализованные внутри клеток, сохраняли жизнеспособность, несмотря на воздействие на эпителиальные клетки пенициллина. В то же время антибиотики группы макролидов (азитромицин и эритромицин) обладали бактерицидным эффектом в отношении данных микроорганизмов. Результаты электронной микроскопии подтвердили отсутствие внутриклеточной фрагментации БГСА (свидетельствующей об их гибели) после воздействия пенициллина. В отличие от этого после воздействия макролидов отмечалась явная фрагментация микроорганизмов. Цефалотин и клиндамицин превосходили пенициллин, но уступали эритромицину и азитромицину по эффективности разрушения внутриклеточно локализованных БГСА. Таким образом, полученные данные позволяют сделать заключение о том, что причиной неэффективности эрадикации S. pyogenes у ряда пациентов является внутриклеточное расположение БГСА и недостаточная способность пенициллина проникать в эпителиальные клетки [14].
В 2007 г. в РФ были изданы практические рекомендации «Применение антибиотиков у детей в амбулаторной практике» (под ред. А. А. Баранова и Л. С. Страчунского), рекомендованные учебно-методическим объединением по медицинскому и фармацевтическому образованию вузов России в качестве учебного пособия для системы последипломного профессионального образования врачей [8]. В соответствии с данными рекомендациями препаратом выбора в лечении БГСА-тонзиллофарингита является феноксиметилпенициллин, альтернативными препаратами — «депо-пенициллины» (бензатина бензилпенициллин), цефалоспорины I–II поколения, макролиды (эритромицин, азитромицин, кларитромицин, рокситромицин, мидекамицин, спирамицин), линкозамиды. Для достижения эрадикации БГСА из ротоглотки все АБП, за исключением однократного введения бензатина бензилпенициллина и 5-дневного курса азитромицина, должны применяться в течение 10 дней.
В 2009 г. были опубликованы результаты Кокрановского метаанализа, сравнивавшего эффективность 3–6-дневных курсов антибактериальной терапии с использованием коротких курсов различных АБП (чаще всего, азитромицина) со стандартным 10-дневным курсом феноксиметилпенициллина при лечении пациентов с острым БГСА-тонзиллофарингитом [15]. В метаанализ были включены рандомизирован-ные контролируемые исследования (РКИ), проведенные у детей в возрасте от 1 до 18 лет с острым БГСА-тонзиллофарингитом.
Вполне логичным является вопрос об оптимальном режиме дозирования азитромицина при БГСА-тонзиллофарингите. В исследованиях азитромицина при лечении стрептококкового тонзиллофарингита можно встретить самые разнообразные схемы терапии с применением 3- или 5-дневных курсов и курсовой дозой препарата от 30 до 60 мг/кг.
В 2005 г. был опубликован метаанализ РКИ азитромицина у взрослых и детей со стрептококковыми тонзиллофарингитами, выполненный J. Casey и M. Pichichero [16]. Всего в метаанализ было включено 14 исследований у детей и 5 — у взрослых (общее число пациентов 4626). В ходе метаанализа были изучены различные режимы дозирования азитромицина у детей и взрослых. Так, у детей в различных исследованиях азитромицин применялся в курсовых дозах 30 мг/кг (10 мг/кг/сутки в течение 3 дней или 10 мг/кг/сутки в первый день и по 5 мг/кг/сутки во 2–5 дни лечения) или 60 мг/кг (20 мг/кг/сутки в течение 3 дней или по 12 мг/кг/сутки в течение 5 дней). У взрослых пациентов азитромицин назначался по 500 мг в день в течение 3 дней или 500 мг в первый день и затем по 250 мг в день в течение 4 дней. Целью метаанализа было сравнение эффективности коротких курсов азитромицина и стандартных 10-дневных курсов других АБП (пенициллина, эритромицина, цефаклора, кларитромицина и амоксициллина/клавуланата).
Оказалось, что у детей азитромицин в курсовой дозе 60 мг/кг достоверно превосходил по эффективности 10-дневный курс препарата сравнения (ОШ 5,27, 95% ДИ 3,34–8,32, р 0,05). В течение 1-го месяца периода последующего наблюдения не было отмечено случаев рецидива заболевания [22].
*НИИ антимикробной химиотерапии СГМА, **СГМА, Смоленск