Эстрогензависимые опухоли что к ним относится эстрогенозависимые у женщин
Что такое менопауза? В каком возрасте начинается?
Что такое менопауза
Менопауза (климактерический период, климакс) – это не болезнь, а новый этап в жизни женщины, который сопровождается рядом физиологических и психологических изменений. В этот период ухудшается самочувствия, возникает ряд неприятных симптомов, о которых нужно знать. Важно понимать, что является нормой, а что патологией.
Климакс (в переводе с греческого «ступень») – это физиологический процесс угасания репродуктивной функции в результате ослабления гормональной функции яичников. Для климактерического периода характерен ряд нейроэндокринных, обменных, психоэмоциональных и вазомоторных изменений. Тяжесть состояния женщины зависит от наследственности, образа жизни и индивидуальных особенностей организма.
Почему появляется
Во сколько лет наступает
Яичники завершают свое функционирование не в один момент, этот процесс длится годами. В среднем менопауза наступает после 50 лет, однако рамки могут сдвигаться как в сторону увеличения, так и уменьшения. В зависимости от возраста наступления климактерических проявлений выделяют 4 вида климакса. Информация в таблице.
Менопаузу можно отсрочить, если отказаться от вредных привычек, избегать стрессов, вести регулярную сексуальную жизнь, поддерживать хорошую физическую форму, высыпаться и придерживаться здорового питания. Особенно эти рекомендации ценные для женщин с плохой наследственностью.
О менопаузе принято говорить, когда месячные отсутствуют в течение года. После наступает постменопаузальный период или постменопауза.
Как понять, что началась менопауза
Каждая женщина должна знать, какие признаки менопаузы. Главный симптом, по которому можно догадаться, что начинается менопауза, это изменение в месячных. Они не сразу прекращаются, как думают многие. Месячные становятся нерегулярными (идут раз в 2-3 месяца или наоборот каждые 2-3 недели), обильными или скудными.
На фоне гормональной перестройки появляются и другие симптомы:
Симптомы менопаузы могут сохраняться в течение 4-х лет после прекращения последних месячных, но их выраженность можно уменьшить.
Гипоэстрогенные состояния у женщин репродуктивного, пре- и менопаузального возрастов
Патогенетической терапией лечения ранневременных симптомов гипоэстрогении является заместительная гормональная терапия (ЗГТ). В случае противопоказаний к ЗГТ или отказа от нее, достаточно эффективны альтернативные фитопрепараты, которые в меньшей степени,
К гипоэстрогенным состояниям относятся изменения в организме женщин на фоне снижения или прекращения выработки эстрогенов яичниками.
В первую очередь возникает комплекс вегетативно-сосудистых, нейроэндокринных и нейропсихических симптомов (ранневременные расстройства). Затем появляются урогенитальные и сексуальные нарушения, изменения внешности (средневременные расстройства). В последнюю очередь наступают поздневременные обменные нарушения: остеопороз, ишемическая болезнь сердца, болезнь Альцгеймера [1].
Эти многочисленные симптомы гипоэстрогении связаны с наличием огромного количества рецепторов к эстрогенам в различных органах и системах женщины: половых органах, гипоталамусе и гипофизе, сердечно-сосудистой системе, уретре и мочевом пузыре, коже и волосах, толстом кишечнике, печени [2].
Вышеназванные изменения могут возникать не только естественно в климактерическом периоде, но и при воздействии на организм женщины других факторов: после хирургических операций (удаление или резекция яичников по поводу кист и апоплексии, ампутации матки); при истощении фолликулярного аппарата (синдром истощения яичников) [3, 4]; при извращенной реакции эстрогеновых рецепторов (синдром резистентных яичников); на фоне применения некоторых лекарственных препаратов, в частности агонистов рилизинг-гормонов (АГ-РГ); при лечении эстроген-зависимых заболеваний женской половой системы, а также в длинных протоколах стимуляции суперовуляции программы экстракорпорального оплодотворения (ЭКО) при лечении бесплодия (требует add-back терапии для снятия нейровегетативных симптомов) [5, 6].
Гипоэстрогенные состояния, связанные с незначительным снижением продукции эстрогенов (при щадящей резекции яичников, каутеризации не поликистозных, а мультифолликулярных яичников и др.), имеют свои особые клинические проявления, чаще всего приводящие к нарушению репродуктивной функции (ановуляция, недостаточность лютеиновой фазы; сниженный овариальный резерв, приводящий к бедному ответу яичников в программах ЭКО) [7]. По нашим данным в программах ЭКО такие пациентки встречаются в 22,3% случаев.
Гипоэстрогения в климактерическом периоде может служить моделью для изучения классических клинических проявлений этого состояния, т. к. климактерий это естественный достаточно длительный биологический процесс перехода от периода репродукции к старости, в основе которого лежит постепенное угасание функции яичников и снижение продукции эстрогенов. Наиболее ярко проявляют себя ранневременные расстройства [1]. Комплекс симптомов ранневременных расстройств при определенной степени выраженности принято называть климактерическим синдромом (КС). По нашим данным, полученным совместно с И. В. Бесман [8], КС в перименопаузе встречается в 57,6% случаев, при этом в 65% — в осложненной форме (т. е. на фоне экстрагенитальной патологии). Осложненная форма КС обуславливает максимальную выраженность симптомов КС. В настоящее время ранневременные симптомы гипоэстрогении связывают с дезорганизацией функции лимбико- ретикулярного комплекса. С нарушением функции гипоталамуса связывают такие проявления ранневременных расстройств, как приливы, гипергидроз, сердцебиение, гипертензия. С нарушением функции лимбической системы связывают депрессию, нарушение сна, головные боли, снижение памяти. Все ранневременные нарушения снижают качество жизни женщины, но особенно это касается приливов и расстройств сна. Приливы могут беспокоить женщину 5–10–20 и более раз в сутки. Расстройства сна: удлинение периода засыпания, частое пробуждение ночью, поверхностный сон — не дают ощущения полноценного отдыха. Несомненно, все эти нарушения требуют дифференцированного подхода к лечению в зависимости от причины гипоэстрогении и возраста, в котором они наступают.
Безальтернативной патогенетической терапией ранневременных симптомов гипоэстрогении считается сегодня заместительная гормональная терапия (ЗГТ) [1, 6]. У женщин репродуктивного возраста после оперативного удаления или резекции яичников, с синдромами резистентных и истощенных яичников лечение можно начинать с комбинированных эстроген-гестагенных препаратов [1]. Это могут быть современные трехфазные препараты, например Клайра. У женщин после гистерэктомии терапия проводится с использованием натуральных эстрогенов с последующим добавлением гестагенов [6]. При плохой переносимости пероральных препаратов можно рекомендовать их в виде геля или пластыря для чрезкожного введения (Эстрожель, Дивигель, Климара) с периодическим назначением гестагенов вагинально (например, Утрожестан). Длительность ЗГТ определяется состоянием и самочувствием пациентки.
В климактерическом периоде при лечении ранневременных расстройств важно придерживаться позиции Международного общества по менопаузе (2007 г.):
Кроме того, должны учитываться современные принципы назначения ЗГТ:
Противопоказания к ЗГТ:
Интересен по своему составу препарат Менопейс Плюс, в который входят капсулы с витаминами и минералами (21 компонент), а также растительные таблетки, содержащие изофлавоны сои, лигнаны семян льна, шалфей и зеленый чай. Составляющие растительной таблетки превращаются в фитоэстрогены в кишечнике, благоприятно действуют на нервную систему, уменьшают приливы, являются источниками антиоксидантов. Цикл приема этого препарата по одной капсуле и одной растительной таблетке в день составляет 28 дней.
Мы, совместно с И. В. Бесман [9], имеем опыт применения альтернативных ЗГТ растительных средств, при лечении осложненной формы КС в случаях, когда ЗГТ было противопоказано. Наши исследования показали, что качество жизни этих пациенток, определяемое по специальной шкале, несколько хуже, чем у тех, кто принимал ЗГТ; но значительно лучше, чем у тех, кто не принимал вообще никаких препаратов. Кроме того, эти средства дают хороший эффект при купировании вазомоторных симптомов в длинных протоколах с АГ-РГ программ ЭКО.
Все вышесказанное еще раз подтверждает мнение специалистов о том, что дифференцированный подход к лечению ранневременных нарушений при гипоэстрогенных состояниях с применением ЗГТ различных режимов или альтернативных растительных средств дает хороший эффект и значительно улучшает качество жизни женщин.
Литература
ГБУЗ МО МОПЦ, Балашиха
Abstract. Pathogenetic therapy treatment of early symptoms of hypoestrogenism consists of hormone replacement therapy (HRT). In the case of contraindications to the HRT medication or refusal of a woman, alternative herbal medication is effective less than HRT, but however improves the quality of life.
Возможен ли рак от избытка эстрогена
» data-image-caption=»» data-medium-file=»https://i2.wp.com/medcentr-diana-spb.ru/wp-content/uploads/2019/03/povyshennyj-estragen1.png?fit=450%2C300&ssl=1″ data-large-file=»https://i2.wp.com/medcentr-diana-spb.ru/wp-content/uploads/2019/03/povyshennyj-estragen1.png?fit=828%2C550&ssl=1″ />
Гормон эстроген продлевает молодые годы женщины, полезен для здоровья сердца и сосудов, укрепляет костную систему, помогает избавиться от избыточного веса.
Эстроген положительно влияет на состояние кожи и волос, нормализует свёртываемость крови. Только перепроизводство эстрогена может привести к появлению злокачественной опухоли в матке, груди и яичниках.
Особенности избытка эстрогена
Этот гормон производится в яичниках, но при нарушении, он может вырабатываться в печени, головном мозге, надпочечниках, мышцах, плаценте.
Симптомы
О повышенном гормональном фоне сигнализирует:
Причины
Выработка эстрогена снижается с наступлением климакса. Это приводит к сухости влагалища, снижению интимного интереса к мужчине.
Как нормализовать гормональный фон?
К счастью, количество эстрогена можно регулировать.
Важно следить за объёмом талии. Избыток жировой ткани на животе активирует выработку эстрогенов. Риск возрастает, если окружность талии приближается к 90 см. В этом случае нужно лечиться у эндокринолога.
Развитие онкологии груди
Особенно часто гормональная опухоль развивается в молочной железе.
Раннюю онкологию обнаружить можно только при медицинском обследовании. До 40 лет молочные железы обследуют с помощью УЗИ. После 40 лет поможет маммография. Обследоваться нужно ежегодно.
Менопаузальная гормонотерапия (МГТ)

Почему же процент женщин, принимающих МГТ, остается невысоким?
Крупное американское исследование WHI (Women’s Health Initiative, 2002 г.) вызвало драматический период в судьбе менопаузальной гормонзаместительной терапии, что способствовало резкому сокращению МГТ в большинстве стран мира, появлению страхов и сомнений в отношении пользы и рисков.
Преждевременное завершение части исследования по менопаузальной гормонзаместительной терапии (МГТ) привлекло к себе всеобщее внимание. Как женщины, так и врачи чувствовали себя обманутыми, так как терапия, которая до этого считалась полезной для здоровья в долгосрочной перспективе, теперь оказалась опасной. Отличающийся от фактического изложения пресс-релиз предварительной работы прогремел в СМИ за неделю до того, как сама статья стала доступна для большинства читателей. Сообщалось, что исследование было остановлено в связи с повышенным риском развития рака молочной железы, связанным с заместительной гормональной терапией. На самом деле, в скорректированном анализе связь МГТ и рака молочной железы не была статистически значима!
Последующий углубленный анализ результатов WHI показал, что МГТ характеризуется благоприятным профилем пользы/риска у более молодых женщин, которые начинают терапию в близкие к менопаузе сроки. Эти результаты характеризовались сходным защитным воздействием терапии в отношении ИБС и снижения общей смертности, которые были продемонстрированы ранее в крупномасштабных наблюдательных исследованиях с участием относительно молодых женщин. После WHI широкое распространение получила так называемая временная гипотеза или гипотеза «окна терапевтических возможностей», согласно которой существует различное влияние МГТ на атеросклероз и связанные с ним клинические события в зависимости от возраста женщины и времени начала использования МГТ по отношению к моменту наступления менопаузы.
Основными недостатки данного исследования являлись:
Что же происходит с женским организмом в 45-55 лет?
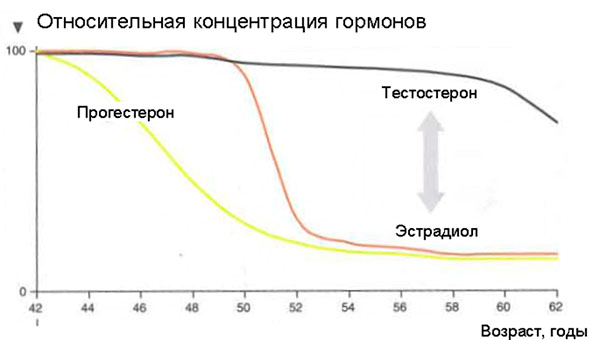
Что будет если МГТ не проводить?
А зачем нужно так «рисковать» и принимать «страшные» гормональные препараты при наступлении менопаузы? Ведь это естественный процесс, может, пусть все идет, как заведено природой? — Но тогда мы неизбежно столкнемся с заболеваниями, которые также предопределены природой.
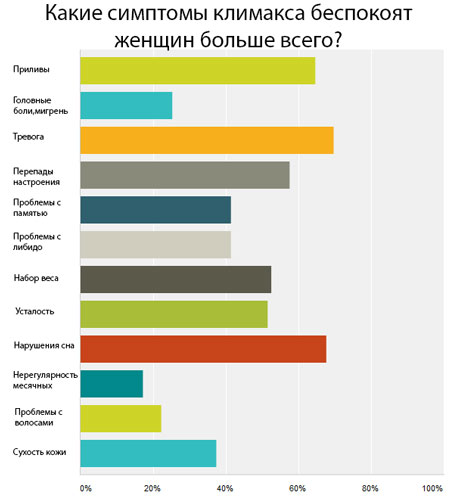
Сначала появляются ранние симптомы:
Через некоторое время появятся и поздние нарушения, связанные с длительным дефицитом половых гормонов:
Какое обследование проводится перед МГТ
Перед назначением менопаузальной гормональной терапии необходимо обследование (впрочем, которое необходимо проводить хотя бы раз в год и без терапии всем сознательным женщинам старше 45 лет).
Дополнительные обследования (при соответствующих данных анамнеза):
Когда пора начинать менопаузальную гормональную терапию?
Но проблема в том, что диапазон нормы ФСГ огромен, и для каждой женщины уровень свой. В идеале нужно сдать анализы крови на гормоны в период максимального расцвета – с 19 до 23 лет. Это и будет вашей индивидуальной идеальной нормой. А начиная с 45 лет ежегодно сверять с ней результаты. Но даже если вы впервые слышите о ФСГ – лучше поздно, чем никогда: в 30, 35, 40 лет имеет смысл выяснить свой гормональный статус, чтобы ближе к критическому возрасту было, на что ориентироваться.
Как самостоятельно понять, что пришло время МГТ?
Уровень эстрогенов снизился, если:
Препаратов огромное количество, какие из них наиболее безопасны?
Действует принцип «минимальности» и «натуральности»!
Для менопаузальной гормональной терапии применяются различные препараты, которые могут быть разделены на несколько групп:
«Натуральные» эстрогены – это препараты эстрогенов, которые по химической структуре идентичны эстрадиолу, синтезируемому в организме женщин. Благодаря современным технологиям создан синтетический эстрадиол, но по своей химической структуре он идентичен натуральному Эстрадиол–17b.
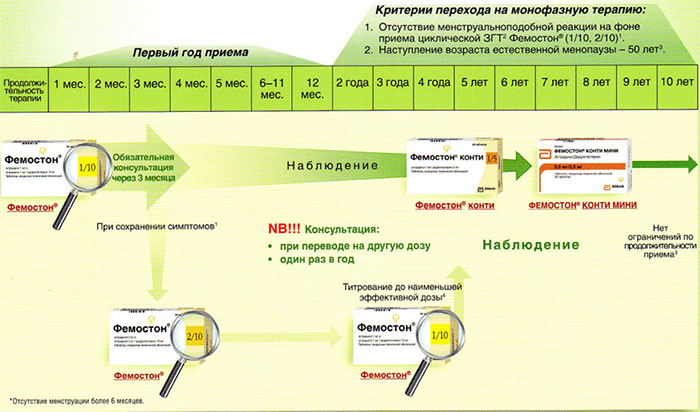
На сегодняшний день таким критериям более всего соответствует препарат Фемостон. Препараты линейки фемостона имеют различные дозировки, что укладывается в один из основных постулатов современной концепции МГТ – использование наименьшей возможной дозировки, которая сохраняет эффективность.
Препараты для двухфазной терапии – когда еще есть месячные
Фемостон 1/10 и Фемостон 2/10
В состав Фемостона 1/10 входят 28 таблеток. 14 белых, содержащих 1 мг Эстрадиола, и 14 серых, содержащих 1 мг Эстрадиола и 10 мг Дидрогестерона.
Состав Фемостона 2/10 отличается только количеством Эстрадиола
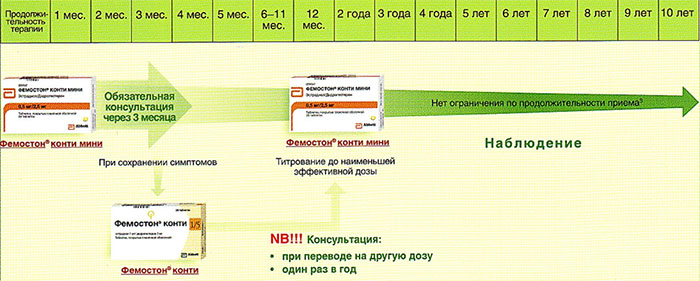
Препараты для монофазной терапии – когда месячные отсутствуют
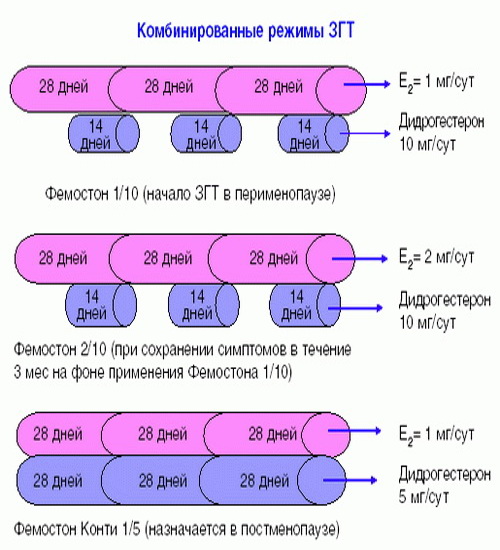
В состав Фемостона конти 1/5 входят 28 таблеток, содержащих 1 мг Эстрадиола и 5 мг Дидрогестерона.
В состав Фемостона мини 0,5/2,5 входят 28 таблеток, содержащих 0,5 мг Эстрадиола и 2,5 мг Дидрогестерона.
Ниже представлена более подробная схема первоначального назначения препаратов фемостон в пременопаузе (то есть до прекращения менструаций, но при наличии характерных климактерических симптомов). Пациенткам, у которых менструации не прекратились, рекомендуют начинать лечение в первый день менструального цикла. Пациенткам с нерегулярным менструальным циклом целесообразно начинать лечение после 10-14 дней монотерапии прогестагеном («химический кюретаж»).
Далее Вашему вниманию представлен алгоритм первоначального назначения препарата фемостон в постменопаузе (то есть когда уже прошел год и более после последней менструации).
Какой способ применения препаратов лучше?
Трансдермальное (накожное) нанесение позволяет избежать первой стадии печеночного метаболизма, благодаря чему колебания концентрации эстрадиола в плазме крови при применении накожных препаратов незначительны. Метаболизм и выведение эстрадиола при трансдермальном введении подобен метаболизму натуральных эстрогенов.
Большинству пациентов желательно использовать оптимальную и наиболее безопасную на сегодняшний день схему: Дивигель накожно + Утрожестан интравагинально.

Схема приема для женщин, у которых сохранена менструальная функция, назначается врачом. Обычно средство прописывают циклом с первого дня после окончания менструации (5 день цикла) в течение 25 дней, после овуляции (c 16 по 25 день цикла) нужно добавлять препараты гестагенов.
Утрожестан – содержит прогестерон микронизированный, существует в двух формах — 100 и 200 мг.
При МГТ в постменопаузе в непрерывном режиме препарат Утрожестан применяется в дозе 100 мг с первого дня приема эстрогенов.
При болях в молочной железе можно добавить прожестожель ежедневно по 1 дозе на каждую молочную железу 2-4 недели.
Противопоказаниями для заместительной гормонотерапии являются:
Нужен ли женщинам тестостерон?
Согласно рекомендациям Международного общества по менопаузе (International Menopause Society (IMS)) основное показание для применения тестостерона – лечение уменьшенного сексуального влечения, которое заставляет данную женщину испытывать значительные страдания. До рассмотрения вопроса о проведении терапии тестостероном необходимо решить вопросы, связанные с другими причинами нарушенного сексуального желания и/или возбуждения. К ним относятся диспареуния, депрессия, побочные эффекты лекарственных препаратов, проблемы взаимоотношений и другие проблемы со здоровьем, влияющие на женщину или ее партнера.
В настоящее время возможно применение трансдермальных препартов. На отечественном фармацевтическом рынке существует только один вариант – Андрогель, но его применение у женщин является «off-label», то есть не разрешено инструкцией. Обычно назначается 1/5 пакета в день (то есть 1 г геля/10 мг тестостерона).
Еще более перспективным может стать интравагинальная форма тестостерона, которая также может оказывать благоприятное действие при лечении вульвовагинальной атрофии.
Ключевые положения по применению препаратов тестостерона
Самые частые заблуждения:
А как же рак молочной железы, ведь это самая главная причина смерти у женщин?
В этом утверждении много заблуждений. На самом деле рак молочной железы – причина смертности в 4% случаев. Ведущая причина преждевременной смерти – сердечно-сосудистые заболевания (50%), которые запускает инсулинорезистентность. А она возникает на фоне гормональных нарушений.
Гормоны вызывают побочные эффекты и от них толстеют?
Новые низкодозированные и высокоселективные препараты направлены четко на мишень. Врачи на протяжении многих лет наблюдали за тысячами женщин, которые получали МГТ? Сегодня уже есть уникальные гестагены, метаболически нейтральные, они не приводят к ожирению и вместе с тем не понижают тестостерон, если у женщины нет его избытка. Выработаны и новые схемы лечения. Иногда при применении таблеток с эстрогенами, где-то в 10% случаев, бывают головные боли и боль в венах. В этом случае они заменяются на трансдермальные формы в виде геля.
Зачем мне принимать гормоны, если у меня нет приливов и отличное самочувствие?
Вместе с падением уровня гормонов возникает риск развития возрастных болезней: повышается артериальное давление, возникает ожирение, увеличивается риск развития сахарного диабета второго типа, подагры, остеопороза и онкологических заболеваний.
Вместо таблеток лучше принимать травы и различные фитоэстрогены?
Эффективность данных препаратов по устранению вазомоторных симптомов составляет 30%, что равно эффективности плацебо. При этом данная группа препаратов никаким образом не оказывает профилактического действия на возрастные заболевания (сердечно-сосудистые, онкологические заболевания, остеопороз, ожирение и сахарный диабет).
Стероидные гормоны, миома матки и нарушения функции печени: патогенез и перспективы лечения
Миома матки (ММ) относится к истинным доброкачественным опухолям гормонально зависимых органов. Ее распространенность колеблется в широких пределах. По данным литературы, каждая четвертая-пятая женщина в мире больна миомой матки
Миома матки (ММ) относится к истинным доброкачественным опухолям гормонально зависимых органов. Ее распространенность колеблется в широких пределах. По данным литературы, каждая четвертая-пятая женщина в мире больна миомой матки [40, 57]. Несмотря на низкую вероятность малигнизации (1%), до 2/3 пациенток, страдающих миомой матки, подвергаются оперативному лечению, причем 60–96% всех операций являются радикальными и приводят к потере репродуктивной и менструальной функции у женщин. Это впоследствии становится основной причиной развития нарушений в гипоталамо-гипофизарно-яичниковой системе, а также вегетососудистых и психоэмоциональных сдвигов [6, 14].
Фоном для усиленного роста миоматозных узлов в пременопаузальном периоде считаются длительные нейроэндокринные нарушения, патологический климакс, действие факторов, стимулирующих гиперпластические процессы в организме, а также различные метаболические расстройства (ожирение, нарушение липидного и углеводного обменов и т. д.) [6, 14, 17].
Миома матки часто сочетается с различными экстрагенитальными заболеваниями: ожирением (64%), заболеваниями сердечно-сосудистой системы (60%), функциональными нарушениями желудочно-кишечного тракта (40%); гипертонической болезнью (19%), неврозами и неврозоподобными состояниями (11%), эндокринопатиями (4,5%). Избыточный вес женщины в сочетании с низкой физической активностью и частыми стрессами относятся к факторам, способствующим появлению ММ. Кроме того, при оценке риска возникновения миомы матки не исключается генетическая предрасположенность ее развития [58].
В клинической практике важное значение имеет характер опухолевого роста. Опухоли матки разделяются по тканевому составу — миомы, фибромы, ангиомы и аденомиомы — в зависимости от содержания в них соединительной ткани и степени развития сосудистого компонента. Выделяют простые и пролиферирующие опухоли, последние встречаются у каждой четвертой больной с миомой матки.
ММ следует рассматривать как дисрегенераторный пролиферат поврежденного миометрия, а не опухоль [24, 38, 58].
Известно, что в миометрии вокруг тонкостенного сосуда сразу закладываются несколько зачатков роста. Миома матки имеет автономный рост (аутокринный и паракринный), обусловленный взаимодействием ростовых факторов и образованием гормонально чувствительных и ростовых рецепторов [14, 23, 38, 53].
Патогенез ММ до сих пор вызывает много споров. Существующие теории развития заболевания основаны на результатах лабораторных и экспериментальных исследований и объясняют лишь некоторые звенья патогенеза. Одно из центральных мест в патогенезе ММ отводится особенностям гормонального статуса и функционального состояния репродуктивной системы [42].
Современные исследования подтверждают традиционное мнение о ведущей роли эстрогенов в патогенезе ММ [40, 41, 56]. Содержание рецепторов эстрадиола и прогестерона в ткани миомы выше, чем в неизмененном миометрии, и подвержено циклическим изменениям. Длительное лечение агонистами гонадолиберина (гипоталамический рилизинг-фактор) уменьшает объем миоматозных узлов на фоне значительного снижения содержания рецепторов эстрогенов в миометрии и тканях миомы [14, 16, 23, 33, 40, 54].
Ведущая роль в патогенезе миомы матки отводится гиперэстрогенемии. Это было доказано в эксперименте возможностью получения псевдомиомы в результате длительного применения эстрогенных гормонов. После прекращения действия эстрогенов ММ у животных подвергается обратному развитию [19].
Эстрогены в крови женщин циркулируют как в свободном, так и в связанном состоянии в виде соединений с серной и глюкуроновой кислотами. Конъюгация эстрогенов с глюкуроновой кислотой с помощью фермента уридинфосфоглюкуронилтрансферазы происходит в основном в печени. Нарушение процессов конъюгации эстрогенов может привести к увеличению свободных фракций эстрогенов, обладающих более выраженной способностью стимулировать гиперпластические процессы в органах-мишенях — матке [19].
У женщин, страдающих ММ, все ткани (а не только ткани матки) реагируют на колебания уровня половых гормонов изменением концентрации своих рецепторов; эстрадиол индуцирует образование сначала рецепторов, а подъем уровня прогестерона в крови приводит к снижению и эстрогенных и прогестеронных рецепторов [23].
Прогестерон наряду с эстрогенами стимулирует рост миомы матки [54], но оба этих гормона, принимая участие в патогенезе миом, используют разные пути [59]. Доказано, что 4-гидроксилирование эстрадиола в ткани ММ повышено по отношению к окружающему миометрию в пять раз. Уровни активности ароматазы и продуктов транскрипции цитохрома Р450-ароматаз в 2 — 20 раз выше в культуре клеток миомы, чем в нормальной ткани. Это указывает на усиление локального биосинтеза эстрогенов, стимулирующих рост миомы [33]. Высокое содержание рецепторов эстрогенов и прогестерона в миоме реализуется в локальном повышении концентрации эстрадиола, прогестерона и стимулировании роста миомы. При этом прогестерон и эстрогены оказывают синергическое действие [59].
Таким образом, нарушения обмена половых стероидов в миоматозных узлах формируются по принципу положительной обратной связи, основанной на аутокринной стимуляции клеток. Развитие этого патофизиологического механизма обусловлено активным участием так называемых факторов роста, что приводит к росту миоматозных узлов, нарушению васкуляризации и кровотечениям [33, 40, 56, 59].
Основную роль в развитии осложнений предположительно играют фактор роста фибробластов, сосудистый эндотелиальный фактор роста, трансформирующий β-фактор роста, паратиреоидный гормоноподобный протеин и пролактин [17].
Решающим фактором, индуцирующим развитие ММ, является локальная гиперэстрадиолемия, не сбалансированная локальной гиперпрогестеронемией. ММ в условиях естественной ановуляции становится фактором риска ускоренного развития гиперпластических процессов миометрия и эндометрия [6, 23, 29, 30].
Нарушение гормонального фона влияет не только на рост миомы матки, но также оказывает воздействие на функции многих органов и систем. Наиболее часто нарушаются метаболические функции печени. Патологической основой для этого является существование в организме функциональной метаболической системы «гипоталамус-гипофиз-яичники-печень» [2, 3, 4, 5, 27]. Следует подчеркнуть, что печень — центральный орган гомеостаза холестерина и его производных [21, 32, 49].
Источником синтеза основных липидов желчи, в частности желчных кислот и неизмененного холестерина желчи, является холестерин различных классов липопротеидов, причем холестерин липопротеидов высокой плотности в основном превращается в желчные кислоты, а холестерин липопротеидов низкой плотности экскретируется в желчь в неизмененном виде [17, 36, 46]. Ключевым моментом синтеза желчных кислот считается 7-альфа-гидроксилаза. Существенная роль в регуляции активности данного фермента отводится половым гормонам, кроме того, активность 7-альфа-редуктазы зависит от количества свободного неэстерифицированного холестерина [21, 35, 46].
Метаболические и катаболические реакции, происходящие в печени, уравновешивают различные секреторные процессы, в частности, здесь активируются и взаимопревращаются гормоны [22, 44]. Изменение превращений гормонов влияет на количество активных форм в крови и тканях. Усиление метаболических реакций ведет как к смещению равновесия между свободной и связанной формами гормонов в сторону увеличения концентрации свободной их фракции, так и к подавлению синтеза специфических транспортных белков и автоматическому повышению содержания свободной активной формы гормонов [19].
Катаболизм гормонов — это совокупность разнообразных процессов ферментной деградации исходной структуры секретируемого гормона [25]. Печень является главным продуцентом гормоносвязывающих белков. Более 90% холестерина, используемого при синтезе стероидных гормонов, образуется в печени. Метаболиты стероидных гормонов плохо растворяются в воде и перед экскрецией превращаются в печени в парные соединения (конъюгаты) эфира с серной, глюкуроновой и другими кислотами [21, 47].
Гормональный импринтинг метаболизма стероидов осуществляется на транскрипционном или трансляционном уровнях. Он сводится к организации определения соотношения молекулярных форм микросомального цитохрома Р-450. Нарушение стероидного обмена связано с усилением активности одних и уменьшением других ферментных систем [37, 48].
Взаимосвязь между репродуктивной и гепатобилиарной системами известна давно [2,3,4,5]. С одной стороны, у пациентов с ММ часто выявляются заболевания печени и желчевыводящих путей, способствующие развитию нарушений метаболизма эстрогенов [39, 45], с другой — избыток в крови некоторых половых стероидов неблагоприятно влияет на различные функции печени [44, 55]. M. Maneshi и A. Martorani (1974) описали печеночно-яичниковый синдром, в определенной степени определяющий эту взаимосвязь [49].
Тесные функциональные взаимосвязи печени и женских половых гормонов, часто встречающееся сочетание их поражений и связанная с ним необходимость применения гормональной терапии, влияющей на деятельность печени, объясняют повышенный интерес к изучению функционального состояния печени у больных с миомой матки.
У больных с ММ и нормальным содержанием эстрогенов в крови связей между экскрецией эстрогенов и изменением содержания белковых фракций в плазме крови не отмечено. При повышении содержания эстрогенов в крови больных с ММ наблюдалась прямая корреляционная связь между содержанием прямого билирубина и концентрацией эстрадиола [7, 9, 10, 11, 12].
У большинства больных с ММ нарушения функций печени происходят в отсутствии клинических признаков заболевания гепатобилиарной системы [20].
Таким образом, установлено, что развитие ММ сочетается с функциональными поражениями печени, и не исключается, что рост миомы происходит на их фоне.
Нельзя исключить, что обнаруженные функциональные изменения печени у больных с ММ связаны с нарушением обмена стероидных гормонов. Установлено, что концентрация плазменных липидов увеличивается параллельно повышению уровня эндогенных половых гормонов, в частности эстрогенов, и это в определенной степени доказывает гормональную обусловленность гиперлипидемии при ММ [34, 44, 50]. Под влиянием эстрогенов происходят торможение синтеза холестерина в печени и уменьшение содержания холестерина в надпочечниках, увеличение содержания фосфолипидов [1, 13, 51, 52].
Известно, что транспорт липидов в печень плазмы крови осуществляется рецепторами мембран гепатоцитов и синусоидальных клеток печени. Эстрогены активируют рецепторы гепатоцитов для ХС ЛПНП, в результате чего увеличивается их захват [8, 10, 26, 31, 46]. Следствием этого процесса является увеличение содержания холестерина в печени и пузырной желчи, но не за счет усиления его синтеза, а за счет повышения уровня эстрогенов, приводящего к снижению синтеза желчных кислот в печени в результате ингибирующего влияния эстрогенов на активность 7-альфа-гидроксилазы холестерина [37, 43].
Повышенное содержание половых гормонов (эстрогенов) обусловливает изменение соотношения холестерина и желчных кислот в желчи. Это приводит к увеличению содержания свободного холестерина, выделяемого с желчью, и образованию насыщенной и перенасыщенной холестерином желчи. Наиболее выраженные нарушения липидного обмена отмечались у больных со значительными размерами опухоли при ее быстром росте. У них имелась отчетливая тенденция к нарастанию концентрации в крови общих липидов, липопротеидов, свободного холестерина, отмечено значительное снижение фосфолипидов и эфиров холестерина [2, 3, 4, 18].
При длительном существовании ММ и ее медленном росте показатели содержания общих липидов, липопротеидов и холестерина в сыворотке крови незначительно отличаются от нормальных значений, тогда как качественные нарушения липидного обмена сохранили описанные выше закономерности и укладываются в рамки дислипопротеидемии [2, 4]. Кроме того, значительный дефицит фосфолипидов, особенно при длительно существующих опухолях, является доказанным фактом [2, 3, 18].
Таким образом, имеющиеся в литературе данные о функциональном состоянии печени у больных с ММ противоречивы, так как были получены при анализе небольшого и неоднородного количества клинических наблюдений, кроме того, часто ограничены характеристикой одной из функций печени. Практически не освещен вопрос комплексной диагностики нарушений функционального состояния печени (особенно на ранних стадиях ее поражения) с применением современных радиоизотопных методов исследования, включая исследования ее ретикулоэндотелиальной системы. Тактика лечения больных с ММ не учитывает нарушения функций печени.
Нельзя упускать из вида следующее обстоятельство: основная задача при лечении ММ, особенно гормональном, направлена на избавление пациенток от миомы. В то же время любой из используемых сегодня препаратов оказывает в той или иной степени негативное влияние, а хирургическое лечение не оказывает положительного воздействия на нарушенные функции печени.
Современные методы диагностики позволяют по-новому взглянуть на проблему лечения миомы матки с учетом патогенеза морфологических и функциональных изменений печени у больных с ММ, что, безусловно, положительно скажется на ее результатах.
Независимо от вида терапии (консервативное или хирургическое) нарушения функции печени при ММ следует рассматривать с позиций липидного дистресс-синдрома Савельева [28]. В этой связи наиболее перспективным направлением лечения метаболических нарушений функции печени можно считать длительную липидокоррегирующую терапию вазелин-пектиновой эмульсией ФИШант С (Россия, ПентаМед) с обязательным применением комбинированных растительных гепатотропных препаратов (гепабене, ратиофарм) и восстановлением микробиоценоза толстой кишки пробиотиками (хилак форте, ратиофарм) [28].
По вопросам литературы обращайтесь в редакцию
З. Р. Кантемирова, кандидат медицинских наук
А. М. Торчинов, доктор медицинских наук, профессор
Т. А. Жигулина
В. В. Кадохова
Е. А. Алексеева, кандидат медицинских наук
Е. А. Девятых
В. А. Петухов, доктор медицинских наук, профессор
МГМСУ, РГМУ, 1-я Градская больница, Москва