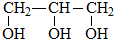Этиленгликоль с чем взаимодействует
Этиленгликоль: химические свойства и получение
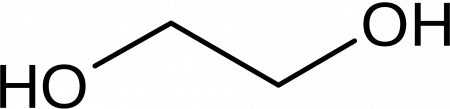
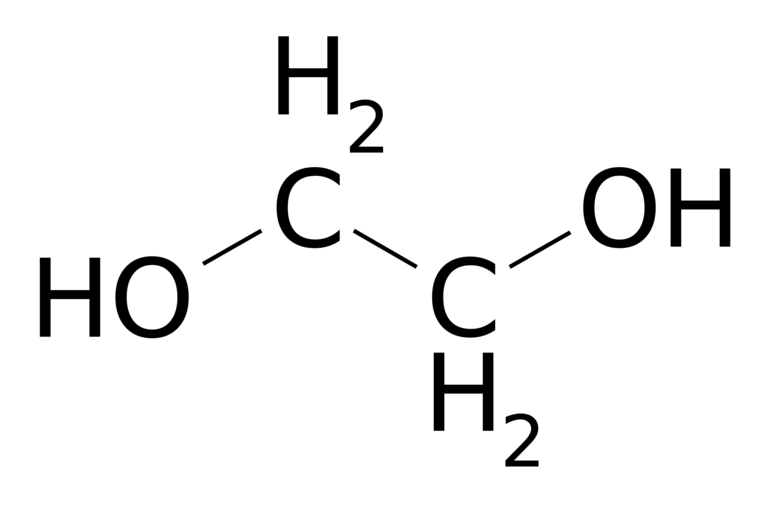
Этиленгликоль C2H4(OH)2 или CH2(OH)CH2OH, этандиол-1,2 – это органическое вещество, предельный двухатомный спирт .
Общая формула предельных нециклических двухатомных спиртов: CnH2n+2O2 или CnH2n(OН)2
Строение этиленгликоля
В молекулах спиртов, помимо связей С–С и С–Н, присутствуют ковалентные полярные химические связи О–Н и С–О.
| Электроотрицательность кислорода (ЭО = 3,5) больше электроотрицательности водорода (ЭО = 2,1) и углерода (ЭО = 2,4). |
Электронная плотность обеих связей смещена к более электроотрицательному атому кислорода:
Водородные связи и физические свойства спиртов
Спирты образуют межмолекулярные водородные связи. Водородные связи вызывают притяжение и ассоциацию молекул спиртов:
Поэтому этиленгликоль – жидкость с относительно высокой температурой кипения.
Водородные связи образуются не только между молекулами спиртов, но и между молекулами спиртов и воды. Поэтому спирты очень хорошо растворимы в воде. Молекулы спиртов в воде гидратируются:
| Чем больше углеводородный радикал, тем меньше растворимость спирта в воде. Чем больше ОН-групп в спирте, тем больше растворимость в воде. |
Химические свойства этиленгликоля
Спирты – органические вещества, молекулы которых содержат, помимо углеводородной цепи, одну или несколько гидроксильных групп ОН.
1. Кислотные свойства
| Спирты – неэлектролиты, в водном растворе не диссоциируют на ионы; кислотные свойства у них выражены слабее, чем у воды. |
1.1. Взаимодействие с раствором щелочей
При взаимодействии этиленгликоля с растворами щелочей реакция практически не идет, т. к. образующийся алкоголят почти полностью гидролизуется водой.
Равновесие в этой реакции так сильно сдвинуто влево, что прямая реакция не идет. Поэтому этиленгликоль не взаимодействует с растворами щелочей.
1.2. Взаимодействие с металлами (щелочными и щелочноземельными)
Этиленгликоль взаимодействует с активными металлами (щелочными и щелочноземельными).
Алкоголяты под действием воды полностью гидролизуются с выделением спирта и гидроксида металла.
2. Реакции замещения группы ОН
2.1. Взаимодействие с галогеноводородами
При взаимодействии этиленгликоля с галогеноводородами группы ОН замещаются на галоген и образуются дигалогеналкан.
| Например, этиленгликоль реагирует с бромоводородом. |
2.2. Этерификация (образование сложных эфиров)
Многоатомные спирты вступают в реакции с карбоновыми кислотами, образуя сложные эфиры.
| Например, этиленгликоль реагирует с уксусной кислотой с образованием эфира: |
2.4. Взаимодействие с кислотами-гидроксидами
Этиленгликоль взаимодействует и с неорганическими кислотами, например, азотной или серной.
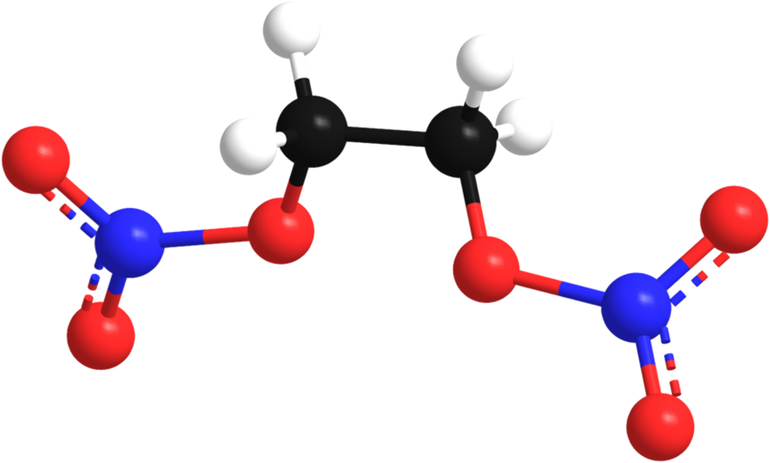
| Например, при взаимодействии этиленгликоля с азотной кислотой образуется нитроэтиленгликоль : |
3. Дегидратация
В присутствии концентрированной серной кислоты от спиртов отщепляется вода. При высокой температуре (180 о С) протекает внутримолекулярная дегидратация этиленгликоля и образуется соответствующий ацетальдегид.
4. Окисление этиленгликоля
Реакции окисления в органической химии сопровождаются увеличением числа атомов кислорода (или числа связей с атомами кислорода) в молекуле и/или уменьшением числа атомов водорода (или числа связей с атомами водорода).
Типичные окислители — оксид меди (II), перманганат калия KMnO4, K2Cr2O7, кислород в присутствии катализатора.
4.1. Окисление оксидом меди (II)
Этиленгликоль можно окислить оксидом меди (II) при нагревании. При этом медь восстанавливается до простого вещества.
4.2. Окисление кислородом в присутствии катализатора
Этиленгликоль можно окислить кислородом в присутствии катализатора (медь, оксид хрома (III) и др.).
4.3. Жесткое окисление
При жестком окислении под действием перманганатов или соединений хрома (VI) этиленгликоль окисляется до щавелевой кислоты.
| Например, при взаимодействии этиленгликоля с перманганатом калия в серной кислоте образуется щавелевая кислота |
4.4. Горение этиленгликоля
При сгорании этиленгликоля образуется углекислый газ и вода и выделяется большое количество теплоты.
5. Дегидрирование этаниленгликоля
При нагревании спиртов в присутствии медного катализатора протекает реакция дегидрирования.
| Например, при дегидрировании этиленгликоля образуется этандиаль |
Получение этиленгликоля
1. Щелочной гидролиз дигалогеналканов
При взаимодействии дигалогеналканов с водным раствором щелочей образуются двухатомные спирты. Атомы галогенов в дигалогеналканах замещаются на гидроксогруппы.
| Например, при нагревании 1,2-дихлорэтана с водным раствором гидроксида натрия образуется этиленгликоль |
2. Гидрирование карбонильных соединений
| Например, при гидрировании этандиаля образуется этиленгликоль |
О=CН-CH=O + 2H2 → CH2(OH)-CH2OH
3. Гидролиз сложных эфиров
При гидролизе сложных эфиров этиленгликоля и карбоновых кислот образуются этиленгликоль и карбоновая кислота.
4. Мягкое окисление алкенов
Мягкое окисление протекает при низкой температуре в присутствии перманганата калия. При этом раствор перманганата обесцвечивается.
В молекуле алкена разрывается только π-связь и окисляется каждый атом углерода при двойной связи.
При этом образуются двухатомные спирты (диолы).
Этиленгликоль
| Этиленгликоль | |||
|---|---|---|---|
| |||
| Систематическое наименование | этандиол-1,2 | ||
| Традиционные названия | гликоль, этиленгликоль, 1,2-диоксиэтан, 1,2-этандиол | ||
| Хим. формула | C2H6O2 | ||
| Рац. формула | C2H4(OH)2 | ||
| Состояние | бесцветная жидкость | ||
| Молярная масса | 62,068 г/моль | ||
| Плотность | 1,113 г/см³ | ||
| Температура | |||
| • плавления | −12,9 °C | ||
| • кипения | 197,3 °C | ||
| • вспышки | 111 °C | ||
| Пределы взрываемости | 3,2 ± 0,1 об.% | ||
| Давление пара | 0,06 ± 0,01 мм рт.ст. | ||
| Константа диссоциации кислоты pKa | 15,1 ± 0,1 | ||
| Показатель преломления | 1,4318 | ||
| ГОСТ | ГОСТ 19710-83 | ||
| Рег. номер CAS | 107-21-1 | ||
| PubChem | 174 | ||
| Рег. номер EINECS | 203-473-3 | ||
| SMILES | |||
| RTECS | KW2975000 | ||
| ChEBI | 30742 | ||
| ChemSpider | 13835235 | ||
| Предельная концентрация | 5 мг/м 3 | ||
| ЛД50 | 4700 мг/кг (крысы, перорально) | ||
| Токсичность | ядовит | ||
| Пиктограммы СГС |  | ||
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. | |||
Этиленгликоль (гликоль, 1,2-диоксиэтан, этандиол-1,2), HO—CH2—CH2—OH — кислородсодержащее органическое соединение, двухатомный спирт, простейший представитель полиолов (многоатомных спиртов). В очищенном виде представляет собой прозрачную бесцветную жидкость слегка маслянистой консистенции. Не имеет запаха и обладает сладковатым вкусом. Токсичен. Попадание этиленгликоля или его растворов в организм человека может привести к необратимым изменениям в организме и к летальному исходу.
Содержание
История открытий и производства
Этиленгликоль впервые был получен в 1859 году французским химиком Вюрцем из диацетата этиленгликоля омылением гидроксидом калия и в 1860-м гидратацией этиленоксида. Он не находил широкого применения до Первой мировой войны, когда в Германии его стали получать из дихлорэтана для использования в качестве замены глицерина при производстве взрывчатых веществ. В США полупромышленное производство начато в 1917 году через этиленхлоргидрин. Первое крупномасштабное производство начато с возведением завода в 1925 году около Саут Чарлстона (Западная Вирджиния, США) компанией «Carbide and Carbon Chemicals Co.» (англ.). К 1929 году этиленгликоль использовался практически всеми производителями динамита.
В 1937 компания Carbide начала первое крупномасштабное производство, основанное на газофазном окислении этилена до этиленоксида. Монополия компании Carbide на данный процесс продолжалась до 1953 года.
Получение
В промышленности этиленгликоль получают путём гидратации оксида этилена при 10 атм и 190‒200 °С или при 1 атм и 50‒100 °С в присутствии 0,1‒0,5% серной или ортофосфорной кислоты, достигая 90% выхода. Побочными продуктами при этом являются диэтиленгликоль, триэтиленгликоль и незначительное количество высших полимергомологов этиленгликоля.
Применение
Благодаря своей дешевизне этиленгликоль нашёл широкое применение в технике.
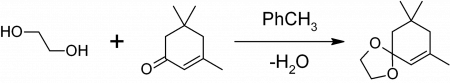
1,3-диоксоланы могут быть получены также при реакции этиленгликоля с карбонильными соединениями в присутствии триметилхлорсилана или комплекса диметилсульфат-ДМФА 1,3-диоксалана устойчивы к действию нуклеофилов и оснований. Легко регенерируют исходное карбонильное соединение в присутствии кислоты и воды.
Этиленгликоль также применяется:
Очистка и осушение
Осушается молекулярным ситом 4А, полуводным сульфатом кальция, сульфатом натрия, Mg+I2, фракционной перегонкой под пониженным давлением, азеотропной отгонкой с бензолом. Чистота полученного продукта легко определяется по плотности.
Таблица плотности водных растворов этиленгликоля, 20°С
| Концентрация % | 30 | 35 | 40 | 45 | 50 | 55 | 60 |
|---|---|---|---|---|---|---|---|
| Плотность, г/мл | 1,050 | 1,058 | 1,067 | 1,074 | 1,082 | 1,090 | 1,098 |
Меры безопасности
Этиленгликоль — горючее вещество. Температура вспышки паров 120 °C. Температура самовоспламенения 380 °C. Температурные пределы воспламенения паров в воздухе, °С: нижний — 112, верхний — 124. Пределы воспламенения паров в воздухе от нижнего до верхнего, 3,8‒6,4% (по объему).
Этиленгликоль умеренно токсичен. По степени воздействия на организм относится к веществам 3-го класса опасности.
Летальная доза при однократном пероральном употреблении составляет 100‒300 мл этиленгликоля (1,5‒5 мл/кг массы тела). Имеет относительно низкую летучесть при нормальной температуре, пары обладают не столь высокой токсичностью и представляют опасность лишь при хроническом вдыхании. Определённую опасность представляют туманы, однако при их вдыхании об опасности сигнализируют раздражение и кашель. Противоядием при отравлении этиленгликолем являются этанол и 4-метилпиразол.
В организме метаболизируется путём окисления до альдегида гликолевой кислоты и далее до гликолевой кислоты, которая затем распадается до муравьиной кислоты и диоксида углерода. Также он частично окисляется до щавелевой кислоты, которая вызывает повреждения почечной ткани. Этиленгликоль и его метаболиты выводятся из организма с мочой.
ХИМИЧЕСКИЕ СВОЙСТВА ЭТИЛЕНГЛИКОЛЯ
Екатеринбург 2016
Содержание
— Понятие об Спиртах
— Применение спиртов в промышленности
Введение
СПИРТЫ (алкоголи) – класс органических соединений, содержащих одну или несколько группировок С–ОН, при этом гидроксильная группа ОН связана с алифатическим атомом углерода (соединения, у которых атом углерода в группировке С–ОН входит в состав ароматического ядра, называются фенолами)
Классификация спиртов разнообразна и зависит от того, какой признак строения взят за основу.
1. В зависимости от количества гидроксильных групп в молекуле спирты делят на:
а) одноатомные (содержат одну гидроксильную ОН-группу), например, метанол СН3ОН, этанол С2Н5ОН, пропанол С3Н7ОН
б) многоатомные (две и более гидроксильных групп), например, этиленгликоль
HO–СH2–CH2–OH, глицерин HO–СH2–СН(ОН)–CH2–OH, пентаэритрит С(СН2ОН)4.
Многоатомные спирты
Многоатомными являются спирты, содержащие две и более гидроксильные группы в составе молекулы органического вещества. Все двухатомные спирты называются гликолями.
Этиленгликоль
Этиленгликоль (тривиальное название) или этандиол (систематическое название). Химическая формула HO−CH2CH2−OHHO−CH2CH2−OH.
Двухатомный спирт, простейший представитель многоатомных спиртов. В очищенном виде представляет собой прозрачную бесцветную жидкость слегка маслянистой консистенции. Не имеет запаха и обладает сладковатым вкусом. Этиленгликоль токсичен. По степени воздействия на организм относится к веществам 3-го класса опасности. Попадание этиленгликоля или его растворов в организм человека может привести к необратимым изменениям в организме и к летальному исходу. Этиленгликоль — горючее вещество. Температура вспышки паров 120 градусов C.
Этиленгликоль находит широкое применение в технике в качестве охлаждающего реагента систем охлаждения двигателей и компьютеров, антифризов и тормозных жидкостей. Используется в органическом синтезе.
ПОЛУЧЕНИЕ ЭТИЛЕНГЛИКОЛЯ
В промышленности этиленгликоль получают путём:
· (I) гидратацией 1,2-дихлорэтана;
· (II) гидратацией хлоргидринов;
· (III) гидратации окиси этилена при повышенном давлении и температуре в присутствии 0,1—0,5 % серной или ортофосфорной кислоты, достигая 90 % выхода;
· (IV) окислением этилена перманганатом калия:
ХИМИЧЕСКИЕ СВОЙСТВА ЭТИЛЕНГЛИКОЛЯ
Этиленгликоль обладает всеми свойствами гликолей.
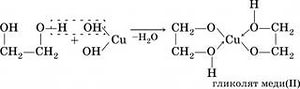
1. Взаимодействие с щелочными металлами: образует соли гликоляты

3. Взаимодействие с галогеноводородами HHal: образует этиленгалогенгидрины
HOCH2CH2OH+HHal⟶HOCH2CH2Hаl+H2O
4. Дегидратация при нагревании в присутствии концентрированной серной кислоты: образуется ацетальдегид 5. Окисление в зависимости от условий и окислителя: могут образовываться
· глиоксалевая и щавелевая кислоты;
Окисление молекулярным кислородом приводит к образованию формальдегида HCOH и муравьиной кислоты HCOOH.
Глицерин
Глицерин(тривиальное название) или пропантриол-1,2,3 (название по систематической номенклатуре).
Бесцветная вязкая жидкость, за счет наличия водородных связей смешивается с водой в любых отношениях. Безводный глицерин очень гигроскопичен, при попадании на кожу вызывает ожоги, но в разбавленном состоянии используется при изготовлении косметических средств (кремов, гелей), и даже в пищевой промышленности для приготовления ликеров.
Получение глицерина
Глицерин получают гидролизом жиров, а также из пропилена (через получение 2,3-гидроксипропановой кислоты с последующим ее восстановлением):
Особенности трёх спиртов
Спирты — это функциональные производные углеводородов, имеющие в своём составе гидроксильную группу. Если она одна, то это одноатомные спирты, если гидроксигрупп несколько, то это многоатомные спирты. Например, в молекуле этандиола-1,2 две гидроксильные группы:
В молекуле пропантриола-1,2,3 три гидроксильные группы. Соответственно, он является трёхатомным спиртом:
НО — СН2 — ОН — СН — СН2 — ОН
Вещества, содержащие несколько ОН-групп одного атома углерода, не относятся к классу спиртов и в большинстве случаев очень неустойчивы. В результате отщепления воды они превращаются в карбонильные соединения: СН3 — ОН — СН — ОН (гидрат ацетальдегида) = С2Н4О (ацетальдегид или этаналь) + Н2О (вода).
Из спиртов выделяются два представителя: этандиол-1,2 (c2h6o2) и пропантриол-1,2,3 (С3Н8О3). Название многоатомных спиртов строится так же, как и одноатомных. Сначала идёт название соответствующего алкана, на конце «ол», а перед ним располагается суффикс, обозначающий количество гидроксигрупп (ди, три, тетра). Например, диэтиленгликоль, триэтандиол, триэтиленгликоль и др.
Этандиол имеет ещё одно название — этиленгликоль, а пропантриол — это тот же глицерин или глицерол. В целом двухатомные спирты часто называют гликолями. Этиленгликолевый раствор (смешанный с водой) замерзает при температурах ниже 40 градусов, поэтому он используется в системе охлаждения двигателей у автомобилей в зимний период.
Этиленгликоль, формула которого С2Н6О2, является простейшим видом спиртов. В очищенном виде он представляет собой прозрачную бесцветную жидкость, слегка маслянистой консистенции. Он не имеет запаха и обладает сладковатым вкусом; токсичен. Попадание этиленгликоля или его растворов в организм человека может вызвать необратимые изменения и привести к смерти.
Химические свойства
Свойства класса многоатомных спиртов во многом сходны с одноатомными. К ним относятся реакции со щелочными металлами. В результате них образуются соли многоатомных спиртов. Если взаимодействие происходит с глицерином, то образуются глицераты:
2С3Н8О3 (глицерин) + 6Na = 2C3H5Na3O3 (глицерат натрия) + 3H2
Если с этиленом, то образуются гликоляты: С2Н6О2 + 2Na = C2H4Na2O2 + H2
Реакции со щелочами
Одноатомные спирты не реагируют с водными растворами щелочей, но для многоатомных спиртов такие реакции вполне возможны: С2Н6О2 + NaOH = C2H5NaO2 + H2O
Здесь необходимо обратить внимание на два нюанса. Главное — это то, что реакция идёт только по первой ступени. Спирт выступает как кислота, то есть, по сути, это аналог реакции нейтрализации. Такое свойство демонстрирует, что многоатомные спирты более сильные кислоты, чем вода. Однако их кислотных свойств недостаточно, чтобы изменять окраску индикатора.
Образование сложных эфиров
Это свойство по-другому ещё называется этерификацией. Возможно воздействие как с органическими кислотами, так и с неорганическими:
С3Н8О3 + (стеариновая кислота) 3С17Н35СООН (t, H+) = (тристеарат глицерина) C3H5 — O3 — C3O3 — C17H35 + 3H2O
Здесь глицерин при нагревании вступает в реакцию со стеариновой кислотой с образованием сложного эфира (тристеарата глицерина). Сложные эфиры глицерина с карбоновыми кислотами называются жирами. Как правило, в состав жиров входят остатки высших карбоновых кислот с числом атомов углерода больше 15 (С15Н31СООН — пальмитиновая, С17Н35СООН — стеариновая).
Реакция с минеральной кислотой
Тут реакция будет идти в присутствии концентрированной соляной кислоты.
С3Н8О3 + 3НNO3 (HCl) = C3H5 — O3 — 3NO6 + H2O
Нитроглицерин не является нитросоединением, несмотря на то, что исходя из названия можно прийти к такому выводу. Нитроглицерин относится к классу сложных эфиров, т. е. это сложный эфир азотной кислоты.
Взаимодействие с гидроксидом меди
Качественная реакция на спирты выявляет их слабые кислотные свойства. Это реакция с гидроксидом двухвалентной меди. Приготавливается водный раствор глицерина. Он очень хорошо растворяется в воде. После это происходит получение гидроксида меди. Для этого необходимо налить в пробирку гидроксид натрия и добавить раствор медного купороса (CuSO4). В результате этого гидроксид меди должен выпасть в осадок.
Чтобы убедиться в том, что глицерин обладает кислотными свойствами, в него добавляется часть осадка гидроксида меди.
Осадок при взаимодействии с глицерином будет растворяться, и образуется тёмно-синий раствор глицерата двухвалентной меди. Этиленгликоль, как и глицерин, тоже хорошо растворяется в воде.
Характеристика пропиленгликоля и глицерина
Пропиленгликоль (С3Н8О2) — это бесцветная жидкость. Его структурные характеристики таковы, что он является немного вязким, имеет слабый характерный запах и сладковатый вкус. Обладает гигроскопическими свойствами. В качестве добавки Е1520 пропиленгликоль разрешён в большинстве стран мира. Он считается нетоксичным веществом. При попадании на кожу или внутрь организма не вызывает раздражения и отравления. Удаляется при помощи воды.
У него можно выделить несколько основных физических свойств. К ним относятся:
Способы получения
Основным способом получения пропиленгликоля или пропандиола является каталитическая гидратация окиси пропилена. Это осуществляется при температуре 150−220 градусов по Цельсию. У пропиленгликоля довольно широкий спектр применения, и его используют для производства следующих продуктов и веществ:
Основными производителями в Европе являются компании Basf chemical и DWO Europe GMBH. Это вещество продаётся в основном под этими марками.
Свойства и использование глицерола
Глицерин — простейший представитель трёхатомных спиртов. Представляет собой вязкую бесцветную жидкость. Смешивается с водой в любых пропорциях. Если сравнить физические свойства основ, то даже без специальных исследований заметно, что этиленгликоль и пропиленгликоль во многом похожи, в отличие от глицерина. Последний даже при плюсовых температурах остаётся достаточно вязким.
Глицерин является довольно безвредным веществом. Он гигроскопичен, т. е. способен удерживать влагу, поглощая её, например, из воздуха. На этом свойстве основано его применение в косметической промышленности, где он используется для производства средств, увлажняющих кожу. Его также можно приобрести в аптеке, где он выпускается в качестве слабительных свечей или в жидком виде. Кроме того, глицерин используется в сельском хозяйстве для обработки семян и сеянцев деревьев. Это помогает прорастанию злаков и защищает кору деревьев от непогоды.
Промышленное применение этиленгликоля
Этандиол используется для производства различных материалов и веществ. К ним относятся:
Жидкость, основанная на глицерине, замёрзнет быстрее.
Теплоносители в системах отопления
Состав любого теплоносителя условно можно разделить на четыре составляющие. К ним относятся:
В состав основы может входить один из трёх спиртов: глицерин, пропиленгликоль, этиленгликоль. Разумеется, если просто перемешать все эти компоненты в домашних условиях, то вместо теплоносителя можно получить бесполезную цветную жидкость с нерастворённой взвесью. Производство теплоносителя — это сложный процесс, осуществляемый в промышленных условиях с соблюдением ГОСТа, многочисленных рецептур и технических требований под контролем высококвалифицированных специалистов.
Основные плюсы этандиола
Обычно чистый концентрат никогда не заливают и смешивают его с дистиллированной водой в пропорции 60 на 40 или 50/50.
Между моноэтиленгликолем и этиленгликолем разницы практически нет — это прозрачная вязкая жидкость, относящаяся к спиртам. К минусам такого теплоносителя относят его токсичность. Попадание 0,1 литра этой жидкости внутрь организма может привести к летальному исходу. Однако при соблюдении эксплуатационных требований и герметичности контура его утечек можно избежать. Всё же по некоторым предписаниям он не применяется в системах отопления детского сада и в некоторых других муниципальных и технических объектах, т. к. в случае утечки это может привести к отравлению людей.
Альтернативная жидкость
Как следствие, позже был изобретён теплоноситель на основе пропиленгликоля. Отличить его можно по специальной маркировке, на которой указана температура замерзания (до минус 30). Пропиленгликоль используется для производства массы продуктов не только в химической, но и в пищевой промышленности. Из него производят добавку Е1520, а также при смешивании с глицерином 50/50 добавляют в электронные сигареты. Иными словами, он совершенно безвреден.
Единственным его минусом является цена, т. к. у такого экологического теплоносителя она будет в два раза больше. Фактически 10 кг этиленгликоля и пропиленгликоля стоят одинаково, однако первый можно разводить с водой почти в два раза, что является намного выгоднее.
У теплоносителя как на основе этиленгликоля, так и на основе пропиленгликоля теплоёмкость гораздо ниже. Соответственно, при проектировании системы отопления следует закладывать большее количество секций радиаторов для создания большей теплоотдачи. Вязкость и плотность у этих теплоносителей также в два-три раза выше, чем у воды, поэтому циркуляционные насосы также следует закладывать больше и мощнее.
Это не касается домов большой площади, т. к. там уже рассчитаны насосы с больши́м запасом.
У пропиленгликоля довольно большое объёмное расширение, и расширительный бак для него необходим большего размера. Кроме того, эти спирты запрещают использовать в качестве теплоносителей большинство производителей газовых и электрических котлов, т. к. их кислотность не всегда совместима с прокладками и теплообменниками. Они также не очень хорошо «дружат» с алюминиевыми радиаторами и межсекционными прокладками, опять же из-за высокой кислотности. Во время эксплуатации их будет разъедать. Отсюда лучше использовать либо литые, либо стальные панельные радиаторы.
Так как этиленгликоль является ядовитым веществом, то утилизировать теплоноситель на его основе (после окончания срока службы) необходимо специальным способом. Существуют определённые компании, которые занимаются его утилизацией. Попросту сливать этиленгликоль в почву крайне не рекомендуется.
Конечно, для хорошей циркуляции по узким каналам отопительного оборудования необходим теплоноситель с самой лучшей текучестью и минимальной вязкостью. Принимая во внимание свойства основ, носители из ядовитого для человека этиленгликоля, представляющего опасность, окрашиваются в красный цвет, а из пропиленгликоля — в зелёный (с пометкой технической жидкости).
Такая жидкость обладает дополнительными свойствами экологичности и безопасности.