глюкозамин хондроитин мсм для чего
7 особенностей приема глюкозамина и хондроитина
Хондропротекторы составляют важную часть лечения артроза и остеоартроза. Хондроитин способствует задержке в хрящевых тканях жидкости, а глюкозамин помогает хрящам восстанавливаться. Принимать их в виде биодобавок можно годами – курсами с определенным перерывом. Если вы выбрали для себя этот вариант, обратите внимание вот на что.
Глюкозамин получают из экзоскелетов моллюсков или из зерна пшеницы
7 особенностей
1. При больших дозировках, которые превышают рекомендуемые 1500 мг в день в разы, наблюдается увеличение газообразования и «размягчение стула». У некоторых людей этот эффект бывает и при обычном приеме.
2. В составе биодобавок есть балластные загрязняющие вещества, от которых невозможно полностью избавиться с помощью современных технологий. Считается, что они могут вызывать аллергическую реакцию.
3. В составе сульфата глюкозамина, стабилизированного солью (хлоридом натрия), достаточно много пищевой соли. Поэтому при его приеме ее количество в пище необходимо намеренно сократить, например, перестать подсаливать еду во время приготовления. Иначе есть риск развития почечных патологий и проблем с артериальным давлением.
При патологиях почек сульфат глюкозамина с хлоридом натрия может быть опасен
4. Хондропротекторы нельзя принимать во время беременности и лактации, а также детям до 15 лет. Среди этих категорий пациентов исследования относительно воздействия глюкозамина и хондроитина на организм не проводились.
5. Хондроитин способен разжижать кровь. Поэтому люди, принимающие разжижающие препараты, должны быть особенно осторожны, чтобы избежать кровотечений.
Источник хондроитина – хрящи и трахеи рыб и крупного рогатого скота
6. Есть мнение, что доза глюкозамина, превышающая допустимую в 6-7 раз, может спровоцировать сахарный диабет, поскольку вещество является моносахаридом. Это мнение подкреплено исследованиями, которые проводились пока только на животных. Тем не менее, людям с сахарным диабетом или склонностью к нему, стоит проявлять предельную осторожность.
7. Хондроитин и глюкозамин – вовсе не панацея: для них характерна индивидуальная усваиваемость. Организм одного пациента усваивает моносахариды отлично, а у другого терапевтический эффект от лечения хондропротекторами напрочь отсутствует.
Эффективность хондроитина и глюкозамина не так однозначна, как утверждают многие ортопеды. Вот один из альтернативных взглядов на хондропротекторы с указанием их побочных эффектов:
Несмотря на определенные побочные эффекты, хондропротекторы все равно во много сотен раз безопаснее, чем длительный прием нестероидных противовоспалительных средств, которые часто назначают при лечении артроза.
Современной медицине известны еще более безопасные терапевтические методы, например внутрисуставные инъекции синтетического заменителя синовиальной жидкости «Нолтрекс». Препарат не содержит животного белка, поэтому не вызывает аллергии, кроме того, с осторожностью разрешен для приема людям с сахарным диабетом.
Какой бы вариант борьбы с остеоартрозом ни был выбран, лечение должно быть комплексным. Чтобы помочь организму восстановить вязкость и количество синовиальной жидкости, необходимо потреблять достаточно воды, придерживаться принципов здорового питания и жить активной жизнью.
Почему хондропротекторы делятся на поколения? Чем новые лучше старых?
Заболевания опорно-двигательного аппарата получают все более широкое распространение. Особое место среди них занимает остеоартроз — дегенеративное изменение суставного хряща. К 50 годам он наблюдается у каждого четвертого, а к 60 — у девяти из десяти человек.
Для лечения и профилактики остеоартроза используются хондропротекторы. Препараты этой группы постоянно совершенствуются, сегодня известны три поколения. В этом материале мы разберем, чем они отличаются.
Что такое хондропротекторы?
Для понимания истории развития этих препаратов познакомимся с ними в целом. Это группа лекарств, действующие вещества которых входят в состав синовиальной жидкости суставов.
• Хондроитин сульфат — природный компонент межклеточного вещества эластичного (гиалинового) хряща. Он активизирует регенерацию хондроцитов (клеток хрящевой ткани) и подавляет активность ферментов, способствующих их деструкции.
• Глюкозамин сульфат — моносахарид, предшественник хондроитина. Он стимулирует синтез сложных белков протеогликанов, которые образуют промежуточное вещество соединительной ткани.
• Глюкозамин гидрохлорид. Обладает аналогичным действием, что и сульфат, однако более устойчив и биодоступен.
• Гиалуронан — препарат гиалуроновой кислоты, которая входит в состав протеогликанов. Он повышает вязкость синовиальной жидкости и эластичность хряща.
Иногда к хондропротекторам относят также пиаскледин (препарат растительного происхождения, стимулирующий регенерацию хрящевой ткани) и алфлутоп (экстракт морских рыб, активизирующий синтез гиалуроновой кислоты).
Когда применяют?
Хондропротекторы для суставов выступают в качестве витаминов или лекарств. В целом их назначают не только при остеоартрозе, но и при других патологиях опорно-двигательного аппарата:
• остеохондрозе (дегенеративных изменениях в хрящах межпозвоночных дисков);
• артрите (воспалении суставов);
• бурсите (воспалении синовиальной сумки).
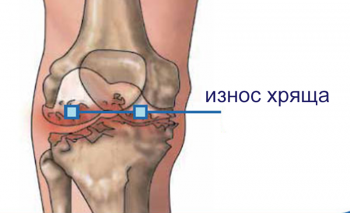
Основная задача хондропротекторов — обеспечить хрящевую ткань достаточным питанием. Кровеносных сосудов в ней нет, поэтому необходимые вещества она получает опосредованно, то есть через диффузию.
В норме при сжатии хряща выделяется синовиальная жидкость, которая его питает и увлажняет. При повышенных нагрузках, травмах, дегенеративных процессах меняется ее консистенция, что препятствует ее впитыванию. Применение хондропротекторных препаратов требуется для восстановления состава и структуры синовиальной жидкости.
Значение синовиальной жидкости для хрящевой ткани
По происхождению — это транссудат крови — выпот невоспалительного характера, отличающийся от плазмы более низкой концентрацией белков. С функциональной точки зрения — это внутрисуставная смазка, заполняющая их полость и обеспечивающая скольжение хряща.
Достаточное количество синовиальной жидкости обеспечивает:
• метаболизм между хрящом и сосудистым руслом;
• активизацию гуморального иммунитета при воспалении;
• биомеханическую подвижность суставов.
Переменная нагрузка на суставные поверхности, подвергающиеся трению, — это основное условие жизнеспособности хрящевой ткани. Во время сжатия из нее выделяется интерстициальная жидкость, которая смешивается с синовиальной и очищается. С расслаблением происходит обратная диффузия. Если ее не будет, хрящу нечем будет питаться, тогда начнется его дегенерация.
Факторы риска для хрящевой ткани
Главную угрозу представляет малоподвижный образ жизни. Нет движений — нет ни сокращений мышц, ни сжатия суставов. Как итог — нарушение кровоснабжения и обменных процессов.
Ограничивают питание хрящей также:
• лишний вес (сложнее всего приходится диабетикам и беременным);
• запредельные физические нагрузки (бывают у спортсменов, подростков, стремящихся испытать себя на прочность);
• длительное пребывание на ногах (в стоячем положении или при ходьбе);
• врастание капилляров с последующим окостенением (случается при непролеченном повреждении).
В результате хондроциты перестают получать вещества для поддержания жизнедеятельности, что ведет к их истощению и последующей гибели. Не получают они и строительный материал для восстановления. Поэтому возникает потребность в помощи извне — хондроитине, глюкозамине, гиалуроновой кислоте.
Эффективность хондропротекторов
Эти лекарства относят к медленнодействующим. Курс приема состоит из нескольких месяцев (точную продолжительность определяет врач). Первые результаты появляются через две-три недели, однако подпитка суставов должна периодически повторяться.
При лечении артроза решаются две основные задачи — подавление воспалительной реакции и нормализация метаболизма в хрящевой ткани. Соответственно, препараты делятся на две группы: симптоматические и структурно-модифицирующие. К первым относят нестероидные противовоспалительные средства, анальгетики и глюкокортикоиды, ко вторым — хондропротекторы. Эффективность гарантируется только в комплексе.
Кроме классификации по основным действующим веществам хондропротекторы делят по поколениям:
• Препараты первого поколения имеют натуральное происхождение. Это выдержки из растительных тканей и хрящей животных.
• Препараты второго поколения содержат отдельные очищенные вещества — хондроитин сульфат, глюкозамин или гиалуроновую кислоту.
• Препараты третьего поколения являются комбинированными. Здесь могут содержаться вещества, необходимых для питания суставов. Иногда в состав включаются другие элементы — витамины, минералы, жирные кислоты.
В аптеках они представлены в разных формах. Для перорального приема есть таблетки, капсулы, растворимые порошки. Для местного применения предусмотрены мази. Также существуют составы для внутримышечных и внутрисуставных инъекций.
Действие хондропротекторов разных поколений
По мере эволюции этих лекарств менялась направленность их действия и увеличивалась эффективность при лечении артроза. Представители первого поколения были ориентированы на субхондроидальную кость, подтвержденные результаты оказались довольно низкими.
С хондропротекторами второго поколения ситуация была неоднозначной:
• Относительно мукополисахаридов (лекарственных форм гиалуроновой кислоты), которые модифицируют структуру суставов, нет достаточной доказательной базы эффективности.
• Лекарственные формы хондроитин сульфата, чье действие направлено непосредственно на хрящ, подтвердили успешность выполнения своей задачи. Однако проблему с недостатком протеогликанов они не решали.
• Препараты глюкозамина, являющиеся стимуляторами синтеза протеогликанов, тоже доказали свою эффективность. Однако для регенерации хондроцитов их недостаточно.
Поэтому и возникла потребность в создании хорошего средства, действующего на суставы комплексно. Цель была достигнута с появлением хондропротекторов нового поколения. Сочетание хондроитина с глюкозамином обеспечивает достижение заданного терапевтического эффекта. А комбинация их с НПВП позволяет проводить комплексное лечение (снимать боль, подавлять воспаление), не увеличивая объем употребляемых медикаментов.
Преимущества хондропротекторов нового поколения
Сейчас ведутся обширные исследования фармакологических средств. Результаты показывают, что комбинация хондроитин сульфата и глюкозамин сульфата/гидрохлорида демонстрирует синергизм. Это означает, что результаты гораздо выше, чем при приеме обоих веществ по отдельности.
Одно из доказательств — показатель выработки гликозаминогликанов хондроцитами:
• при монотерапии препаратами второго поколения она повышалась на 32%;
• комплексное лечение хондропротекторами третьего поколения давало прирост 96%.
Боль после полугодового курса их приема ослабевает на 79%. Однако сегодня в ревматологии нет однозначного мнения, что позволяет этого достичь. Это может быть присутствие НПВП в составе, следствие восстановления хрящевой структуры или эффект плацебо.
Особенности применения
Боль в суставах на фоне артроза может настигнуть каждого, независимо от возраста. Не стоит думать, что это проблема только пожилых. Однако важно учитывать особенности применениях хондропротекторов разными группами пациентов:
• Спортсменам, чьи суставы испытывают повышенные нагрузки, эти препараты назначаются в качестве профилактики. Продолжительность курса и необходимые действующие вещества подбираются спортивным врачом.
• Раньше при лечении подростков они практически не использовались. Однако с учетом распространения остеохондроза у школьников включение этих препаратов в курс терапии становится все более оправданным.
• Беременным такие лекарства противопоказаны. Однако хрящевая ткань во время вынашивания плода страдает. При наличии сильных болей и разрешения акушера-гинеколога допускается прием биологически активных добавок аналогичного действия.
Дополнительная защита суставов нужна людям с лишним весом, женщинам в период менопаузы, представителям профессий, которым свойственна стоячая работа. Их применение оправдано как при появлении боли, так и в профилактических целях.
Чем заменить?
Мы выяснили, что беременным препараты хондропротекторного действия принимать нежелательно. Родители подростков могут отнестись к их назначению скептически. Но проблему нужно решать во избежание усугубления дегенеративного процесса.
Хондроитин и глюкозамин можно получить из:
• ингредиентов для холодца (копыт, ушей, хвостов);
• куриного или говяжьего бульона, сваренного на медленном огне (быстрая варка разрушает вещества);
• рыбы (особенно речной);
• мидий;
• креветок;
• авокадо;
• сои.
Часто можно услышать, будто желатин заменяет хондропротекторы. Это не совсем так. Он действительно богат коллагеном — белком, укрепляющим соединительные ткани. Вещество, используемое для его загущения, добывается из животных хрящей. Однако ни хондроитина, ни глюкозамина желатин не содержит.
ГХК (глюкозамин-хондроитиновый комплекс)
Инструкция по применению
Фармакологические свойства
Для начала понадобится как можно более раннее диагностирование заболевания квалифицированным медспециалистом, когда дистрофические изменения только начали проявляться. В этом случае затягивание с посещением доктора может выступить причиной инвалидности. Остановить разрушение суставных хрящей или даже кости уже будет невозможно. Часто причиной нарушений ОДА считается наследственная предрасположенность, родовая травма, связанная с повреждением позвоночника и последующим развитием сколиоза, гиподинамия, травмы и даже пагубные привычки. И это описаны только те патологии, которые видны невооруженным взглядом.
Сегодня аптеки наводнены различными препаратами. Они в той или иной степени устраняют симптоматику, болевые ощущения, снимают воспалительные процессы в суставах. Выпускаются медикаменты в различных лекарственных формах: таблетированной, в виде мазей, гелей, растворов для инъекций. Но по отзывам больных самым результативным на сегодняшний день считается глюкозамин хондроитин – ГХК.
Особую группу пациентов составляют профессиональные спортсмены, которые часто получают серьезные травмы, оставляющие свои следы на всю жизнь. Еще пару десятков лет назад в распоряжении спортивных врачей были только глюкокортикостероидные и противовоспалительные химматериалы. В самых крайних случаях прибегали к оперативному вмешательству. Сейчас фармацевтическая индустрия предлагает биологически активные пищевые добавки, которые на практике показали свою результативность. Степень опасности их использования по сравнению со стероидными веществами значительно ниже. Лекарство считается средством комбинированного воздействия на хрящевую ткань. Обуславливает его группа входящих в препарат соединений. Хондроитинсульфат представляет собой полимерное сульфатированное гликозаминогликановое вещество, являющееся непосредственным участником синтезирования хрящевой субстанции. Под его влиянием снижается активность ферментов, способствующих деструкции хрящевых волокон. Мукополисахарид приостанавливает реакции воспаления, в результате чего регистрируется ингибирование дегенеративных процессов. В случае комбинированного поражения сустава хрящей прием хондроитинсульфата снижает болевой синдром. Препарат регулирует синтезирование гиалуроновой кислоты, устраняет дефицит гликозаминов. С его помощью происходит инициация реакции закрепления серы, участвующей в формировании костной ткани. Максимальная плотность хондроитинсульфата в крови достигается через 3-4 часа после однократного приема. Абсорбция происходит в кишечнике. Часть вещества метаболизируется в гепатобилиарной биосистеме с образованием мочевой кислоты и оксида углерода. Выводятся продукты обмена через почки в течение 24 часов.
Состав и упаковка выпуска
Показания к применению
Международная классификация болезней (МКБ-10)
М15-19 Воспаления суставов различной этиологии; М16 Воспаление тазобедренного сустава; М17 Воспаление коленного сустава; М22 Патология надколенника; М42 Дистрофический процесс в межпозвонковых дисках и других тканях позвоночника.
Побочные эффекты
Противопоказания
Ограничения по использованию глюкозамин-хондроитинового комплекса накладываются при сосудистых патологиях, сахарном диабетическом синдроме, поражениях печеночной и почечной биосистем в тяжелой форме, повышенной сенситивности к активным компонентам. В период вынашивания плода и питания ребенка грудной лактозой использования капсул запрещается.
Использование при беременности
Если женщина в положении или кормит новорожденного грудью, то лечение с использованием хондропротектора нецелесообразно. Во время беременности это объясняется вредным влиянием вещества на развитие плода. Если в момент лактации существует жизненная необходимость проведения терапевтического курса, то ребенка переводят на искусственное питание.
Способ и особенности использования
Медикамент ГХК вводится внутрь пероральным путем, без разжевывания, за 30 минут до завтрака. Учитывая степень поражения суставов, врач-ортопед устанавливает схему дозировки и продолжительность терапии. Взрослая норма, включая подростков старше 15 лет, составляет одну капсулу при двукратном употреблении в течение дня. Через 21 день лечения доза уменьшается до одной капсулы в сутки. Курс лечения продолжается 60 дней. В сложных случаях доктор может его продлить до 6 месяцев. В этот период употребление алкогольных напитков нужно исключить полностью, а норму сахара в еде максимально снизить. Что касается детей младше 15 лет, то специальных рекомендаций ни в инструкции по применению хондропротекторов, ни в других медицинских справочниках не существует. Поэтому назначение такого специфического медикамента должно проводиться только профильным врачом после детального обследования.
Взаимодействие с другими лекарствами
Передозировка
Прецедентов, которые бы описывали факт приема хондропротекторов в овердозах, не существует.
Аналоги
Химпрепарат имеет следующие аналоги: Терафлекс, Остеалем, Хондрофлексом и другие.
Условия реализации
Биологическая добавка может быть продана только при наличии рецепта доктора.
Условия хранения
Фармпродукт рекомендуется содержать в сухом затемненном месте. Температурный режим не должен превышать 25°С. Срок хранения составляет 2 года. При нарушении целостности упаковки продукт следует немедленно утилизировать. То же самое касается истечения срока годности.
Специалисты
Относительная биодоступность и интенсивность проникания глюкозамина при пероральном, инъекционном способах введения и местном применении препарата Хондроксид® Максимум, трансдермальный глюкозаминовый комплекс в эксперименте
1 MB Research Laboratories, 1765 Wentz Road, Spinnerstown, PA 18968, USA, Blair Yasso, B.S., Study Director;
2 Alliance Pharma, Inc., 17 Lee Blvd, Malvern, PA 19355, USA, Yinghe Li, Bioanalytical Principal Investigator;
3 Foura Pacific Pte Ltd, (Singapore), 35 Selegie Road #10-05, Parklane Shopping Mall, Singapore 188307, Asafov Alexander, R&D, CEO;
4 Кафедра фармацевтической химии ГБОУ ВПО НижГМА Минздрава России (заведующий кафедрой – профессор, д.х.н. Мельникова Н.Б., г. Нижний Новгород, ул. Родионова, 293)
5 Центральная научно-исследовательская лаборатория ГБОУ ВПО НижГМА Минздрава России (заведующий ЦНИЛ – профессор, д.б.н. Мухина И.В., г. Нижний Новгород, пр. Гагарина, 70)
Ключевые cлова: относительная биодоступность, глюкозамина сульфат, трансдермальный глюкозаминовый комплекс, мицеллярная трансдермальная система доставки.
РЕЗЮМЕ
Проведено сравнение относительной биодоступности и интенсивности проникания глюкозамина сульфата при пероральном, инъекционном применении и местном введениипрепарата Хондроксид ® Максимум в виде крема, содержащего мицеллярную систему трансдермальной доставки глюкозамина, в эксперименте на крысах линии Спраг-Доули. На основе анализа фармакокинетических профилей глюкозамина в плазме крови крыс установлено, что при введении ежедневно 3 раза в день в течение недели крема Хондроксид ® Максимум в дозе 400 мг/кг и разовой инъекции 4% раствора Глюкозамина сульфата в дозе 400 мг/кг относительная биодоступность составляла 61,6 %. Рассчитаны средняя скорость проникания глюкозамина в плазму крови через кожу крыс за 4 часа, равная 26,9 мкг/см 2 ∙ч, и доля проникания глюкозамина из крема через кожу в плазму крови животного при однократном введении за 4 часа, которая составила 4,12 %.
Сопоставительный анализ литературных и экспериментальных данных, а также расчеты на их основе, позволили сделать вывод, что, в процессе лечения в соответствии с инструкцией на препарат Хондроксид® Максимум, расчетная средняя концентрация глюкозамина в синовиальной жидкости воспаленного сустава может составлять величину (0,7–1,5) мкг/мл, что в 10-75 раз выше концентрации эндогенного глюкозамина в синовиальной жидкости сустава человека (0,02-0,07) мкг/мл. Эта величина сравнима с уровнем, достигаемым инъекционными формами глюкозамина и превышает до 2 раз уровень, достигаемый пероральными формами глюкозамина.
ВВЕДЕНИЕ
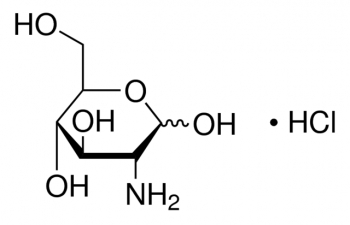
Глюкозамин (2-амино-2-дезокси-D-глюкоза) надежно зарекомендовал себя в качестве хондропротектора в профилактике и лечении нарушений метаболизма костной и соединительной тканей, в частности в коллагеновом и хрящевом матриксах. По данным обзора Р.Д. Альтмана 1 глюкозамин в качестве лекарственного средства продемонстрировал симптоматический и модифицирующий течение остеоартрита эффект. Глюкозамин в этом случае является специфическим субстратом и стимулятором синтеза эндогенных гликозаминогликанов (гиалуроновой кислоты, хондроитинсульфата А и С, дерматансульфата, кератансульфата, гепарина и гепарансульфата) и, соответственно, протеогликанов, которые наряду с гиалуроновой кислотой являются одним из основных компонентов – строительных элементов внеклеточного матрикса соединительной ткани. Недостаток эндогенного глюкозамина вызывает воспалительные и дегенеративные изменения, поэтому большое влияние на развитие и течение таких заболеваний оказывает концентрация глюкозамина в синовиальной жидкости, которая может быть восполнена введением глюкозамина в плазму крови одним из рассматриваемых здесь путей.
Препараты глюкозамина широко представлены пероральными, инъекционными и наружными лекарственными формами, содержащими глюкозамина гидрохлорид или глюкозамина сульфат, предполагающие разовую дозу от 100 до 1500 мг. Причиной, ограничивающей использование пероральных препаратов глюкозамина в практике, является необходимость использования высоких концентраций глюкозамина при длительном приеме для обеспечения необходимой биодоступности, что может привести к проантиоксидантному эффекту. Существующие наружные лекарственные формы (крем, мазь, эмульсия, гель), имеющие в своем составе глюкозамин не располагают эффективным механизмом его переноса к синовиальной мембране, окружающей пораженное место. Поэтому несмотря на высокую потенциальную эффективность глюкозамина, лечебный эффект классических местных средств сильно уступает пероральной форме. Инъекционные препараты, при их максимальной биодоступности, ограничены самим методом введения, приемлемым не для всех пациентов, а также необходимостью их применения с участием профессионального медицинского персонала.
К сожалению, до настоящего времени, фармакокинетические исследования, позволяющие выявить преимущества использования такого трансдермального комплекса и сопоставить его действие с пероральными и инъекционными формами, отсутствовали, что затрудняло масштабное внедрение этого препарата в практику.
Целью исследования являлось сравнительное экспериментальное изучение относительной биодоступности и интенсивности проникания глюкозамина сульфата при его пероральном и инъекционном введении и местном введениипрепарата Хондроксид ® Максимум ТГК в эксперименте на крысах линии Спраг-Доули, а также прогнозирование содержания глюкозамина в синовиальной жидкости воспаленного сустава человека.
МАТЕРИАЛЫ И МЕТОДЫ
Экспериментальные исследования проведены в лаборатории MB Research Laboratories Spinnerstown, PA (США) с привлечением аналитической лаборатории Alliance Pharma, Inc., Malvern, PA (США) в соответствии с Положениями и принципами действующих правил GLP (Good Laboratory Practices), Агентства о защите Окружающей среды (EPA), 40 CFR Часть 160 и 792, Управления Контроля Продуктов и Лекарств (FDA), 21 CFR Часть 58, и ОЭСР.
Доза исследуемого 4% раствора Глюкозамина сульфата калия хлорида для применения внутрь по действующему веществу составила 400 мг/кг (88,8 мг/крысу). 4% раствор глюкозамина сульфата вводился перорально в объеме 10 мл/кг.
Доза исследуемого 4% раствора для инъекций составила 400, 100 и 25 мг/кг (соответственно 102,4, 25,9 и 6,2 мг/крысу). Препарат вводился внутримышечно в объемах 10, 2,5 и 0,625 мл/кг 4% раствора глюкозамина сульфата, соответственно.
Из фармакокинетических кривых определяли основные фармакокинетические характеристики: Стах – максимальную концентрацию лекарственного вещества в крови; С4 часа – среднюю концентрацию лекарственного вещества в крови за первые 4 часа;tmax– время достижения максимальной концентрации; AUCt — площадь под кинетической кривой «концентрация – время» (англ. area under curve). Для расчета биодоступности использовалась только AUCt.
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ
На первом этапе был исследован фармакокинетический профиль глюкозамина в плазме крови крыс при однократном местном введении крема Хондроксид ® Максимум (в дальнейшем «крем») на область спины в размере 400 мг/кг (табл. 1).
Сопоставление инъекционного метода введения с местным проведено на трех уровнях дозы – 400 мг/кг (102,0 мг/крысу), 100 мг/кг (25,9 мг/крысу), 25 мг/кг (6,2 мг/крысу), отражающих диапазон, в которых у крыс данного вида реализуется желаемый эффект глюкозамина без признаков побочного действия. Из данных рисунка 1(Б) видно, что в этом интервале доз сохраняется линейность фармакокинетики. Максимальная концентрация Cmax местного нанесения равная 7,31 мкг/мл наиболее приближена к Cmaxравному 13,05 мг/мл, определенной по фармакокинетической кривой при внутримышечном введении в дозе 25 мг/кг (6,2 мг/крысу); величины AUCt равны 7,35 мкг∙ч/мл и 10,8 мкг∙ч/мл, соответственно (табл. 1).
Сравнение перорального (400 мг/кг), внутримышечного (25 мг/кг) и местного (400 мг/кг) введения продемонстрировано в таблице 1. Из данных таблицы 1 видно, что Cmax глюкозамина в плазме крови при внутримышечном (в/м) введении достигалась через 0,5 часа, при местном введении через 1 час и при пероральном введении – через 1,5 часа.
Учитывая вышеизложенные факты, для расчета относительной биодоступности крема с дозой 102,0 мг/крысу при однократном введении были использованы данные по внутримышечному введению 4% водного раствора глюкозамина с дозой 6,2 мг/крысу.
Рисунок 1. Концентрация глюкозамина в плазме крови крыс Sprague—Dawley при различных способах введения. По оси ординат – концентрация глюкозамина в мкг/мл,
по оси абсцисс – время взятия пробы крови
Фармакокинетические параметры глюкозамина в плазме крови крыс при однократном применении
Расположение кривых, рис. 1
Доза на крысу по ЛФ, мг
Крем Хондроксид ® Максимум
4% раствор для применения внутрь
4% раствор для инъекций
4% раствор для инъекций
где AUC х представляет значения:
AUC per os – AUC при пероральном введении с дозой 88,8 мг на 1 крысу.
Сравнительная характеристика методов введения
Инъекционно 400 мг/кг
Инъекционно 25 мг/кг
Перорально 400 мг/кг
Из данных таблицы 2 следует, к примеру, что однократное нанесение крысе крема массой 1,28 г (доза глюкозамина 102 мг) соответствует однократному введению инъекционно 4% раствора глюкозамина в количестве 4,2 мг.
РАСЧЕТ СРАВНИТЕЛЬНОЙ БИОДОСТУПНОСТИ ЧЕРЕЗ КОЖУ ЧЕЛОВЕКА
Проникание глюкозамина из крема через кожу площадью 39 см 2 в плазму крови оценивали через долю α, % и удельную скорость проникания υпр (удельная диффузия)
Доля проникания глюкозамина α (%) крема массой m при однократном местном введении через кожу в плазму за 4 часа равнялась:
α, % = (С ГА в плазме, мг/ m, мг)*100 = 4,2/102 *100 = 4,12%,
а удельная скорость проникания υпр. глюкозамина соответствовала 26,9 мкг/см 2 /ч:
υпр = (С ГА (6,2мг) в плазме, мкг/ Sкожи, см 2 )/ 4 ч = (4200мкг /39 см 2 )/4ч = 26,9 мкг/см 2 /ч
Величину α, % можно рассматривать как биодоступность глюкозамина за 4 часа после нанесения крема.
Для прогнозирования проникания β in vivo глюкозамина из препарата Хондроксид ® Максимум в кожу человека использовали следующее уравнение полученное авторами статьи 8 :
β in vivo человека = К′эф * υ in vivo крысы,
где К′эф = υ in vitro человека/υ in vitro крысы ≈ 0,3-0,5, определенная в эксперименте в диффузионной камере методом диализа; υ in vivo крысы = 26,9 мкг/см 2 /ч.
В соответствии с вышеприведенной зависимостью удельная скорость проникания (диффузии) глюкозамина в плазму крови при нанесении препарата Хондроксид ® Максимум на кожу человека составила величину β in vivo человека =(8,1-13,5) мкг/см 2 /ч.
ПРОГНОЗ КОНЦЕНТРАЦИИ ГЛЮКОЗАМИНА В СИНОВИАЛЬНОЙ ЖИДКОСТИ
Сопоставление данных анализа фармакокинетических профилей глюкозамина для плазмы крови человека, полученных в работе 9 при однократном пероральном применении в дозе 1500 мг, и плазмы крови крыс при наружном нанесении крема Хондроксид ® Максимум в нашей работе, свидетельствует о высокой биодоступности глюкозамина из исследуемого препарата. Фармакокинетические параметры – AUCt (мкг*ч/мл) при пероральном введении человеку равен 3,6±0,72, а при наружном нанесении крема крысе равен 7,35±1,48; Cmax, мкг/мл равна 0,49±0,16 (перорально для человека) и 7,31±2,08 (местно, крема Хондроксид ® Максимум для крыс).
Приближенно рассчитанная величина β in vivo человека может быть использована для оценки уровня концентрации глюкозамина в плазме крови сосудов микроциркуляторного русла, окружающих сустав. Например, по инструкции к препарату Хондроксид ® Максимум в виде крема с ТГК количество наносимого крема составляет полоску крема длиной до 3 см, что примерно соответствует 3 – 3,5 г. При сохранении удельной величины наносимого на кожу крема, используемой в эксперименте на животных в течение 4 часов, площадь для нанесения крема составит 106 см². Количество глюкозамина, доставленного в плазму крови через капилляры сосочкового слоя дермы, составит величину: (8,1 – 13,5) мкг/см²/час * 106 см² * 4 ч = (3434 – 5724) мкг.
Принимая объем циркулирующей крови у человека равным в среднем 5500 мл, самая пессимистическая (без учета прямого проникновения глюкозамина в составе ТГК через кожу к синовиальной мембране) оценка величины средней концентрации глюкозамина в плазме крови сосудов микроциркуляторного русла, окружающих сустав, в течение 4 часов будет составлять величину: (3434 – 5724) мкг / 5500 мл = (0,62 – 1,04) мкг/мл.
При лечении остеоартрозов инъекционным препаратом на основе глюкозамина (ЛСР-000050 от 26.12.2007), курс лечения составляет 3 инъекции внутримышечно в неделю по 3 мл с содержанием глюкозамина 400 мг в одной инъекции или 0,072 мг/мл плазмы крови.
Биодоступность при инъекционном введении глюкозамина на модели крупного животного. По данным авторов 10 пиковая концентрация (Сmах) глюкозамина в плазме при однократном в/в введении здоровой лошади из расчета 0,2 мг на 1 мл плазмы крови, достигала 50 мкг/мл, средняя концентрация глюкозамина в плазме крови за 12 часов составляла 4,5 мкг/мл, а пиковая концентрация глюкозамина в синовиальной жидкости составляла 1,5 мкг/мл при средней концентрации глюкозамина в синовиальной жидкости за 12 часов 0,7 мкг/мл.
Биодоступность при инъекционном введении глюкозамина человеку. Учитывая, что инъекция глюкозамина человеку проводится в концентрации в 3 раза ниже, чем в модели, рассмотренной выше (0,072 мг на 1мл плазмы крови), пиковая концентрация глюкозамина в плазме крови при разовой инъекции составит величину приблизительно 15 – 20 мкг/мл, средняя концентрация в плазме в течение 12 часов после инъекции при этом составит величину около 1,5 – 1,7 мкг/мл, а средняя концентрация глюкозамина в синовиальной жидкости здорового сустава человека составит величину 0,25 – 0,3 мкг/мл.
Биодоступность при пероральном введении глюкозамина человеку. При приеме внутрь взрослым при остеоартрозе назначается максимальная доза 1500 мг глюкозамина в сутки, что составляет 0,2 мг/мл плазмы крови. Глюкозамин принимают внутрь в виде капсул или приготовленного водного раствора. Рекомендованная продолжительность терапии, в зависимости от тяжести заболевания, составляет от 4 до 12 недель. По данным авторов 12 при введении 1500 мг глюкозамина человеку однократно пиковая концентрация глюкозамина в плазме крови человека достигает 1,6 мкг/мл к 3 часу после момента приема, средняя площадь под кривой зависимости концентрации от времени в течение периода 48 часов составляет 14,6 мкг* час/мл, тогда средняя концентрация от разового приема глюкозамина в дозе 1500 мг в течение 48 часов составит величину 0,3 мкг/мл. Соответственно, доза 1500 мг, принимаемая каждые сутки даст среднюю концентрацию в плазме крови человека не более 0,6 мкг/мл. Более поздняя работа тех же авторов 13 показывает, что при введении перорально дозы 1500 мг глюкозамина, ежедневно, в течение 14 дней, в плазме крови и синовиальной жидкости сустава человека происходит накопление глюкозамина и на 14-й день средняя концентрация глюкозамина в плазме крови возрастает от эндогенного уровня концентрации 0,052 мкг/мл до 1,28 мкг/мл, в синовиальной жидкости сустава, соответственно от 0,037 мкг/мл до 0,78 мкг/мл. Другими словами, средняя концентрация глюкозамина в плазме крови после 14 дневного приема возрастает примерно в 20 раз по сравнению с эндогенным уровнем концентрации глюкозамина и в 2 раза по сравнению с уровнем средней концентрации глюкозамина, достигаемым после разового приема. Средняя концентрация глюкозамина в синовиальной жидкости после 14 дневного приема возрастает также примерно в 20 раз.
Биодоступность при пероральном введении глюкозамина на модели крупного животного. При введении лошади перорально глюкозамина, однократно, в дозе 0,2 мг/мл, пиковая концентрация в плазме крови составляет величину 1,13 мкг/мл, средняя концентрация глюкозамина в плазме крови за 12 часов после введения составляет величину 0,4 мкг/мл, пиковая концентрация глюкозамина в синовиальной жидкости составляет величину 0,16 мкг/мл, средняя концентрация экзогенного глюкозамина в синовиальной жидкости составляет величину 0, 072 мкг/мл. С учетом того, что удельные дозы при пероральном введении лошади и человеку в рассматриваемых случаях равны (0,2 мг/мл), а параметры пиковой и средней концентрации глюкозамина в плазме крови очень близки, можно предположить, что у человека при разовом пероральном введении глюкозамина уровень средней концентрации глюкозамина в синовиальной жидкости будет составлять такую же величину 0,07 мкг/мл.
Тогда можно также сделать обобщающий вывод, следующий из всех вышеприведенных экспериментальных данных по биодоступности глюкозамина при пероральном введении лошади и человеку. При ежедневном введении глюкозамина перорально, в течение 14 дней, происходит накопление глюкозамина в плазме крови и синовиальной жидкости воспаленного сустава, средняя концентрация глюкозамина при этом, по сравнению с результатами, полученными при однократном введении, возрастает, соответственно, примерно в 2 раза в плазме крови человека от 0,6 мкг/мл до 1,28 мкг/мл и примерно в 11 раз в синовиальной жидкости воспаленного сустава человека от 0,07 мкг/мл до 0,78 мкг/мл.
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
На основе проведенных исследований и теоретических расчетов при однократном внутримышечном введении глюкозамина в составе 4% раствора Глюкозамина сульфата калия хлорид человеку в дозе 400 мг (0,072 мг/мл плазмы крови) пиковая концентрация глюкозамина в плазме, может быть оценена величиной 15 – 20 мкг/мл, что обеспечивает величину среднего уровня концентрации глюкозамина в синовиальной жидкости в течение первых 12 часов 0,25 – 0,3 мкг/мл для здорового сустава, и величину до 1,25 –1,5 мкг/мл для воспаленного сустава с периодом полувыведения около 68 часов. При многократном введении 3 раза в неделю, поскольку следующее введение происходит через 48 – 72 часов, концентрация глюкозамина в синовиальной жидкости до момента каждого следующего введения падает до уровня 0,6 – 1,0 мкг/мл, а средняя концентрация глюкозамина в синовиальной жидкости воспаленного сустава в течение курса лечения может быть оценена величиной 1,2 – 1,3 мкг/мл.
Таким образом, средняя концентрация глюкозамина в синовиальной жидкости воспаленного сустава в течение инъекционного курса лечения (3 инъекции в неделю, в/м, по 3 мл с содержанием глюкозамина 400 мг в одной инъекции) может быть оценена величиной 1,2 – 1,3 мкг/мл.
При приеме больным остеоартрозом глюкозамина 1500 мг внутрь, не менее 14 дней, ежедневно, в виде капсул или раствора, средняя концентрация глюкозамина в плазме крови человека достигнет величины не менее 1,3 мкг/мл, средняя концентрация в синовиальной жидкости воспаленного сустава человека составит величину не менее 0,7 – 0,8 мкг/мл.
Таким образом, средняя концентрация глюкозамина в синовиальной жидкости воспаленного сустава в течение перорального курса лечения (прием внутрь в дозе 1500 мг глюкозамина в сутки, в течение 14 дней) может быть оценена величиной 0,7 – 0,8 мкг/мл.
При нанесении препарата Хондроксид® Максимум, крем с ТГК однократно, средняя концентрация в плазме крови в течение 4 часов после каждого нанесения ТГК будет составлять величину 0,62 – 1,04 мкг/мл.
Далее есть два пути для оценки эффективности стандартного курса лечения ТГК. Если взять за основу расчета зависимости, полученные для перорального введения, то получатся следующие величины. Поскольку уровень средней концентрации глюкозамина в плазме крови после однократного нанесения очень близок к величинам, получаемым при однократном пероральном введении (0,6 мкг/мл), а частота введения в 3 раза выше, то с большой долей вероятности можно применить механизм накопления глюкозамина в плазме крови и синовиальной жидкости сустава. Тогда, сделав предположение, что в 3 раза большая частота введения приведет к концентрации в 3 раза большей, получим вывод, что после курса лечения препаратом Хондроксид® Максимум, крем с ТГК в течение 14 дней, средняя концентрация в плазме крови может составить величину не менее 1,8 – 3,1 мкг/мл, а в синовиальной жидкости воспаленного сустава величину порядка 0,9 – 1,5 мкг/мл или в среднем 1,2 мкг/мл.
Если взять за основу расчета зависимости, полученные для инъекционной модели введения, то получатся следующие величины. Средняя концентрация глюкозамина при нанесении ТГК примерно в 1,6 раза ниже, чем при инъекционном введении, поэтому средняя концентрация глюкозамина в синовиальной жидкости будет примерно во столько же раз ниже и составит величину 0,17 мкг/мл для здорового сустава. С учетом информации, о том, что уровень максимальной концентрации глюкозамина в синовиальной жидкости воспаленного сустава примерно в 5 раз выше, чем в интактном, то среднюю концентрацию в синовиальной жидкости воспаленного сустава можно оценить величиной 0,8 – 0,9 мкг/мл для больного сустава. Если учитывать, что с каждым нанесением ТГК (примерно каждые 6-8 часов) концентрация глюкозамина в синовиальной жидкости воспаленного сустава будет восстанавливаться до максимально возможного уровня, то можно сделать вывод, что концентрация глюкозамина в синовиальной жидкости воспаленного сустава в этом случае будет практически поддерживаться на уровне 0,7 – 0,8 мкг/мл или в среднем 0,75 мкг/мл.
ВЫВОДЫ
1. Экспериментально выявлено, что при нанесении на кожу крысам линии Спраг-Доули препарата Хондроксид® Максимум, крем с глюкозамином в дозе 400 мг/кг, 3 раза в день, ежедневно, в течение недели, количество глюкозамина, введенного в плазму крови с помощью Трансдермального Глюкозаминового Комплекса, составило 61,6 % от полученного при разовой инъекции 4% раствора Глюкозамина сульфата калия хлорид животному в дозе 400 мг/кг.
2. Средняя величина удельной диффузии глюкозамина при нанесении препарата Хондроксид® Максимум, крем с Трансдермальным Глюкозаминовым Комплексом на кожу животного в дозе 0,033 г/см² равная 26,9 мкг/см²/час сопоставима с литературными данными по скорости чрезкожного переноса в экспериментах in vitro, которая находится в пределах от 19,2±0,6 мкг/см²/час до 48,2±1,9 мкг/см²/час.
3. Сопоставительный анализ литературных и экспериментальных данных, а также расчеты на их основе позволили сделать вывод, что в процессе лечения в соответствии с инструкцией на препарат Хондроксид® Максимум расчетная средняя концентрация глюкозамина в синовиальной жидкости воспаленного сустава может составлять величину (0,7–1,5) мкг/мл, что в 10-75 раз выше концентрации эндогенного глюкозамина в синовиальной жидкости сустава человека (0,02-0,07) мкг/мл. Эта величина сравнима с уровнем, достигаемым инъекционными формами глюкозамина и превышает до 2 раз уровень, достигаемый пероральными формами глюкозамина.
Relative bioavailability and penetration of glucosamine after topical treatment by Hondroxid ® Maximum transdermal glucosamine complex in comparison with oral, injectable routes in experiment on the rats.
1 MB Research Laboratories, 1765 Wentz Road, Spinnerstown, PA 18968, USA, Blair Yasso, B.S., Study Director;
2 Alliance Pharma, Inc., 17 Lee Blvd, Malvern, PA 19355, USA, Yinghe Li, Bioanalytical Principal Investigator;
3 Foura Pacific Pte Ltd, (Singapore), 35 Selegie Road #10-05, Parklane Shopping Mall
Singapore 188307, Asafov Alexander, R&D, CEO;
4 Department of pharmaceutical chemistry of NSMA Russian Ministry of Health (Head of department – Professor, Dr. Melnikova N.B, Nizhny Novgorod, Rodionova str, 293)
Key words: relative bioavailability, glucosamine sulfate, transdermal glucosamine complex, micellar transdermal delivery system
SUMMARY
A comparison of the relative bioavailability and intensity of penetration of glucosamine sulfate in oral, injection and topical administration of the dosage form Hondroxid ® Maximum as a cream containing micellar system for transdermal delivery of glucosamine in the experiment by Sprague-Dawley rats was carried out. On the base on the pharmacokinetic profiles data of glucosamine in rat blood plasma with daily administration in 3 times a day for 1 week by cream Hondroxid ® Maximum 400 mg/kg and the single injection solution of 4% Glucosamine sulfate 400 mg/kg was found that the relative bioavailability was 61.6 %. Calculated penetration rate of glucosamine in the plasma through the rats skin in 4 hours, equal to 26.9 μg/cm 2 ∙ h, and the penetration of glucosamine through the skin into the plasma after a single dose of cream in 4 hours was 4.12 %.
Comparative analysis of literature and experimental data and calculations based on them suggest that medicine Hondroxid ® Maximum, cream with transdermal glucosamine complex in the treatment in accordance with the instructions can provide an average concentration of glucosamine in the synovial fluid of an inflamed joint in the range (0.7-1.5) µg/ml, much higher than the concentration of endogenous glucosamine human synovial joint fluid (0.02-0.07 µg/ml).
By theoretical calculations taking into account experimental data it is shown that the medicine Hondroxid® Maximum can reach the bioavailability level of the modern injection forms and exceed the bioavailability level of modern oral forms of glucosamine up to 2 times.
СПИСОК ЛИТЕРАТУРЫ
1. Р.Д. Альтман, Клиническая Фармакология, 2(4), 359-371 (2009)
2. M.L. Tiku, H. Narla, M. Jain, P. Yalamanchili, Arthritis Research & Therapy, 9(4), R76, 1-10 (2007).
4. В.В. Береговых, Н.В. Пятигорская, Ю.А. Прудкевич, С.А. Кедик, Вестник МИТХТ, 7(5), 17-22 (2012).
5. A. Sharma and S. Arora, World Journal of Pharmacy and Pharmaceutical Sciences, 2(6), 6448-6462 (2013).
6. Z. Liang, J. Leslie, A. Adebowale, et al., Journal of Pharmaceutical and Biomedical Analysis, 20(5), 807-814 (1999).
7. Руководствопопроведениюдоклиническихисследованийлекарственныхсредств. Ч. 1, Гриф и К, Моcква (2012).
8. B. Van Ravenzwaay and Е. Leibold, Human & Experimental Toxicology, 23, 421-430 (2004).
9. C.G. Jackson, A.H Plaas, J. D. Sandy, et al., Osteoarthritis and Cartilage, 18, 297-302 (2009).
10. M. Meulyzer, P.Vachon, F. Beaudry, et al, Osteoarthritis Cartilage, 16(9), 973-979 (2008)
11. M. Meulyzer, P. Vachon, F. Beaudry, et al, Osteoarthritis Cartilage, 17(2), 228-34 (2009)
12. S. Persiani E. Roda, L.C. Rovati, et al, Osteoarthritis Cartilage, 13(12), 1041-9 (2005)
13. S. Persiani, R. Rotini, G. Trisolino,et al, Osteoarthritis Cartilage, 15(7), 764-72 (2007)